Иммуногистохимические и морфологические маркеры тенденции к перенашиванию и переношенной беременности
Aннотация
Актуальность: Переношенная беременность является актуальной проблемой, что связано с высоким процентом осложнений в родах и перинатальной смертности. Множество морфологических исследований показало взаимосвязь жизнедеятельности плода при переношенной беременности с изменениями в плаценте. За последние годы значительно возрос интерес к иммуногистохимическому методу диагностики переношенной беременности. Однако не изучена роль в диагностике переношенной беременности таких маркеров, как коллаген и проколлаген, играющих ключевую роль в образовании структуры плаценты и ее функционировании. Цель исследования: Изучение роли маркёров NO-синтазы, CD34, коллагена и проколлагена в плаценте при тенденции к перенашиванию и переношенной беременности как клинико-морфологических и иммуногистохимических критериев диагностики и профилактики постнатальных нарушений. Материалы и методы: Были изучены биопсии плаценты, полученные при стандартном морфологическом исследовании и разделенные на 3 группы в зависимости от срока родоразрешения: 39-40 недель; 40-41 недель и более 41 недели. Проводилось иммуногистохимическое исследование материала на степень экспрессии маркеров: CD34, NO-синтаза, коллаген и проколлаген. C целью статистической обработки полученных данных использовалась аналитическая программа «Statistica 10.0», а также программа «Excel 2010». Результаты: В результате исследования не обнаружено достоверной разницы в степени экспрессии CD34, NO-синтазы в ворсинах хориона при доношенной и переношенной беременности. Установлен низкий уровень экспрессии коллагена I типа и коллагена IV типа при сроке родоразрешения более 41 недели. У пациенток с тенденцией к перенашиванию значительно чаще встречались: хроническая компенсированная недостаточность плаценты, дефект ворсинчатого хориона, хроническая компенсированная недостаточность плаценты с острой декомпенсацией. Заключение: Маркеры CD34 и NO-синтаза являются диагностически не значимыми, что делает нецелесообразным их изучение для оценки переношенной беременности. Выявленное снижение уровня экспрессии коллагена I и IV типа при переношенной беременности свидетельствует о том, что плацента при переношенной беременности не выполняет в полной мере свои функции.
Введение. Известно, что переношенная беременность несет в себе большие риски для жизнедеятельности плода. Согласно сведениям литературы, частота данной патологии колеблется от 1,4% до 14%, и составляет порядка 8% [1]. При переношенной беременности наблюдаются следующие характерные признаки: резорбция амниотической жидкости и маловодие, старение плаценты, а также присутствие признаков переношенности плода, что объяснимо нарастанием гестационного срока, превосходящим физиологические нормы. Вследствие высокого риска антенательной и интранатальной гибели плода при данной патологии - переношенная беременность располагается на одной из первых позиций в структуре перинатальной смертности [2, 3].
Изменения в плаценте являются определяющими в патогенезе переношенной беременности [4, 5]. Следует принимать во внимание, что в связи с ограниченным сроком внутриутробного развития человека в конце доношенной беременности в плаценте возникают генетические запрограммированные инволютивно-дистрофические процессы, и при отсутствии развития родовой деятельности в виду различных факторов, данные процессы в плаценте непрерывно прогрессируют в старение согласно заложенной генетической программе [6, 7].
При переношенной беременности наблюдается различная морфологическая картина, при этом макро-, и микроскопические изменения при этой патологии не являются специфическими [8, 9]. Они могут встречаться как при срочных родах, так и при разного рода патологиях, чаще всего при преэклампсии [10, 11, 12].
За последние годы значительно возрос интерес к иммуногистохимическому методу диагностики переношенной беременности. Один из изучаемых маркеров – CD34 – визуализирует эндотелиальную выстилку сосудов всех типов [5, 13]. Известно, что хориальные ворсины выступают в качестве СD34-иммунопозитивных структур, однако стоит отметить, что до сих пор не полностью изучены особенности локализации маркеров плацентарной недостаточности CD34.
В литературе представлены особенности экспрессии маркера NO-синтазы в ворсинчатом хорионе как основного плацентарного вазодилататора. Было показано, что синцитиотрофобласт, синцитиокапиллярные мембраны, эндотелий капилляров ворсин NOS-иммунопозитивными [13].
Коллаген I типа, являясь основным структурным коллагеном, экспрессируется в базальных и якорных частях ворсин: в самих ворсинах – в парацентральных зонах, а в периферических зонах котиледонов его экспрессия отсутствует [14-16]. В тех участках плаценты, где не развита коллагеновая сеть, происходит дефект развития плаценты, что подтверждает наличие плацентарной недостаточности и свойственно при переношенной беременности, при этом при доношенной беременности сеть коллагена распространена гомогенно в переферической и центральной зонах плаценты [14].
Также в результате проведенных иммуногистохимических исследований была выявлена корреляционная зависимость между перинатальным исходом и экспрессией коллагена IV типа, традиционно определяющимся как коллаген сосудистого русла, в связи с его экспрессией в стенках сосудов и капилляров в плацентах при доношенном сроке беременности [17, 18]. При переношенной беременности наблюдалась повышенная степень экспрессии коллагена IV в краевых очагах инволюции плаценты [19]. Из этого следует, что основной компонент разрушенных участков плаценты представлен коллагеном IV типа, что, скорее всего, способствует сохранению эластичности плаценты при физиологическом сроке беременности. Занимая место структурообразующих коллагенов I и III типов, коллаген IV типа сигнализирует об угрозе срыва компенсаторных механизмов плода накануне родоразрешения. Все это обуславливает степень тяжести плацентарной недостаточности, влияя в конечном счете на исход беременности для плода и новорожденного при переношенной беременности [17, 20].
Таким образом, морфологические и иммуногистохимические исследования плаценты при переношенной беременности требуют продолжения исследований.
Цель исследования: изучить роль маркёров NO-синтазы, маркера предшественника гематопоэтических клеток человека CD34, коллагена и проколлагена в плаценте при тенденции к перенашиванию и переношенной беременности как клинико-морфологических и иммуногистохимических критериев диагностики и профилактики постнатальных нарушений.
Задачи исследования: оценить степень выраженности патоморфологических изменений в плаценте в зависимости от срока гестации.
Материал и методы исследования
Исследование проведено на биопсиях плацент, полученном при стандартном морфологическом исследовании. Весь материал был разделен на 3 группы:
- 15 родильниц, родоразрешенных на сроке беременности 39-40 недель;
- 15 родильниц, родоразрешенных на сроке гестации 40-41 недель;
- 15 родильниц, родоразрешенных на сроке гестации более 41 недели.
Критерии исключения: родильницы с тазовым предлежанием плода, с тяжелой преэклампсией, с рубцом на матке после миомэктомии или кесарева сечения, с многоплодной беременностью, с преждевременными родами, с тяжелой экстрагенитальной патологией.
Клинической базой являлось патологоанатомическое отделение Научно-исследовательского института имени Д.О. Отта.
Иммуногистохимическое исследование проводилось с использованием флуоресцентной метки с парафиновыми срезами толщиной 2 мкм, которые устанавливали на предметные стекла, покрытые пленкой из поли-L-лизина (Sigma). Эти препараты подвергались процессу высушивания при температуре 37°С в течение суток с использованием термостата. Иммунофлуоресцентное исследование включало применение стандартного двухэтапного протокола с демаскировкой антигена в 0,01 М цитратном буфере рН=6,08-6,10. Оперировали указанными первичными моноклональными антителами: SIRT1 (1:1000, Abcam), SIRT2 (1:8000, Abcam), SIRT6 (1:300, Novus Biologicals) и NFkB p105 / p50 (1:400, Abcam); инкубация осуществлялась при требованиях, соответствующих инструкции, во влажной камере в нужном температурном режиме. Визуализация проводилась набором Mouse and Rabbit Specific HRP Detection IHC Kit (abcam). Блокировку неспецифического окрашивания проводили с помощью коммерческого раствора Protein Block (abcam). Для проверки работы антител производили негативный и позитивный контроли. Специфичность антител подтверждали в контрольных экспериментах.
Количественную оценку результатов иммуногистохимической реакции проводили на микрофотографиях с увеличением ×400 раз. Использовалась микроскопическая система визуализации: микроскоп Olympus, камера Olympus BX46 и специализированное программное обеспечение «CellSens 47 Entry». Поля зрения с дефектами тканей, а также их окрашивания и артефактами, были удалены из снимка. Параметры компьютерного анализа следующие:
- окуляр: ×10 увеличение;
- объектив: ×40 увеличение;
- полностью открытая апертура диафрагмы;
- поднятый конденсатор в режиме «Фото»;
- время экспозиции: 1/20 с;
- максимальная чувствительность камеры;
- размер кадра: 1280×1024 пикселей;
- формат кадра: JPEG.
Относительная плотность экспрессии (%) анализировалась в программном обеспечении «ImageJ». В каждом срезе в 5 полях зрения оценивали следующие показатели:
- оптическая плотность экспрессии, автоматически вычисляемая на основании закона Бугера-Ламберта-Бера;
- площадь относительного проявления, рассчитываемая как отношение области иммунопозитивных клеток к общей площади препарата.
Далее рассчитывались средние значения исследуемых параметров.
Статистические методы
Достоверность и убедительность полученных результатов исследования гарантирована методологической и теоретической аргументированностью исследования, включающего применение методического оборудования, соответствующего цели и задачам настоящего исследования, характерностью и достаточным объемом выборки. C целью статистической обработки полученных данных использовалась аналитическая программа «Statistica 10.0», а также программа «Excel 2010» (США). Рассчитывалось среднее арифметическое (M), средняя ошибка среднего значения (m) для признаков, имеющих непрерывное распределение, а также частота встречаемости признаков с дискретными значениями. Также для статистического анализа полученных данных применялся критерий Краскела-Уоллиса. Данный критерий используется для оценки отличий одновременно между тремя и более выборками и дает возможность выяснить, что признак меняется при смене одной группы на другую, но не показывает на направление изменений. Он представляет собой обобщение критерия Манна-Уитни на большее количество выборок. Все значения группируются и выстраиваются в общем ряду. Потом в каждой выборке рассчитываются суммы рангов. Если отличия оказываются случайными, то высокие и низкие ранги однородно разделятся по выборкам. Когда в какой-либо группе будут доминировать высокие ранги, а в оставшейся группе низкие, то это свидетельствует о том, что отличия неслучайны.
Адекватным допустимым уровнем статистической значимости принимали 0,05.
Результаты исследования. Пациентки трех групп достоверно не отличались по возрасту, массе плаценты и ряду морфофункциональных характеристик плацент (табл. 1).
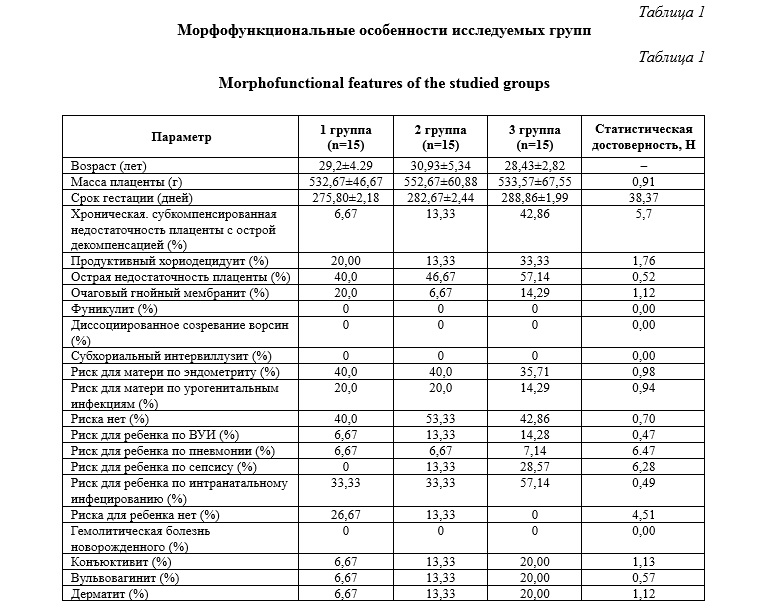
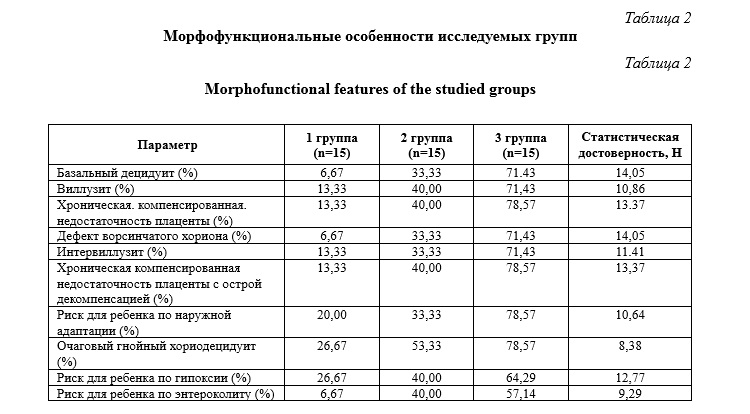
В ходе проведенного исследования были выявлены достоверные отличия между первой и третьей группами по следующим морфофункциональным данным: частота базального децидуита, виллузита, хронической компенсированной недостаточности плаценты, дефекта ворсинчатого хориона, интервиллузита, хронической компенсированной недостаточности плаценты с острой декомпенсацией, очагового гнойного хориодецидуита, риска для ребенка по нарушениям адаптации, для ребенка по гипоксии, риска для ребенка по энтероколиту (p<0,05). Вышеперечисленные параметры достоверно чаще встречаются в группе со сроком беременности более 41 недели, чем в группе со сроком гестации 39-40 недель. (p<0,05) (табл. 2).
В ходе иммуногистохимического исследования плацент были получены данные, представленные на рисунке 1 для маркеров CD34, NO-синтазы, Coll-I и Coll-IV.

В результате обработки представленных данных были получены следующие результаты: достоверных отличий в исследуемых группах по относительной площади экспрессии и оптической плотности маркеров CD34 (рис. 2а и 3а соответственно) и NO-синтазы (рис. 2б и 3б соответственно) выявлено не было.
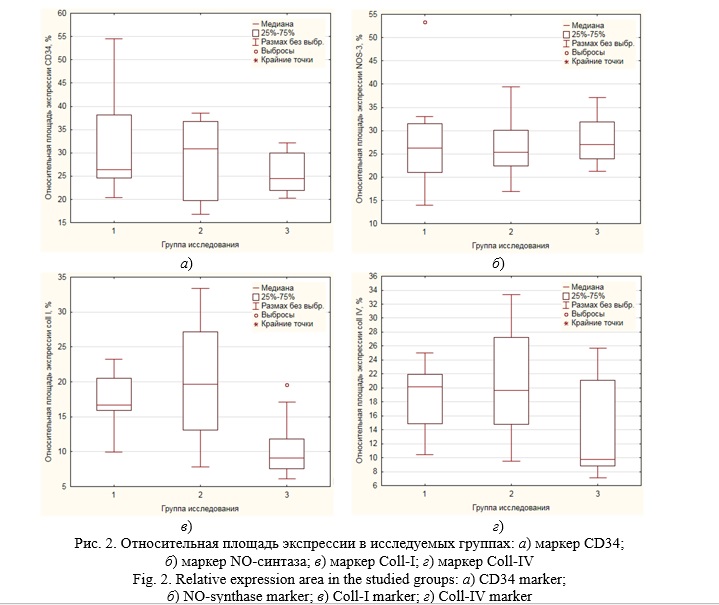
Однако первая и третья группы, а также вторая и третья группы достоверно отличались по относительной площади экспрессии и оптической плотности маркеров Coll-I (рис. 2в и 3в соответственно) и Coll-IV (рис. 2г и 3г соответственно). Таким образом, маркеры CD34 и NO-синтаза являются диагностически не значимыми, что делает нецелесообразным их изучение для оценки переношенной беременности.

Обсуждение результатов исследования
Следовательно, полученное в результате исследования отсутствие достоверной разницы в площади экспрессии CD34, NO-синтазы в ворсинчатом хорионе при доношенной и переношенной беременности доказывает теорию функциональной зрелости, а не «старении» плаценты [7].
В ходе исследования выявлен низкий уровень экспрессии коллагена I типа в плаценте при переношенной беременности, что подтверждает нарушение развития плаценты на данном сроке беременности. Ввиду ключевой роли коллагена I типа в регенерации тканей, заживлении ран и эластичности, установленный низкий уровень экспрессии этого маркера свидетельствует о том, что плацента перестает при переношенных сроках беременности, в полной мере, выполнять свою функцию. Однако выявлен низкий уровень экспрессии коллагена IV типа, который принято относить к основному компоненту дезинтегрированных участков плаценты и считается индикатором компенсации жизнедеятельности внутриутробного плода, замещая структурообразующие коллагены I и III типов, что также соответствует литературным сведениям [14].
Включая в себя ретикулярные волокна и будучи основным компонентом внеклеточного матрикса, коллаген III типа создает основной каркас многих органов, в том числе плаценты и кожи. Как правило, комбинируясь с первым типом коллагена, коллаген III типа является необходимым элементом для упругости и эластичности кровеносных сосудов, тканей сердца и кожи. Недостаток коллагена III типа в большой степени увеличивает риск разрыва сосудов, а также в отдельных критических случаях многократно увеличивает риск смерти [15].
Известно, что TGF бета, опосредованно, через коллаген IV типа мониторирует клеточную дифференцировку, пролиферацию и прочие функции в основной массе клеток, содействует иммунному ответу, нарушению микроциркуляции и сердечно-сосудистым патологиям. Выявленное снижение уровня экспрессии коллагена IV типа при переношенной беременности может служить свидетельством того, что все процессы пролиферации, клеточной дифференцировки и формирования сосудистого русла закончены и плацента при переношенной беременности не выполняет в полной мере трофическую, а также защитную функции [18].
При оценке результатов гистологического исследования плацент при тенденции к перенашиванию достоверно чаще наблюдались воспалительные изменения, чем при родах в срок (р<0,05). В то время как при доношенном сроке, так и при тенденции к перенашиванию основная локализация воспалительного процесса выявлялась на уровне гладкого хориона и париетальной пластинки либо совмещалась с поражением базальной децидуи, что также соответствует данным литературы [21]. При гистологическом исследовании последов у женщин с тенденцией к перенашиванию значительно чаще встречались: хроническая компенсированная недостаточность плаценты, дефект ворсинчатого хориона, хроническая компенсированная недостаточность плаценты с острой декомпенсацией [8]. Также новорожденные у женщин с тенденцией к перенашиванию относительно женщин с доношенным сроком беременности характеризовались более высокой частотой реализации внутриутробной инфекции в виде энтероколита, а также более высокой частотой гипоксии и, тем самым, в большей потребности в респираторной поддержке новорожденных, а также необходимостью более продолжительной их госпитализации.
Все это еще раз свидетельствует о необходимости разработки эффективного и быстрого метода подготовки беременных с тенденцией к перенашиванию с целью уменьшения перинатальных осложнений и гнойно-септических осложнений у матери.
Заключение. Обобщая полученные результаты исследования можно сделать вывод, что маркеры CD34 и NO-синтаза являются диагностически не значимыми, что делает нецелесообразным их изучение для оценки переношенной беременности. В то время, как выявленный низкий уровень экспрессии коллагена I типа в плаценте при переношенной беременности подтверждает нарушение развития плаценты на данном сроке беременности. Снижение уровня экспрессии коллагена IV типа при переношенной беременности может служить свидетельством того, что все процессы пролиферации, клеточной дифференцировки и формирования сосудистого русла закончены и плацента при переношенной беременности не выполняет в полной мере свои функции. Таким образом, требуется профилактика развития постнатальных нарушений при тенденции к перенашиванию, что выражается в необходимости разработки эффективного и быстрого метода подготовки беременных с тенденцией к перенашиванию с целью уменьшения перинатальных осложнений и гнойно-септических осложнений у матери.





















Список литературы