Герминальные мутации как возможные биомаркеры эффективности терапии ингибиторами контрольных точек иммунитета у пациентов с почечно-клеточной карциномой (мини-обзор)
Aннотация
Актуальность: Применение ингибиторов контрольных точек иммунитета (ИКТИ) является перспективной терапией в лечении онкологических заболеваний, в частности почечно-клеточной карциномы (ПКК). Несмотря на революционный прорыв в лечении рака данной группой препаратов, существенная доля пациентов не демонстрирует ответа на лечение. На сегодняшний день оценка уровня экспрессии белка PD-L1 (лиганда рецептора запрограммированной клеточной гибели 1) на опухолевых клетках является единственным одобренным методом определения показаний к назначению ИКТИ, однако, данный маркер не позволяет точно спрогнозировать ответ на терапию. В связи с этим, актуален поиск дополнительных прогностических факторов для контроля эффективности лечения пациентов препаратами ИКТИ на основе комплексного генетического и эпигенетического анализа. Цель исследования: Проанализировать и обобщить результаты молекулярно-генетических исследований c целью возможного использования в качестве прогностических биомаркеров эффективности при назначении препаратов ИКТИ. Материалы и методы: Были проведены обзор и анализ российских и зарубежных источников литературы в базах данных Pubmed, Scopus, Google Academy, Elibrary за последние 5 лет по существующим исследованиям, позволяющим оценить возможные эффекты генетических полиморфизмов на результативность терапии ИКТИ и развитие резистентности. Результаты: Герминальные мутации генов, связанные с микроокружением опухоли и генов PD-1, CTLA-4, а также гетерозиготное носительства гена системы человеческого лейкоцитарного антигена класса I (HLA-I) были ассоциированы с улучшением показателей эффективности и выживаемости у пациентов, получающих терапию ИКТИ. Несмотря на существующую проблему невысокой эффективности существующих биомаркеров при назначении иммунотерапии, роль молекулярно-генетических особенностей пациентов с опухолями различной локализации мало изучена и требует проведения дальнейших исследований в этой области. Заключение: Молекулярно-генетические особенности пациента играют важную роль в формировании ответа на терапию, в том числе противоопухолевую. Использование их в качестве дополнительных прогностических маркеров эффективности терапии ИКТИ у пациентов с различными опухолями позволит персонифицировать подход в лечении онкологических заболеваний, повысить точность отбора кандидатов и уменьшить риск возникновения иммуноопосредованных нежелательных явлений.
Ключевые слова: ингибиторы контрольных точек иммунитета, PD-1, лекарственная резистентность, почечно-клеточная карцинома, генетика, герминальные мутации
Введение. Злокачественные новообразования почек составляют около 2% глобальных диагнозов рака и смертей от него. Около 95% всех случаев рака почки представлены почечно-клеточным раком (ПКР, ПКК). В большинстве молекулярно-биологических и клинических исследований исследуют самую частую форму рака почки – светлоклеточную почечно-клеточную карциному (скПКК), составляющую около 75% случаев заболевания [1, 2]. За последние полвека заболеваемость ПКК в развитых странах увеличилась более чем вдвое. Согласно статистике GLOBOCAN, смертность от ПКК в 2020 году составила более 179 000 человек [3]. В России ПКК входит в число наиболее часто возникающих опухолей в общей структуре онкологических заболеваний. В 2019 году в РФ летальный исход при ПКК составил более 8000 человек [4].
Ингибиторы контрольных точек иммунитета (ИКТИ) произвели прорыв в системной противоопухолевой терапии [5-21], в частности, в лечении метастатической ПКК [1]. Их противоопухолевое действие основано на блокаде сигнальных путей CTLA-4 и PD-1/PD-L1 и усилении противоопухолевой активности лимфоцитов (Рис.1). Внедрение в клиническую практику ингибиторов контрольных точек иммунного ответа, блокирующих цитотоксический Т-лимфоцит-ассоциированный протеин 4 (CTLA-4), белок запрограммированной клеточной гибели-1 (PD-1) и лиганд рецептора запрограммированной клеточной гибели (PD-L1), позволило улучшить показатели выживаемости пациентов со злокачественными новообразованиями различной локализации, в том числе при ПКК.
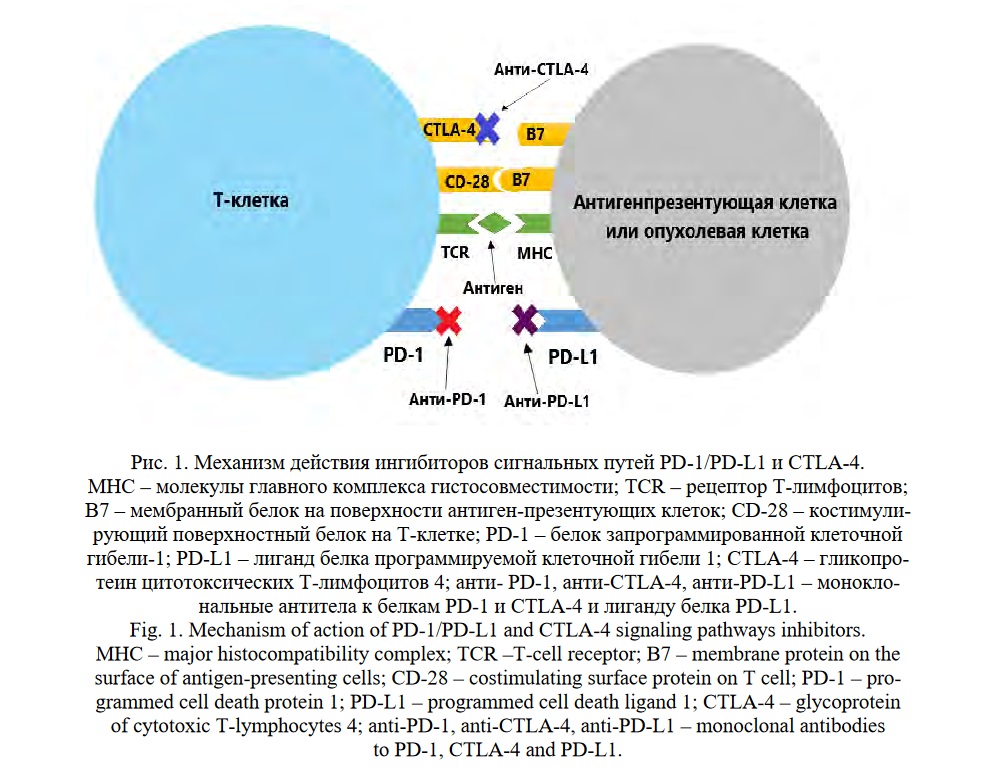
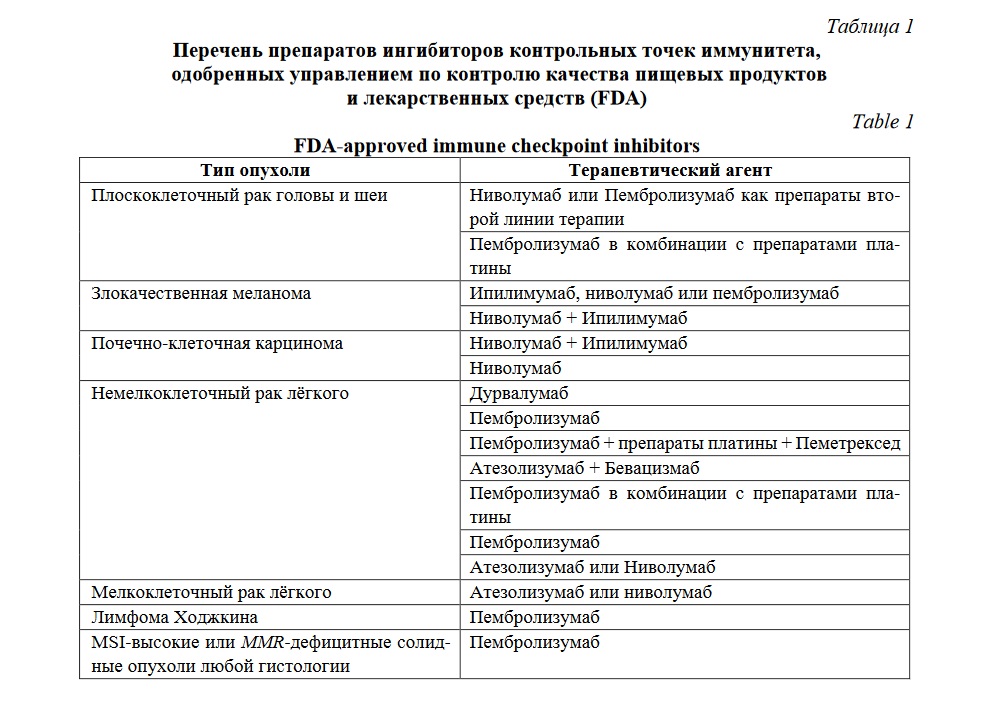
В настоящее время иммуноонкологические препараты, одобренные управлением по контролю качества пищевых продуктов и лекарственных средств (FDA), применяются в качестве монотерапии или в комбинации с другими группами препаратов для терапии широкого спектра раковых опухолей (Таблица 1).
Несмотря на улучшение прогноза выживаемости и большое разнообразие схем лечения препаратами данной группы, только небольшая часть пациентов демонстрирует ответ на терапию, большинство остается невосприимчивыми и резистентными к лечению [5, 18, 21, 22, 23].
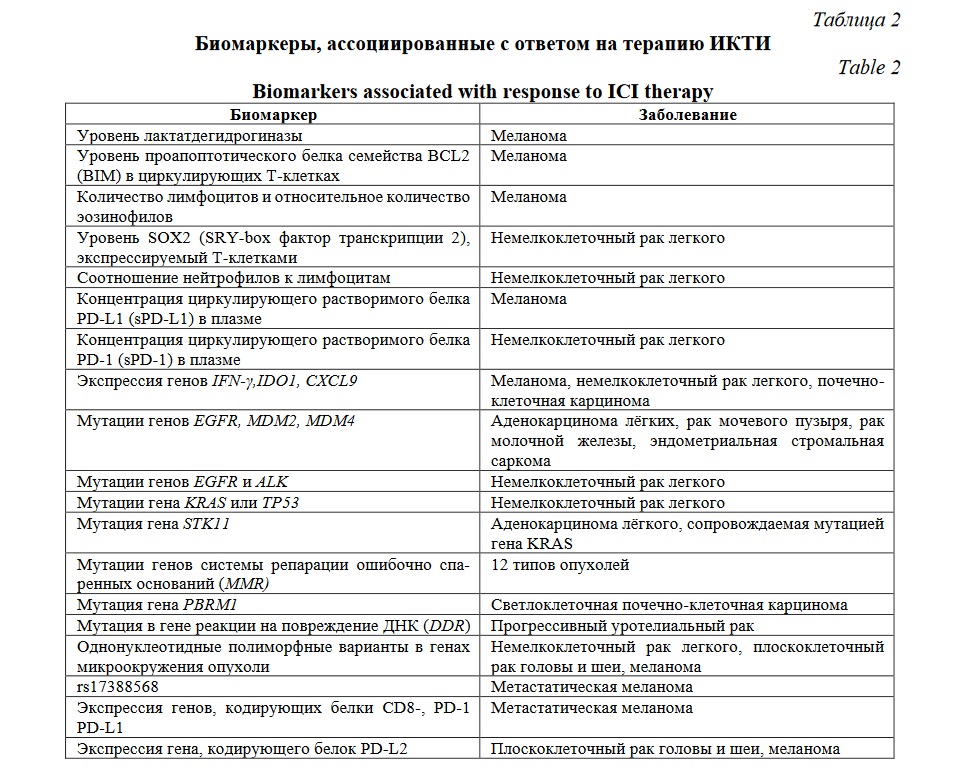
Существует несколько биомаркеров, ассоциированных с реакцией на терапию анти-PD-1/анти-PD-L1 антителами (Таблица 2). Эти биомаркеры охватывают как саму опухоль, так и её микроокружение и включают экспрессию белка PD-L1, уровень лактатдегидрогеназы (LDH), мутации генов системы восстановления несоответствия (репарации) ДНК (MMR), варианты генов, мутационную нагрузку опухоли и т.д. [18]. Однако, перечисленные биомаркеры имеют ряд недостатков, что требует всестороннего поиска кандидатов, которые смогут восполнить недостатки существующих предикторов [19].
Цель исследования. Анализ и обобщение результатов молекулярно-генетического изучения герминальных мутаций как возможных предикторов эффективности и безопасности при назначении терапии ИКТИ.
Индивидуальные генетические особенности пациента
На сегодняшний день большинство исследований, направленных на прогнозирование клинической эффективности иммуноонкологических препаратов, сосредоточены на анализе молекулярного портрета опухоли [5, 21, 24, 25] и её микроокружения [5, 21, 24, 26, 27]. Очень часто различия эффективности и токсичности любой терапии, в том числе противоопухолевой, зависят от индивидуальных генетических особенностей пациента [21, 24, 28]. В терапии рака важен комплексный подход и анализ как генома опухоли (соматический), так и генома самого пациента (герминальный), которые определяют исход лечения. Совокупность герминальных изменений в геноме пациента, кодируя соответствующие белки, обеспечивает все жизненно важные процессы в организме. Следовательно, изменчивость генома может иметь последствия для любой системы организма пациента. Герминальные патогенные мутации возникают в половых клетках наследуются в последующих поколениях, обнаруживаются во всех клетках организма [29] и редко встречаются в популяциях (частота их встречаемости меньше 1%). Однако, частота герминальных мутаций, ассоциированных с различными наследственными онкологическими заболеваниями [30, 31], с чувствительностью и резистентностью к определенному виду терапии, с развитием побочных реакций [32] может достигать порядка 15% [29].
Однонуклеотидные полиморфизмы (SNP) традиционно используются для понимания механизмов реакции на лекарственную терапию при различных заболеваниях и легче стандартизуются [19]. На сегодняшний день влияние генетических полиморфизмов ключевых генов на терапевтический ответ при лечении препаратами ИКТИ при различных онкологических заболеваниях мало изучено [21]. Выявление полиморфных вариантов генов как факторов эффективности иммунотерапии, а также факторов, способных предсказать токсичность, связанную с лечением, является актуальной задачей, решение которой будет способствовать формированию групп пациентов с наибольшей вероятностью отвечающих на терапию. Подобная информация целесообразна для применения в практической онкологии для персонифицированного подхода в иммунотерапии онкологических заболеваний различной локализации, в том числе при ПКК.
В связи с этим во всём мире активно ведутся исследования герминальных и соматических изменений, способных влиять на терапевтический ответ при лечении препаратами ИКТИ.
Иммунная система и эффективность терапии ИКТИ
Доказано, что гомеостаз иммунной системы организма и ключевые биологические механизмы, её контролирующие, играют важную роль в успешном применении препаратов ИКТИ [5]. Взаимосвязь канцерогенеза с воспалительным компонентом опосредуется через активацию факторов врожденного иммунитета. Иммунная система представляет собой сложный многоуровневый комплекс систем разных типов клеток, распознающих чужеродные клетки. Данный комплекс состоит из активизирующих и ингибирующих компонентов, включая многочисленные механизмы иммунологической толерантности. Нормальное функционирование иммунной системы подразумевает серию комплексных взаимодействий.
Регуляция защитных реакций организма, в том числе функций клеток-мишеней, осуществляется с помощью растворимых медиаторов, называемых цитокинами, на внеклеточном и внутриклеточном уровнях. Они являются ключевыми модуляторами тканевого повреждения, множества гомеостатических и воспалительных процессов, участвуют в патогенезе многих заболеваний. Цитокины классифицируют на отдельные группы на основе их структуры, связанного с ними сигнального пути, а также по характеру действия (интерлейкины, интерфероны, хемокины, факторы роста, фактор некроза опухоли (ФНО) [33]. Так, хемокины могут прямо и косвенно воздействовать на опухолевые клетки и способны регулировать их пролиферацию, миграцию, инвазию, метастазирование [34, 35]. Они также инициируют хемотаксис, который лежит в основе процесса «ускользания» опухолевых клеток от иммунного ответа; могут привести к иммунной толерантности и прогрессированию опухоли [36, 37]. Хемокины и цитокины также принимают участие в ангиогенезе опухоли, который необходим для оптимальной прогрессии онкологического процесса. Количество кровеносных сосудов в опухоли коррелирует с более высокой частотой метастазирования и более частыми рецидивами [37].
Не менее важную роль в формировании и регуляции иммунного ответа при раке играют интерлейкины, обеспечивающие медиаторное взаимодействие и связь иммунной системы с другими системами организма, а также интерфероны, которые оказывают антипролиферативную и противоопухолевую активность в отношении опухолевых клеток.
Определяющим фактором поддержания гомеостаза иммунной системы является наследственный компонент индивидуума [5]; генетические особенности лежат в основе различий в активации определенных типов иммунных клеток, в частности CD4+ и CD8+ Т-клеток [38], иммуностимулирующих молекул и генов, связанных с иммунитетом [39].
Так, в недавнем исследовании обнаружена взаимосвязь между SNP генов, связанными с микроокружением опухоли (CCL2, NOS3, IL1RN, IL12B, CXCR3 и IL6R) и эффективностью терапии ингибиторами контрольных точек иммунного ответа у пациентов с опухолями различной локализации, в том числе ПКК [25]. Безопасность данной группы препаратов была ассоциирована с SNP, расположенными в генах UNG, IFNW1, CTLA 4, PD-L1 и IFNL4 у тех же пациентов [25].
Герминальные мутации и прогнозирование ответа на терапию ИКТИ
При анализе однонуклеотидных полиморфных вариантов в генах PD-L1 показано, что пациенты с немелкоклеточным раком лёгкого – носители генотипов rs4143815*C/C и rs4143815*C/G гена PD-L1 при терапии ниволумабом демонстрировали лучшую эффективность и выживаемость без прогрессирования по сравнению с пациентами-носителями генотипа rs4143815*G/G [40-44]. Аналогичным образом, взаимосвязь частоты объективного ответа на терапию препаратами ИКТИ и выживаемости без прогрессирования была продемонстрирована у пациентов с генотипами rs2282055* G/G и rs2282055*G/T гена PD-L1 по сравнению с пациентами, являющимися носителями генотипа rs2282055* T/T [40, 41].
В другом исследовании показано, что носители минорного аллеля rs17388568*А демонстрировали ответ на терапию антителами к PD-1 рецептору [45].
У пациентов с меланомой, получающих терапию анти-PD-1 антителами, был проанализирован ряд однонуклеотидных полиморфизмов – rs36084323, rs11568821, rs2227981, rs10204225б rs2227982 и обнаружено, что носители генотипа rs11568821*G/G демонстрировали более полный терапевтический ответ по сравнению с носителями генотипа rs11568821*A/G. Это свидетельствует о том, что аллель rs11568821*G ассоциирован с лучшей выживаемостью без прогрессирования [46].
В работе, проведенной Mirjam de With с коллегами в 2021 году выявлено, что пациенты с сочетанием генотипов rs2227981*CT и rs2227981*TT гена PD-1 демонстрировали ухудшение общей выживаемости по сравнению с пациентами-носителями генотипа rs2227981*CС. Кроме того, у носителей PDCD1 804C > T обнаружили снижение доли периферических PD-1+CD4+ Т-клеток [47].
С другой стороны, в другом исследовании продемонстрировали влияние полиморфных вариантов гена белка 4 цитотоксических Т-лимфоцитов (CTLA-4) на ответ на терапию антителами к CTLA-4 у пациентов с меланомой [48].
Недавнее секвенирование нового поколения (NGS) позволило выявить взаимосвязь гетерозиготного носительства гена главного комплекса гистосовместимости (HLA-I), презентующего Т-клеткам опухолевые пептиды, с реакцией на терапию анти- PD-антителами и показателями выживаемости у пациентов с меланомой и раком легких [5]. Полученные данные соответствуют результатам более ранних исследований, которые показали, что эффективность терапии ИКТИ зависит от иммунной активности HLA-I [21, 49, 50, 51]. При этом эффективность терапии препаратами ИКТИ снижалась при соматической потере гетерозиготного носительства гена системы тканевой совместимости HLA-I в опухолевых клетках. Таким образом, это демонстрирует взаимосвязь презентации специфических опухолевых антигенов Т-эффекторным клеткам с разным носительством гена системы HLA-I [49]. А Hasan Ali O. с коллегами в своей работе выявили взаимосвязь развития побочных эффектов у пациентов со специфическими мутациями генов системы HLA-I при применении ИКТИ [52].
Заключение. Таким образом, несмотря на значительное количество проведенных исследований, до сих пор не выявлены какие-либо надежные маркеры, способные предсказать эффективность применения препаратов ИКТИ у пациентов с онкологическими заболеваниями. В связи с этим, понимание механизмов, лежащих в основе индивидуальных особенностей ответа на терапию препаратами ИКТИ, остается одной из ключевых задач персонализированного подхода в современной онкотерапии. Акцент на герминальных изменениях в геноме пациента и использование их в качестве прогностических факторов, ввиду их специфичности, легкодоступности и неинвазивности, позволят потенциально прогнозировать эффективность и безопасность применения препаратов ИКТИ при лечении пациентов. Перечисленные выше исследования демонстрируют ассоциацию герминальных полиморфных вариантов ряда генов с показателями общей выживаемости в ответ на иммунотерапию у пациентов с опухолями различной локализации и должны учитываться вместе со свойствами опухоли и её микроокружением в качестве прогностических биомаркеров эффективности терапии ИКТИ. Полученные на небольших выборках данные подтверждают роль генетических полиморфизмов в прогнозировании эффективности и безопасности иммунотерапии. Последующее изучение и подтверждение данных на больших выборках позволит в дальнейшем применять генетические полиморфизмы в качестве дополнительных биомаркеров прогнозирования эффективности и безопасности иммунотерапии.
Информация о финансировании
Работа проведена при поддержке Министерства образования и науки Российской Федерации [№AAA-A16-116020350032-1] и финансовой поддержки Санкт-Петербургского государственного университета (проект № 93025749).





















Список литературы