Роль высокопенетрантных мутаций в генах BRCA1 и CHEK2 в характере ассоциаций полиморфизма генов матриксных металлопротеиназ с раком молочной железы
Aннотация
Актуальность: Рак молочной железы (РМЖ) это опухоль молочной железы злокачественного характера, которая занимает ведущее место как в структуре онкозаболеваний у женщин, так и среди причин смертности женского населения от злокачественных новообразований. Роль генетических факторов в формировании РМЖ не вызывает сомнений. Цель исследования:Изучить роль высокопенетрантных мутаций в генах BRCA1 и CHEK2 в характере ассоциаций полиморфизма генов матриксных металлопротеиназ (ММР) с РМЖ. Материалы и методы:Для решения поставленной цели исследования были сформированы следующие три выборки: 26 больных РМЖ, имеющие высокопенетрантные мутации в генах BRCA1 (c.5266dup (5382insC), c.68_69del (185delAG), 2080delA) и CHEK2 (I157T)), 332 больных РМЖ без герминальных мутаций в генах BRCA1 (c.5266dup (5382insC), c.68_69del (185delAG), 2080delA, 4153delA), BRCA2 (6174delT) и CHEK2 (I157T) и 746 женщин контрольной группы. В работе изучены десять полиморфизмов пяти генов матриксных металлопротеиназ (MMP1, MMP2, MMP3,MMP8 и MMP9). Анализ ассоциаций проводился методом логистической регрессии. Результаты:Генотип ТТ rs1940475 MMP8 у больных РМЖ, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 (3,84%) встречается в 6-7 раз реже в сравнении как с пациентками, не имеющих этих мутаций (22,80% pperm=0,04), так и индивидуумами контрольной группы (26,18% ORcov=0,11 95%CIcov 0,01-0,81 pperm=0,03). Среди больных РМЖ, не имеющих высокопенетрантных мутаций в генах BRCA1 и CHEK2, с заболеванием ассоциирован полиморфизм гена ММР9: rs17576 (ORcov=0,81 pperm=0,03), rs2250889 (ORcov=0,61-0,66 pperm=0,03), rs3787268 (ORcov=2,03 pperm=0,04) и девять различных гаплотипов шести изученных локусов ММР9 (pperm<0,05). Заключение:Полиморфный локус rs1940475 MMP8 связан с риском развития РМЖ у женщин с высокопенетрантными мутациями в генах BRCA1 и CHEK2, а полиморфизм гена ММР9 ассоциирован с заболеванием у женщин, не имеющих данных мутаций
Рак молочной железы (РМЖ) это опухоль молочной железы злокачественного характера, имеющая эпителиальное происхождение [1]. Согласно данным мировой статистики (материалы Международного агентства по изучению рака) в настоящее время ежегодно среди населения мира выявляется более 2 миллионов новых случаев РМЖ [2]. Среди всех случаев рака (ежегодно в мире регистрируется 19,3 млн новых случаев онкопатологии) РМЖ является наиболее частым (11,7%) [2]. Среди женского населения удельный вес РМЖ среди всех онкозаболеваний составляет 24,5% [3].По данным Росстата в 2020 году в Российской Федерации количество женщин у которых был впервые в жизни установлен диагноз РМЖ составило 65,0 тыс. человек, а показатель заболеваемости был равен 82,8 на 100000 человек [4]. Обращает на себя внимание имеющаяся тенденция к росту заболеваемости РМЖ в РФ: стандартизованный показатель заболеваемости на 100000 населения (мировой стандарт) за последние десять лет вырос с 42,83 в 2008 г. до 51,63 в 2018 г., параметр среднегодового темпа прироста заболеваемости составил 1,97%, а показатель прироста заболеваемости за данный временной период – 22,15% [5].
Наследственные факторы играют важное значение в развитии РМЖ [6-10]. Проведенные к настоящему времени полно-геномные исследования (GWAS) РМЖ указывают на связь с заболеванием более 180 различных генетических вариантов [https://www.ebi.ac.uk/gwas/search?query=breast%20carcinoma], вовлеченность которых в формирование патологии зависит от таких факторов как молекулярный подтип опухоли (люминальный, тройной негативный и др.), наличие мутаций в генах BRCA1/2 и др. [11, 12, 13]. При этом следует отметить, что данные полиморфные локусы объясняют лишь 18% наследуемости заболевания [9], а с высокопенетрантными мутациями в генах BRCA1/BRCA2, CHEK2,ATM, PALB2 и ряде др. генов связано ≈5% РМЖ [6, 7]. Вместе с этим, по современным генетико-эпидемиологическим оценкам вклад наследственной компоненты в формирование РМЖ достигает до 31% [10]. Исходя из этого можно заключить, что несмотря на активное исследование генетических основ РМЖ, которое активно проводится многочисленными научными коллективами, в течении последних десятилетий, значительная часть генетических детерминант, вовлеченных в возникновение заболевания, до настоящего времени остается неизвестной, что диктует необходимость продолжения генетико-эпидемиологических исследований РМЖ.
Среди «потенциальных» генов-кандидатов РМЖ активно изучаются гены матриксных металлопротеиназ (ММР) [14, 15]. Связь продуктов экспрессии этих генов (одноименные белки) с заболеванием в настоящее время не вызывает сомнений [16, 17]. За счет своей коллагеназной активности, способности расщеплять проапоптотические факторы, мобилизовывать/активировать проангиогенные факторы (факторы роста), подавлять выработку ингибиторов ангиогенеза (ангиостатин, эндостатин) ММР обеспечивают деградацию компонентов стромальной соединительной ткани и базальной мембраны ММР, что имеет «ключевое» значение в процессах ангиогенеза, инвазии и метастазирования опухоли [16, 17].Повышенная экспрессия ММР (ММР1, ММР2, ММР9, др.) в очаге поражения индуцирует рост опухолевой ткани, инициирует ее инвазию и метастазирование [15, 18]. Имеются убедительные данные о связи ММР с выживаемостью больных РМЖ [16].
Связь функционально значимого полиморфизма генов ММР (ММР1, ММР2, ММР9, др.) с риском развития РМЖ активно изучается различными научными коллективами [15, 19-31 и др.]. При этом несмотря на значительный накопленный фактический материал по этой теме, следует констатировать, что эти данные нередко не согласуются между собой, в ряде случаев они противоречивы, а по отдельным локусам (например, rs17577 ММР9, rs1940475 ММР8 и др. [30, 31]) – единичны и фрагментарны. Например, значимая ассоциация rs1799750 гена MMP1 с РМЖ обнаружена в пяти работах, тогда как в десяти исследованиях такой связи выявлено не было [15, 19-22 и др.]. Противоречивые данные по ассоциации с РМЖ имеются в литературе для локуса rs3918242 MMP9: в одних работах полиморфный вариант Т демонстрировал «рисковое» значение для заболевания [23, 24, 25], по результатам других исследований этот локус не был связан с болезнью [19, 20, 21, 26, 27, 28] или наоборот генетический вариант ТТ проявлял «защитный» эффект для РМЖ [29]. Вышеуказанные данные диктуют необходимость продолжения исследований по этой теме с целью установления «значимых» для РМЖ полиморфных локусов генов ММР в отдельных этно-территориальных группах и в том числе Российской Федерации.
Целью данной работы явилось изучение роли высокопенетрантных мутаций в генах BRCA1 и CHEK2 в характере ассоциаций полиморфизма генов матриксных металлопротеиназ с раком молочной железы.
Материалы и методы исследования. Для решения поставленной цели исследования были сформированы следующие три выборки: 26 больных РМЖ, имеющие высокопенетрантные мутации в генах BRCA1 (c.5266dup (5382insC), c.68_69del (185delAG), 2080delA) и CHEK2 (I157T)), 332 больных РМЖ без герминальных мутаций в генах BRCA1 (c.5266dup (5382insC), c.68_69del (185delAG), 2080delA, 4153delA), BRCA2 (6174delT) и CHEK2 (I157T) и 746 женщин контрольной группы. Следует отметить, что среди 26 больных РМЖ, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 (доля этой группы пациентов среди всех больных РМЖ (n=358) равна 7,26 %), генетический вариант c.5266dup (5382insC) BRCA1 встречался у 22 пациенток (6,14 % среди всех больных РМЖ, n=358), мутация c.68_69del (185delAG) BRCA1 была выявлена у 1 женщины (0,28 %), мутация 2080delA BRCA1 диагностирована у 1 пациентки (0,28 %) и мутация I157T CHEK2 установлена у 2 женщин (0,56 %). Следует отметить, что мутация в гене BRCA2 (6174delT) не была выявлена среди больных РМЖ, поэтому при описании результатов работы для характеристики рассматриваемых групп больных РМЖ мы использовали термины «больные РМЖ, имеющие/не имеющие высокопенетрантные мутации в генах BRCA1 и CHEK2».
Обследование больных РМЖ и постановка диагноза заболевания проводились врачами-онкологами Белгородского областного онкологического диспансера в период 2010-2016 гг. Верификация диагноза выполнялась при патогистологическом исследовании образцов опухолевой ткани (материал для морфологического исследования был получен интраоперационно) [1]. Формирование контрольной группы (без клинико-анамнестических признаков РМЖ) проводилось на базе перинатального центра БОКБ (в ходе проф. осмотров). Возрастные характеристики больных и контроля были сопоставимы. Все больные РМЖ и женщины контрольной группы были русскими, проживали (родились) в Центральном Черноземье России [30, 31] и подписали информированное согласие на участие в исследовании (проведение исследования было согласовано с этическим комитетом медицинского института БелГУ).
Генотипирование образцов ДНК (получены из венозной крови обследуемых методом фенольно-хлороформной экстракции) проводилось на амплификаторе фирмы Bio-Rad (CFX96) методом TaqManзондов (использовалась технология real-time ПЦР) [32] с использованием реагентов, разработанных фирмой «Тест-Ген». При проведении экспериментальных исследований было выполнено ре-генотипирование части образцов (≈5%) с целью контроля качества генотипирования [33], подтвердившее полную (100%) воспроизводимость результатов. В работе изучались десять полиморфизмов пяти генов матриксных металлопротеиназ и в том числе шесть полиморфизмов генаMMP9 (rs2250889, rs17576, rs3787268, rs17577, rs3918249, rs3918242) и по одному полиморфизму генов MMP1 (rs1799750), MMP2 (rs243865),MMP3 (rs679620) и MMP8 (rs1940475). При отборе полиморфизмов для исследования учитывались определенные критерии [34]: их связь с РМЖ в ранее выполненных исследованиях, регуляторный потенциал (для его оценки был проведен in silico анализ материалов биоинформатической базы HaploReg [35]), частота альтернативного варианта в европейских популяциях не менее 0,05.
Связь полиморфизма с заболеванием оценивалась на основе рассчитанных методом регрессионного анализа в программе PLINK (версия 1.07) показателей отношения шансов (OR) и их 95% доверительного интервала (95%CI) [36] с включением в анализ ковариат- возраста и индекса массы тела (соответственно были рассчитаны ORcov и 95%CIcov). Для коррекции на множественные сравнения в работе использовались пермутационные процедуры [37]. При значении показателя pperm<0,05 различия считались статистически значимыми [38]. Для локусов генов ММР, связанных с заболеванием в рассматриваемых подгруппах больных (наличие или отсутствие высокопенетрантных мутаций в генах BRCA1 и CHEK2) проведен «детальный» анализ их регуляторного потенциала [39] (использовалась онлайн база эпигенетической информации HaploReg [35], GTExportal [40] и другие литературные материалы по этой теме).
Результаты и их обсуждение. Проведенное исследование распределения десяти полиморфных локусов генов MMP среди больных РМЖ, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 и не имеющих данные мутации, а также в контрольной группе не выявило достоверных отличий в наблюдаемом распределении генотипов по данным локусам в сравнении с ожидаемым распределением при выполнении закона Харди-Вайнберга (в работе вводилась поправка на множественные сравнения (поправка Бонферрони) в соответствии с количеством изучаемых локусов равная 10-pbonf >0,005 (0,05/10)) (таблица 1).
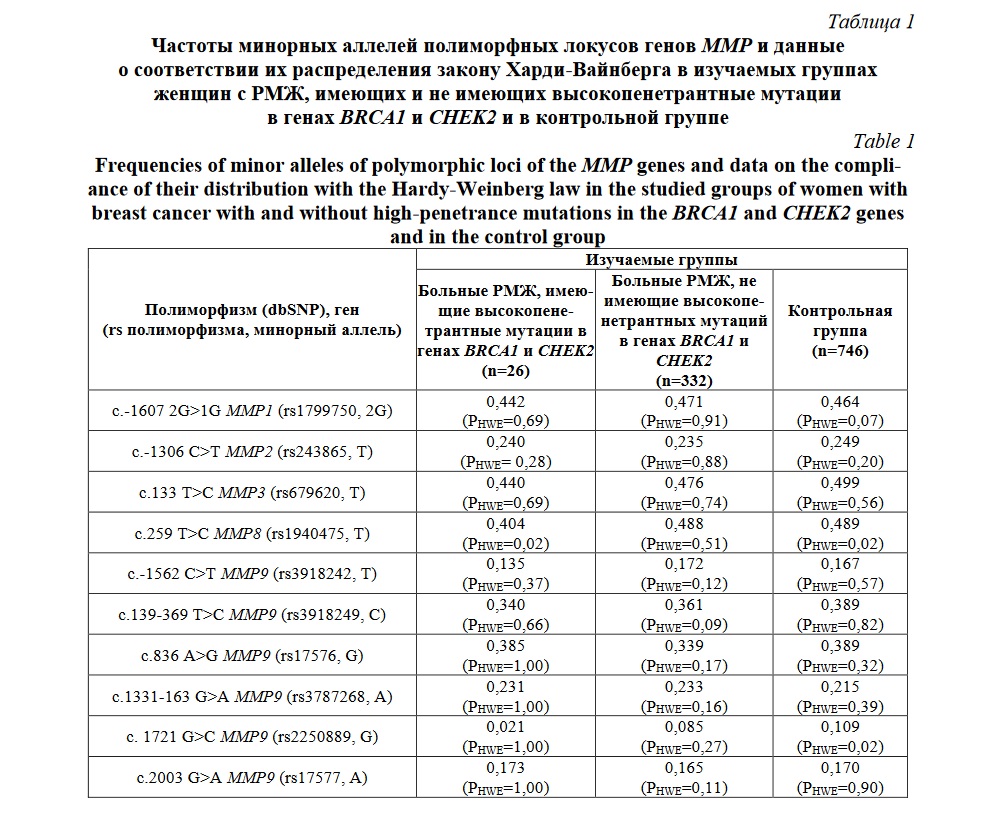
Данные таблицы 2 свидетельствуют о существенных различиях в характере ассоциации полиморфных локусов генов MMP у больных РМЖ, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 в отличие от больных РМЖ, не имеющих данные мутации. Так, среди больных РМЖ с высокопенетрантными мутациями в генах BRCA1 и CHEK2 с заболеванием ассоциирован полиморфный локус rs1940475 гена MMP8, причем аллельный вариант Т этого локуса согласно рецессивной генетической модели (TT vs СТ и CC) имеет протективное значение для развития патологии (ORcov=0,11 95%CIcov 0,01-0,81 pcov=0,03 pperm=0,03). Тогда как среди больных РМЖ, не имеющих высокопенетрантных мутаций в генах BRCA1 и CHEK2, с заболеванием ассоциированы три полиморфизма гена ММР9: rs17576, rs3787268 и rs2250889 (таблица 2).Следует отметить, что минорные аллельные варианты G rs17576 и rs2250889 проявляют «защитный» эффект при развитии патологии согласно аллельной (для rs17576: G vs A, ORcov=0,81 95%CIcov 0,66-0,98 pcov=0,03 pperm=0,03), аддитивной и доминантной (для rs2250889: GG vs СG vs CC, ORcov=0,66 95%CIcov 0,45-0,96 pcov=0,03 pperm=0,03 и GG и СG vs CC, ORcov=0,61 95%CIcov 0,40-0,94 pcov=0,03 pperm=0,03 соответственно) генетическим моделям (таблица 2). Наряду с этим минорный аллельный вариант А rs3787268 в рамках рецессивной генетической модели является фактором риска развития РМЖ у женщин, не имеющих высокопенетрантных мутаций в генах BRCA1 и CHEK2 (GG vs СG и CC ORcov=2,03 95%CIcov 1,05-3,95 pcov=0,04 pperm=0,04) (таблица 2).

Обнаружены ассоциации гаплотипов шести полиморфных локусов гена MMP9 (расположены на 20 хромосоме на расстоянии ≈7 kb, участок генома (hg38) 46007337 – 46014472) с РМЖ только среди женщин, не имеющих высокопенетрантных мутаций в генах BRCA1 и CHEK2. В этой группе женщин ассоциированы с РМЖ девять различных гаплотипов, в состав которых входят все шесть изученных в работе SNPs гена MMP9. Четыре из этих девяти гаплотипов повышают риск возникновения патологии: CA rs3918249-rs17576 (ORcov=2,03 p=0,013), ССА rs3918242-rs3918249-rs17576 (ORcov=2,49 p=0,007), ССAG rs3918242-rs3918249-rs17576-rs3787268 (ORcov=3,78 p=0,004), CAGCG rs3918249-rs17576-rs3787268-rs2250889-rs17577 (ORcov=3,01 p=0,008). Пять гаплотипов ассоциированы с низким риском развития заболевания: GG rs17576-rs3787268 (ORcov=0,63 p=0,004), GG rs3787268-rs2250889 (ORcov=0,58 p=0,015), GGC rs17576-rs3787268-rs2250889 ORcov=0,65 p=0,009), CGG rs3918249-rs17576-rs3787268 (ORcov=0,64 p=0,007), CGGC rs3918249-rs17576-rs3787268-rs2250889 ORcov=0,64 p=0,009). Все вышеуказанные данные подтверждены пермутационным тестом (pperm<0,05). В группе больных РМЖ с высокопенетрантными мутациями в генах BRCA1 и CHEK2 достоверных ассоциаций гаплотипов SNPs гена MMP9 с заболеванием не выявлено (pperm>0,05).
Проведенный сравнительный анализ распределения аллелей и генотипов изучаемых полиморфных вариантов генов ММР в двух группах больных – имеющих/не имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2, показал достоверные различия в распространенности генотипа ТТ rs1940475 гена MMP8 (рецессивная генетическая модель, TT vs СТ и CC): данный генетический вариант средибольных РМЖ, не имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2, встречается в 5,93 раза чаще чем среди пациенток у которых зарегистрированы данные мутации (22,80% и 3,84% соответственно, рcov=0,04 pperm=0,04) (таблица 3). Так же, следует отметить, что данный генетический вариант (генотип ТТ rs1940475 MMP8) в контрольной группе встречается с частотой 26,18% и этот показатель достоверно не отличается от аналогичного показателя у больных РМЖ, не имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 (22,80%, p>0,05), но при этом он в 6,81 раза превышает данный параметр в сравнении с больными РМЖ, имеющими высокопенетрантные мутации в генах BRCA1 и CHEK2 (3,84%, pperm<0,05) (таблица 2).
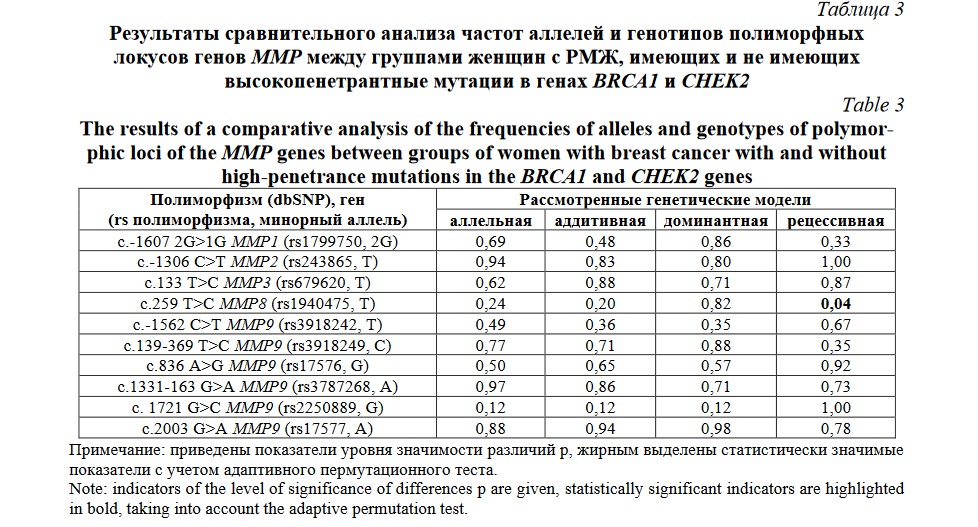
Таким образом, можно заключить, что существенно более низкая частота генотипа ТТ rs1940475 MMP8 (практически в 6-7 раз) является «специфической» характеристикой больных РМЖ у которых зарегистрированы высокопенетрантные мутации в генах BRCA1 и CHEK2, отличающая их как от пациенток с РМЖ, не имеющих этих мутаций, так и от индивидуумов контрольной группы. Наряду с этим, можно констатировать факт того, что полиморфизм гена ММР9, как самостоятельно (rs17576, rs2250889 и rs3787268), так и в составе девяти различных гаплотипов (rs17576, rs17577, rs3918249, rs3918242, rs2250889, rs3787268) определяет подверженность РМЖ у женщин, не имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2 и не связан с риском развития заболевания у женщин, у которых диагнозцированы данные мутации.
Имеющиеся литературные данные о связи полиморфизма rs1940475 MMP8 с РМЖ малочисленные и неоднозначные. В доступной нам литературе имеется лишь четыре работы по этому вопросу [41-44].В исследовании, проведенном Decock et al. [41] на выборке из 140 европейских пациенток с РМЖ (Бельгия), установлена связь rs1940475 MMP8 с развитием метастазов у больных РМЖ – протективным фактором метастазирования является аллельный вариант Т (OR=0,60, p=0,03), что согласуется с нашими данными о «защитной» роли генотипа ТТ rs1940475 MMP8 при формировании РМЖ среди женщин европейской части России, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2. Wang et al. [42] на выборке из 571 больных РМЖ и 578 контроля из этнической группы Han китайской популяции, с одной стороны, не выявили «главного» эффекта rs1940475 MMP8 при формировании заболевания (p>0,05), с другой стороны, показали значимые ассоциации этого полиморфизма с РМЖ в составе гаплотипа “AGTCA”, включающего полиморфные локусы rs3740938, rs2012390, rs1940475, rs11225394, и rs11225395 гена MMP8 (OR = 1,23; 95% CI = 1,00–1,51; Р = 0,048). Следует отметить, что в составе данного гаплотипа аллельный вариант Т rs1940475 MMP8 является фактором риска развития заболевания в китайской популяции [42], тогда как согласно наших данных генотип ТТ rs1940475 MMP8 имеет протективное значение при формировании патологии среди женщин европейской части России, имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2. Важно подчеркнуть, что у женщин европейской части России, у которых отсутствуют высокопенетрантные мутации в генах BRCA1 и CHEK2 (подавляющее большинство больных РМЖ, 92,74%) так же как и в исследовании Wang et al. [42] в китайской популяции rs1940475 MMP8 не ассоциирован с РМЖ. В двух исследованиях, выполненных в европейских популяциях, значимых ассоциаций rs1940475 MMP8 с РМЖ выявлено не было [43, 44]. Следует отметить, что в литературе имеются данные о связи rs1940475 MMP8 с другими формами онкопатологии (рак мочевого пузыря, желудка и др.) [45].
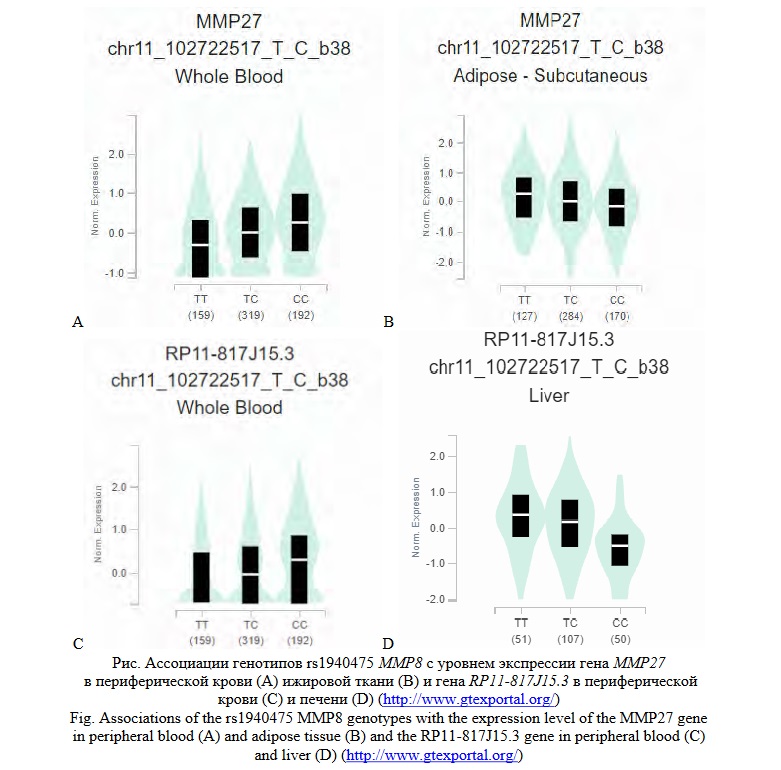
Согласно литературным материалам и базы данных по эпигенетике HaploReg полиморфизм гена MMP8 и в том числе rs1940475 имеет важное функциональное значение в организме [45, 46]: rs1940475 находится в экзоне гена MMP8 и является миссенс-мутацией, определяя аминокислотную замену Lys87Glu в соответствующем полипептиде (р.K87E), расположен в функционально активном регионе генома (так называемый «отрытый» хроматин), выполняющем регуляторную функцию (энхансер) в различных культурах клеток (мonocytes-CD14+ RO01746 рrimary сells и др.) и тканях (кровь (рrimary neutrophils from peripheral blood, рrimary monocytes from peripheral blood, рrimary mononuclear cells from peripheral blood и пр.) и др.) и в том числев органе-мишене при РМЖ - первичных клетках эпителия молочной железы (HMEC мammary еpithelial рrimary сells), входит в состав сайтов связывания ДНК с тремя факторами транксрипции (CIZ,Myc,NF-AT1). Причем, аллельный вариант Т, имеюший протективное значение для РМЖ у женщин с высокопенетрантными мутациями в генах BRCA1 и CHEK2 (в составе генотипа ТТ), связан с более высокой афинностью регуляторного мотива ДНК к факторам транскрипции CIZ и Myc, и более низкой его чувствительностью к транскрипционному фактору NF-AT1. Полиморфизм rs1940475 MMP8 ассоциирован с уровнем экспрессии гена ММР27 в периферической крови, жировой и мышечной тканях,гена RP11-817J15.3 в периферической крови и печени (данные [40]) (рисунок 1).
Имеются литературные данные о значимой роли в формировании РМЖ сильно сцепленного с rs1940475 MMP8 полиморфного локуса rs11225395 (r2=0,84 D' =1,00) [41, 42]. Данные о значимых ассоциациях rs11225395 MMP8 с РМЖ и патогенетически значимыми для РМЖ параметрами получены как для европейской (метастазирование при РМЖ, население Бельгии) [41] так и для азиатской (риск РМЖ, этническая группа Han Китая; стадии РМЖ и выживаемость больных, шанхайская выборка с РМЖ) популяций [41, 42]. Экспериментальные исследования убедительно показали, что полиморфизм rs11225395, расположенный в регионе промотора гена MMP8 на расстоянии 799 bp от сайта инициации транскрипции, связан с 1,8-кратным повышением активности промотора в MDA-MB-231 клетках рака молочной железы при наличии аллельного варианта Т в сравнении с аллельным вариантом С [41]. В дальнейших экспериментах установлено, что последовательность ДНК при наличии аллеля T в регионе rs11225395 взаимодействует с ядерными белками в MDA-MB-231 клетках рака молочной железы, тогда как при наличии аллеля С rs11225395 это ДНК-белковое взаимодействие не было обнаружено [41]. Результаты этих экспериментальных исследований лежат в основе предположения об ингибирующем действии MMP8 на процессы метастазирования рака молочной железы [41, 45].
ММP-8 также известная как нейтрофильная коллагеназа или коллагеназа-2 является эндопептидазой (относится к подсемейству коллагеназ), которая отвечает за гидролитическое расщепление значительно числа фибриллярных и нефибриллярных коллагенов (важнейшие компоненты внеклеточного матрикса) [41, 45]. Считается, что MMP8 проявляет некоторые противоопухолевые эффекты за счет расщепления субстрата Эфрин-B1 - принадлежит к семейству белков эфрина, которые передают сигналы, связанные с клеточной адгезией и ангиогенезом [45]. Другим механизмом противоопухолевого действия MMP8 может быть вызванное данной металлопротеиназой усиление экспрессию TGF-β1 вследствие активации PI3K/Akt/Rac1-пути [45]. Наряду с этим, следует отметить, неоднозначность имеющихся к настоящему моменту времени фактических данных о связи уровня ММР8 и РМЖ [45].
В настоящей работе показано, что полиморфизм гена ММР9, как самостоятельно (rs17576, rs2250889 и rs3787268), так и в составе девяти различных гаплотипов (rs17576, rs17577, rs3918249, rs3918242, rs2250889, rs3787268) определяет подверженность РМЖ у женщин, не имеющих высокопенетрантные мутации в генах BRCA1 и CHEK2. При этом минорные аллели G rs17576 (ORcov=0,81 pperm=0,03) и rs2250889 (ORcov=0,61-0,66 pperm=0,03) имеют протективное значение для РМЖ, а альтернативный вариант A rs3787268 (ORcov=2,03 pperm=0,04) является фактором риска развития заболевания. Следует отметить, что литературные данные о связи вышеуказанных полиморфизмов с РМЖ в разных популяциях неоднозначны (ниже приведены только данные экспериментальных исследований, результаты мета-анализов в связи с малочисленностью экспериментальных данных не учитывались): для rs2250889 MMP9 ассоциации с РМЖ показаны лишь в одной работе [47], тогда как в трех исследованиях статистически значимых результатов выявлено не было [28, 48, 49]; для rs3787268 MMP9 разнонаправленные связи с РМЖ (рисковое/протективное значение полиморфизма) обнаружены в работах [42, 48, 50] и отсутствие ассоциаций в исследовании [28]; для rs17576 не выявлены ассоциации с заболеванием в работах [28, 48], а противоположные результаты (рисковое/протективное значение полиморфизма) продемонстрированы в исследованиях [47, 51, 52].Следует отметить, что ММР9 так же известная как желатиназа В или коллагеназа IV типа за счет своего участия в процессах деградации коллагена IV типа и денатурированных коллагенов, согласно литературным данным, играет важную роль в процессах прогрессирования РМЖ и его метастазирования [23].
Заключение: В результате проведенного исследования установлены особенности ассоциаций полиморфизма генов ММР с РМЖ в зависимости от наличия/отсутствия у больных высокопенетрантных мутаций в генах BRCA1 и CHEK2. Выявлено, что полиморфный локус rs1940475 MMP8 связан с риском развития РМЖ у женщин с высокопенетрантными мутациями в генах BRCA1 и CHEK2, тогда как полиморфизм гена ММР9 ассоциирован с заболеванием у женщин, не имеющих данных мутаций.
Информация о финансировании
Работа выполнена при финансовой поддержке гранта Президента РФ «Изучение генетических факторов репродуктивного здоровья женщин» (МД-3284.2022.1.4).





















Список литературы