Генетические маркеры тяжелого течения преэклампсии
Aннотация
Актуальность: В современной медицине пристальное внимание уделяется вопросам снижения показателей материнской заболеваемости и смертности, в структуру которых значительный вклад вносят гипертензивные расстройства гестации, в особенности преэклампсия. Сложные патоморфологические механизмы, лежащие в основе этиопатогенеза данного осложнения беременности, происходят задолго до манифестации выраженных клинических признаков, что затрудняет раннюю диагностику преэклампсии и определяет актуальность поиска новых специфичных для преэклампсии маркеров, в том числе и генетических. Цель исследования:Оценить ассоциации полиморфных маркеров GWAS-значимых генов-кандидатов АГ с развитием преэклампсией тяжелого течения. Материалы и методы:В выборку женщин с умеренным течением преэклампсии вошло 145 индивидуумов, а в выборку женщин с тяжелой преэклампсией – 72. Всем обследуемым проведено генотипирование четырех полиморфных локусов (rs8068318 TBX2, rs2681472 ATP2B1, rs4387287 OBFC1, rs1799945 HFE). Изучено эмпирическое распределение генотипов и его соответствие теоретически ожидаемому в рамках закономерности Харди-Вайнберга. Проведен логистический регрессионный анализ и изучены ассоциации полиморфных локусов с развитием преэклампсии тяжелого и умеренного течения согласно четырем генетическим моделям, с введением поправок на ковариаты. Результаты:Установлено, что rs8068318 гена TBX2 ассоциирован с развитием преэклампсии тяжелого течения в рамках аллельной (OR = 0,45; рperm = 0,004), аддитивной (OR = 0,46; рperm = 0,002), доминантной (OR = 0,42; рperm = 0,005) и рецессивной (OR = 0,22; рperm = 0,04) генетических моделей. Полиморфный локус rs8068318 гена TBX2 локализован в области гиперчувствительности к ДНКазе, регионе регуляторных мотивов ДНК к четырем факторам транскрипции, области гистоновых меток, маркирующих энхансеры и промоторы в различных органах и тканях, отрицательно регулирует экспрессию гена TBX2-AS1 в жировой ткани и головном мозге, гена TBX2 в щитовидной железе, и ассоциирован с уровнем альтернативного сплайсинга генов TBX2-AS1 и RP11-332H18.5 в различных тканях. Заключение:Полиморфный маркер rs8068318 гена TBX2 ассоциирован с развитием преэклампсии тяжелого течения у населения Центрального Черноземья РФ.
Введение. В настоящее время, вопросы репродуктивного здоровья населения и факторов, его определяющих, рассматриваются как одни из наиболее значимых для современного населения [1]. Особое внимание уделяют показателям материнской и перинатальной смертности, как ключевым параметрам, по которым отображается экономическое и социальное благополучие населения отдельных стран. Гипертензивные расстройства беременности осложняют течение гестации в 5-15% всех случаев и ежегодно занимают лидирующие позиции среди причин материнской заболеваемости и смертности [2]. Особое место в данной группе заболеваний занимает преэклампсия (ПЭ), как наиболее опасное и непредсказуемое осложнение беременности, поскольку патоморфологические процессы, лежащие в основе патогенеза ПЭ, происходят задолго до манифестации выраженных клинических признаков данного осложнения гестации [3].
Принципиальное значение в клинической практике для определения прогноза и тактики ведения данной беременности имеет разделение ПЭ на два фенотипа: с ранним началом (до 34 недели гестации) и с поздним – после 34 недели гестации [4, 5]. Нарушение инвазии вневорсинчатого цитотрофобласта и неполноценное ремоделирование спиральных маточных артерий приводит к патоморфологическим изменениям маточно-плацентарного кровотока и ранней манифестации ПЭ, в основном, тяжелого течения [6]. Развитие поздней ПЭ обусловлено, преимущественно, наличием особенностей функционирования сердечно-сосудистой системы и гемодинамики матери и сопровождается умеренным течением [7]. Тяжелое течение ПЭ сопряжено с более высокими рисками развития неблагоприятных последствий. Так у 42 % женщин с тяжелым течением ПЭ в течение года после родоразрешения сохраняется стойкая артериальная гипертензия (АГ), а в отдаленном будущем риск развития сердечно-сосудистых заболеваний более чем в 10 раз выше в сравнении с поздним формированием ПЭ умеренного течения [4, 8]. Однако, не смотря на различные молекулярные механизмы, лежащие в основе патогенеза этих фенотипов, дифференцировать между собой два типа ПЭ только на основе определения биохимических параметров не представляется возможным, что предопределяет актуальность поиска новых специфичных для тяжелого течения ПЭ маркеров [4, 9].
Не вызывает сомнений роль наследственной предрасположенности как основополагающего фактора риска. Согласно литературным данным, вклад генетических детерминант в формирование ПЭ составляет более 50%, среди которых доминирующая роль отводится материнскому геному – более 35% [10]. Многими научными коллективами изучается вклад различных групп генов-кандидатов, биологические продукты которых вовлечены в патогенез данного осложнения гестации [11]. Широко проводятся репликативные исследования однонуклеотидных полиморфных вариантов различных генов, показавших значимые ассоциации с заболеваниями, имеющие с ПЭ единые биологические механизмы развития [12]. Особую нишу среди данных работ занимают репликативные исследования GWAS-значимых полиморфных локусов, ассоциированных с формированием АГ, как одного из «ключевых» клинических симптомов ПЭ [13, 14]. Однако, стоит отметить, что полученные данные зачастую неоднозначны и имеют низкую воспроизводимость в выборках с иными этно-территориальными характеристиками, в том числе, и на территории России, что обуславливает актуальность продолжения изучения молекулярно-генетических основ ПЭ [15].
Цель исследования. Оценить ассоциации полиморфных маркеров GWAS-значимых генов-кандидатов АГ с развитием ПЭ тяжелого течения у населения Центрального Черноземья РФ.
Материалы и методы исследования. Обследовано 217 женщин с ПЭ, не имеющих между собой родственных связей (средний возраст составил 26,52±5,51 лет). В выборки для данной работы включались женщины русского этноса, родившиеся и проживающие на территории Центрального Черноземья России и давшие добровольное согласие на участие в исследовании. Критерии исключения установлены следующие: диагностированные заболевания матки (фибромиома матки, аномалии развития внутренних половых органов), иная патология гестации (резус-конфликт, аномалии прикрепления и расположения плаценты, плацентарная недостаточность с синдромом задержки роста плода), врожденные пороки развития плода, многоплодная беременность. В выборку женщин с ПЭ умеренного течения вошло 145 лиц, а в выборку женщин, у которых отмечались клинические признаки тяжелого течения ПЭ – 72 индивидуума. Диагноз ПЭ устанавливался при регистрации артериальной гипертензии при двукратном измерении на одной руке с интервалом не менее 15 минут, и протеинурии. Верификация диагноза ПЭ тяжелого течения осуществлялась при регистрации тяжелой АГ (ДАД≥110 мм рт. ст. и/или САД≥160 мм рт. ст.) и суточной протеинурии более 5 г/л в сочетании с одним или более критериев тяжелой ПЭ, указанным в клинических рекомендациях «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2016). При исключении же данных признаков тяжелой ПЭ и наличии только умеренного повышения АД (САД = 140-159 мм рт. ст. и/или ДАД = 90-109 мм рт. ст.) и протеинурии ≥0,3 г/л – устанавливался диагноз ПЭ умеренного течения [16]. Клиническое, клинико-анамнестическое и клинико-лабораторное обследование беременных проводились на базе Перинатального центра «Белгородской областной клинической больницы Святителя Иоасафа» под контролем этического комитета медицинского института.
Молекулярно-генетическое исследование четырех однонуклеотидных полиморфизмов (rs8068318 TBX2, rs2681472 ATP2B1, rs4387287 OBFC1, rs1799945 HFE) осуществлялось стандартным методом ПЦР-синтеза с использованием TagMan зондов на амплификаторе CFX-96 Real Time System (BioRad, США). Выделение геномной ДНК производилось из лейкоцитов периферической венозной крови обследуемых женщин методом фенол-хлороформной экстракции [17]. При помощи спектрофотометра Nanodrop 2000 (Thermo Scientific) проведено измерение концентрации и оценка качества выделенной ДНК. Основанием для включения полиморфных вариантов в данное исследование и последующего генотипирования являлось наличие ассоциаций с развитием АГ, которые достигли полногеномного уровня значимости (p≤5×10-8) по данным двух и более GWAS-исследований и наличие значимого регуляторного потенциала согласно материалам онлайн-ресурса HaploReg (v.4.1) (http://compbio.mit.edu/HaploReg). Выполнен сравнительный анализ эмпирического распределения генотипов рассматриваемых полиморфных маркеров и его соответствие теоретически ожидаемому согласно закономерности Харди-Вайнберга (отклонения принимались за статистически значимые при p≤0,05). Проведен логистический регрессионный анализ и изучены ассоциации полиморфных локусов (rs8068318 TBX2, rs2681472 ATP2B1, rs4387287 OBFC1, rs1799945 HFE) с развитием ПЭ тяжелого и умеренного течения. Тестировались четыре генетические модели: аллельная, аддитивная, рецессивная и доминантная [18] с введением поправок на ковариаты (возраст, наследственная отягощенность по ПЭ, индекс массы тела в период, предшествующий наступлению гестации). В рамках генетического анализа выполнялась коррекция на множественные сравнения с использованием адаптивного пермутационного теста (pperm). За статистически значимый принимался уровень pperm <0,05. Для оценки ассоциативных связей полиморфных вариантов с ПЭ были определены показатели ОR (отношение шансов) и 95%CI (95% доверительный интервал для OR) [19]. Вышеуказанные статистические вычисления производились в программе PLINK v. 2.050 (http://zzz.bwh.harvard.edu/plink).
Для полиморфных вариантов, показавших значимые ассоциации с развитием ПЭ тяжелого течения, проведена оценка их связи с уровнем транскрипционной активности (eQTL) и альтернативного сплайсинга генов (sQTL) [20] согласно данным проекта Genotype-Tissue Expression (GTEx) (http://www.gtexportal.org/), а эпигенетические эффекты рассмотрены с помощью онлайн-сервиса HaploReg (v4.1), http://archive.broadinstitute.org/mammals/haploreg/haploreg.php).
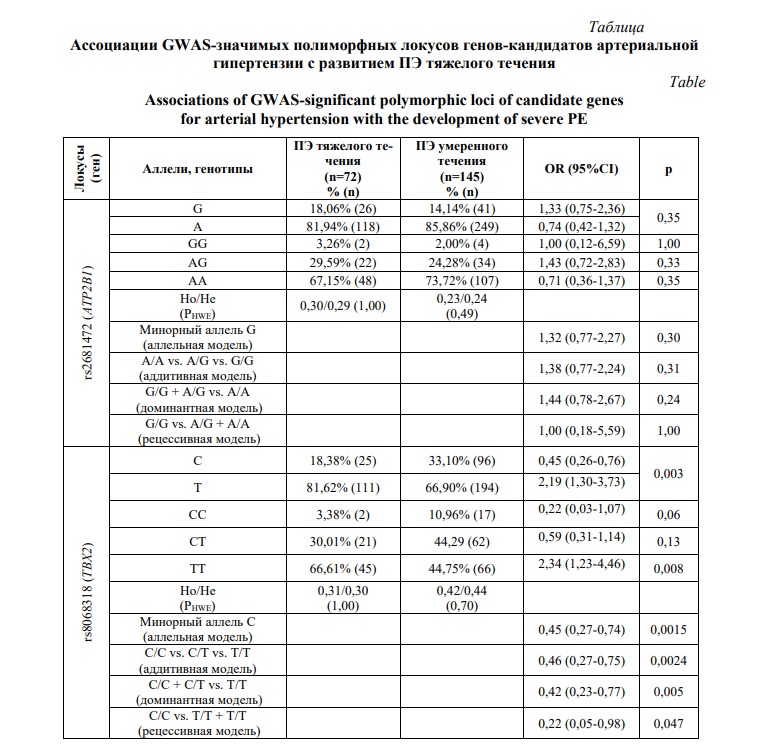
Результаты и их обсуждение. Проведенный популяционно-генетический анализ наблюдаемого распределения генотипов по изучаемым полиморфным вариантам генов-кандидатов АГ (rs8068318 TBX2, rs2681472 ATP2B1, rs4387287 OBFC1, rs1799945 HFE) показал его соответствие ожидаемому распределению согласно закономерности Харди–Вайнберга.
Выявлена ассоциативная связь полиморфного локуса rs8068318 гена TBX2 с развитием ПЭ тяжелого течения. Согласно полученным в работе данным, аллель Т (OR = 2,19; 95CI = 1,30-3,73; p = 0,003) и генотип ТТ (OR = 2,34; 95CI = 1,23-4,46; p = 0,008) rs8068318 гена TBX2 ассоциирован с увеличением риска развития ПЭ тяжелого течения, а минорный аллель С и генотип СС выступает в роли «протективного» фактора согласно всем четырем тестируемым генетическим моделям: аллельной (OR = 0,45; 95% CI 0,27-0,74; p = 0,0015; рperm = 0,004), аддитивной (OR = 0,46; 95% CI 0,27-0,75; p = 0,0024; рperm = 0,002), доминантной (OR = 0,42; 95% CI 0,23-0,77; p = 0,005; рperm = 0,005) и рецессивной (OR = 0,22; 95% CI 0,05-0,98; p = 0,047; рperm = 0,04) (Табл. 1).
Для полиморфного маркера rs8068318 гена TBX2, показавшему значимые ассоциации с развитием ПЭ тяжелого течения в рамках настоящего исследования, проведена оценка функционального потенциала с использованием данных онлайн-ресурса HaploReg (v.4.1). Получено, что изучаемый SNP локализован в регионе гиперчувствительности к ДНКазе, регионе регуляторных мотивов ДНК к четырем транскрипционным факторам: MZF1:1-4, Pax-5, RXRA, SPIB, в области гистоновых меток H3K27ac и H3K9ac, маркирующих, соответственно, активные энхансеры и промоторы в патогенетических значимых для развития ПЭ тканях (плаценте, надпочечниках и почках плода, яичниках, различных отделах головного мозга, культуре клеток фибробластов и др.). Согласно материалам ресурса GTExportal, изучаемый полиморфный локус rs8068318 гена TBX2 отрицательно регулирует экспрессию гена TBX2-AS1 в висцеральной жировой клетчатке (β= -0,23; р=9,1×10-11), коре головного мозга (β= -0,35; р=5,7×10-9) и гена TBX2 в щитовидной железе (β= -0,26; р=6,9×10-12), ассоциирован с уровнем альтернативного сплайсинга генов TBX2-AS1 и RP11-332H18.5 в висцеральной жировой клетчатке (р=1,1×10-60), яичниках (р=2,9×10-12), матке (р=2,6×10-15) и др. Для данного полиморфного локуса установлено 15 SNPs, находящихся с ним в неравновесии по сцеплению (r2≥0,8) и имеющих значимый регуляторный потенциал. 7 из 15 сцепленных SNPs находятся в регионах ДНК, взаимодействующих с 4 регуляторными белками: POL 2, GATA2, SUZ12, CHD 2. Непосредственно изучаемый локус не относится к несинонимическим заменам, но один из сцепленных с ним SNP (rs1057987) является миссенс-мутацией (r2=1, D´=1), обуславливающей замену серина на аргинин (Ser609Arg) в аминокислотной последовательности в полипептидет T-box транскрипционного фактора (TBX2).
По данным GWAS-каталога, полиморфный локус rs8068318 гена TBX2 показал значимые ассоциации (p≤5×10-8) с параметрами артериального давления (АД) и АГ по данным двух полногеномных исследований [21, 22]. Выявлено, что аллель Т исследуемого полиморфного варианта ассоциирован с развитием АГ и повышением показателей САД и ДАД в европейской популяции [21], в то время как аллель С выполняет «проективную» роль в отношении развития АГ и связан с более низким уровнем АД (САД, ДАД, СрАД) [22], что полностью согласуется с полученными нами данными о «протективной» роли аллеля С для развития ПЭ тяжелого течения. В рамках полногеномного исследования, проведенного Chambers et al. (2010), установлено, что rs8068318 гена TBX2 вовлечен в регуляцию экскреторной функции почек ― аллель С ассоциирован со снижением уровня креатинина (OR=0,80; p=3,4×10-10) [23].
Ген TBX2 кодирует белок T-box transcription factor 2 (TBX2), являющимся регулятором транскрипционной активности различных генов (https://www.uniprot.org/) и относится к членам филогенетически консервативного семейства генов с общим ДНК-связывающим мотивом (домен T-box) [24]. Ген TBX2 вовлечен в процессы морфогенеза различных органов и систем органов в эмбриогенезе, а также выступает ключевым звеном регуляции механизмов клеточной пролиферации, дифференцировки, апоптоза и старения клеток [25-28]. В работе Fernando F. et al. (2021) получено, что при сверхэкспрессии TBX2 в клетках миометрия снижается высвобождение провоспалительных цитокинов (IL-1β, IL-2), хемоаттракантов моноцитов (CCL3, CXCL13) и фактора некроза опухоли α (TNFα), и одновременно увеличивается продукция хемокинов классов CCL7, CXCL6, CCL13, играющих важную роль в инициации родовой деятельности [29]. Аллель C полиморфного локуса rs8068318 гена TBX2 повышает афинность (рассчитывалась как разница между LOD scores альтернативного (alt) аллеля и референсного (ref)) регуляторного мотива ДНК к фактору транскрипции RXRA (∆LOD = 2,3). RXRA представляет собой X-рецептор ретиноидной кислоты и лиганд-индуцируемый транскрипционный фактор, дифференциально экспрессируемый в плаценте и участвующий в регуляции трансформации пролиферативного типа трофобласта в инвазивный для последующей перестройки спиральных маточных артерий [30]. Отмечается сверхэкспрессия гена RARRES1, индуцируемая посредством активации RXRA и RARA в клетках трофобласта в плацентах женщин, гестация которых осложнялась ПЭ [31]. Таким образом, выявленные медико-биологические эффекты полиморфного варианта rs8068318 гена TBX2 имеют важное этиопатогенетическое значение при формировании ПЭ.
Заключение. Полиморфный маркер rs8068318 гена TBX2 ассоциирован с развитием ПЭ тяжелого течения у населения Центрального Черноземья РФ согласно аллельной (OR = 0,45; рperm = 0,004), аддитивной (OR = 0,46; рperm = 0,002), доминантной (OR = 0,42; рperm = 0,005) и рецессивной (OR = 0,22; рperm = 0,04) генетических моделей. Полиморфный локус rs8068318 гена TBX2 локализован в регионе гиперчувствительности к ДНКазе, регионе регуляторных мотивов ДНК к четырем транскрипционным факторам, области гистоновых меток H3K27ac и H3K9ac, маркирующих активные энхансеры и промоторы в патогенетически значимых для развития ПЭ тканях (плаценте, надпочечниках и почках плода, яичниках, различных отделах головного мозга, культуре клеток фибробластов и др.). Полиморфный вариант rs8068318 гена TBX2 отрицательно регулирует экспрессию гена TBX2-AS1 в висцеральной жировой клетчатке и коре головного мозга, а также гена TBX2 в щитовидной железе, и ассоциирован с уровнем альтернативного сплайсинга генов TBX2-AS1 и RP11-332H18.5 в висцеральной жировой клетчатке, яичниках, матке и др.





















Список литературы