Генетические детерминанты уровня половых гормонов у больных эндометриозом
Aннотация
Актуальность: Эндометриоз – это хроническое гормонозависимое воспалительное заболевание, определяемое наличием очагов эндометриальной ткани вне полости матки. Генетические факторы занимают лидирующие позиции в этиопатогенезе данного заболевания. При эндометриозе наблюдается выраженный гормональный дисбаланс в половых гормонах как в очаге поражения, так и в организме больной женщины в целом. Цель исследования:Изучить ассоциации полиморфизма генов половых гормонов с гормональным профилем пациенток с эндометриозом. Материалы и методы:В группу исследования вошли 103 пациентки с эндометриозом, у которых были изучены уровни половых гормонов (фолликулостимулирующий гормон, лютеинизирующий гормон, пролактин, эстрадиол, прогестерон, тестостерон и дегидроэпиандростерон). В работе проведено генотипирование 9 однонуклеотидных полиморфизмов (SNP) GWAS-значимых генов половых гормонов (rs148982377 ZNF789, rs34670419ZKSCAN5, rs11031002 and rs11031005 FSHB, rs112295236 SLC22A10, rs117585797 ANO2, rs117145500 CHD9, rs727428 SHBG, rs1641549 TP53). Методом линейной регрессии исследованы ассоциации SNPs с уровнем половых гормонов у больных эндометриозом. Результаты:Среди пациенток с эндометриозом уровень эстрадиола в сыворотке крови ассоциирован с полиморфными локусами rs148982377 ZNF789 (β=-0,488 - -0,445, pperm≤0,050)и rs34670419 ZKSCAN5 (β=-0,544 - -0,449, pperm≤0,050), лютеинизирующего гормона – rs117585797 ANO2 (β=0,618 - 0,709, pperm≤0,050), прогестерона – rs117145500 CHD9 (β=0,365 - 0,429, pperm<0,050), пролактина – rs1641549 TP53 (β=-0,306 - -0,218, pperm<0,050), тестостерона – rs148982377 ZNF789 и rs34670419 ZKSCAN5 (β=0,492, pperm=0,050). Заключение:Установлены ассоциации полиморфизма генов-кандидатов с уровнем половых гормонов у пациенток с эндометриозом
Введение. Эндометриоз представляет собой гинекологическое заболевание, которое характеризуется ростом эндометриоподобных тканей внутри и снаружи полости малого таза [1]. Распространенность данного заболевания колеблется от 2% до 11% среди женщин, не имеющих клинически значимой симптоматики, от 5% до 50% среди женщин, страдающих бесплодием и от 5% до 21% среди женщин с хронической тазовой болью [2, 3]. Эндометриоз проявляется различными симптомами, включая дисменорею, хроническую тазовую боль, бесплодие диспареунию и т.д. [3, 4] и имеет широкий спектр социально-экономических последствий для женщин, страдающих данным заболеванием, их семей, а также общества в целом [4-7].
Молекулярные механизмы эндометриоза остаются весьма «загадочными» и в значительной степени неизвестными [8, 9]. Этиопатогенез данного заболевания включает множество гормональных, воспалительных, генетических, иммунологических факторов, а также факторов окружающей среды [4, 10]. Генетические факторы играют важную роль в этиологии эндометриоза [8, 11-16]. Результаты близнецовых исследований показали, что генетические влияния на развитие эндометриоза весьма значительны и составляют 47% [11]. Lee et al. оценили SNP-наследуемость эндометриоза в 26% [12]. В полногеномном исследовании (GWAS) Sapkota et al. выявлено, что 5,19% вариабельности эндометриоза определяется 19 GWAS-значимыми локусами [8]. Таким образом, показатель вклада наследственных факторов в развитие эндометриоза, полученный на основе известных GWAS-значимых полиморфизмов (≈5%), почти в 10 раз меньше аналогичного показателя, полученного на основе данных близнецовых исследований (47%). Однако, следует отметить, что на сегодняшний день мало что известно о конкретных генетических вариантах, которые способствуют возникновению данного заболевания [15, 17, 18].
Эндометриоз – гормонозависимое гинекологическое заболевание, связанное с половыми гормонами (эстрадиол, прогестерон, фолликулостимулирующий гормон и др.) [5, 6, 9]. Многочисленные ассоциативные исследования, включая GWAS, показали взаимосвязь между эндометриозом и полиморфизмом генов половых гормонов (FN1, FSHB, ESR1, CCDC170, LHCGR, SYNE1 и др.) [7, 8, 19, 20]. В то же время имеются GWAS данные о взаимосвязи ряда SNP с уровнем нескольких половых гормонов (эстрадиола, глобулина, связывающего половые гормоны, индекса свободных андрогенов, тестостерона, дегидроэпиандростерона, лютеинизирующего гормона, фолликулостимулирующего гормона, прогестерона) [21-24]. Можно предположить, что GWAS-значимые полиморфизмы уровня половых гормонов могут быть вовлечены в развитие эндометриоза. Следует отметить, что в предыдущих исследованиях только для некоторых из этих полиморфных локусов промотора FSHB (rs11031002 и rs11031005) и сильно связанных с ними SNP (rs74485684, rs11031010r, s10835638, rs1782507, rs555621) были продемонстрированы ассоциации с эндометриозом [7, 8, 19, 25, 26]. И наоборот, менделевский рандомизационный анализ данных GWAS по эндометриозу и половым гормонам [8, 23], выполненный Garitazelaia et al. не выявил достоверной связи между эндометриозом и уровнем репродуктивных гормонов [26]. Существующая неопределенность в этом вопросе диктует необходимость продолжения исследований по этой проблеме.
Цель исследования. Изучение ассоциаций полиморфизма генов-кандидатов с уровнем половых гормонов у пациенток с эндометриозом.
Материалы и методы исследования. Группа исследования, включавшая 103 пациентки с эндометриозом, формировалась на базе гинекологического отделения БОКБ. Данные женщины были уроженками Центрального Черноземья России русской национальности [27, 28, 29] и дали согласие на участие в исследовании. Средний возраст больных эндометриозом составил 34,19±6,42 лет.
В работе был изучен уровень следующих половых гормонов у пациенток с эндометриозом: фолликулостимулирующий гормон, лютеинизирующий гормон, пролактин, эстрадиол, прогестерон, тестостерон и дегидроэпиандростерон. Для генотипирования нами были отобраны 9 GWAS-значимых полиморфных локусов генов половых гормонов (rs148982377, rs34670419, rs11031002, rs11031005, rs112295236, rs117585797, rs117145500, rs727428, rs1641549), которые характеризуются выраженным регуляторным потенциалом и оказывают влияние на экспрессию генов. На амплификаторе Bio-Rad (CFX96) с использованием наборов реагентов, синтезируемых ООО ТестГен (г. Ульяновск) выполнялось генотипирование анализируемых молекулярно-генетических маркеров (применялся метод TaqMan зондов) [30, 31].
Изучение ассоциаций полиморфных локусов генов половых гормонов с гормональным профилем у пациенток с эндометриозом осуществлялось в программе PLINK методом линейной регрессии. В связи с тем, что распределение рассматриваемых количественных показателей, характеризующих уровень половых гормонов, отличалось от нормального (р<0,05), мы использовали в расчетах их трансформированные значения.
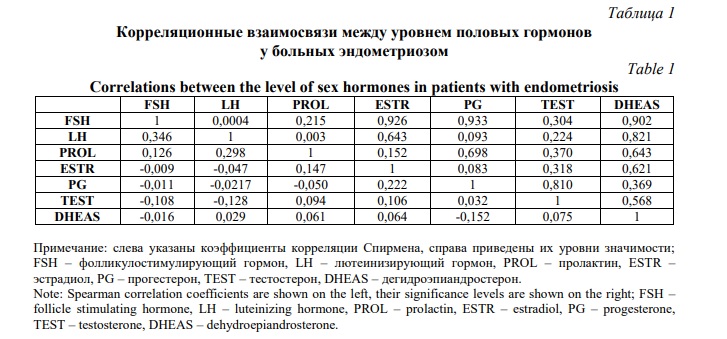
Результаты и их обсуждение. Распределение всех анализируемых 9 молекулярно-генетических маркеров, включенных в исследование, соответствует равновесию Харди-Вайнберга (р>0,05), также частота редкого аллеля (MAF) >5%. Изучены корреляционные взаимосвязи между уровнем половых гормонов у больных эндометриозом (Табл. 1). Выявлены положительные корреляции между уровнем фолликулостимулирующего и лютеинизирующего гормонов (R=0,346, р=0,0004). Также получены положительные корреляции между уровнем лютеинизирующего гормона и пролактина (R=0,298, р=0,003).
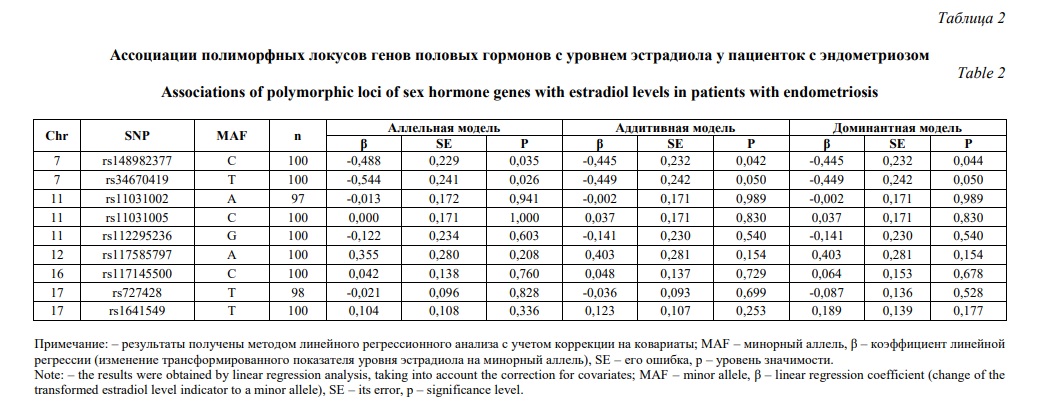
На следующем этапе исследования проанализированы связи полиморфных локусов генов половых гормонов с гормональным профилем у пациенток с эндометриозом. Результаты представлены в таблицах 2-5 (приведены данные по тем половым гормонам, по которым получены статистически достоверные данные). С уровнем эстрадиола у пациенток с эндометриозом ассоциированы два полиморфных локуса rs148982377 и rs34670419 (Табл. 2). Молекулярно-генетический маркер rs148982377 связан с концентрацией эстрадиола в рамках аллельной (β=-0,488, р=0,035, pperm=0,050), аддитивной (β=-0,445, р=0,042, pperm=0,050) и доминантной (β=-0,445, р=0,044, pperm=0,050) моделей. Полиморфный локус rs34670419 также ассоциирован с уровнем эстрадиола в рамках трех моделей: аллельной (β=-0,544, р=0,026, pperm=0,047), аддитивной (β=-0,449, р=0,050, pperm=0,049) и доминантной (β=-0,449, р=0,050, pperm=0,050). Следует отметить, что минорные аллели С rs148982377 и Т rs34670419 связаны с более низкой концентрацией эстрадиола в сыворотки крови больных эндометриозом (β<0).
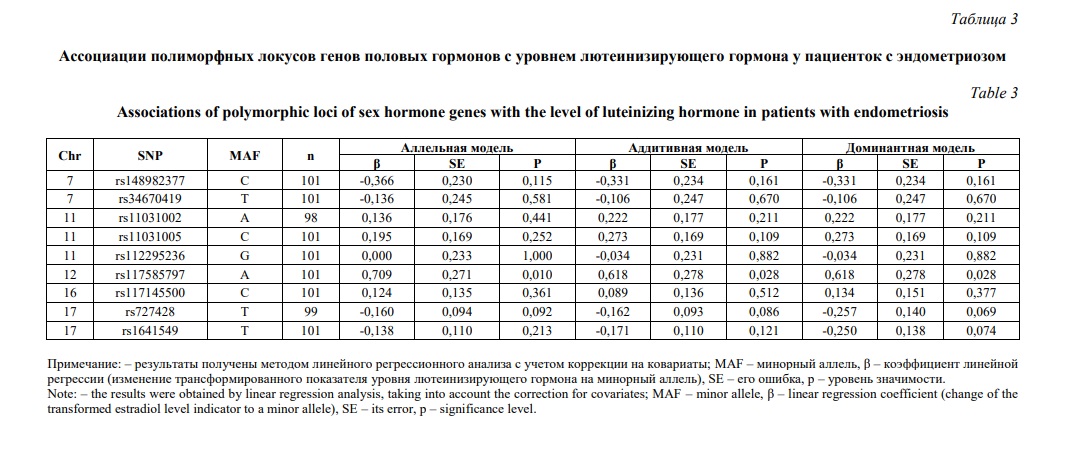
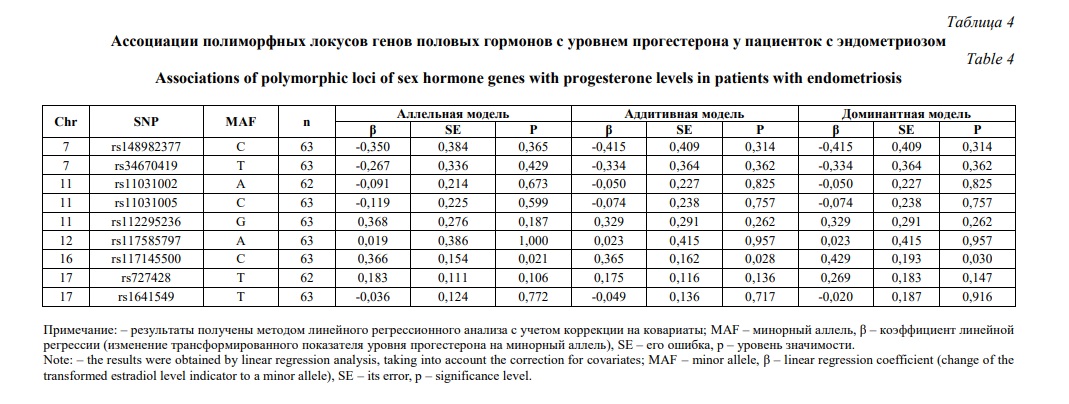
Молекулярно-генетический маркер rs117585797 ассоциирован с уровнем лютеинизирующего гормона у пациенток с эндометриозом согласно аллельной (β=0,709, р=0,010, pperm=0,050), аддитивной (β=0,618, р=0,028, pperm=0,030) и доминантной (β=0,618, р=0,028, pperm=0,033) моделей (таблица 3). При этом аллель А rs117585797 связан с более высокой концентрацией лютеинизирующего гормона в сыворотки крови женщин, имеющих эндометриоз (β>0). Уровень прогестерона у больных эндометриозом детерминируется полиморфным локусом rs117145500 в рамках аллельной (β=0,366, р=0,021, pperm=0,044), аддитивной (β=0,365, р=0,028, pperm=0,036) и доминантной (β=0,429, р=0,030, pperm=0,020) моделей (таблица 4). Следует подчеркнуть, что аллель С rs117145500 ассоциирован с более высоким содержанием прогестерона в сыворотки крови у пациенток с эндометриозом (β>0)
С концентрацией пролактина у женщин с эндометриозом связан молекулярно-генетический маркер rs1641549 согласно аллельной (β=-0,218, р=0,038, pperm=0,032), аддитивной (β=-0,233, р=0,022, pperm=0,019) и доминантной (β=-0,306, р=0,020, pperm=0,022) моделей (таблица 5). Следует отметить, что с более низким уровнем пролактина в сыворотке крови больных эндометриозом ассоциирован аллель Т rs1641549 (β<0). Установлена ассоциация гаплотипа TG полиморфных локусов rs148982377-rs34670419 с концентрацией тестостерона (β=0,492, р=0,037, pperm=0,050). Данный гаплотип TG rs148982377-rs34670419 связан с более высокой концентрацией тестостерона в сыворотки крови женщин, имеющих эндометриоз (β>0).
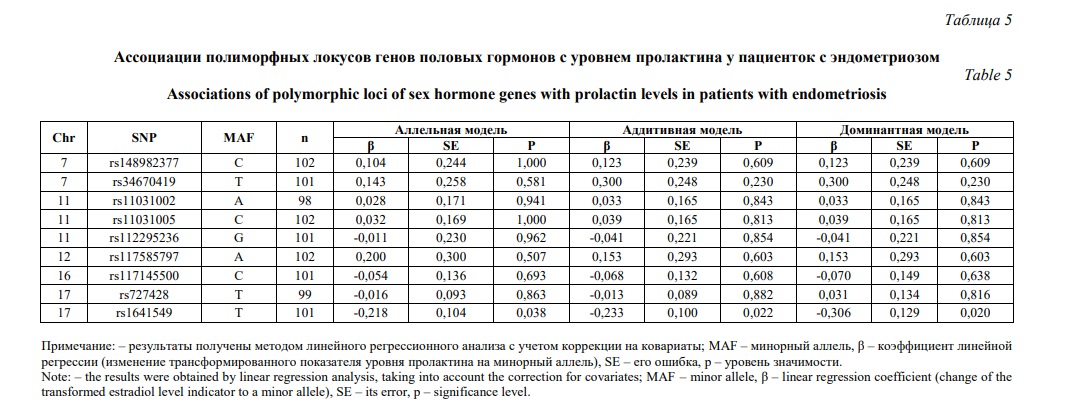
Таким образом, нами установлены ассоциации полиморфизма генов кандидатов с уровнем половых гормонов у пациенток с эндометриозом. С концентрацией эстрадиола связаны полиморфные локусы rs148982377 и rs34670419, лютеинизирующего гормона - rs117585797, прогестерона - rs117145500, пролактина - rs1641549, тестостерона - rs148982377 и rs34670419. Маркерами низкого уровня эстрадиола и пролактина в сыворотке крови больных эндометриозом являются аллели С rs148982377, Т rs34670419 и Т rs1641549 соответственно, а маркерами высокого уровня лютеинизирующего гормона и прогестерона служат аллели А rs117585797 и С rs117145500 соответственно. Высокий уровень тестостерона у женщин с эндометриозом маркируется гаплотипом TG rs148982377-rs34670419.
Согласно ранее полученным GWAS данным, полиморфизмы rs11031002 и rs11031005 гена FSHB, проанализированные в настоящем исследовании, связаны с различными фенотипами, характеризующими репродуктивную систему женщины как в норме, так и различных заболеваниях. Полиморфный локус rs11031002 ассоциирован с уровнем лютеинизирующего гормона (β=0,221 для аллеля A) [23], уровнем сывороточного белка CGA;FSHB (β=-0,162 для аллеля A) [32], синдром поликистозных яичников (OR=1,24 для аллеля A) [33], минеральной плотностью костной ткани (β=0,02 для аллеля T) [34].
Молекулярно-генетический маркер rs11031005 коррелирует как с эндометриозом, так и с мигренью (OR=1,08 для аллеля T) [7], концентрацией фолликулостимулирующего гормона (β=-0,232 для аллеля С) [23], уровнем общего (β=0,033 для аллеля С) и биодоступного (β=0,023 для аллеля С) тестостерона [24], возрастом менархе (β=-0,035 для аллеля T) [35], возрастом менопаузы [36], синдром поликистозных яичников (β=-0,159 для аллеля T) [37], кистой яичника (β=-0,110 для аллеля С) [38]. Приведенные выше данные свидетельствуют о ярко выраженных плейотропных эффектах полиморфизма гена FSHB. Из литературных материалов известно, что “специфическими” характеристиками гормонального профиля женщин с эндометриозом являются сниженные частоты/амплитуды импульсов гонадотропин-рилизинг-гормона и лютеинизирующего гормона, что приводит к снижению уровня лютеинизирующего гормона, увеличению фолликулостимулирующего гормона, снижению соотношения лютеинизирующий гормон/фолликулостимулирующий гормон, увеличению концентрации глобулина, связывающего половые гормоны, снижению сывороточного/фолликулярного тестостерона, высокой концентрации эстрадиола в очагах поражения и нормальному или низкому уровню сывороточного эстрадиола (в организме в целом), повышению соотношения эстрадиол/тестостерон, изменению экспрессии ароматазы и т.д. [6, 9]. Эти гормональные изменения предопределяют и способствуют пролиферации эндометрия, воспалению органов малого таза и другим фенотипическим признакам эндометриоза [9, 17].
Результаты настоящего исследования полностью согласуются с недавно выдвинутой в нескольких обзорах Dinsdale N. и Crespi B. гипотезой о том, что низкий уровень тестостерона в пренатальный период может быть причиной развития эндометриоза в дальнейшей жизни женщины [6, 9, 39]. Авторы предположили, что низкий уровень тестостерона в пренатальный период перепрограммирует гипоталамо-гипофизарно-гонадную ось у женщин, что приводит к изменениям выработки ряда половых гормонов (более низкий уровень лютеинизирующего гормона по сравнению с фолликулостимулирующим гормоном, более высокий уровень глобулина, связывающего половые гормоны, более низкий уровень тестостерона в яичниках и сыворотке и т.д.), что в конечном итоге предрасполагает к эндометриозу у взрослых [6, 39]. У женщин тестостерон вырабатывается яичниками и надпочечниками и влияет на рост/плотность мышечной ткани и костей, регулирует фолликулогенез и децидуализацию, способствует накоплению энергии и подавляет воспаление [9, 40]. Гормоны гипоталамо-гипофизарно-гонадной оси (гонадотропин-рилизинг гормон и лютеинизирующий гормон) являются “ключевыми” регуляторами выработки тестостерона по принципу отрицательной обратной связи [40], а снижение импульсов гонадотропин-рилизинг гормона и лютеинизирующего гормона приводит к снижению уровня тестостерона, что коррелирует с высоким риском эндометриоза [9]. Интересно, что около 60% циркулирующего тестостерона у женщин связано с глобулином, связывающим половые гормоны [40]. Следовательно, глобулин, связывающий половые гормоны влияет на его биодоступность [9]. В GWAS исследовании Sinnott-Armstrong N. et al. установлена сильная отрицательная генетическая корреляция между биодоступным тестостероном и глобулином, связывающим половые гормоны у женщин (r2=-0,75) [40]. Важно подчеркнуть, что мы установили ассоциацию GWAS-значимых для содержания глобулина, связывающего половые гормоны полиморфных локусов rs727428 SHBG и rs1641549 TP53 с риском развития эндометриоза в рамках межлокусных моделей взаимодействий.
Чтобы выяснить, имеют ли эндометриоз и уровень половых гормонов общее генетическое происхождение, Garitazelaia А. et al. [26] провели менделевскую рандомизацию, используя общедоступные данные GWAS по эндометриозу (была изучена когорта FinnGen, включающая 3380/31753 больных/контроля) и половым гормонам (перечень аналогичен нашему списку) [23]. В результате этого анализа авторы, с одной стороны, не выявили достоверных связей между уровнем половых гормонов и эндометриозом, с другой стороны, что стало для них неожиданностью, были выявлены плейотропные генетические ассоциации двух полиморфных локусов rs11031002 и rs11031005 гена FSHB с эндометриозом и уровнем половых гормонов [26]. В этой работе были обнаружены отрицательные значения β для rs11031002 и положительные значения β для rs11031005, указывающие на то, что эффекты этих SNPs были разнонаправленными, тогда как в нашем исследовании влияние этих локусов на риск развития эндометриоза было однонаправленным и имело протективное значение. Более того, согласно исследованию Garitazelaia А. et al., SNPs (rs11031005 и rs11031006) в области гена FSHB (25-40 kb в 5' области гена) показали значимые плейотропные ассоциации с другими репродуктивными показателями, которые могут коррелировать с эндометриозом (возраст менопаузы и возраст менархе, продолжительность менструального цикла) [26].
Многочисленные GWAS данные подтверждают важность промоторной области FSHB (в частности локуса rs11031006) для различных фенотипов, характеризующих репродуктивную систему женщины, включая возраст менархе [41] и менопаузы [42], параметры менструального цикла (продолжительность менструального цикла и чрезмерные, частые и нерегулярные менструации), двустороннюю овариэктомию [43], рождение дизиготных близнецов и концентрацию фолликулостимулирующего гормона [44], миому матки [45], синдром поликистозных яичников, концентрации фолликулостимулирующего гормона и лютеинизирующего гормона [46, 47].
В этом контексте Ruth K.S. et al. показали, что полиморфный локус rs10835638, расположенный в том же регионе связан с низким уровнем фолликулостимулирующего гормона, более длительным менструальным циклом и поздним возрастом менопаузы, бесплодием у женщин и низким риском развития эндометриоза [19]. Bianco B. et al. продемонстрировали влияние этого локуса на концентрацию лютеинизирующего гормона у женщин с эндометриозом и бесплодием [20]. Генетический вариант -211 G>T FSHB (rs10835638) определял уровни фолликулостимулирующего гормона и лютеинизирующего гормона в сыворотке крови у здоровых женщин с аменореей и бесплодием [48] и был связан с реакцией на контролируемую гиперстимуляцию яичников, концентрацией лютеинизирующего гормона, количеством антральных фолликулов, яйцеклеток и эмбрионов [49], синдромом поликистозных яичников [50]. В других исследованиях также сообщалось об ассоциации полиморфизмов промотора FSHB с эндометриозом (rs74485684) [8], возрастом менархе (rs11031010, rs1782507, rs555621) [51], синдром поликистозных яичников и уровнем лютеинизирующего гормона у этих пациенток (rs11031010) [52], возрастом менопаузы (rs12294104) [53].
Заключение. В результате проведенного исследования установлено, что среди пациенток с эндометриозом уровень эстрадиола в сыворотке крови ассоциирован с полиморфными локусами rs148982377 ZNF789 и rs34670419 ZKSCAN5, лютеинизирующего гормона – rs117585797 ANO2, прогестерона – rs117145500 CHD9, пролактина – rs1641549 TP53, тестостерона – rs148982377 ZNF789 и rs34670419 ZKSCAN5.





















Список литературы