Генетические маркеры остеоартроза коленного сустава у женщин Центрального Черноземья России
Aннотация
Актуальность: Остеоартроз (ОА) коленного сустава является многофакторным заболеванием. Среди множества факторов риска заболевания несомненна роль наследственной компоненты. Доля генетических факторов в развитии ОА составляет около 50%. Цель исследования:Изучить роль полиморфных локусов генов-кандидатов в развитии остеоартроза коленного сустава у женщин Центрально-Чернозёмного региона России. Материалы и методы:В выборку для исследования были включены 590 женщин, из них 292 пациента с диагнозом ОА коленного сустава и 298 женщин контрольной группы. Всем участникам исследования проведено генотипирование четырёх полиморфных локусов генов-кандидатов (rs2820443 LYPLAL1, rs11177GNL3, rs56116847 SBNO1 и rs34195470WWP2), показавших связь с ОА коленного сустава в ранее проведённых полногеномных исследованиях. Проведен логистический регрессионный анализ (тестировались аллельная, аддитивная, рецессивная, доминантная генетические модели) с учётом ковариат (возраст, ИМТ, наследственная отягощенность, наличие заболеваний сердечно-сосудистой, эндокринной, опорно-двигательной систем). Результаты:Установлено, что минорный аллель А rs11177генаGNL3 ассоциирован с развитием ОА коленного сустава у женщин согласно аллельной (ОR=0,74, рperm=0,011), аддитивной (ОR=0,65, рperm=0,009), доминантной (ОR=0,58, рperm=0,025) и рецессивной (ОR=0,56, рperm=0,042) генетическим моделям. Генотип GG rs11177генаGNL3 является фактором риска развития ОА коленного сустава(OR=1,53, p=0,026). Выявленные ассоциации rs11177генаGNL3 с развитием заболевания у женщин могут быть связаны свыраженными функциональными эффектами данного SNP:определяетмиссенс-мутацию (Arg39Gln в полипептиде GNL3), локализуется в эволюционно консервативном регионе, в области гиперчувствительности к ДНКазе-1, в области гистонов, маркирующих промоторы в 10 тканях и энхансеры в 14 тканях, в регионе связывания с регуляторным белком ZNF263 и регионе регуляторного мотива ДНК – RXRA, связан с уровнем экспрессии 24 генов и альтернативного сплайсинга 12 генов в различных тканях и органах, вовлечённых в патогенез ОА коленного сустава (жировая ткань, щитовидная железа, скелетные мышцы и др.). Заключение:Аллельный вариант А rs11177 гена GNL3 имеет протективное значение в развитии ОА коленного сустава у женщин Центрального Черноземья России (OR=0,56-0,74), генотип GG rs11177 имеет рисковую роль для заболевания (OR=1,53)
Введение. Остеоартроз (ОА) занимает одну из лидирующих позиций среди заболеваний костно-мышечной системы [1, 2]. Для данного заболевания характерно наличие болевого синдрома, деструкции и потери суставного хряща, ремоделирование субхондральной кости, образованием остеофитов, воспаление синовиальной оболочки, вовлечение в патологические процессы как внутрисуставных, так и околосуставных структур и отдаленных от суставов тканей [3, 4]. Частота этого недуга, согласно ВОЗ, составляет от 11 до 13%. По данным отечественных учёных в России ОА коленных и/или тазобедренных суставов страдают около 13% населения [5]. Среди крупных суставов коленные поражаются чаще [6]. ОА коленного сустава представляет собой одну из наиболее значимых медико-социальных и экономических проблем не только из-за широкой распространённости, но и в связи с тем, что данное заболевание приводит к снижению качества жизни пациентов, может стать причиной нетрудоспособности [7, 8]. Стоит отметить, что наиболее распространённым методом лечения при терминальных стадиях гонартроза считают эндопротезирование, являющееся весьма дорогостоящим [9-12]. При этом около 21% пациентов недовольны результатом после тотальной артропластики коленного сустава [13].
ОА коленного сустава является многофакторным заболеванием [14, 15]. Среди факторов риска развития и прогрессирования данного недуга выделяют женский пол [14-18]. Частота ОА возрастает в менопаузальный период и для заболевания характерно менее благоприятное клиническое течение в этот период [19]. Более низкий уровень эстрогенов в менопаузе приводит впоследствии к повышению уровня костного метаболизма в субхондральной кости, развитию воспалительных процессов в тканях сустава, деградации хрящевой ткани [20]. Стоит отметить и более высокую частоту тотального эндопротезирования коленных и тазобедренных суставов у женщин в сравнении с мужчинами [21].
Согласно литературным данным генетические факторы имеют ключевую роль в развитии и прогрессировании ОА коленного сустава [22-25]. В ранее опубликованном исследовании сообщалось о том, что доля наследственной компоненты в развитии ОА коленного сустава у женщин составляет 37% [26]. Стоит отметить, что прогрессирование рентгенологического ОА коленного сустава у женщин также находится под генетическим контролем [27]. При этом, несмотря на очевидную роль генетических (наследственных) факторов в развитии и прогрессировании данного заболевания [28], исследования, посвящённые изучению вклада отдельных полиморфных локусов генов-кандидатов в подверженность ОА коленного сустава у женщин крайне ограничены и фрагментарны.
Цель исследования. Изучить роль полиморфных локусов генов-кандидатов в развитии остеоартроза коленного сустава у женщин Центрально-Чернозёмного региона России.
Материалы и методы исследования. Объём выборки для исследования составил 590 женщин, из них 292 больных ОА коленного сустава и 298 женщин контрольной группы. Диагноз заболевания был установлен в соответствии с Федеральными клиническими рекомендациям по диагностике и лечению остеоартроза [29], а также согласно критериям Американской ассоциации ревматологов [30]. Выборка сформировалась на базе травматологических отделений №1 и №2 ОГБУЗ «Городская больница №2 г. Белгорода» в период с 2016 по 2018 гг. В данную выборку относили лица женского пола, которые родились и проживают на территории Центрально-Черноземного региона РФ и не имели родства между собой, давшие добровольное информированное согласия на участие в исследовании [31]. Критерии включения в группу больных: 1) возраст пациенток ≥ 40 лет, 2) диагностированный первичный ОА коленного сустава 2-4 рентгенологических стадий, 3) наличие боли в коленном суставе по визуально-аналоговой шкале более 40 баллов. В группу контроля включались лица без какой-либо патологии опорно-двигательной системы. Критерии исключения из исследуемых групп были следующие: 1) не русский этнос, проживание и/или рождение вне Центрального Черноземья России, 2) тяжёлые формы артериальной гипертензии, ишемической болезни сердца, сахарный диабет, онкологические заболевания, врождённые пороки развития опорно-двигательной системы. Данное исследование проведено при соблюдении этических норм и стандартов Хельсинской декларации, одобрено этическим комитетом ФГАОУ ВО «Белгородский государственный национальный исследовательский университет».
Для исследования были отобраны полиморфные локусы четырёх генов-кандидатов, связанные с ОА коленного сустава согласно ранее проведённым полногеномным исследованиям (GWAS) в европейских популяциях [32-35]: rs2820443 LYPLAL1, rs11177 GNL3, rs56116847 SBNO1, rs34195470 WWP2, а также обладающие выраженным регуляторным потенциалом (regSNPs) согласно онлайн ресурсу HaploReg (v.4.1) [36]. Для исследования использовалась геномная ДНК, выделенная фенол-хлорофорным методом [37]. Генотипирование полиморфных локусов генов-кандидатов проводили стандaртным методом полимеразной цепной реакции с использованием TagMan зондов на амплификаторе CFX-96 Real Time System [38, 39, 40]. Генотипирование выполнено на специально разработанных наборах ООО «Тест – Ген» (г. Ульяновск).
Для описания количественных признаков (возраст, рост, ИМТ) применяли среднее арифметическое (  ) и стандартную ошибку (SD), для их сравнения использовали критерий Манна-Уитни. Для качественных признаков определяли их абсолютные значения (n) и проценты. Для сравнения качественных показателей применяли критерий χ2. За статистически значимый принимали результат при p<0,05.
) и стандартную ошибку (SD), для их сравнения использовали критерий Манна-Уитни. Для качественных признаков определяли их абсолютные значения (n) и проценты. Для сравнения качественных показателей применяли критерий χ2. За статистически значимый принимали результат при p<0,05.
В исследуемых группах женщин для полиморфных локусов генов-кандидатов ОА коленного сустава проведены расчёты наблюдаемой и ожидаемой гетерозиготности, частот минорного и частого аллелей, наблюдаемых и ожидаемых распределений генотипов и их соответствия закономерности Харди-Вайнберга. При сравнении частот аллелей и генотипов изучаемых SNPs между контрольной группой и больными использовали таблицы сопряженности 2х2 с применением критерия χ2 с поправкой Йетса на непрерывность. За статистически значимый принимали результат при p<0,05. Проведён логистический регрессионный анализ (тестировались аллельная, аддитивная, рецессивная, доминантная генетические модели) с учётом ковариат (возраст, ИМТ, наследственная отягощенность, наличие заболеваний сердечно-сосудистой, эндокринной, опорно-двигательной систем) в программе PLINK v. 2.050 [41] и изучены ассоциации SNPs (rs2820443 LYPLAL1, rs11177 GNL3, rs56116847 SBNO1 и rs34195470 WWP2) кандидатных генов с развитием ОА коленного сустава у женщин. Направленность ассоциаций изучаемых полиморфных локусов генов-кандидатов с развитием заболевания оценивали на основе ОR – показателя отношения шансов и его 95% доверительного интервала (95% СI). Для корректировки множественных сравнений применяли стандартные пермутационные процедуры (выполнено 1000 пермутаций). Статистически значимым считали уровень рperm<0,05.
Для полиморфных локусов, показавших значимые ассоциации с развитием гонартроза у женщин, были изучены эпигенетические эффекты (regSNP) с помощью онлайн сервиса HaploReg (v4.1) [36], проведён eQTL- и sQTL-анализ (связь с уровнем экспрессии и альтернативного сплайсинга генов) с помощью онлайн ресурса GTExportal [42, 43].
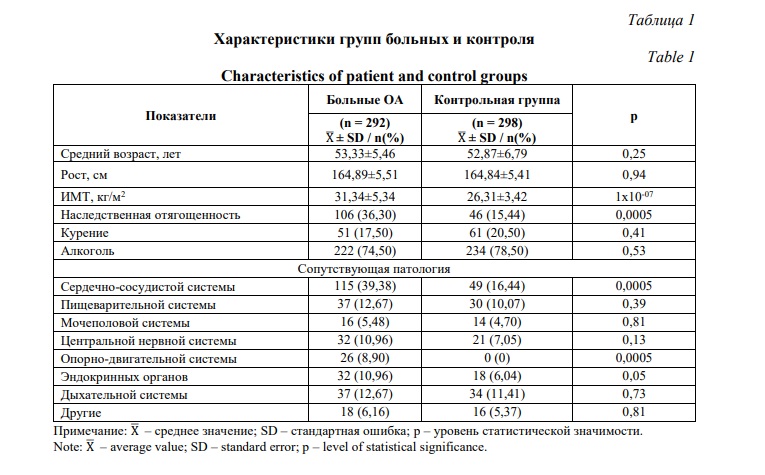
Результаты и их обсуждение. Основные медико-биологические характеристики изучаемых групп женщин представлены в таблице 1. Данные группы были сопоставимы по возрасту, росту (p>0,05). В отношении статуса табакокурения и алкоголя также данные группы не отличались. Однако группа больных женщин достоверно имела более высокий ИМТ по сравнению с популяционным контролем (p<0,05). Анализ данных о наличии в изучаемых группах больных ОА коленного сустава и контроля сопутствующей патологии свидетельствует о достоверно более высоком удельном весе пациенток с заболеваниями сердечно-сосудистой, эндокринной и опорно-двигательной систем (p<0,05). Также у больных ОА коленного сустава чаще регистрируется наследственная отягощенность (Табл. 1).
Проведено изучение распределения генотипов изучаемых полиморфных маркеров – rs2820443 LYPLAL1, rs11177 GNL3, rs56116847 SBNO1, rs34195470 WWP2 в группе больных и контроле. Установлено, что для всех локусов как среди больных, так и в контрольной группе наблюдаемое распределение генотипов по всем рассматриваемым SNPs соответствовало ожидаемому согласно равновесию Харди-Вайнберга (PHWE>0,05) (Табл. 2).
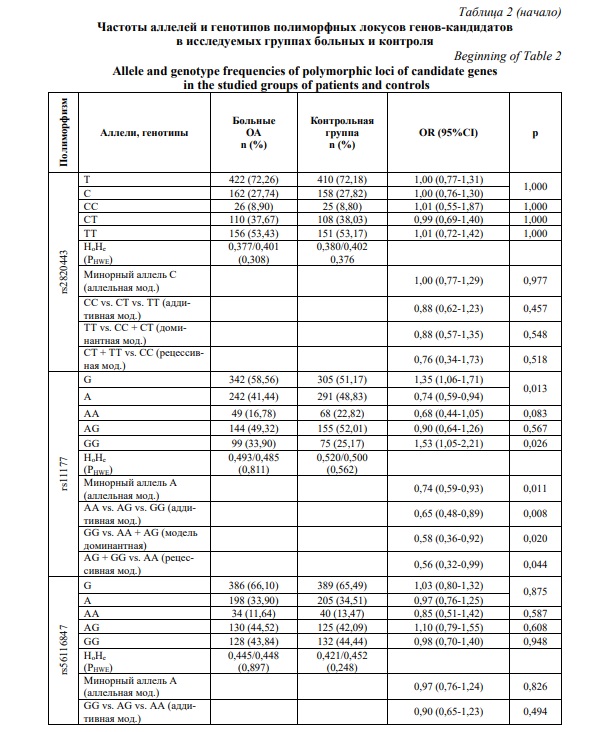
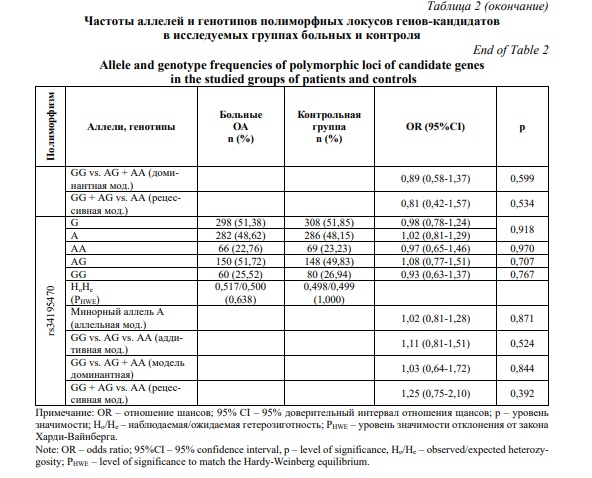
Выявлены ассоциации полиморфного локуса rs11177 гена GNL3 с развитием ОА коленного сустава у женщин. Аллель А данного полиморфного локуса связан с низким риском развития заболевания (OR=0,74, 95CI 0,59-0,94, p=0,013), в свою очередь генотип GG rs11177 гена GNL3 является фактором риска развития ОА коленного сустава (OR=1,53, 95CI 1,05-2,21, p=0,026). В рамках логистического регрессионного анализа также установлено, минорный аллель А rs11177 гена GNL3 показал ассоциации с развитием ОА коленного сустава у женщин согласно аллельной (ОR=0,74, 95%СI 0,59-0,93, р=0,011, рperm=0,011), аддитивной (ОR=0,65, 95%СI 0,48-0,89, р=0,008, рperm=0,009), доминантной (ОR=0,58, 95%СI 0,36-0,92, р=0,020, рperm=0,025) и рецессивной (ОR=0,56, 95%СI 0,32-0,99, р=0,044, рperm=0,042) генетическим моделям (Табл. 2).
Связь полиморфного локуса rs11177 гена GNL3 с ОА на полногеномном уровне была установлена в нескольких GWAS [32, 33, 44]. Zeggini E. et al. (2012) на выборках европейского происхождения установлено, что аллель А rs11177 GNL3 является фактором риска развития ОА (OR=1,09, p=5,13x10-09) [32]. Однако в GWAS Yau M.S. et al. (2017), выполненном на выборке из 3898 больных ОА коленного сустава и 3168 контроля, ассоциация полиморфного маркера rs11177 гена GNL3 с заболеванием у американцев европейского происхождения не подтвердилась [44]. В 2018г. связь rs11177 гена GNL3 с ОА тазобедренного сустава на полногеномном уровне была установлена в GWAS Styrkarsdottir U. et al. у европейцев. Авторами выявлено, что фактором риска развития ОА тазобедренного сустава является аллельный вариант А rs11177 гена GNL3 (OR=1,07, p=6,5x10-08) [33]. Также в 2018г. данная ассоциация была реплицирована Liu В. еt аl. у больных гонартрозом в китайской популяции Хань, но не достигла полногеномного уровня (OR=1,25, р=2,6x10-05) [45].
Согласно нашим результатам, аллельный вариант А rs11177 гена GNL3 имеет протективное значение при формировании ОА коленного сустава у женщин (OR=0,56-0,74), что согласуется с результатами Panoutsopoulou K. et al. (2017) и Шаповаловой Д.А. (2020). В работе Шаповаловой Д.А. (2020), выполненной на выборке из 417 женщин (256 женщин с полиартрозом, коксартрозом и гонартрозом и 161 женщина контрольной группы) русской, татарской, башкирской национальностей и других этносов Волго-Уральского региона России установлены значимые ассоциации аллеля G rs11177 гена GNL3 с ОА у метисов и других этносов (OR=2,17, 95% Сl 1,14-4,14, р=0,018) [46]. В исследовании Panoutsopoulou K. et al. (2017) установлена связь минорного аллеля А rs11177 гена GNL3 с развитием ОА тазобедренного сустава с аксиальным/медиальным сужением суставного пространства у европейцев (OR=0,84, 95% Сl 0,72-0,97, р=0,022) [47].
Согласно материалам онлайн ресурса HaploReg [36], изучаемый rs11177 гена GNL3 обладает выраженными регуляторными эффектами. Полиморфный локус rs11177, определяющий миссенс-мутацию (Arg39Gln в полипептиде GNL3), локализуется в эволюционно консервативном регионе, в области гиперчувствительности к ДНКазе-1 и в области гистонов, маркирующих промоторы и энхансеры в 10 и 14 тканях соответственно, в регионе связывания с регуляторным белком ZNF263 и регионе одного регуляторного мотива ДНК. Материалы онлайн ресурса GTExportal [43] свидетельствуют о важном eQTL (связан с транскрипцией 24 генов – DNAH1, GLT8D1, GLYCTK, GLYCTK-AS1, GNL3, ITIH1, ITIH4, MUSTN1, NEK4, NT5DC2, PBRM1, POC1A, PPM1M, RFT1, RP11-168J18.6, RP11-894J14.2, RP5-1157M23.2, RP5-966M1.5, RP5-966M1.7, SERBP1P3, SFMBT1, SPCS1, TMEM110, WDR82) и sQTL (ассоциирован с уровнем альтернативного сплайсинга транскрипта 12 генов – GLT8D1, GNL3, ITIH1, ITIH3, ITIH4, MUSTN1, NT5DC2, PBRM1, PHF7, SMIM4, STAB1, TMEM110) значениях полиморфизма rs11177 в более 30 различных органах и тканях, в том числе вовлечённых в патогенез ОА (скелетные мышцы, жировая ткань, большеберцовые артерии и нервы и т.д.). Стоит отметить, что с rs11177 сильно сцеплены 198 eQTL-значимых SNPs, ассоциированных с транскрипцией 27 генов (ALAS1, DNAH1, GLT8D1, GLYCTK, GLYCTK-AS1, GNL3, ITIH1, ITIH4, MUSTN1, NEK4, NT5DC2, PBRM1, POC1A, PPM1M, PRKCD, RFT1, RP11-168J18.6, RP11-894J14.2, RP5-1157M23.2, RP5-966M1.5, RP5-966M1.7, SERBP1P3, SFMBT1, SMIM4, SPCS1, TMEM110, WDR82) и альтернативным сплайсингом транскрипта 13 генов (GLT8D1, GLYCTK, GNL3, ITIH1, ITIH3, ITIH4, MUSTN1, NT5DC2, PBRM1, PHF7, SMIM4, STAB1, TMEM110) в различных органах и тканях.
Аллельный вариант А rs11177 GNL3, являюшийся, согласно нашим данным, протективным фактором в развитии заболевания у женщин, снижает аффинность к транскрипционному фактору RXRA, связан с пониженной экспрессией 14 генов (DNAH1, GLYCTK, GNL3, ITIH1, ITIH4, NT5DC2, PBRM1, POC1A, PPM1M, RFT1, RP5-1157M23.2, RP5-966M1.5, RP5-966M1.7, SPCS1) и повышенной транскрипцией 14 генов (DNAH1, GLT8D1, GLYCTK-AS1, ITIH4, MUSTN1, NT5DC2, PBRM1, RP11-168J18.6, RP11-894J14.2, SERBP1P3, SFMBT1, SPCS1, TMEM110, WDR82), ассоциирован как с более низким уровнем альтернативного сплайсинга транскрипта 10 генов (GLT8D1, GNL3, ITIH1, ITIH4, MUSTN1, NT5DC2, PHF7, SMIM4, STAB1, TMEM110), так и с высоким уровнем альтернативного сплайсинга 6 генов (GLT8D1, GNL3, ITIH3, NT5DC2, PBRM1, SMIM4) в различных культурах клеток, тканях и органах, в том числе имеющих важную роль в патогенезе ОА коленного сустава (щитовидная железа, большеберцовые артерии и нервы, жировая ткань и др.).
Ген GNL3 кодирует гуанин-нуклеотид-связывающий белок (нуклеостемин), который играет важную роль во многих процессах, происходящих в клетке, в том числе участвует в пролиферации стволовых клеток, регуляции клеточного цикла [48]. Анализ дисбаланса аллельной экспрессии гена GNL3 показал, что rs11177 является цис-активным регулятором, который вероятно вносит вклад в значимость ассоциаций с ОА рядом расположенных полиморфных локусов в 3 хромосоме (3p21) [49]. В работе Gee F. et al. (2014) показано, что ОА-ассоциированный аллель А rs11177 связан с более низкой экспрессией гена GNL3 в хрящевой ткани больных ОА, перенесших замену тазобедренного или коленного суставов, что доказывает роль GNL3 в патогенезе заболевания [49]. Louka M.L. et al. (2016) показали, что относительная экспрессия гена GNL3 в образцах синовиальной ткани и жидкости была значительно выше в группе больных с первичным остеоартрозом по сравнению с контрольной группой (p<0,01) [50].
Заключение. Аллель А rs11177 гена GNL3 имеет протективную роль в развитии ОА коленного сустава у женщин Центрального Черноземья России (OR=0,56-0,74). Генотип GG rs11177 является рисковым для заболевания (OR=1,53). Медико-биологической основой выявленных ассоциаций могут быть выраженные функциональные эффекты SNP: определяет миссенс-мутацию (Arg39Gln в полипептиде GNL3), локализуется в эволюционно консервативном регионе, в области гиперчувствительности к ДНКазе-1, в области гистонов, маркирующих промоторы в 10 тканях и энхансеры в 14 тканях, в регионе связывания с регуляторным белком ZNF263 и регионе регуляторного мотива RXRA, связан с уровнем экспрессии 24 генов и альтернативного сплайсинга 12 генов в различных тканях и органах, вовлечённых в патогенез ОА коленного сустава (жировая ткань, щитовидная железа, скелетные мышцы и др.).
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы