Электронный допплеровский фетальный мониторинг и непрямая ЭКГ плода в современном акушерстве (обзор)
Aннотация
Актуальность: В настоящее время кардиотокография (КТГ) является одним из ведущих методов оценки состояния плода и маточной активности (схваток) при беременности и в родах. Допплеровская методика кардиотокографии с использованием ультразвуковых датчиков широко распространена в акушерстве. Однако, в последние годы появились работы, посвященные непрямой электрокардиографии (ЭКГ) плода с применением абдоминальных электродов при беременности и в родах. Ультразвуковой фетальный мониторинг и непрямая ЭКГ плода в акушерстве – это два способа получения записи частоты сердечных сокращений плода (тахограммы) с целью диагностики гипоксии или дистресса плода. Непрямая ЭКГ плода в акушерской практике не используется для диагностики патологии миокарда, нарушений проводимости сердца плода, как у детей и взрослых пациентов. Цель исследования: Оценить роль электронного допплеровского фетального мониторинга и непрямой фетальной ЭКГ в диагностике гипоксии или дистресса плода. Материалы и методы: Выполнен обзор литературы, посвященный роли допплеровского фетального мониторинга и непрямой ЭКГ плода в диагностике гипоксии или дистресса плода при беременности и в родах, по источникам литературы в базах данных Pubmed, Elibrary, Scopus за последние 15 лет. Результаты: Анализ данных литературы показал широкое применение ультразвукового фетального мониторинга в диагностике гипоксии или дистресса плода по сравнению с непрямой фетальной ЭКГ на сегодняшний день развития медицинской техники. Большинство публикаций по непрямой ЭКГ плода описывали качество сигнала, единичные источники литературы посвящены диагностике гипоксии плода. Заключение: Фетальный мониторинг плода или кардиотокография остается основным методом диагностики гипоксии или дистресса плода. Непрямая ЭКГ плода является альтернативой электронному допплеровскому фетальному мониторингу. Однако имеет место недостаточная надежность непрямой ЭКГ плода в диагностике гипоксии или дистресса плода по сравнению с ультразвуковой кардиотокографией.
Введение. В акушерской практике остаются ведущими два функциональных метода - ультразвуковое исследование фетоплацентарного комплекса и кардиотокография (КТГ). КТГ – метод диагностики гипоксии или дистресса плода при беременности и в родах. Он основан на регистрации и записи частоты сердечных сокращений плода (тахограммы), маточной активности (токограммы) и шевелений (актограммы) плода [1-5].
Кардиотокография (CTG) – европейское название, электронный допплеровский фетальный мониторинг (EFM) – американское обозначение вышеназванного метода. Фетальный мониторинг или КТГ последние пятьдесят лет был основан только на ультразвуковом методе (эффект Допплера). Поэтому в зарубежных источниках литературы можно найти дословный перевод кардиотокографии - электронный допплеровский фетальный мониторинг [6-10]. Более 10 лет назад в акушерстве был зарегистрирован для клинического применения фетальный монитор “Monica AN24” (Великобритания) с целью диагностики гипоксии или дистресса плода. В зарубежной литературе данный функциональный метод исследования в акушерстве обозначается как непрямая ЭКГ плода (fECG). Поэтому кардиотокография перестала быть только ультразвуковой и термин допплеровский фетальный мониторинг изменился на фетальный мониторинг (FM) на американском континенте. В России и Европе широко используется термин кардиотокография [11-16].
Электронный допплеровский фетальный мониторинг и непрямая ЭКГ плода в акушерстве – это два способа получения записи частоты сердечных сокращений плода (тахограммы) с целью диагностики гипоксии или дистресса плода [17, 18]. Непрямая ЭКГ плода в акушерской практике не используется для диагностики патологии сердца плода, как у детей и взрослых пациентов.
Цель данного обзора – сравнить надежность, точность диагностики гипоксии или дистресса плода с помощью одного метода – кардиотокографии, полученной двумя способами (ультразвуковыми датчиками и ЭКГ электродами), проанализировать эффективность использования электронного допплеровского фетального мониторинга и непрямой ЭКГ плода в акушерстве.
Электронный допплеровский фетальный мониторинг и непрямая ЭКГ плода - краткое описание, особенности, сходства, различия, показания к применению.
Ультразвуковая методика КТГ за рубежом получила название электронный допплеровский фетальный мониторинг. Обозначения – электронный (так как используются электронные компоненты в устройстве), допплеровский (основан на эффекте Допплера), фетальный мониторинг (отслеживается ЧСС плода в течение 30-60 минут при беременности или более в родах) характеризуют ультразвуковую классическую методику КТГ [13-16]. В России вышеназванная методика называется коротко КТГ.
Ультразвуковая методика КТГ представлена на рисунке 1 и 2.

Широкое распространение в России в акушерстве получила ультразвуковая методика регистрации частоты сердечных сокращений (ЧСС) плода на фетальных мониторах Российского (“УНИКОС”, “Сономед”, Москва, “МАК”, Челябинск) и импортного (“Huntleig”, Великобритания, “GE” США, “PHILLIPS”, Евросоюз) производства [19].
Данные медицинские устройства используют ультразвуковые датчики с частотой от 1 до 2 МГц. Ультразвуковые волны данной частоты излучаются пьезокерамическими дисками датчиков и достигают сокращающееся сердце плода, отражаются от него и принимаются вышеназванными дисками с допплеровским сдвигом (эффект Допплера). Так получается первоначальный аналоговый допплеровский сигнал тонов сердца плода, который позже усиливается и оцифровывается. Данный сигнал можно прослушать через динамики фетальных мониторов и отличить сокращения сердца плода от аорты матери. Это первый этап ультразвуковой технологии КТГ для регистрации ЧСС плода, который не регистрируется на бумаге. Главная цель – получить цепочку ЧСС плода для фетального мониторинга. Второй этап – математический алгоритм, который обнаруживает максимальную амплитуду первых тонов сердца плода, вычисляет продолжительность каждого кардиоинтервала. Далее каждый кардиоинтервал пересчитывается в ЧСС плода в ударах в минуту. Так регистрируется и записывается на бумаге ЧСС плода (тахограмма) вышеназванным способом [20, 21, 22].
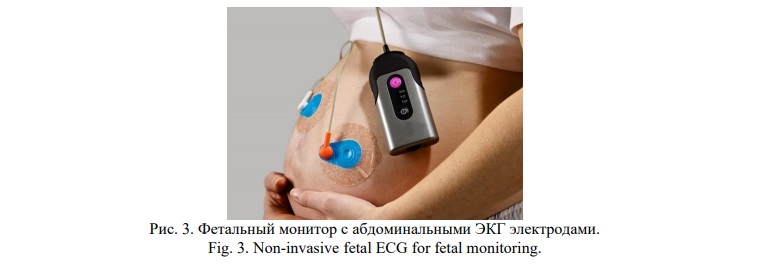
Тахограмму (ЧСС плода во времени) можно получить с помощью наружных ЭКГ электродов, которые накладываются на живот матери. Данная новая технология реализована в фетальных мониторах “Monica AN24” (Великобритания). Первый этап данной технологии заключается в обнаружении R-зубцов на ЭКГ плода и фильтрации от ЭКГ матери. Далее следует второй этап - математический алгоритм, который высчитывает продолжительность каждого кардиоинтервала между R-R зубцами и пересчитывает в ЧСС плода в ударах в минуту [23, 24]. Непрямая ЭКГ плода получила данное название, так как не используется в данном случае инвазивный скальп-электрод (прямая ЭКГ плода), который накладывается на головку плода в родах [25].
Непрямая ЭКГ плода в клинической акушерской практике используется только для записи ЧСС плода (тахограммы), схваток и относится к одному методу – КТГ [26].
Непрямая ЭКГ плода с целью регистрации ЧСС плода представлена на рисунке 3.
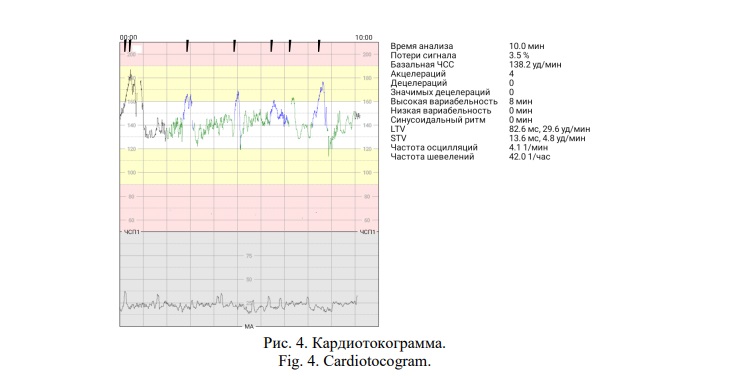
Тахограмма очень важна для анализа кардиотокограммы. Низкая вариабельность ритма плода, наличие децелераций, отсутствие акцелераций, брадикардия на кардиотокограмме – признаки гипоксии плода в практическом акушерстве. Диагностика критических состояний плода в акушерстве с последующим принятием решения в сторону экстренного родоразрешения значительно снизила частоту перинатальной смертности, особенно на уровне стационаров в современном акушерстве. Показания для электронного допплеровского фетального мониторинга и непрямой фетальной ЭКГ в акушерстве – гипоксические состояния плода при беременности или дистресс в родах [27, 28].
Кардиотокограмма представлена на рисунке 4.
Качество записи при непрямой ЭКГ плода и ультразвуковом фетальном мониторинге.
В настоящее время в акушерстве непрямая фетальная электрокардиография с целью диагностики гипоксии плода реализована в мониторе “Monica AN24” (Великобритания), других конкурирующих производителей непрямой ЭКГ плода в клинической акушерской практике нет.
Используя ключевое слово «непрямая ЭКГ плода (fECG)» в базах данных PubMed, Elibrary, Scopus найдено чуть более 20 источников литературы. Все зарубежные работы посвящены анализу качества сигнала непрямой фетальной ЭКГ с целью регистрации ЧСС плода, влиянию внешних и внутренних факторов на получение непрерывной кардиотахограммы. В то же время, имеют место единичные публикации, посвященные определению чувствительности и специфичности, средней точности вышеуказанной неультразвуковой методики КТГ в оценке состояния плода.
Так, T. Fuchs et al. (2014) исследовали потери сигнала при непрямой фетальной электрокардиографии (fECG) у 773 беременных в сроках от 28 до 42 недель гестации. Было установлено, что средняя потеря сигнала при непрямой ЭКГ плода составила 32%. Рекомендации Международной федерации гинекологии и акушерства (FIGO) по потере сигнала – не более 20%. Таким образом, качественный сигнал должен составлять не менее 80% продолжительности записи для дальнейшего анализа КТГ по данным FIGO. Качество записи, соответствующее критериям потери сигнала по FIGO, в работе T. Fuchs et al. (2014) было зафиксировано всего у 46% (357/773) беременных. Рекомендации DGGG (Германского общества гинекологии и акушерства) по потере сигнала - не более 15%. Таким образом качественный сигнал должен составлять не менее 85% продолжительности записи по данным DGGG для дальнейшего анализа КТГ. Качество записи, соответствующее критериям DGGG, в работе T. Fuchs et al. (2014) было зафиксировано только у 39% беременных. При исследовании никакой корреляции между качеством сигнала при непрямой фетальной электрокардиографии и индексом массы тела пациенток не было выявлено [29].
B. Arya et al. (2015) в своей работе “Технико-экономическое обоснование неинвазивного электрокардиографического мониторинга плода в клинической практике” указывают на несовершенство технологии фетального мониторинга “Monica AN24”. Записи проводились от 5 до 15 минут с целью оценки зубцов и кардиоинтервалов. Были взяты 60 фетальных электрокардиограмм от 50 матерей. Однако качественный сигнал был получен в 20 из 60 случаев с 259 фетальными сердечными циклами. При средней ЧСС плода 130-140 уд./мин. – это промежуток времени около 2 минут. Для диагностики дистресса плода в акушерстве необходима запись минимум 10 минут или более. Другими словами, качественный сигнал был получен в 33,3% случаев. Далее авторы указывают, что оценка кардиоинтервалов была затруднительна в сроках от 26 до 30 недель беременности. Кроме того, трудно было оценить QT интервал [30]. Известно, что качественный сигнал должен составлять не менее 80% записи по рекомендациям FIGO и 85% записи - по данным DGGG [29].
Так, германские авторы J. Reinhard et al. (2008) в своей работе “Фетальная ЭКГ как альтернатива ультразвуковой допплеровской кардиотокографии в оценке антенатального состояния плода”, обследовав 10 беременных в сроках более 32 недель гестации, указывают на низкое качество записи при фетальной электрокардиографии. Было установлено, что качественная запись при непрямой ЭКГ плода была получена в активные часы в 62,3% случаев, в неактивные часы (сон) плода - 75.3%, в ночное время с 23ч00м до 7ч00м - 78,3%. В то же время, качественная запись материнской электрокардиограммы составила 99,7%. В заключение авторы говорят о необходимости дальнейших исследований в области фетальной электрокардиографии, чтобы сравнить эффективность двух методик: ЭКГ и ультразвуковой [31].
E. M. Graatsma et al. (2010) выявили отсутствие влияния ожирения на качество записи при фетальной электрокардиографии при использовании “Monica AN24”, производства Monica Healthcare [32]. Авторы указали, что медиана индекса массы тела (ИМТ) обследуемых женщин составила 26,9. ИМТ=m/h2, где m - масса тела человека (в килограммах), а h - рост человека (в метрах). Известно, что значения ИМТ: меньше 15 - острый дефицит веса; от 15 до 20 - дефицит веса; от 20 до 25 - нормальный вес; от 25 до 30 - избыточный вес; свыше 30 - ожирение.
Sänger N. et al. (2012) оценили качество сигнала ЧСС плода, полученного с помощью непрямой ЭКГ плода “Monica AN24” и ультразвукового фетального монитора “Corometrics 250” допплеровским методом. В исследовании участвовали 70 беременных женщин в сроках от 20 до 40 недель беременности, которым проводили непрямую ЭКГ плода с помощью системы “Monica AN24”, а далее ультразвуковую кардиотокографию. Качество сигнала ЧСС плода, полученного вышеназванными методиками, коррелировало с гестационным возрастом и индексом массы тела (ИМТ). В целом, качественный сигнал ЧСС плода при непрямой фетальной ЭКГ был получен в 77,4% случаев, а при ультразвуковой кардиотокографии соответственно в 73,1% случаев (р>0,05). В сроках от 27 до 36 недель беременности качественный сигнал ЧСС плода, полученный ЭКГ методикой, составил 72,3%, а при ультразвуковой кардиотокографии - 83,0% (р=0,001). Между двумя методиками не было обнаружено различий в качестве сигнала после 37 недель беременности - 87,7% и 86,1% соответственно (р>0,05) [26].
В другой работе N. Sänger et al. (2013) указывают, что качественный сигнал был получен при тазовом и головном предлежании плода в первом периоде родов в 87,8% и 85,7% случаев соответственно (р> 0,05), а во втором периоде в 78,4% и 55,4% случаев соответственно (р=0,08) [33].
Интересно, что J. Reinhard et al. (2014), сравнивая эффективность инвазивной методики ЭКГ плода (спиральный ЭКГ электрод устанавливается на головку плода) с помощью STAN технологии и неинвазивной “Monica AN24” (ЭКГ электроды устанавливается на переднюю брюшную стенку женщины), рекомендуют продолжить техническое совершенство непрямой фетальной электрокардиографии [34].
Также представляет интерес исследование A. Wacker-Gussmann et al. (2018), в котором была проведена оценка точности определения кардиоинтервалов плода (FCTI) с помощью устройства ЭКГ плода “Monica AN24”. В исследование включили 18 здоровых плодов, начиная с 32 недель беременности. Небольшая и носимая система мониторинга “Monica AN24” включала стандартные электроды, расположенные на животе матери для мониторинга фетальной ЭКГ (fECG), ЭКГ матери и электромиограммы матки (ЭМГ). Точность определения кардиоинтервалов плода оценивались по 1000 усредненным R-R интервалам. Порог потери сигнала был задан на уровне 30%. Всего было проведено 149 исследований, из которых отобрали 117 для анализа FCTI. В 97% случаев определялся зубец P и интервал PQ, комплекс QRS в 100% случаев, однако зубец T был обнаружен только в 41% случаев. Несмотря на ограниченное использование непрямой ЭКГ плода в современном акушерстве, авторы делают вывод, что она может быть только дополнительным инструментом для точного выявления FCTI, начиная с 32 недель беременности [24].
J. DiPietro et al. (2022) проанализировали у 131 плодов кардиотокограммы, полученные допплеровским методом (CTG) и с помощью фетальной наружной ЭКГ (fECG) дважды во время беременности (в 28 и 36 недель) с использованием коммерчески доступного устройства “Monica AN24”. Качественная запись при ультразвуковой КТГ составила 90% случаев в каждом гестационном возрасте по сравнению с непрямой ЭКГ плода, показавшей более низкие значения [35].
В своей работе B. S. Kisilevsky et al. (2016) определяли точность двух методик измерения частоты сердечных сокращений (ЧСС) плода с помощью непрямой ЭКГ плода и ультразвуковой кардиотокографии в неактивный период (сон плода) и период шевеления плода. Данные о ЧСС плода получали с помощью “Monica AN24” и ультразвукового фетального монитора “Hewlett-Packard Model 1351A”. Одновременно данные о ЧСС матери были получены с использованием того же устройства “Monica AN24” и второго ультразвукового фетального монитора “Spacelab 514T” с детектором комплекса QRS матери. Корреляция между частотой сердечных сокращений плода, полученной ультразвуковой методикой, и ЧСС плода с помощью непрямой ЭКГ, составила r=0,57-0,97 у 77% плодов в неактивный период (сон плода). Точность определения средней ЧСС плода за 20 мин сна плода варьировала от 0,0 до 0,8 уд/мин. После 2 минутной аудио-стимуляции материнским голосом начинался активный период шевеления плода. Корреляция между частотой сердечных сокращений плода, полученной ультразвуковой методикой, и ЧСС плода с помощью непрямой ЭКГ, составила r=0,54-0,99 у 95% плодов и была высокой r=0,99 при усреднении ЧСС плода. Точность определения средней ЧСС плода в активный период варьировала от 0,0 до 0,6 ударов в минуту. Точность определения средней частоты сердечных сокращений матери за 10 мин составила ≤1 уд/мин; корреляция показателей вариабельности сердечного ритма варьировала от r=0,89 до 0,97 [36].
Наш опыт работы в области ультразвуковой кардиотокографии показал, что потеря сигнала в среднем составляла 3,1% при обследовании 155 беременных в сроках гестации 32-40 недель в роддоме БУЗ ВО ВГКБСМП №10 (Воронеж). Во все случаях при минимальной потере сигнала был проведен компьютерный анализ кардиотокограмм с получением в 100% случаев заключения по критериям Dawes/Redman (2014) [37]. Другими словами, данная минимальная потеря сигнала не влияла на алгоритм оценки и получение автоматического заключения для диагностики гипоксии плода.
Непрямая ЭКГ плода и ультразвуковой фетальный мониторинг при беременности.
Современное акушерство невозможно представить без фетального кардиомониторинга в диагностике внутриутробной гипоксии плода [38, 39, 40]. Многочисленные работы, посвященные этой проблеме при беременности и в родах, основаны на ультразвуковом методе в кардиотокографии, единичные на непрямой ЭКГ плода.
В настоящее время внутриминутная вариабельность (STV) ритма, полученная с помощью компьютерного анализа частоты сердечных сокращений плода, является параметром, который важен для диагностики внутриутробной гипоксии плода при беременности или дистресса в родах.
G. Seligeret et al. (2017) изучали состояние плода с помощью монитора ЭКГ плода “Monica AN24” длительно в течение суток и высчитывали внутриминутную вариабельность ритма плода. Семьдесят плодов наблюдались в среднем в течение 12ч. Медиана срока гестации составила 37 недель беременности. Результаты STV за час были классифицированы как “патологические” при STV<4 мс и “нормальные” при STV=4 мс или более. Средняя величина STV у здоровых плодов составила 9,6±2,6 мс, а при дистрессе плода 3,0±0,5 мс. Дистресс плода встречался в 1% случаев. Чувствительность метода непрямой фетальной ЭКГ в диагностике дистресса плода составила 39% при однократной величине “патологической” STV, 68% при получении двух результатов “патологической” внутриминутной вариабельности ритма плода, 80% при трех “патологических” STV [18].
В то же время, E. A. Huhn et al. (2017) обследовали кардиотокограммы 63 пациенток с нормальной беременностью, которые носили монитор “Monica AN24” дома, и 42 женщин, носивших устройство во время пребывания в стационаре. Все женщины, использующие “Monica AN24” дома, и 13 пациенток в больнице носили фетальный монитор в дневное и ночное время. Качественная запись непрямой фетальной ЭКГ была получена в 86,8% случаев в ночное время и 40,2% в дневное время при домашнем фетальном мониторинге. Качественная запись в стационаре ночью зарегистрирована в 71,1% случаев, днем - 43,3%. Данный показатель был связан с гестационным возрастом, но не имел корреляцию с индексом массы тела беременной и задержкой внутриутробного развития плода. Результат определения ЧСС плода по R-R интервалам зависел от движения беременной и позы матери. Авторы делают вывод, что клиническая целесообразность использования абдоминального монитора “Monica AN24” ограничена активностью или изменением позы беременной [41].
A. Crawford et al. (2018) получили качественную запись ЧСС плода при непрямой фетальной ЭКГ на мониторе “Monica AN24” у 19 из 22 беременных в 86,3%, ЧСС матери – в 99,0% случаев. Качество записи положительно коррелировало с гестационным возрастом и отрицательно коррелировало с маточной активностью и передвижением пациентки. Авторы пришли к выводу, что использование “Monica AN24” является осуществимой и приемлемой формой мониторинга за состоянием плода для беременных женщин, хотя требует дальнейшего практического улучшения конструкции и работы устройства. Необходимы дальнейшие исследования использования непрерывного фетального ЭКГ мониторинга в оценке состояния плода [42].
В современной литературе мало публикаций о влиянии позы или положения матери на изменения частоты сердечных сокращений плода на поздних сроках беременности. S. Ibrahim et al. (2015) провели проспективное исследование, проходившее в больнице Тайгерберг в Кейптауне. Беременные женщины, поступившие на плановое кесарево сечение, были обследованы с целью определения влияния изменения позы беременной на ЧСС матери и плода. В исследовании использовалась непрерывная трансабдоминальная неинвазивная регистрация ЧСС матери и плода, а также определялась маточная активность в течение одного часа у 119 женщин с использованием устройства “Monica AN24”. Положение матери менялось каждые 15 минут из бокового в лежачее, затем в другое боковое положение и, наконец, снова в лежачее положение. Исследование показало, что средняя ЧСС плода была на четыре удара в минуту меньше в левом боковом положении, чем в правом боковом. Изменения средней ЧСС матери наблюдались в 10,9% случаев и были связаны с активностью матки, а не с положением матери [43].
Известно, что у плодов малого гестационного возраста (SGA) риск осложнений выше при преждевременных родах, чем у плодов при срочных родах. В своей работе H. Kapaya et al. (2019) изучали надежность фетальной ЭКГ “Monica AN24” в разные сроки гестации, начиная с 24 недель беременности и предполагаемой массой плода ниже десятого процентиля. Тридцать пять женщин использовали это устройство дома однократно для фетального мониторинга, двадцать четыре из них использовали дома два раза. Качественная запись непрямой фетальной ЭКГ была получена в 48,6% случаев с 24 недель беременности, а после 34 недель – в 68,8% случаев. Авторы сделали вывод, что непрямая фетальная ЭКГ плода является перспективным методом фетального мониторинга только с 34 недель беременности. H. Kapaya et al. (2019) подчеркивают, что необходимы дальнейшие исследования, прежде чем можно будет установить клиническую полезность данного диагностического метода. В целом, работа показала, что длительный фетальный мониторинг на дому возможен, но есть факторы, препятствующие использованию данного монитора в современных условиях оказания акушерской помощи беременным. Авторы подчеркнули, что непрямая фетальная ЭКГ может быть только дополнением к современным методам ультразвукового фетального мониторинга [44].
Суправентрикулярная (наджелудочковая) тахикардия плода является редкой аритмией плода, но хорошо диагностируется антенатально и требуют особенного внимания. В работе S.S.Bhatia et al. (2020) были описаны три случая обнаружения у разных женщин допплеровским методом кардиотокографии тахикардии плода >200 ударов в минуту и соответственно дистресса плода. Всем беременным провели экстренное родоразрешение путем кесарева сечения [45].
Многие авторы указывают, что компьютерный анализ кардиотокограмм улучшает диагностику гипоксии плода и перинатальные исходы [2, 12-15, 46, 47, 48].
Также представляют интерес исследования, посвященные определению точности диагностики дистресса плода путем расшифровки кардиотокограмм по известным авторским методикам.
Анализ результатов обследования 319 плодов с помощью ультразвуковой кардиотокографии в сроках гестации 32-40 недель беременности выявил низкую чувствительность 64,9% (74/114) и специфичность 75,6% (155/205) оценки состояния плода по методике W.M. Fischer (1976). Средняя точность этого метода составила 70,3% [19]. Интересно, что использование автоматизированной системы анализа КТГ по методике В.Н. Демидова (1983) показало более высокую среднюю точность диагностики дистресса плода - 89,7%. Обобщение результатов обследования 154 плодов с помощью ультразвуковой кардиотокографии показало в отношении данного метода чувствительность 90,0% (45/50), специфичность 89,4% (93/104) в сроках гестации 32-40 недель беременности [19].
Следует подчеркнуть, что применение ультразвуковой кардиотокографии с автоматическим анализом по критериям Dawes/Redman (2014) выявило среднюю точность диагностики дистресса плода в антенатальном периоде 92,1%, чувствительность 91,03% (71/78), специфичность 93,15% (449/482). В работе было обследовано 560 плодов в сроках гестации 32-40 недель беременности [19].
Интересно, что результаты обследования 32 беременных с помощью непрямой ЭКГ плода в сроках гестации 22-40 недель беременности в роддоме ГКБСМП №10 (г. Воронеж) показали низкую чувствительность 40% и специфичность 25,9% на фетальных мониторах “Monica AN24” [19].
Ультразвуковой фетальный мониторинг и непрямая ЭКГ плода в родах.
Кардиотокография (КТГ) остается основным методом оценки состояния плода, который благодаря своей информативности и стабильности получаемой информации практически полностью вытеснил из акушерской клинической практики ЭКГ плода [27].
Следует подчеркнуть, что оценка состояния плода очень важна для предотвращения внутриутробной гибели, асфиксии при рождении, неврологических нарушений новорожденных и неонатальной смертности. L. Nazir et al. (2021) указывают, что патологическая кардиотокограмма, полученная традиционным ультразвуковым методом, является показателем рождения детей с низким баллом по шкале Апгар [49].
Ультразвуковая кардиотокография с использованием анализа ритма плода в течение схваток улучшает диагностику дистресса плода в родах [50].
Тахисистолия – специальный термин в кардиотокографии, который обозначает чрезмерно активную родовую деятельность, когда частота сокращений превышает 5 сокращений за 10 мин – в двух последовательных 10-минутных периодах или усредненная (за 30 мин) [27, 51].
Наличие более 5 схваток в течение 10 минут в родах может уменьшить оксигенацию плода, уменьшая маточно-плацентарный кровоток, особенно при использовании утеротоников. Используя ультразвуковую кардиотокографию, S.J. Leathersich et al. (2018) оценили эффективность применения токолитиков в коррекции чрезмерной родовой деятельности, а также для улучшения состояния плода во время родов [52].
Авторы, используя ультразвуковой метод кардиотокографии в диагностике дистресса плода, пришли к выводу, что женщины с сахарным диабетом 1 и 2 типа подвержены повышенному риску дистресса плода во время родов по сравнению с контрольной группой [17]. Наличие сальтаторного ритма по данным допплеровской КТГ у беременных с гестационным сахарным диабетом также связано с дистрессом плода [53].
C. Redman (2014), основатель английской школы ультразвуковой кардиотокографии, в своей последней работе указывал, что визуальный метод является субъективным или недостоверным в сложных случаях диагностики дистресса плода, особенно в родах. Так как каждая кардиотокограмма индивидуальна и на 100% не подобна другим. Только автоматический компьютерный анализ, основанный на многотысячной базе данных ультразвуковых кардиотокограмм, газовый состав крови пуповины или предлежащей части плода, позволяют достигнуть высокой точности в оценке состояния плода. Автор указывают, что методика Daews/Redman (2014) основана именно на вышесказанном и остается самой высокоточной в области кардиотографии [54].
Мониторинг двойни возможен ультразвуковыми датчиками от фетальных мониторов и с помощью непрямой ЭКГ плода [55].
E. Keenan et al. (2020) указали на возможность обнаружения аритмий плода с помощью непрямой ЭКГ плода, но широко данная методика не применяется в акушерстве [56]. Это связано с низким качеством идентификации зубца P при непрямой ЭКГ плода [57].
Также представляет интерес исследование A. Fisenko et al. (2018), в котором значимость показателей ультразвуковой КТГ в сочетании с уровнем лактата в крови плода для диагностики дистресса плода в родах составила 82% [58].
Известно, что ультразвуковая КТГ отрицательно коррелирует с индексом массы тела матери (ИМТ). Фетальный электрод на головке плода (FSE) считается эталонным стандартом для мониторинга ЧСС плода. Он применяется при прямой ЭКГ плода в родах только после разрыва плодных оболочек при достаточном открытии маточного зева, иногда противопоказан. Альтернативой может быть непрямая ЭКГ плода, но необходимы дальнейшие исследования в акушерстве и совершенствование аппаратной части устройства [25].
В родах на состояние плода влияет характер родовой деятельности и изменение кровообращения в системе мать-плацента-плод, а также продвижение плода по родовому каналу, особенно в полости малого таза. Вышесказанное увеличивает трудность интерпретации КТГ в родах по сравнению с антенатальным периодом [27, 28].
В настоящее время для улучшения диагностики дистресса плода в родах используются стандарты или руководства по расшифровке ультразвуковой кардиотокографии.
Королевская коллегия акушеров и гинекологов Великобритании (RCOG), Общество акушеров и гинекологов Канады (SOGC), Национальный институт детского здоровья и развития человека США (NICHD), Американский колледж акушеров и гинекологов (ACOG) и Медицинское общество матери и плода (Society for Maternal-Fetal Medicine), Институт акушерства и гинекологии Королевской коллегии врачей Ирландии (Institute of Obstetricians and Gynecologists Royal College of Physicians of Ireland), Королевский австралийский и новозеландский колледж акушеров и гинекологов (RANZCOG, 2014г) опубликовали собственные стандарты интранатальной кардиотокографии, которые практически не отличаются друг от друга [15].
В России также был принят клинический протокол по применению кардиотокографии в родах в апреле 2015г. [59]. В октябре 2015г. Международная федерация гинекологии и акушерства (FIGO) опубликовала новое руководство по ультразвуковой кардиотокографии в родах [4].
Использование данных руководств, протоколов по расшифровке кардиотокограмм, современной акушерской тактики ведения пациенток, а также своевременное родоразрешение при критических состояниях плода позволяют снизить показатели перинатальной смертности [27, 28].
C. Lempersz et al. (2020) в своем обзоре литературы указали на возможность использования неинвазивной ЭКГ плода во время родов, однако будущие исследования должны быть сосредоточены на улучшении качества сигнала [60].
Заключение. Таким образом, исследования, посвященные роли непрямой фетальной электрокардиографии в диагностике гипоксии или дистресса плода являются единичными. Следует подчеркнуть недостаточную надежность фетальной ЭКГ по сравнению с ультразвуковой кардиотокографией в диагностике гипоксических состояний плода при беременности и в родах. Все это диктует необходимость дальнейших исследований в области непрямой ЭКГ плода. Полученные данные могут быть использованы для улучшения перинатальных исходов.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы