Анализ полиморфных вариантов генов рецепторов серотонина и гамма-аминомасляной кислоты у больных сахарным диабетом 2 типа
Aннотация
Актуальность: СД2 одно из наиболее распространенных заболеваний 21 века. СД2 имеет многофакторную природу, в его этиологии ведущую роль играют такие факторы, как возраст и ожирение, а также генетическая предрасположенность, обусловленная полиморфизмом ряда генов. Цель исследования: Анализ полиморфных вариантов генов рецепторов серотонина HTRD rs674386, HTR1F rs56398417, HTR2A rs6313, HTR3A rs1062613, HTR2C rs6318, гена рецептора гамма-аминомасляной кислоты GABRA2 rs279845, среди больных СД2, проживающих в РБ. Материалы и методы: Образцы ДНК включали группу больных СД2 691 человек и контроль 1096 человек. Исследование полиморфных маркеров проводили с использованием полимеразной цепной реакции (ПЦР) TaqMan. Результаты: В результате изучения 6 полиморфных локусов генов нейротрансмиттерной системы были выявлены протективные маркеры, включающие генотипы CT и СС полиморфного локуса rs1062613 гена HTR3A (OR=0,73, Pcor_FDR=0,0007) и генотипы риска GC и CC полиморфного локуса rs6318 гена HTR2C (OR=2,21, Pcor_FDR=0,0045) среди женщин, генотип СС является рисковым и среди мужчин (OR=4,05, Pcor_FDR=0,0045). Мультилокусный анализ комбинаций генотипов и аллелей выявил пять сочетаний повышенного и пониженного риска развития СД2. Наиболее значимая ассоциация была выявлена для комбинации HTR3A rs1062613аллель C+HTR2A rs6313аллельA+HTRD rs674386 аллель А+HTR1F rs55639841 генотип СС (OR=1,74, Pcor_FDR=0,0004). Проведенный анализ ROC кривых показал, что исследуемые локусы HTRD rs674386, HTR1F rs56398417, HTR3A rs1062613, GABRA2 rs279845 и такие переменные как пол, возраст обследуемых и уровень ИМТ, включенные в построение модели расчета риска, могут предсказывать развитие СД2 с чувствительностью 79,0% и специфичностью 75,0%, площадь под кривой AUC составила 83,40% (95% CI 83,50-87,40). Заключение: Полученные результаты могут свидетельствует о высоком уровне прогностической значимости полиморфных вариантов генов нейротрасмиттерной системы в оценке предрасположенности к риску СД2.
Ключевые слова: сахарный диабет 2 типа, нейротрасмиттерная система, рецепторы серотонина, рецептор гамма-аминомасляной кислоты
Введение. Сахарный диабет 2 типа (СД2) является метаболическим заболеванием, характеризующимся повышенным содержанием глюкозы в крови, его развитие обусловлено формированием резистентности инсулину [1]. Распространенность СД2 увеличивается во всем мире, приводя к снижению качества жизни и преждевременной смерти [1]. Основываясь на концепции психобиосоциальной модели патогенеза СД2 и рассматривая образ жизни в качестве триггерного фактора формирования СД2, актуальным и целесообразным представляется изучение нейротраснмиттеров при развитии СД2. Одним из нейромедиаторов центральной нервной системы является серотонин (5-НТ), который принимает участие в регуляции сложного поведения, например, такого как агрессия и контроль аппетита [2]. Серотонин встречается в организме в двух разных пулах, один в центральной нервной системе и другой в периферических тканях. Примерно 90% всего 5-НТ, присутствующего в организме, вырабатывается клетками желудочно-кишечного тракта, выделяемый нейромедиатор принимает участие в контроле секреции инсулина [3]. Установлено, что измененные функции серотонина обуславливает дисфункцию b-клеток поджелудочной железы и в конечном итоге приводят к развитию СД2 [4]. Bennet H., 2015 установили, что повышенная экспрессия генов HTR1D и HTR2A в ткани b-клеток поджелудочной железы среди больных СД2 по сравнению со здоровым контролем [5]. Исследования связи СД2 и серотонинергической системы выявили ассоциацию полиморфных вариантов генов рецепторов серотонина HTR2A, HTR2C с риском развития СД2 типа у европеоидов [6, 7], полиморфные варианты гена HTR3B ассоциированы с СД2 типа у корейцев [8], полиморфизм гена HTR2C связан с СД2 у иранцев [9]. Полиморфные варианты гена GABRA2, кодирующий α2 субъединицу рецептора гамма-аминомасляной кислоты (ГАМК- α), были связаны с риском зависимости от алкоголя [10]. Также эти рецепторы, играют важную роль в регуляции секреции инсулина и высвобождения глюкагона в островковых клетках поджелудочной железы как у здоровых, так и у пациентов СД2 [11]. По результатам GWAS исследований среди жителей Арабских Эмиратов для генов ГАМК- α были определены маркеры риска развития СД2 [12]. Однако роль нейротрасмиттеров в патогенезе СД2 остается мало изученной. В этой связи анализ полиморфных вариантов генов нейротрасмиттерной системы представляет актуальную проблему.
Цель исследования. Анализ полиморфных вариантов генов рецепторов серотонина HTRD rs674386, HTR1F rs56398417, HTR2A rs6313, HTR3A rs1062613, HTR2C rs6318, гена рецептора гамма-аминомасляной кислоты GABRA2 rs279845, среди больных СД2, проживающих в Республике Башкортостан (РБ).
Материалs и методы исследования. В работе были использованы образцы ДНК неродственных индивидов, татар по этнической принадлежности, проживающих на территории Республики Башкортостан. Группа больных СД2 включала 691 человек. Клинический диагноз СД2 определялся согласно диагностическим критериям Всемирной организации здравоохранения (1999-2013 гг.) и Алгоритмам специализированной медицинской помощи больным сахарным диабетом от 2021 г.: концентрация глюкозы в плазме венозной крови натощак более или равно 7,0 ммоль/л, либо концентрация глюкозы в плазме венозной крови через 2 часа после проведения ПГТТ более или равно 11,1 ммоль/л [1]. Группа пациентов была сформирована с учетом клинико-инструментального исследования на базе многопрофильного стационара Городская клиническая больница №21 г. Уфа. Контрольная группа включала 1096 практически здоровых индивидов. Характеристика групп пациентов и контроля представлена в таблице 1.
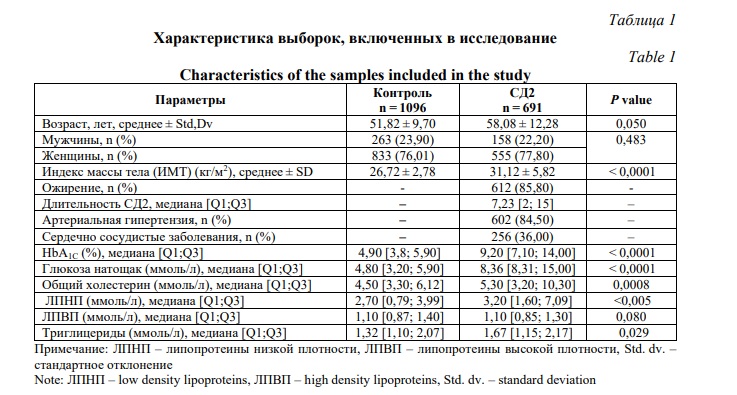
Исследование одобрено комитетом по этике ИБГ УФИЦ РАН. От всех участников исследования получали информированное добровольное согласие на использование биологического материала в планируемых исследованиях.
ДНК выделяли из венозной крови методом фенольно-хлороформной экстракции. Исследование полиморфных маркеров проводили с использованием полимеразной цепной реакции (ПЦР) TaqMan (https://oligos.ru, ООО «ДНК-синтез», Россия) на приборе CFX Bio-Rad Laboratories Inc., USA. Флуоресценцию «по конечной точке» и дискриминацию генотипов определяли по протоколу BioRad CFX96TM, используя программу CFX Manager TM Software.
Статистическая обработка. Оценку соответствия частота генотипов и аллелей равновесию Харди-Вайнберга проводили с помощью критерия χ2 (Р Х-В). Анализ ассоциаций с развитием СД2 проводили с использованием программы PLINK v.1.9 [13]. Поправку на множественность сравнения Pcor_FDR оценивали с помощью он-лайн калькулятора https://www.sdmproject.com/utilities/?show=FDR. Ассоциация считалась значимой при уровне Pcor_FDR менее 0.05, а 95% доверительный интервал не пересекал единицу. Анализ ассоциаций рассчитанной для основной группы представлен в моделях: кодоминатной и аддитивной, а также в виде аллельного теста. Множественной логистический регрессионный анализ и ROQ-анализ проводился с использованием SPSS v.22. Анализ ген-генных ассоциаций с СД2 между аллелем и или/генотипом был рассчитан с помощью программы APSampler 3.6.0 (http://apsampler.sourceforge.net).
Результаты и обсуждения. Для проведения анализа ассоциаций первоначально был произведен расчет на соответствие распределения частот генотипов исследованных полиморфных локусов равновесию Харди–Вайнберга, с учетом частоты редкого аллеля (MAF) среди больных и здоровых испытуемых (Табл. 2).
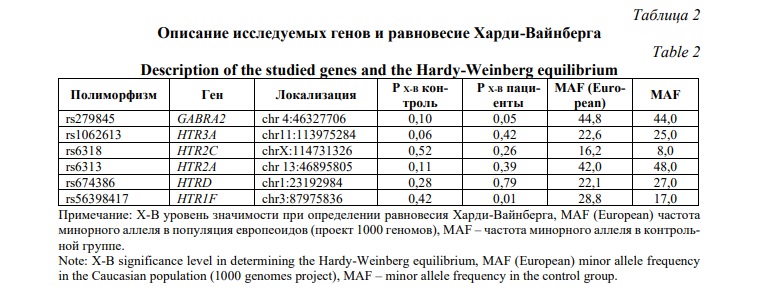
Локус гена HTR2C расположенного в X-хромосоме анализировали отдельно у женщин и мужчин. Анализ проводился в кодоминатной и аддитивной моделях, а также оценивался аллельный тест, данные представлены в таблице 3. Статистически значимые различия были получены для локуса rs1062613 гена HTR3A в кодоминантной модели для генотипов CT и СС (OR=0,71 и OR=0,59, Pcor_FDR=0,004). В аддитивной модели показатель OR составил 0,73, Pcor_FDR=0,0007. Для полиморфного локуса rs6318 гена HTR2C получены статистически значимые различия в группе женщин. В кодоминантной модели ассоциация с риском развития СД2 определена для генотипов GC и CC (OR=2,37 (95% CI 1,74-3,24), Pcor_FDR=0,0045, OR=2,77 (95% CI 0,93-8,25), Pcor_FDR=0,0045). Учитывая, что доверительный интервал во-втором случае пересек 1, наиболее статистически значимой моделью является аддитивная OR=2,21 (95% CI 1,66-2,94), Pcor_FDR=0,0045). Среди мужчин генотип СС также ассоциировал с риском развития СД2 (OR=4,05, Pcor_FDR=0,0045). Анализ локуса rs279845 гена GABRA2 выявил тенденцию к увеличению частоты генотипа ТТ среди пациентов до 37,2% по сравнению с 31,0% в контроле (OR=0,75 и OR=0,79, Pcor_FDR=0,046), соответственно для проективных генотипов СТ и СС.
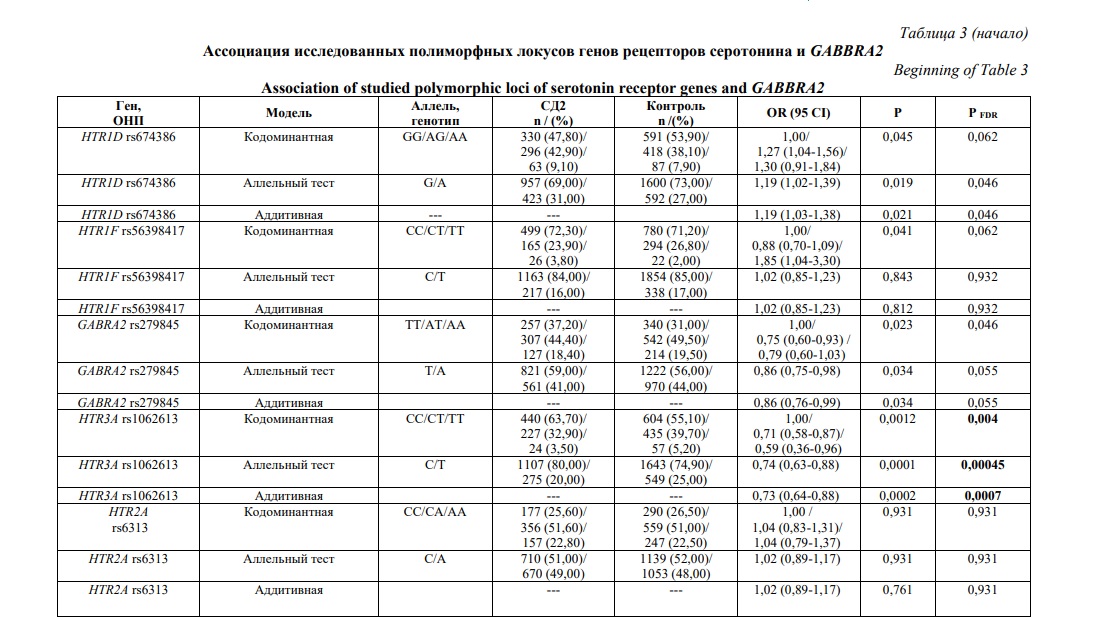
В результате проведения мультилокусного анализа ассоциаций определено пять сочетаний генотипов и аллелей, показавших статистическую значимость с СД2. Аллель C локуса rs1062613 гена HTR3A входил в состав двух моделей повышенного риска СД2 и аллель Т входит в состав трех моделей пониженного риска. В трех моделях встречался локус rs674386 гена HTRD, в этом случае аллель А представлена в модели повышенного риска заболевания, аллель G определялся в составе моделей пониженного риска (Pcor_FDR=0,007 и (Pcor_FDR=0,001). При индивидуальном анализе ассоциация аллель G также чаще встречался среди здоровых. наиболее значимая ассоциация была выявлена для сочетания HTR3A rs1062613 аллель C +HTR2A rs6313 аллель A+HTRD rs674386 аллель А+HTR1F rs55639841 генотип СС (OR=1,74, Pcor_FDR=0,0004).
При анализе ROC кривых для оценки прогностической значимости выявленных рисковых значений в развитии СД2 были построены две модели, для первой модели были учтены только полиморфные локусы: HTRD rs674386, HTR1F rs56398417, HTR3A rs1062613, GABRA2 rs279845, во вторую модель были включены эти же локусы, а также такие переменные как пол, возраст обследуемых и ИМТ. Эффективность прогноза измеряли с использованием площади под кривой (AUC). ROC-анализ показал AUC равную 56.70% (95% CI 53,90-59,40) для модели, включающей только исследуемые полиморфные варианты. Для второй модели AUC составила 83,40% (95% CI 83,50-87,40) с чувствительностью 79,0% и специфичностью 75,0%, что указывает на высокую способность показателей включенных в анализ правильно классифицировать индивидов с СД2 и здоровых.
Наибольшее количество ассоциаций продемонстрировал полиморфный вариант rs1062613 гена HTR3A. Данный полиморфизм расположен в 5ʹUTR области гена, установлено, что аллель С данного полиморфного локуса влияет на аффинность связывания фактора транскрипции CTCF с промоторной областью гена HTR3A [14]. По данным ряда авторов аллель С ассоциирован с низкой экспрессией гена HTR3A [15] и высоким уровень метилирования [16]. Низкая экспрессия, в свою очередь, обуславливает снижение уровня серотонина в центральной нервной системе, приводит к изменению пищевого поведения и развитию гиперфагии, а впоследствии и ожирения, провоцирующего развитие СД2 [17]. Ассоциация с развитием СД2 была показана для локуса rs6318 гена HTR2C. Данный полиморфизм обусловлен заменой аминокислоты Cys на Ser в 23 положении. Показано, что белок, кодируемый аллелем Ser23 или С имеет пониженную аффинность к серотонину [18]. Рядом авторов установлена ассоциация данного локуса с риском развития депрессии [18], а также ожирения и СД2, что подтверждает наши данные [19-21]. Локус rs279845 гена GABRA2 ассоциирован с алкоголизмом, носители аллеля Т в меньшей степени страдают алкоголизмом [22, 23].
Заключение. В данном исследовании мы провели оценку влияния полиморфных вариантов генов нейротрансмиттерной системы на риск развития СД2 с помощью анализа комбинаций генотипов и аллелей, а также анализа ROC кривых. Показано, что набор генетических вариантов (HTRD rs674386, HTR1F rs56398417, HTR3A rs1062613, GABRA2 rs279845) и таких показателей как пол, возраст и значение ИМТ, достоверно улучшает прогнозирование развития СД2 среди жителей РБ. Анализ комбинаций генотипов и аллелей выявил пять сочетаний повышенного и пониженного риска развития СД2. Тем не менее, необходимы дальнейшие масштабные исследования нейротрансмиттерной системы для подтверждения значимости генов рецепторов серотонина в развитии СД2.
Информация о финансировании
Исследование поддержано Российским научным фондом (№22-25-00010).




















Список литературы