Перспективы исследования ретроэлементов в терапии COVID-19 (обзор)
Aннотация
Актуальность: Поиск методов лечения COVID-19 с использованием генетических достижений может стать основой для эффективной борьбы с данной вирусной инфекцией. Таргетная терапия с применением некодирующих РНК отвечает условиям современной персонализированной медицины, поскольку позволит диагностировать вовлеченные в патогенез COVID-19 молекулярные механизмы и точно воздействовать на них. Цель исследования:Определить наиболее значимые эпигенетические звенья патогенеза COVID-19, воздействие на которые перспективно для разработки таргетной терапии. Материалы и методы:Использованы базы данных Scopus, WoS, PubMed для анализа роли микроРНК, длинных некодирующих РНК, ретроэлементов в развитии COVID-19. Результаты:Согласно проанализированной литературе, длинные некодирующие РНК и при-микроРНК способны транслироваться с образованием функциональных пептидов, которые регулируют экспрессию собственных и других генов. В патогенезе COVID-19 важную роль играют эпигенетические факторы, что отражается в изменении экспрессии определенных некодирующих РНК у пациентов в зависимости от степени тяжести и характера течения болезни. Это может быть обусловлено участием ретроэлементов в противовирусном ответе и его неэффективности при старении. Результатом являются более тяжелые формы COVID-19 у пожилых людей с развитием цитокинового шторма, несмотря на наличие физиологического иммунодефицита. Заключение: Поскольку особенности экспрессии специфических некодирующих РНК у пожилых больных COVID-19 отражают регуляторный дисбаланс транспозонов, перспективна разработка пептидов, влияющих на экспрессию микроРНК, длинных некодирующих РНК и ретроэлементов. Данный подход мог бы стать основой не только для эффективного лечения возрастных пациентов, но и для продления их жизни в связи с влиянием на эпигенетические механизмы старения. Для этого необходимо определение спектра действия синтезируемых для терапии COVID-19 пептидов
Введение. Коронавирусы относятся к подсемейству Coronavirinae, семейства Coronaviridae, отряда Nidovirales и являются крупнейшими из известных одноцепочечных «плюс-нитевых» РНК-вирусов (используют свой геном непосредственно в качестве мРНК). Их диаметр достигает 160 нм, а общая длина генома в среднем 32000 п.н. Подсемейство Coronavirinae включает роды Alphacoronavirus, Betacoronavirus, Gammacoronavirus и Deltacoronavirus. SARS-CoV-2, вызывающий COVID-19 (human coronavirus disease 19), относится к роду Betacoronavirus [1]. Структура SARS-CoV-2 соответствует специфическим характеристикам известных коронавирусов: более 67% генома на 5’-конце входит в состав отрытой рамки считывания ORF1ab и кодирует orf1-ab-полипротеины. Остальная часть РНК вируса на 3’-конце содержит гены структурных белков: поверхностные (S), мембранные (М), оболочечные (Е) и нуклеокапсидные (N), а также 6 дополнительных белков, продуктов трансляции ORF3a, ORF3b, ORF6, ORF7a, ORF7b и ORF8 [2].
COVID-19 характеризуется высокой смертностью и большим количеством осложнений. Наиболее характерными из них являются гипериммунные реакции, такие как «цитокиновый шторм», детский мультисистемный воспалительный синдром, иммуноопосредованные кожные и неврологические заболевания наряду с аутоиммунными проявлениями с нарушением регуляции механизмов свертывания крови [3]. Данные изменения могут быть обусловлены влиянием вирусных инфекций на транспозоны (мобильные генетические элементы (МГЭ)), которые участвуют в регуляции иммунной системы и экспрессии генов хозяина [4]. МГЭ являются специфическими структурно-функциональными участками генома, которые способны перемещаться в новый локус путем «вырезания и вставки» (ДНК-транспозоны) или «копирования и вставки» (ретроэлементы (РЭ)). Последние наиболее распространены у млекопитающих и используют промежуточную мРНК для обратной транскрипции и встраивания кДНК в геном хозяина [5].
МГЭ являются неотъемлемой частью ДНК практически всех эукариот и составляют более 40% генома человека [6]. Сохранение такого количества МГЭ в ходе эволюции связано с их использованием для контроля экспрессии (используются в качестве сайтов связывания с транскрипционными факторами [7, 8]) и эпигенетической регуляции различных генов с помощью процессируемых из их транскриптов некодирующих РНК (нкРНК): микроРНК [9] и длинных нкРНК [10]. Одомашнивание МГЭ в эволюции привело к образованию из них альтернативных экзонов [11] белок-кодирующих генов (БГК) и, соответственно, возникновения новых функциональных доменов белков. Кроме того, гены крупных МГЭ в эволюции оказались источниками большого количества эволюционно молодых белок-кодирующих генов (БКГ) [7, 12]. Нужно отметить также способность нкРНК, образуемых из МГЭ, помимо собственной регуляторной функции, связываться с рибосомами и формировать пептиды, участвующие в тех же биологических процессах, что и их нкРНК-предшественники (Рис. 1). Так, при-микроРНК транслируются с образованием miPEP (microRNA-encoded peptides), которые способны регулировать не только определенные биологические реакции, но также транскрипцию генов микроРНК, источников собственных при-микроРНК [13].

Цель исследования. Определить наиболее значимые эпигенетические звенья патогенеза COVID-19, воздействие на которые перспективно для разработки таргетной терапии. Поскольку РЭ являются важными источниками микроРНК и длинных нкРНК, сделан акцент на поиск взаимосвязи РЭ с данными молекулами и с вирусом SARS-CoV-2.
Материалы и методы исследования. Использованы базы данных Scopus, WoS, PubMed для анализа роли микроРНК, длинных некодирующих РНК, ретроэлементов в развитии COVID-19. Для нахождения необходимой информации в поисковике были введены сочетания терминов «SARS-CoV-2 retroelements», «SARS-CoV-2 transposons», «SARS-CoV-2 transposable elements», «SARS-CoV-2 HERV», «SARS-CoV-2 LINE-1», «SARS-CoV-2 Alu», «COVID-19 miRNA», «COVID-19 lncRNA», «SARS-CoV-2 miRNA», «SARS-CoV-2 lncRNA», «retroelements miRNA», «retroelements lncRNA», «transposable elements miRNA», «transposable elements lncRNA». Проведен анализ 987 источников литературы, из которых для написания данной статьи были использованы 97 источников.
Результаты и их обсуждение
Роль мобильных генетических элементов в развитии COVID-19
Воздействие МГЭ на течение COVID-19 отмечено на всех этапах болезни, начиная с проникновения вируса в клетки. Ангиотензин-превращающий фермент 2 (АСЕ2 – angiotensin-converting enzyme 2) является рецептором для прохождения SARS-CoV-2 в эндотелиоциты [14]. В норме АСЕ2 необходим для деградации аниготензина-II. Поэтому дефицит АСЕ2 (истощение вследствие связывания с вирусом) ведет к избыточной стимуляции рецепторов ангиотензина 2 (AT1R) и последующим повреждениям эндотелиальных клеток с васкулопатией, а также тромбозам с коагулопатией. Это, в свою очередь, приводит к системному воспалению [15]. В интронах гена АСЕ2 располагаются Alu-элементы (неавтономные РЭ) [14], а также РЭ MIRb, служащий промотором для образования альтернативной нестабильной изоформы белка MIRb-ACE2, выработка которого индуцируется интерфероном (IFN). В то же время, основная изоформа ACE2 нечувствительна к IFN [16], хотя продукты экспрессии открытых рамок считывания ORF3b, ORF6, ORF7, ORF8 вируса SARS-CoV-2 ингибируют синтез IFNI и IFNII, что является основанием для применения IFN в лечении COVID-19 [17].
Необходимо отметить, что тяжелые формы COVID-19 и цитокиновый шторм чаще встречаются у людей пожилого и старческого возраста [18] (что отражается на смертности от 0,01% в 25 лет до 15% в 85 лет [19]), для которых характерно развитие асептического воспаления вследствие повышенной выработкой IFNI. Стимулом для экспрессии IFNI служат активирующиеся при старении HERV [20] – их белковые продукты распознаются Толл-подобными рецепторами (TLR) в качестве патоген-ассоциированного молекулярного паттерна [21]. С этих позиций с возрастом должна снижаться восприимчивость к инфицированию SARS-CoV-2, который чувствителен к противовирусному воздействию IFNI [17]. Однако клинические исследования показывают более частое развитие COVID-19 у пожилых [22]. Кроме того, при старении животных [23] и человека [24, 25] снижаются функции иммунитета, что также не согласуется с большей распространенностью у пожилых пациентов цитокинового шторма [26], проявляющегося повышенными уровнями провоспалительных цитокинов со снижением количества Т-лимфоцитов [27]. Перечисленные, казалось бы, противоречия, в действительности отражают сложные пути функционирования МГЭ в регуляции экспрессии генов в онтогенезе. До начала старения активация МГЭ строго запрограммирована, и вирусные инфекции в норме способствуют эффективному иммунному ответу. У людей пожилого и старческого возраста происходит патологическая активация МГЭ, которая ведет к дисбалансу во всех органах и системах, в том числе эндокринной [28] и иммунной, что, несмотря на гиперпродукцию IFN и физиологический возрастной иммунодефицит, способствует патологическому иммунному ответу. Это связано с ролью МГЭ в функционировании иммунной системы. Например, RAG1 и RAG2 V(D)J рекомбинации произошли от ДНК-транспозонов [29].
Эндогенные ретровирусы (ERV), которые относятся к LTR (long terminal repeats) содержащим РЭ (LTR-РЭ) [5], занимая 8% генома человека [3], сформировали в эволюции транскрипционные сети, лежащие в основе интерферонового ответа. В различных филогенетических ветвях млекопитающих, независимо друг от друга, ERV образовывали многочисленные IFN-индуцибельные энхансеры [30]. ERV участвуют также в регуляции иммунной системы человека, так как являются энхансерами для гена HLA-G [31]. HERV-K102 экспрессируются активированными моноцитами и выходят в вакуоли, связанными с их поверхностями, превращая клетки в «пенистые». Высвобождение HERV-K102 происходит только при лизисе макрофагов. При этом HERV-K102 защищают клетки человека от вирусных инфекций и злокачественных новообразований [24]. Патологическая экспрессия HERV-W моноцитами и лимфоцитами наблюдается при рассеянном склерозе [32], в этиопатогенезе которого предполагается роль коронавирусов [33], в том числе SARS-CoV-2 [34].
Влияние инфекции SARS-CoV-2 на ретроэлементы
HERV являются останками древних экзогенных ретровирусов, внедрившихся в геном животных в ходе эволюции. При этом некоторые гены HERV были одомашнены клетками хозяев для выполнения важнейших функций, таких как образование плаценты. К ним относится произошедший от ENV (кодирует оболочку ретровируса) ген Syncytin, который оказался вовлечен в патогенез психических симптомов COVID-19 [35]. Было проведено исследование влияния коронавирусных инфекций на МГЭ в первичных образцах пациентов и клеточных линиях с помощью секвенирования РНК. В результате выявлено, что в зависимости от типа инфицированных клеток и инфекционного агента (SARS, MERS, RSV, HPIV3 или IAV) усиливается или ослабляется транскрипция специфических РЭ. При этом дифференциально экспрессируемые МГЭ при инфекции SARS-CoV-2 были обогащены сайтами связывания с транскрипционными факторами, которые участвуют в иммунном ответе. У больных COVID-19 выявлено снижение уровней не только HERV, но и L1 в периферических моноцитах и значительное усиление экспрессии этих РЭ в жидкости бронхоальвеолярного лаважа [4]. Более того, было показано усиление экспрессии HERV клетками бронхиального эпителия с индуцированным в них старением, что свидетельствовало о вероятной роли патологической активации РЭ как фактора более тяжелого течения COVID-19 [36]. Анализ транскриптома клеток, полученных из тканей легкого людей, инфицированных MERS-CoV, SARS-CoV и SARS-CoV-2 показал усиленную экспрессию РЭ с активацией генов ТЕТ (ten-eleven translocation). Белковые продукты TET катализируют деметилирование ДНК – превращение 5-метилцитозина в 5-гидроксиметилцитозин. В клетках кишечника пораженных SARS-CoV-2 людей также выявлена активация РЭ. Этим можно объяснить развитие более тяжелых форм инфекции у пациентов с изначально повышенным уровнем экспрессии РЭ (например, онкологических больных или пожилых людей) [6].
Активация РЭ под влиянием SARS-CoV-2, наиболее вероятно, первоначально является функцией, направленной на защиту от вирусной инфекции. Соответственно, истощение РЭ у пациентов с нормальной их функцией (растущие организмы) в ходе инфекции должно коррелировать с худшим прогнозом COVID-19. Действительно, при исследовании детей, инфицированных SARS-CoV-2, выявлено повышение экспрессии HERV наряду с IFNI, IFNII, TRIM28, SETDB1 при легком течении, и их снижение при тяжелых формах COVID-19 [37]. Важно отметить, что ERV выполняют защиту хозяев от вирусных инфекций, вызванных эволюционно наиболее родственными HERV экзогенными ретровирусами. Продукты генов env используются в качестве факторов рестрикции против экзогенных ретровирусов у кур, овец, мышей и кошек. Предполагается наличие подобных механизмов и в геномах других организмов, в том числе человека [38]. В экспериментах на мышах с нокдауном генов рецепторов TLR определена также роль ERV в защите от вируса простого герпеса HSV-2 [39]. Противовирусная эффективность РЭ связана также с эффектом нкРНК, образующихся при процессинге их транскриптов. Так, у мышей ERV являются источниками длинной нкРНК lnc-EPAV, которая повышает экспрессию генов противовирусного ответа путем стимулирования NF-κB [40]. Происходящий от гена gag эндогенных ретровирусов рестрикционный ген Fv1 активно ингибирует вирус лейкоза мышей MLV, а также вирус инфекционной анемии лошадей EIAV, синцитиальный вирус кошек FFV, лентивирусы и спумавирусы [41].
HERV активируются в ответ на инфекционные агенты, способствуя не только защите от вирусов, но и приводя к различным иммунопатологическим эффектам. Была определена повышенная экспрессия гена env HERV-W в лейкоцитах крови больных COVID-19 по сравнению со здоровым контролем. При этом уровень экспрессии коррелировал с концентрациями цитокинов в крови, дифференцировкой и истощением Т-лимфоцитов. Более тяжелое течение пневмонии и выработка маркеров воспаления при COVID-19 развивались у пациентов с высокой долей HERV-W env-позитивных лимфоцитов. Та же закономерность выявлена в отношении респираторных осложнений у госпитализированных больных. В связи с иммуно- и нейропатогенностью белка HERV-W ENV, предполагается его использование в качестве биомаркера тяжести течения COVID-19 [3, 32]. Патологическая активация РЭ, приводящая к цитокиновому шторму и другим осложнениям под влиянием SARS-CoV-2, наиболее вероятна для людей пожилого и старческого возраста, поскольку при старении происходит дерепрессия HERV [20], а их продукты способствуют асептическому воспалению в тканях [21].
Помимо непосредственного влияния SARS-CoV-2 на РЭ, вирус может изменять их экспрессию за счет воздействия на нкРНК, мишенями многих из которых являются транскрипты РЭ. Это связано с эволюционным происхождением генов длинных нкРНК [10, 42] и микроРНК [43] от МГЭ. Исследование данных механизмов наиболее перспективно в связи с возможностью модулирования течения COVID-19 путем таргетного воздействия с помощью нкРНК. Значительным потенциалом в этом отношении обладает miR-200c, которая необходима для проникновения вируса в клетки. Данная микроРНК подавляет экспрессию гена ACE2 за счет присоединения к 3’-нетранслируемой области его мРНК [44]. Не менее важна miR-98-5p, мишенью которой является мРНК гена TMPRSS2, экспрессируемого эндотелиальными клетками и необходимого для слияния вирусной и клеточной мембран [45]. В 2020 году в сыворотке крови больных COVID-19 (в сравнении со здоровым контролем) было выявлено повышение уровней 35 и снижение – 38 различных микроРНК по сравнению со здоровым контролем. Мишенями данных молекул являются транскрипты генов пептидаз, протеинкиназ и убиквитиновой системы [46].
Экспрессия специфических микроРНК различается у пациентов с разной тяжестью COVID-19, что говорит об их влиянии на течение болезни. Были идентифицированы более высокие уровни miR-15b-5p, miR-486-3p, miR-486-5p и более низкие – miR-181a-2-3p, miR-31-5p, miR-99a-5p только при тяжелом течении COVID-19 (без их изменений при легком и средней тяжести) по сравнению с контролем [47]. В 2022 году опубликованы результаты исследования микроРНК в плазме крови 96 больных COVID-19, для которых была характерна выраженная дифференциальная экспрессия 200 различных микроРНК, 75 из которых оказались специфичными для легкого и бессимптомного течения инфекции. Для пациентов с тяжелой формой COVID-19 определен высокий уровень экспрессии 137 микроРНК по сравнению с пациентами со средней тяжестью болезни [48]. Кроме того, идентифицированы высокоспецифичные для COVID-19 микроРНК, которые могут быть использованы в качестве биомаркеров данной инфекции. К ним относится miR-155 (90% чувствительности и 100% специфичности), уровень экспрессии которой прямо коррелирует со степенью тяжести и смертностью при COVID-19 [49]. Сходными свойствами обладают miR-320b и miR-483-5p [50]. Перспективно исследование специфических микроРНК для разработки таргетной терапии COVID-19. Предполагается использовать miR-1307-3p, miR-3613-5p, которые подавляют размножение SARS-CoV-2 за счет взаимодействия с 3’-нетранслируемыми областями его генов [51].
Перспективы исследования влияния ретроэлементов на COVID-19
Несмотря на защитный механизм активации РЭ в ответ на коронавирусную инфекцию, ферменты РЭ могут быть использованы для обратной транскрипции (ревертаза) и инсерции (эндонуклеаза) SARS-CoV-2 в ДНК хозяина. Этим можно объяснить повторные позитивные тесты ПЦР на SARS-CoV-2 у больных после перенесенной COVID-19. В эксперименте на культуре клеток человека было показано, что ДНК-копии вируса SARS-CoV-2 могут интегрировать в геномы инфицированных клеток. В результате наблюдается дупликация целевых сайтов (фланкирующих данные копии), консенсусные нуклеотидным последовательностям узнавания эндонуклеазы L1 в области инсерции, что согласуется с механизмами, при которых используются обратная транскриптаза и эндонуклеаза L1 элементов. Кроме того, в образцах тканей, взятых у отдельных больных COVID-19, были выявлены значительные фракции вирусных последовательностей, транскрибированных из интегрированных ДНК-копий, образующих химерные транскрипты вируса и хозяина [52], которые могут быть образованы и другими путями. Описана возможность образования химерных молекул между SARS-CoV-2 и молекулами РНК – транскриптами ядерного и митохондриального генома человека [53].
Нужно отметить, что РЭ эффективно взаимодействуют не только с экзогенными вирусами, но и с эволюционно неродственными РЭ, о чем говорят данные филогенетических исследований. Так, 135 из 213 членов семейства HERV-W характеризуются не прямыми ретровирусными интеграциями, а образованием процессированных псевдогенов с использованием ферментов L1 элементов [54]. Это свидетельствует об отсутствии выраженной селективности ферментов L1 при формировании молекул кДНК и потенциальном использовании их экзогенными РНК-вирусами для обратной транскрипции и интеграции. Помимо ретровирусов, для которых встраивание в геном хозяина является необходимым этапом жизненного цикла, способность к инсерциями с помощью ферментов РЭ выявлена и у ряда других РНК-содержащих вирусов: лимфоцитарного хориоменингита LCMV [55], везикулярного стоматита VSV [56], плюс-нитевого РНК-вируса диареи крупного рогатого скота BVDV (с рекомбинацией с РНК хозяев) [57], арбовирусов у комаров [58]. Более того, были идентифицированы эндогенные вирусные элементы, возникшие в результате интеграций обратнотранскрибированных кДНК копий РНК-вирусов семейств Filoviridae, Rhabdoviridae, Reoviridae и Flaviviridae (жизненный цикл которых происходит в цитоплазме, подобно SARS-CoV-2) в геномы половых клеток животных, и сохраняющиеся в эволюции в ряде поколений [59]. Даже у человека и других млекопитающих обнаружены эндогенные вирусные элементы, гомологичные вирусам семейства Filoviridae [60] и гену нуклеопротеина вируса из семейства Bornaviridae, передающиеся вертикально [61]. При сравнительном исследовании одноцепочечных РНК-вирусов с геномами позвоночных, у 19 видов были определены эндогенные вирусные элементы, произошедшие в эволюции от 4 известных семейств вирусов около 40 млн лет назад. Средин них плюс-нитевые РНК-вирусы семейства Flaviviridae [62].
Помимо участия в возможной интеграции вируса в геном человека, активированные под влиянием коронавирусов L1-элементы могут служить индукторами для выработки аутоантител против ткани легкого. В частности, при исследовании больных SARS, у 40,9% из них были выявлены антитела к эндонуклеазе L1, которые экспрессировались в ткани легкого [63]. Поскольку у больных COVID-19 также были определены повышенные уровни L1 (активированные под влиянием вируса SARS-CoV-2) в ткани легкого, можно предположить сходный механизм их влияния на развитие аутоиммунно-воспалительных процессов [4, 6, 36]. Было показано, что не только экзогенные вирусы, но и взвешенные в воздухе твердые частицы способны вызывать в эпителии бронхов гипометилирование и активацию L1, а также Alu-элементов [64]. Структурные особенности транскриптов Alu, в свою очередь, запускают врожденные иммунные ответы с патологическими реакциями. В норме двуцепочечные РНК Alu-элементов подвергаются дезаминированию аденозина в инозин (A-to-I редактирование), воздействию эндорибонуклеаз и секвестрации РНК-связывающими белками. У больных COVID-19 (а также при гриппе и рассеянном склерозе) происходит потеря A-to-I редактирования, что инициирует воспалительные процессы [65] и более тяжелое течение инфекции. В результате неизмененные транскрипты Alu образуют двуцепочечные молекулы, индуцирующие транскрипционный ответ регуляторного фактора интерферона и NF-κB со стимуляцией генов IFN, IL6 и IL8. Предполагается использовать коррекцию данных изменений для предотвращения цитокинового шторма у больных COVID-19 [66].
Расположение Alu в области интрона гена ACE2 c участием в регуляции его активности предполагает роль Alu в патогенезе COVID-19. В частности, полиморфные варианты Alu в гене ACE2 могут влиять на индивидуальные особенности ответа на SARS-CoV-2 [14]. Учитывая глобальное распространение Alu в геноме человека, наиболее вероятно воздействие данных РЭ, расположенных и в других генах, в том числе иммунного ответа. Например, при сравнении распределения инсерций Alu в области гена HLA-DRB1 выявлены значительные отличия полиморфных аллелей в 12 минорных этнических популяциях Китая [67].
Регуляторная роль МГЭ отражается на индивидуальных особенностях противовирусного ответа в связи со специфическим распределением МГЭ в геноме, что может отражаться на различных показателях смертности от COVID-19, характере течения болезни, заболеваемости и восприимчивости. Действительно, даже полиморфизм распределения Alu в гене ACE1, который не служит рецептором для SARS-CoV-2, но является аналогом ACE2, влияет на смертность от COVID-19 [68]. Поскольку на течение вирусной инфекции влияют различные гены, участвующие в управлении онтогенезом, в регуляции которых вовлечены множество МГЭ [69], их специфические инсерции вероятно могут отражаться на популяционных особенностях течения COVID-19. Еще в 2013 году было проведено исследование распределения МГЭ в геномах разных популяций людей и определено 12 специфических инсерций HERV-K [70]. При изучении полиморфных инсерций МГЭ по 16192 локусам у 2504 человек из 26 популяций были показаны специфические различия по инсерциям в зависимости от мест проживания популяций [71]. Характерные для разных популяций распределения МГЭ в геномах были выявлены также при исследовании 14384 инсерций у 1511 человек из 15 популяций [72]. Подобные работы были бы перспективны для выявления специфических РЭ, наиболее достоверно вовлеченных в развитие тяжелых форм COVID-19, поскольку на экспрессию РЭ можно регуляторно воздействовать таргетной терапией с помощью микроРНК.
Таким образом, РЭ могут влиять на развитие COVID-19. Роль РЭ в развитии COVID-19 может быть опосредована экспрессией происходящих от них микроРНК. Нами проведен анализ базы данных MDTE DB о возникших от РЭ микроРНК [43], экспрессия которых специфически изменятся при COVID-19. Было выявлено, что семейство miR-31 (низкий уровень у больных COVID-19) [47] произошло от LINE-2a [43], miR-320b (повышенный уровень при COVID-19) [48, 50] – от LINE-2 [43], miR-5695 (повышен уровень при COVID-19) [46] – от LTR/ERV1 [43], miR-340 (снижается уровень при COVID-19) [46] – от ДНК-транспозона TcMar-Mariner [43], miR-4525 (значительно ассоциирован повышенный уровень с COVID-19) [48] – от LTR/ERV1 [43], miR-4661 (значительно ассоциирован повышенный уровень с COVID-19) [48] – от LTR/Gypsy [43], miR-548a-3 [48] – от LTR/ERVL-MaLR [43].
Потенциал исследования взаимосвязи микроРНК и COVID-19
Было показано, что из генома SARS-CoV-2 образуются короткие РНК длиной 20 нуклеотидов, которые ингибируют трансляцию белков человека, вовлеченных в метаболизм кислорода, функционирование иммунной системы и обоняние. Одним из механизмов этого эффекта оказалась гибридизация последовательности РНК белка S SARS-CoV-2 с молекулами мРНК бета-глобина и интерферонов I типа [73]. С помощью программы VMiR Analyzer в геноме SARS-CoV-2 было выявлено 898 потенциальных пре-микроРНК, при отборе которых системой HuntMi более точно определено 45 кандидатных вирусных пре-микроРНК (средняя длина 78 нуклеотидов), из которых 30 – в прямой ориентации, 15 – в обратной. Дальнейший анализ с использованием программы MatureBayes позволил выявить 90 предполагаемых зрелых микроРНК. Количественная ПЦР в клетках Vero E6, инфицированных SARS-CoV-2, показала высокие уровни MR147-3p, MR369-3p, MR66-3p и MR359-5p, которые не экспрессировались в неинфицированных клетках (контроль). При вирусной инфекции SARS-CoV-2 синтезирует на высоком уровне miR-147-3p, которая значительно снижает экспрессию в клетках человека генов (способствуя аномальной активации иммунной системы), таких как EXOC7 (Exocyst Complex Component 7), TFE3 (Transcription factor E3), RAD9A (RAD9 Checkpoint Clamp Component A). Последний кодирует белок контрольной точки клеточного цикла и регулирует гибель клеток, способствуя апоптозу [74]. Специфические микроРНК человека взаимодействуют с молекулами вируса SARS-CoV-2, опосредуя определенные патологические эффекты. Так, S-белок SARS-CoV-2 способен модифицировать в клетках человека экзосомный транспорт в отдаленные неинфицированные ткани и органы, инициируя катастрофический иммунный каскад в ЦНС. При этом клетки с трансфекцией SARS-CoV-2 высвобождают значительное количество экзосом, нагруженных miR-148a и miR-590, которые усваиваются микроглией человека и подавляют экспрессию гена-мишени USP33 (кодирует убиквитин-специфическую пептидазу 33) с нижележащими уровнями IRF9 (кодирует регуляторный фактор интерферона 9). Поглощение экзосом регулирует также экспрессию генов, кодирующих TNFα, NF-κB, IFN-β, что ведет к повреждениям ЦНС через гиперактивацию микроглии человека [75].
Найдены микроРНК человека, которые связываются с комплементарными последовательностями вирусных РНК SARS-CoV-2 и разрушают вирусную РНК, ингибируя тем самым экспрессию вирусного белка. К ним относятся miR-148a, miR-17, miR-214, miR-223, miR-574-5p, miR98 [76], miR-15a-5p, miR-15b-5p, miR-30b-5p, miR-409-3p, miR-505-3p, miR-548d-3p [77]. В РНК-геноме SARS-CoV-2 в 5’- и 3’-нетранслируемых областях определены различные мишени для микроРНК человека. При этом мутации вирусного генома могут вызывать создание или потерю сайтов связывания с микроРНК, что играет решающую роль в патогенности SARS-CoV-2. Например, область NSP3 генома SARS-CoV-2 является мишенью для miR-197-5p. При мутации в данной области miR-197-5p неспособна связываться с вирусом и вызывать деградацию его транскрипта [76]. Поэтому необходимо секвенировние генома SARS-CoV-2 для более эффективного применения таргетной терапии с помощью нкРНК. В 2020 году были предложены miR-512-3p, miR-516b-5p, miR-517-3p, ингибирующие вирусы, для создания вакцины против SARS-CoV-2. Данные микроРНК способствуют аутофагии инфицированных клеток [78].
МикроРНК, способствующие развитию COVID-19 могут быть использованы в качестве мишеней для использования анти-микроРНК в лечении болезни. Так, в крови и моче больных COVID-19 циркулирует miR-2392 (не определяется у здоровых лиц), которая может служить диагностическим маркером болезни и как объект для терапевтического воздействия. В эксперименте на хомяках было разработано воздействие на miR-2392, ингибирующее тяжелое течение вирусной инфекции, что потенциально может быть использовано для лечения COVID-19 у человека. MiR-2392, экспрессия которой специфически повышается при COVID-19, способствует прогрессированию болезни за счет подавления экспрессии митохондриальных генов, усиления гипоксии, гликолиза и воспаления [79]. Кроме того, микроРНК человека влияют на восприимчивость к COVID-19, поскольку микроРНК необходимы для регуляции клеточных рецепторов для вирусной инвазии. Например, miR-98-5p и let-7a-g/I специфически подавляют экспрессию TMPRSS2. При этом синтез let-7a-g/I стимулируется эстрогенами, поскольку ген let-7a-g/l расположен внутри гена, регулируемого эстрадиолом [80]. Под влиянием данного гормона находится и miR-98-5p, которая подавляет экспрессию не только TMPRSS2, но и IL6 [81]. Соответственно, эти микроРНК могут быть потенциальными мишенями для профилактики и лечения COVID-19.
МикроРНК являются нестабильными молекулами, поэтому проблемой их применения является возможность доставки в клетки и сохранение биологического эффекта. Кроме того, вероятность комплементарного связывания не только с вирусными нуклеотидными последовательностями, но и с мРНК клетки хозяина может стать причиной побочных эффектов. В связи с этим перспективно использование более стабильных молекул, обладающих высокой специфичностью воздействия исключительно на вирус SARS-CoV-2. Данными свойствами обладают пептиды, транслируемые из при-микроРНК, зрелые молекулы микроРНК которых оказывают влияние на вирус. Разработка подобных молекул имеет высокий потенциал применения, поскольку пептиды широко используются в современной медицине. Описана возможность пространственного взаимодействия пептидов с молекулами нуклеотидов генома [82]. Поскольку последовательность РНК вируса SARS-CoV-2 обладает специфическими особенностями, перспективно изучение связывания с геномом вируса определенных пептидов, которые обладали бы наибольшей специфичностью в отношении противовирусной терапии.
Потенциал использование пептидов в терапии COVID-19
Поскольку на вирусную инфекцию могут воздействовать микроРНК, а их продукты трансляции (пептиды miPEP) способны индуцировать те же биологические пути, перспективна разработка таких пептидов для лечения COVID-19 (Рис. 2).
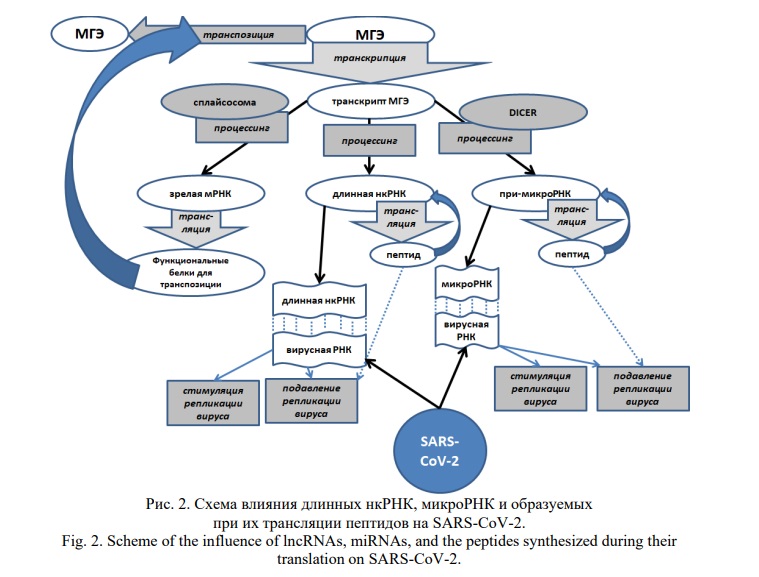
Для этого необходимо сравнительное исследование эффективности miPEP у пожилых и молодых пациентов и определение их возможной геропротекторной активности. Наиболее изучены miPEP, влияющие на развитие неоплазм в связи с их перспективностью в практическом применении в онкологии. Так, пептид, транслируемый из длинной нкРНК HOXB-AS3, ингибирует рак ободочной кишки путем воздействия на альтернативный сплайсинг пируваткиназы-М [83]. Из при-микроРНК miR-200a и miR-200b транслируются пептиды miPEP-200a и miPEP-200b соответственно. Они подавляют экспрессию бета-катенина, Е-кадгерина и виментина, ингибируя миграцию клеток рака простаты за счет подавления процесса эпителиально-мезенхимального перехода [84]. Нужно отметить, что miR-200a и miR-200b вовлечены в те же пути канцерогенеза [85, 86]. MiPEP-133 транслируемый из pri-miRNA-34a, усиливает экспрессию онкосупрессорного белка р53, который регулирует транскрипцию pri-miR-34a, что свидетельствует также о взаиморегуляции пептидов и различных белков [87]. Нахождение подобных связей для специфических пептидов, образуемых при трансляции длинных нкРНК и при-микроРНК перспективно в отношении COVID-19 для разработки новых эффективных способов лечения болезни. Поскольку в патогенезе COVID-19 играют роль иммунные нарушения, важно нахождение miPEP, способных регулировать данные процессы. Так, выявлено, что miPEP-155 ингибирует аутоиммунное воспаление путем подавления презентации антигена клетками [88]. При этом miR-155, из при-микроРНК которой транслируется miPEP-155, вовлечена в регуляцию врожденного и приобретенного иммунитета [89]. Помимо miPEP огромным терапевтическим потенциалом обладают пептиды, транслируемые из длинных нкРНК и кольцевых РНК. Например, кодируемые кольцевыми РНК пептиды FBXW7-185aa, PINT-87aa, SHPRH-146aa используются для подавления роста глиомы [13].
Нужно отметить уникальную способность некоторых коротких пептидов в составе белков оказывать регуляторное воздействие на микроРНК. Например, богатые GW (дипептид глицина и триптофана) белки напрямую взаимодействуют с AGO. Последние, в свою очередь, служат гидами для микроРНК в отношении их целевых мРНК. При этом содержащие GW белки координируют данные процессы, обеспечивая эффективный сайленсинг генов. В эксперименте было обнаружено, что короткий пептид GW также содержит домен взаимодействия с AGO и может быть использован для изоляции эндогенных белковых комплексов AGO. Внутри клетки такие короткие пептиды конкурируют с содержащими GW эндогенными белками за связывание с AGO и могут быть использованы для ингибирования микроРНК [90]. Можно предположить, что одним из механизмов регуляторного воздействия пептидов на кодирующие их гены нкРНК является не только прямое их взаимодействие с последовательностями ДНК [82], но также специфическое связывание с собственными микроРНК с образованием функциональных РНП, которые принимают активное участие в тех же биологических реакциях. Кроме того, данный комплекс РНП может играть роль в транскрипционной регуляции собственных и других генов. В литературе пока не описано таких взаимодействий, происходящих в естественных условиях в клетках. Однако экспериментально синтезированы подобные комплексные молекулы, которые оказались весьма эффективными. Еще в 2013 году были опубликованы результаты использования пептидов-переносчиков, проникающих через клетки для доставки в них микроРНК. Так, пептид, названный низкомолекулярным протамином (LMWP), в комплексе с miR-29b был эффективно применен для трансфекции мезенхимальных стволовых клеток и стимулировал дифференцировку остеобластов [91].
В 2018 сообщалось об эффективной целенаправленной доставке в ткань опухоли и в клетки HeLa самособирающегося нанокомплекса, образованного миметиками микроРНК (онкосупрессорная miR-34a) с фунциональным пептидным конъюгатом (FA-R9-FPcas3). В результате индуцировался апоптоз клеток HeLa и подавлялся рост опухоли в эксперименте на живых мышах [92]. Подходящей системой доставки для микроРНК являются амфипатические пептиды N-TER, которые способствуют нековалентному комплексообразованию за счет электростатических взаимодействий между обоими компонентами. Кроме того, комплекс пептида N-TER с нуклеиновой кислотой характеризуется клеточной адгезией с поглощением через клеточные мембраны и внутриклеточным высвобождением микроРНК. На культуре клеток 3Т3-L1 был продемонстрирован антиадипогенный эффект комплекса пептида N-TER с miR-27a, который вызывал уменьшение образования липидных капель в зрелых адипоцитах [93]. В 2019 году был синтезирован нанокомплекс пептид/микроРНК (пептид TatBim и miR-34a), введение которого в клетки вызывало их апоптоз [94]. В 2021 году представлена эффективность пептида RP1R3V6 в качестве переносчика anti-microRNA-92 олигонуклеотида AMO92a в легочную ткань крыс с моделированным острым повреждением легких (поскольку miR-92 стимулирует данную патологию). При этом пептид оказывал дополнительное противовоспалительное действие за счет антагонизма с рецепторами конечных продуктов гликирования RAGE, подавления фактора некроза опухоли TNF-α в активированных липополисахаридами макрофагальных клетках [95].
Согласно данным NGS, более 10000 длинных нкРНК в геномах млекопитающих содержат короткую ORF (small ORF), которая связана с активной трансляцией. При помощи полногеномных высокопроизводительных методов были идентифицированы потенциальные микропептиды, закодированные в small ORF длинных нкРНК, участвующих в иммунном противовирусном ответе, выявлены десятки потенциальных кандидатов. Из них 4 пептида, экспрессируемые в ответ на вирусные инфекции, оказались наиболее консервативными и перспективными объектами для дальнейшего изучения: MMP24-AS1, ZFAS1, RP11-622K12.1, MIR22HG [96]. Была показана также способность вирусных кольцевых РНК транслироваться с образованием функциональных пептидов – данное свойство перспективно исследовать у SARS-CoV-2 для возможного таргетного терапевтического воздействия. Так, при инфекции двуцепочечными РНК-содержащими реовирусами выявлена кольцевая вирусная РНК vcircRNA_000048, которая транслируется в состоящий из 21 аминокислоты пептид, ослабляющий репликацию вируса [97]. Поскольку образование таких молекул для самого вируса не выгодно, можно предположить, что в их синтезе участвуют защитные системы хозяина, использование которых перспективно для проектирования новых методов противовирусной терапии.
Заключение. В настоящее время имеются прямые и косвенные свидетельства влияния РЭ на патогенез COVID-19 (Рис. 3).
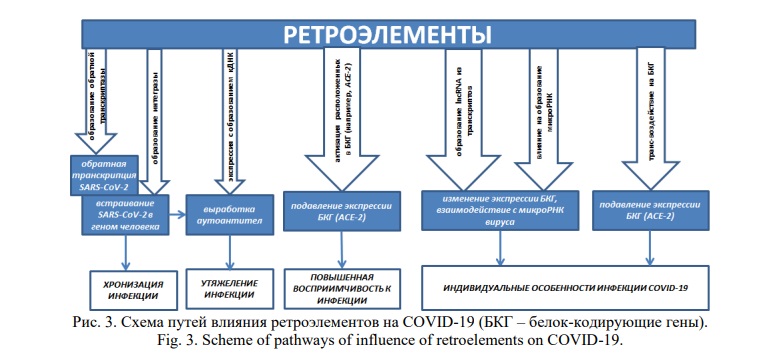
Получены доказательства того, что SARS-CoV-2 в эпителиальных клетках бронхов больных вызывает активацию РЭ, наиболее выраженную в состаренных клетках. Это согласуется с более тяжелым течением COVID-19 у пациентов пожилого возраста, поскольку при старении происходит дисрегуляция РЭ, которые индуцируют иммунную систему для развития асептического воспаления и гиперпродукции интерферона. То есть при первоначально имеющихся изменениях активности РЭ как при физиологическом старении, так и при сопутствующей патологии, при которой происходит дисрегуляция РЭ, SARS-CoV-2 усугубляют ее, а также влияют на другие РЭ в геноме. Поскольку РЭ играют важную роль в функционировании иммунной системы, их дисрегуляция коррелирует с вероятностью развития цитокинового шторма. Полученные данные свидетельствуют о перспективном исследовании роли РЭ в патогенезе COVID-19, поскольку изменения активации РЭ обратимы и могут быть модулированы воздействием микроРНК и длинных нкРНК, которые являются также перспективными прогностическими молекулами в диагностике COVID-19. Ключевыми источниками нкРНК служат МГЭ, которые также могут быть применены в качестве биомаркеров прогрессирования и тяжести болезни. Имеются свидетельства о роли РЭ в интеграции SARS-CoV-2 в геном человека, что согласуется с проанализированными литературными данными об интеграции других РНК-вирусов, в том числе плюс-нитевых, реплицирующихся в цитоплазме клеток. Возможной причиной активации РЭ под влиянием SARS-CoV-2 является защитная реакция РЭ от экзогенных вирусных инфекций, а также наличие между ними идентичных нуклеотидных последовательностей. Поэтому перспективен поиск специфических локусов в составе SARS-CoV-2, сходных с определенными РЭ в геноме человека. Это могло бы стать основой для проектирования направленных на данные локусы микроРНК и их miPEP в таргетной терапии COVID-19.
Информация о финансировании
Работа выполнена в рамках государственного задания Минобрнауки РФ (№АААА-А16-116020350032-1) при частичной поддержке мегагранта Правительства Республики Башкортостан и гранта Российского научного фонда (проект № 17-78-30028).





















Список литературы