Клинико-генетическая характеристика муковисцидоза в Республике Башкортостан
Aннотация
Актуальность: По оценкам Всемирной организации здравоохранения ежегодно в мире рождается 40-50 тысяч детей с муковисцидозом (МВ) – моногенным заболеванием с генетической гетерогенностью и клинической вариабельностью, обусловленными региональными и этническими различиями генофонда популяций. Мониторинг особенностей течения заболевания и молекулярного патогенеза у пациентов из различных регионов многонациональной России необходим для оптимизации алгоритмов медико-генетического консультирования и улучшения качества жизни пациентов. Цель исследования: Обобщение и систематизация результатов динамических клинических наблюдений, лабораторных и молекулярно-генетических исследований пациентов с муковисцидозом из Республики Башкортостан (РБ) для осуществления мониторинга эффективности работы с пациентами согласно реестру пациентов МВ Республики Башкортостан, совершенствования медико-генетической помощи отягощенным семьям. Материалы и методы: В группу исследования вошли больные муковисцидозом, члены их семей и пациенты из группы риска по муковисцидозу, проживающие в Республике Башкортостан – 400 человек. Применялись клинико-лабораторные, молекулярно-генетические и статистические методы исследования, биоинформатическая обработка результатов NGS секвенирования. Результаты: За период с 2019 г. по 2022 г. число пациентов в РБ возросло с 80 до 94 человек, частота заболевания составила 1,9 и 2,297 на 100 тыс. населения, соответственно. Диагноз подтвержден в ходе ДНК-диагностики 94 пациентам с муковисцидозом в Республике Башкортостан. Определены региональные особенности генетической архитектуры МВ, это 12 патогенных вариантов нуклеотидной последовательности в гене CFTR: Phe508del, E92K, CFTRdele2,3, 3849+10kbC>T, L138ins, G509D, 394delTT, N1303K, W1282X, Y84X, 2143delT, 1525-1G>A составляют 94,9%, частота комплексного аллеля – c.1399C>T (p.Leu467Phe, L467F) – 16,6 %. Пациентам назначена таргентная терапия. Заключение: Исследование позволило выявить региональные особенности клинико-генетических аспектов МВ для применения дифференциального и персонализированного подхода в оказании медицинской помощи и планировании мероприятий по улучшению качества жизни больных МВ в регионе.
Введение. Муковисцидоз (МВ), кистозный фиброз (Cystic fibrosis, OMIM 219700, МКБ-10 Е 84) – одно из самых частых по распространенности наследственное заболевание, встречается во всем мире, но существуют выраженные популяционные различия по его частоте: у азиатов она составляет 1 : 100 000–350 000, у европейцев - 1 : 2500–4500 [1, 2]. Заболевание обусловлено патогенными вариантами нуклеотидной последовательности в гене муковисцидозного трансмембранного регулятора проводимости (МВТР; Cystic Fibrosis Transmembrane conductance Regulator – CFTR), расположенном на 7 хромосоме (7q31.2), наследуется по аутосомно-рецессивному типу [3].
Установлено, что белок CFTR человека представляет собой многодоменный интегральный мембранный белок из 1480 остатков, который регулирует поток ионов хлора через клеточную мембрану. Он является членом надсемейства белков-транспортеров АТФ-связывающей кассеты (ABC) и состоит из двух трансмембранных доменов (MSD), двух нуклеотидсвязывающих доменов (NBD) и регуляторной области (R). Уникальный регуляторный домен (regulatorydomain, RD) контролирует активность канала. Трансмембранные сегменты соединены между собой четырьмя внутриклеточными петлями (intracellularloops (ICL)), расположенными на поверхности клетки, и шестью внеклеточными петлями (extracellularloops (ECL)), находящимися снаружи клетки, именно в апикальной мембране CFTR выполняет свою функцию [4]. К настоящему времени выявлено 7 классов мутаций, приводящих к дисфункции хлоридно-анионного канала. Мутации связаны с нарушением синтеза м-РНК для CFTR, формирования его вторичной и третичной структур и работы регуляторных доменов [5, 6]. Генетические варианты в гене CFTR запускают патологический процесс в организме больного муковисцидозом с развитием тяжелых жизнеугрожающих состояний.
В настоящее время в мире зарегистрированооколо 100 тыс. людей, страдающих МВ. Частота заболевания среди европеоидов составляет от 1 на 600 до 1 на 17000 новорожденных [7, 8]. В Российской Федерации и в Республике Башкортостан этот показатель составляет примерно 1 на 9000 новорожденных [9, 10]. Однако существует различия по распространенности МВ в разных регионах РФ, наибольшее количество больных в г. Москве – 447, наименьшее в Магаданской области – 1 человек [11].
Совершенствование методов ранней ДНК диагностики и использование эффективного таргентного лечения привело к увеличению продолжительности и улучшению качества жизни больных. Несмотря на впечатляющие успехи в диагностике и лечении МВ в РБ и РФ, необходим постоянный мониторинг динамики современных тенденций в медицинской науке для своевременного их внедрения в практическое здравоохранение.
Цель исследования. Обобщение и систематизация результатов динамических клинических наблюдений, лабораторных и молекулярно-генетических исследований пациентов с муковисцидозом из Республики Башкортостан (РБ) для осуществления мониторинга эффективности работы с пациентами согласно реестру пациентов МВ Республики Башкортостан, совершенствования медико-генетической помощи отягощенным семьям.
Материалы и методы исследования. Нами проведен проспективный анализ клинико-лабораторных параметров 400 пациентов, которые наблюдались с диагнозом муковисцидоз, пациентов из группы риска с неустановленным диагнозом муковисцидоз, также членов их семей. Диагноз муковисцидоз подтвержден на основании клинической картины, данных положительной потовой пробы и/или генетического исследования [6]. В 2022 г. на диспансерном наблюдении находились 94 пациента (n=94): 22 – взрослый, 72 – ребенка. Данные пациентов вошли в регистр МВ РБ, их параметры были проанализированы в ходе мониторинга с данными Национального регистра МВ РФ за 2020г. Формат параметров соответствовал Европейскому регистру больных МВ [12].
Оценка состояния здоровья пациентов проведена по следующим критериям: возраст установления диагноза, уровень хлоридов в поте при проведении потового теста, результаты микробиологических исследований, функция внешнего дыхания по данным спирометрии, наличие осложнений течения МВ.
Состояние и функцию легких определяли по показателю форсированной жизненной емкости легких (ФЖЕЛ) и объема форсированного выдоха за первую секунду (ОФВ1). Исследования проводили в соответствии с критериями ERS/ATS (American Thoracic Society и European Respiratory Society по спирометрии) в группе детей, способных сделать дыхательный маневр при проведении спирометрии. Микробиологические исследования флоры дыхательных путей проводились в центральных бактериологических лабораториях. Хронический высев диагностировали согласно рекомендациям [13, 14]. Потовые пробы проводились на приборе для сбора и анализа проводимости пота «Nanoduct» - классический метод индукции пота посредством ионофореза пилокарпина, который сопровождается анализом концентрации электролитов с помощью сенсора проводимости. Молекулярно-генетические исследования проведены у 400 пациентов, подтвержден диагноз муковисцидоз у 94 пациентов и выявлено 150 пациентов с гетерозиготным носительством патогенных вариантов в гене CFTR. Исследование проведено с использованием мультиплексной лигазно-зависимой амплификацией зондов (SALSA MLPA Probemix P091 CFTR, MRC Holland), таргетного секвенирования следующего поколения (NGS) гена CFTR (Набор ParseqLab, Россия) на платформе Illumina (MiSeq, США), с валидацией полученных результатов секвенированием по Сэнгеру.
Оценку функциональной значимости изменений нуклеотидной последовательности генов проводили, используя различные базы данных и предсказательные программы (SIFT, Polyphen2, MutPred, VarSome, EIGEN, FATHMM, PROVEAN, LRT и т.д.). Для анализа результатов NGS секвенирования использовалось программное обеспечение «VariFind». Объем проводимой терапии пациентам из РБ ценен согласно параметрам, предоставленным в Национальном регистре больных МВ РФ.
Статистическую обработку данных проводили с помощью пакета прикладных программ STAТISTICA (StatSoft). Для описания выборки использовались меры: критерий среднего арифметического (М), стандартное отклонение (SD), медиана (Ме) применялась для результатов, не имеющих нормального распределения. Уровень значимости считался статистически значимыми при p < 0,05.
Соблюдение прав пациентов и правил биоэтики: исследование одобрено на Ученом совете Федерального государственного бюджетного образовательного учреждения высшего образования «Башкирский государственный медицинский университет». Все пациенты и здоровые доноры подписали информированное добровольное согласие на участие в исследовании в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта».
Результаты и их обсуждение. В Республике Башкортостан к 2022 г. состоит на учете с МВ 94 человека. При оценке демографических особенностей МВ в РБ отмечается рост заболеваемости МВ, это связано с доступностью диагностических мероприятий, в том числе применением ДНК диагностики. За период с 2019 г. по 2022 г. количество пациентов в РБ увеличилось с 80 до 94 человек, частота заболевания составила 1,9 и 2,297 на 100 тыс. населения, соответственно (Табл. 1). У 6 пациентов выявлено заболевание в результате неонатального скрининга, 250 пациентам проведено дообследование, подтверждающая ДНК диагностика, в результате 8 пациентам установлены мутации в гене CFTR (ранее наблюдались с неподтвержденным диагнозом). Одному пациенту, который наблюдался с диагнозом муковисцидоз, после обследования (определение хлоридов в поте, ДНК-диагностики, в том числе у членов семьи пробанда), определено гетерозиготное носительство патогенных вариантов в гене CFTR, таким образом диагноз снят. Выявлено 150 человек с гетерозиготным носительством патогенных вариантов в гене CFTR в отягощенных семьях.

При анализе клинических данных учитывается своевременность диагностики заболевания, как фактора, влияющего на продолжительность жизни пациентов (Табл. 2). Из таблицы 2 видно, что средний возраст пациентов в Республике Башкортостан в 2022 году составил 13,9±9,6 года, что сопоставимо с параметрами по РФ – 13,7±9,7 года. Доля пациентов в возрасте ≥ 18 лет по данным регистра по РФ (26,5%) в Республике Башкортостан (23,4%). Самому взрослому пациенту в РБ 42 года (самому старшему пациенту в РФ – 63,1 лет). Средний возраст постановки диагноза в РБ и РФ – 3,3±4,1 и 3,6±6,1 года, соответственно. В РБ в 2022 г. среди пациентов преобладают пациенты женского пола 57,4%, тогда как в РФ в целом преобладают мужчины 52,0%.
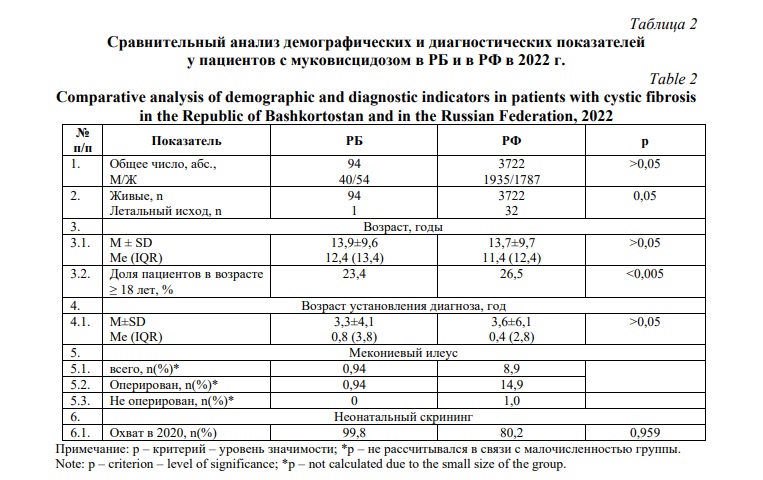
Для оценки тяжести течения заболевания МВ в РБ проведен мониторинг данных инфекционного бронхолегочного воспаления у пациентов из РБ (Табл. 3). Определен микробиологический статус, который у пациентов из РБ соответствует общероссийскому, хотя частота встречаемости хронического инфицирования Pseudomonas aeruginosa выше и составила – 42,4%, в РФ этот показатель – 34.1%.

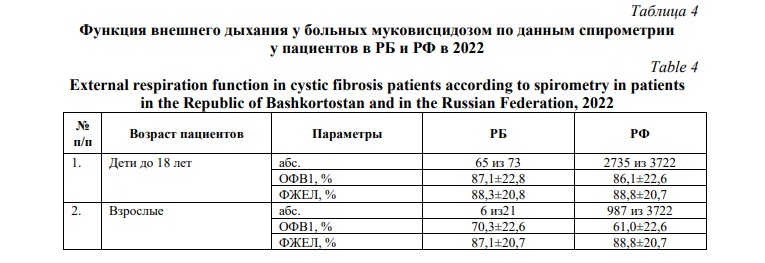
К одним из основных параметров состояния здоровья пациентов с МВ относится респираторная функция по данным спирометрии, в таблице 4 представлены средние показатели (М±SD) функции внешнего дыхания больных старше 5 лет в РБ и РФ. Самый высокий охват данным исследованием в РБ отмечается среди детей в возрасте с 6 до 18 лет. Средние показатели (М±SD) функции внешнего дыхания у пациентов сопоставимы с показателями по РФ, данное исследование должно быть доступно всем пациентам с муковисцидозом для контроля эффективности проводимой терапии.
При проведении неонатального скрининга (ранней диагностики) за период с 2006 г. по 2022 г. 48 (88,9%) больным диагностирован МВ, тогда, как всего за этот период диагноз муковисцидоз установлен 54 пациентам. Таким образом, неонатальный скрининг не позволяет выявить всех пациентов на раннем этапе диагностики, поэтому необходимо сохранение настороженности, так как возможна и поздняя манифестации заболевания. Охват неонатальным скринингом в РБ в 2020 г. составил 99,6%, в ходе которого диагноз муковисцидоз установлен: в 2019 г. – 2, 2020 г. – 2, 2021 г. – 1, 2022 г. – 1 пациенту.
Охват генетическим обследованием пациентов с МВ в РБ в 2019-2022 гг. составил 100%, что гораздо выше по сравнению с показателем охвата по РФ – 93% (Табл. 5).

Проведена оценка спектра и частоты мутаций в гене CFTR с использованием различных технологий в том числе и таргентного NGS секвенирования. Молекулярный дефект заболевания идентифицирован у 94,7% пациентов с муковисцидозом, выявлены 26 мутаций в гене CFTR. В результате проведенной ДНК диагностики диагностировали 36 генотипов у 89 пациентов, у 2 пациентов выявлена 1 мутация, у 3 - мутации не обнаружены, хотя имеются высокие показатели хлоридов в поте, пациенты находятся под динамическим клиническим наблюдением.
Чаще всего в РБ встречаются 5 мутаций (варианты нуклеотидной последовательности, варианты): Phe508del, E92K, CFTRdele2,3, 3849+10kbC>T, L138ins, которые в сумме дают 80,8% мутаций. 7 мутаций: G509D, 394delTT, N1303K, W1282X, Y84X, 2143delT, 1525-1G>A составляют – 14,1%. Остальные варианты гена CFTR не являются регион специфичными, хотя при наличии клинической картины у пациентов целесообразна ДНК-диагностика на муковисцидоз. Региональные особенности вариантов всегда учитываются при проведении ДНК-диагностики муковисцидоза в РБ с целью уменьшения сроков и расходов на диагностику заболевания, так как в ходе исследования нами выявлены существенные отличия частоты мутаций по сравнению с общими данными по РФ [15]. Необходимо стремиться к полному генетическому обследованию больных, включая полногеномное секвенирование, MLPA анализ, проведение теста кишечных потенциалов больным, у которых не выявлены патогенные варианты гена CFTR стандартными методами.
При сравнительном анализе частот вариантов гена CFTR у пациентов из РБ с выборкой из регистра РФ выявлены достоверные различия. В РФ в пятерку мажорных мутаций вошли: F508del, CFTRdele2,3, E92K, 1677delTA, 3849+10kbC->T. Вариант F508del- главная генетическая причина МВ в РФ и в РБ. Аллельная частота генетического варианта F508delв РБ и РФ – 43,9% и 52,61%, соответственно. Мутация L138ins в РФ составляет 1,53%, в РБ эта мутация встречается чаще – 5,6%, частота комплексного аллеля F508del/[L467F;F508del] – 16,7 % (в РФ частота – 6,0-8,0%). Это учитывается при проведении ДНК-диагностики муковисцидоза пациентам из РБ в регионе.
Проведено исследование аллельной частоты всех обнаруженных вариантов нуклеотидной последовательности гена CFTR и идентификация степени тяжести генотипа (для «тяжелого» присутствие мутации гена CFTR I–III класса, «мягкого» – 1 вариант гена CFTR IV–VII класса) [16, 17]. «Тяжелые» генотипы преобладают среди пациентов РБ во всех возрастных группах, однако их число снижается с возрастом, как в РФ.
Нами также проведена комплексная оценка проводимого лечения муковисцидоза в Республике Башкортостан (Табл. 6). В целом назначение антибиотикотерапии проводится в соответствии с чувствительностью выделенных микроорганизмов, с учетом ранее проводимого лечения, в том числе пациентам назначается курсовое применение ингаляционных антибиотиков, согласно национальному консенсусу по диагностике и лечению МВ [18, 19]. Применяется монотерапия азитромицином и комбинации аминогликозидов и цефалоспоринов III-IV поколения [20].
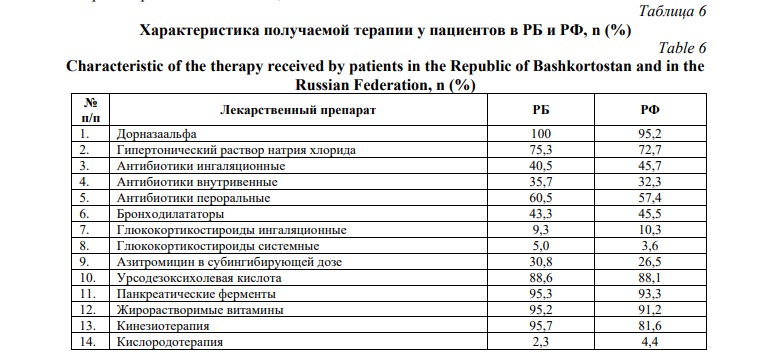
Терапия, включающая дорназу альфа, ферменты, кинезиотерапию, витамины, урсодезоксихолевую кислоту, проводилась всем пациентам в РБ, принципиальных различий между показателями между РФ и РБ не выявлено (Табл. 6). Назначение доз панкреатических ферментов осуществляется с учетом особенностей течения заболевания при «мягком» и «тяжелом» генотипе у пациентов с МВ, проведена коррекция терапии у пациентов с вариантом E92K. В РБ терапия пациентов с муковисцидозом проводится в соответствии с клиническими рекомендациями «Кистозный фиброз (муковисцидоз)» [20].
Согласно данным Фонда «Круг добра» в 2022 году РБ оказалась в лидерах по РФ по обеспеченности пациентов до 18-летнего возраста таргентной терапией, так как всем пациентам РБ проведено молекулярно-генетическое исследование, что является главным критерием назначения таргентной терапии. 44 ребенка получают современное эффективное лечение. В настоящее время в Республике Башкортостан начали получать таргентную терапию препаратом: МНН «Лумакафтор+ивакафтор» – 11 пациентов гомозигот по Phe508del. Таргентный препарат, незарегистрированный в РФ, предоставляемый Фондом «Круг добра» МНН «Элексакафтор+Тезакафтор+Ивакафтор/Ивакафтор» получают 33 ребенка.
Мы исследовали генотип F508del/[L467F;F508del], который приводит к устойчивости к таргентной терапии VX-809 лумакафтор и VX-770 ивакафтор [21, 22]. Таким образом, у 13 детей, обнаружены 2 пациента с комплексным аллелем. Всего в РБ 18 пациентов гомозиготных по F508del в гене CFTR, у троих больных выявлен генотип F508del/[L467F;F508del] – частота составила – 16,7 %.
По мере взросления у пациентов нарастает количество осложнений, что утяжеляет состояние здоровья больных, поэтому применение единых клинических рекомендацийпозволит сформировать раннюю тактику диагностики, терапии, мониторинга состояния здоровья пациентов с МВ в РБ и в РФ и реализует персонализированный подход для лечения детей и взрослых с МВ с использованием современной фармакогенетической терапии. Высокая эффективность применения таргентной терапии подтверждена клиническим опытом специалистов разных стран, в которых она широко используется на протяжении 10 лет [23, 24].
Таким образом, оказание медицинской помощи пациентам с МВ необходимо проводить с учетом региональных особенностей течения заболевания, спектра и частот мутаций в гене CFTR [25, 26, 27], что позволит улучшить качество и продолжительность жизни пациентов.
Заключение. Проведена клинико-генетическая характеристика муковисцидоза в Республике Башкортостан и выявлены некоторые региональные особенности. В Республике Башкортостан показатели среднего возраста пациентов, возраст установления диагноза сопоставимы с аналогичными показателями по РФ. При оценке функций внешнего дыхания у пациентов с МВ отмечен высокий уровень ОФВ1, благодаря ранней диагностике, назначению дорназы-альфа, бронходилататоров, кинезиотерапии, антибиотиков. Высокий процент случаев установления диагноза при проведении неонатального скрининга достигается его высоким охватом и эффективной организацией. Охват генетическим исследованием в Республике Башкортостан выше по сравнению с эти показателем по РФ, 100 % и 93 % соответственно. Определены региональные особенности спектра и частот мутаций – это 12 вариантов нуклеотидной последовательности в гене CFTR: Phe508del, E92K, CFTRdele2,3, 3849+10kbC>T, L138ins, G509D, 394delTT, N1303K, W1282X, Y84X, 2143delT, 1525-1G>A составляют 94,9%, идентифицирована частота комплексного аллеля – c.1399C>T (p.Leu467Phe, L467F) – 16,6 %. По результатам молекулярно-генетической диагностики МВ в РБ, пациентам назначена таргентная терапия.
Информация о финансировании
Финансирование данной работы не проводилось.




















Список литературы