Поиск молекулярно-генетических маркеров гипермобильности суставов
Aннотация
Актуальность: Гипермобильность суставов (ГМС) – состояние, которое может иметь как доброкачественный характер, так и сопровождаться болевым синдромом и ранним развитием остеоартрита. Для ранней верификации риска развития осложнений необходимо исследование молекулярного патогенеза различных вариантов ГМС. Цель исследования:Поиск ассоциаций полиморфных вариантов генов-кандидатов, участвующих в метаболизме соединительной ткани, с гипермобильностью суставов в изолированной и сочетанной с дисплазией соединительной ткани (ДСТ) вариантах. Материалы и методы:В исследовании приняли участие лица молодого (21,86±0,22 лет) возраста (n=181). Было проведено клиническое исследование на наличие ГМС (шкала Beighton) и ДСТ (модифицированная таблица Кадуриной Т.И). Проведено молекулярно-генетическое исследование и поиск ассоциаций полиморфных вариантов генов рецептора витамина Д (VDR), люмикана (LUM), тенасцина (TNXB), фактора роста и дифференциации 5 (GDF5), ионного канала магния (TRPM6), костного морфогенетического белка 5 типа (BMP5) с ГМС в изолированной и сочетанной с ДСТ формах. Статистическая обработка данных проводилась с использованием точного критерия Фишера с поправкой Йетса для таблиц сопряженности 2x2. Силу ассоциаций оценивали в значениях показателя соотношения шансов (Odds Ratio, OR, при p<0,05), поправка на множественность – методом FDR (Бенджамини-Хохберга). Количественные данные оценивались попарно с использованием t-критерия Стьюдента, нормальность распределения по критерию Колмогорова-Смирнова. Результаты:Были выявлены ассоциации аллеля G и генотипа GG локуса rs3734444 и аллеля A локуса rs1470527 гена BMP5 с наличием ГМС в изолированном состоянии (OR=3,70 и OR=5,10; OR=8,00). Выявлены ассоциации аллеля T и генотипа ТТ локуса rs11144134 гена TRPM6 с ГМС в изолированной (OR=3,00 и OR=10,19) и в сочетанной с ДСТ формах (OR=3,17 и OR=11,28), генотип ТТ также ассоциировался с изолированной формой ДСТ (OR=3,74). Генотип GT локуса rs73611720 гена GDF5 ассоциировался с изолированной ДСТ (OR=4,15). Для полиморфных вариантов rs11540149 (VDR), rs2268578, rs3759222 (LUM), rs3130342 (TNXB) не было обнаружено статистически значимых ассоциаций с ГМС. Заключение:Аллель G локуса rs3734444 гена BMP5 является потенциально рисковым маркером ГМС в целом, аллель А локуса rs1470527 – изолированной ГМС, генотип GT локуса rs73611720 гена GDF5 – маркером изолированной ДСТ, аллель Т локуса rs11144134 гена TRPM6 – маркером ГМС в сочетании с ДСТ
Ключевые слова: гипермобильность суставов, дисплазия соединительной ткани, полиморфные варианты, VDR, LUM, TNXB, GDF5, TRPM6, BMP5
Введение. Молекулярно-генетические механизмы развития гипермобильности суставов (ГМС) представляют интерес с позиции превентивной медицины, так как ГМС является одной из возможных причин развития таких заболеваний опорно-двигательного аппарата, как ранний остеоартрит [1], остеопороз [2], вывихи различной локализации [3], нарушение осанки [4] с формированием хронического болевого синдрома [5]. Этиология и патогенез ГМС окончательно не установлены. Значительный интерес представляет исследование молекулярно-генетических аспектов метаболизма соединительной ткани как причины гипермобильности.
На сегодняшний день для поиска молекулярно-генетических механизмов возникновения многофакторных заболеваний, в частности ГМС, все более актуальным становится ген-кандидатный подход. В качестве кандидатных генов можно рассматривать гены структурных белков и белков-регуляторов гомеостаза соединительной ткани. Одним из таких регуляторов является витамин D, так как он играет ключевую роль в клеточной дифференцировке и пролиферации [6]. Сообщается, что возможный вклад в развитие и деградацию соединительной ткани может вносить люмикан (ген LUM) – член суперсемейства протеогликанов класса II с малыми богатыми лейцином повторами, которые органиуют коллагеновые фибриллы во внеклеточном матриксе [7]. Также представляет интерес тенасцин (ген TNXB), который регулирует расстояние между фибриллами путем прямого связывания с отдельными коллагеновыми волокнами во внеклеточном матриксе или путем непрямого связывания через декорин, а также его участие в ремоделировании эластических волокон и регуляции экспрессии некоторых компонентов матрикса, например, коллагена VI типа, протеогликанов и металлопротеаз [8]. Фактор роста и дифференцировки 5 (ген GDF5) играет важную роль во время формирования суставов. Это один из самых ранних генов, экспрессируемых в эмбриональной суставной интерзоне, дающий начало суставным тканям, включая суставной хрящ, синовиальную оболочку, мениски и связки [9]. Также в литературе описывается влияние костных морфогенетических белков на гомеостаз соединительной ткани, в частности, они участвуют в развитии синовиальных суставов и гомеостазе суставной ткани и поэтому ген BMP является потенциальным геном-кандидатом, вовлеченным в регенерацию тканей суставов [10]. Помимо вышеописанных генов на состояние соединительной ткани оказывает влияние уровень магния. Белок ионных каналов магния, кодируемый геном TRPM6, экспрессируется в эпителиальных клетках кишечника и почечных канальцах, что преимущественно опосредует всасывание Mg2+ в кишечнике и экскрецию Mg2+ почками. Также было обнаружено, что определенные полиморфные варианты гена TRPM6 человека связаны с дефектом закрытия нервной трубки, а более низкие уровни Mg2+ в сыворотке тесно связаны с пороками развития скелета, несовершенным остеогенезом и задержкой роста эмбриона [11]. В связи с этим, вышеперечисленные кандидатные гены могут быть вовлечены в молекулярный патогенез ГМС и привлекательны для поиска генетических маркеров данного состояния.
Цель исследования. Поиск ассоциаций полиморфных вариантов генов-кандидатов метаболизма соединительной ткани (VDR; LUM; TNXB; GDF5; TRPM6; BMP5) с развитием ГМС в изолированной форме и в сочетании с ДСТ.
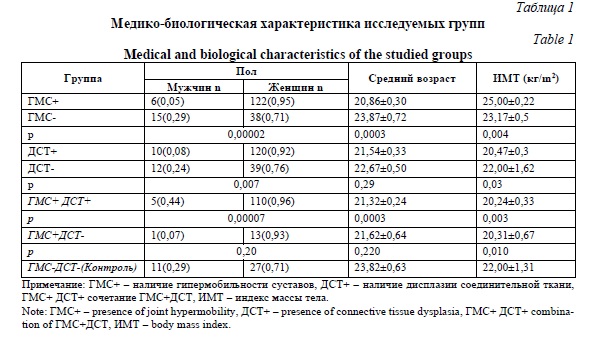
Материалы и методы исследования. В исследовании приняли участие 181 человек молодого возраста: средний возраст женщин(n=159) составил 21,71±0,23, для мужчин (n=22) 22,91±0,71. Медико-биологические характеристики исследуемых групп представлены в таблице 1. Из исследования были исключены обследуемые в случае отказа от участия в исследовании, наличии травм скелета в анамнезе, моногенных форм дисплазии соединительной ткани, ассоциированных с ГМС (синдромы Элерса-Данло и Марфана, несовершенный остеогенез), системных заболеваний соединительной ткани, в том числе ревматоидного артрита, инфекционных заболеваний, сахарного диабета, а так же профессии, связанных с развитием «профессиональной» гипермобильности (танцоры, гимнасты, балерины). Исследование проводилось в несколько этапов. На первом этапе всем участникам было проведено клиническое обследование определялось наличие признаков ГМС и ДСТ. Наличие гипермобильности суставов и степень ее выраженности оценивали по шкале Beighton (1998). Данная шкала включает в себя 5 проб, максимальное количество баллов – 9 (4 пробы двусторонние пассивные и одна односторонняя активная). Проба считалась положительной при 4 и более баллах. Фенотипические проявления ДСТ оценивались балльно-количественным методом по модифицированной таблице Кадуриной Т.И. (2015). Все пробы проводились двумя независимыми исследователями.
1. пассивное сгибание пястно-фалангового сустава 5-го пальца в обе стороны;
2. пассивное сгибание 1-го пальца в сторону предплечья при сгибании в лучезапястном суставе;
3. переразгибание локтевого сустава свыше 10°;
4. переразгибание коленного сустава свыше 10°;
5. наклон вперед при фиксированных коленных суставах, при этом ладони достигают пола.
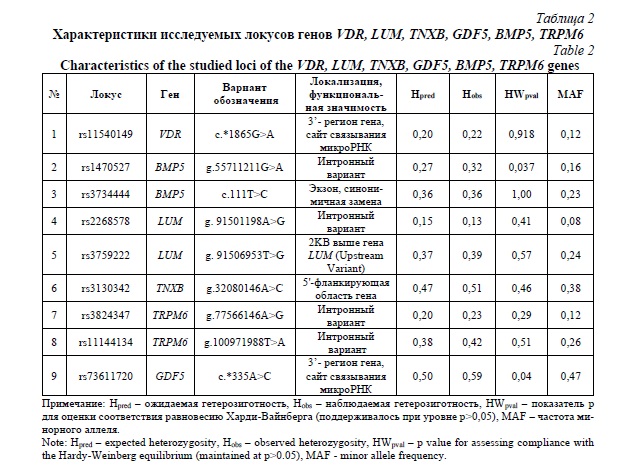
Обследуемые были разделены на следующие группы сравнения: ГМС+/ГМС-(контроль), ДСТ+/ДСТ-(контроль); ГМС+ ДСТ+ и ГМС+ДСТ- попарно сравнивались с ГМС-ДСТ-(контроль). Далее было проведено молекулярно-генетическое исследование. В исследование были включены гены, вовлеченные в метаболизм соединительной ткани, анализировались локусы, являющиеся структурными или регуляторными. Подбор осуществлялся с помощью баз данных ensembl.org (https://www.ensembl.org/) и dbSNP (https://www.ncbi.nlm.nih.gov/snp/?term=). В качестве кандидатных генов исследуются: ген основного костного морфогенетического протеина (BMP5) – белка, способствующего образованию хряща in vivo [12]: локус rs1470527, являющийся интронным микросетеллитом, оказывает регуляторный эффект на промотор BMP5 in vitro [13], а локус rs3734444 является синонимичным SNP и не влияет на аминокислотную последовательность, предполагается, что он изменяет сайты связывания фактора транскрипции CP2 и фактора энхансера миоцитов 2A. Кроме того, предполагается, что rs3734444 располагается в сайтах связывания экзонного сплайсинга, сайленсера и энхансера, которые играют важную роль в конститутивном и альтернативном сплайсинге [14]. Так же ген белка люмикана (LUM), отвечающего за пространственную организацию коллагеновых волокон и репарацию ткани [7], функциональные значения локусов rs2268578 и rs3759222 не описываются, но полиморфный вариант rs2268578 был ассоциирован с раком молочной железы [15], а находящийся в одной области с rs3759223 rs3759222, показал возможность влияния на связывание факторов транскрипции [16]. Фактор роста и дифференцировки 5 (GDF5), участвующий в формировании суставов [17], rs73611720 которого является сайтом связывания микроРНК, что ингибирует экспрессию белка путем прямого связывания с 3'-UTR областью мРНК-мишени [18]. Ген тенасцина (TNXB), регулирующего расстояние между фибриллами путем прямого связывания с отдельными коллагеновыми волокнами во внеклеточном матриксе [19] так же рассматривается как ген-кандидат, а локус rs3130342, идентифицированный в 50-й фланкирующей области TNXB, как возможный полиморфный вариант, восприимчивый к SLE в японской популяции [20]. Ген рецептора витамина Д (VDR), участвующего в дифференцировке клеток соединительной ткани [21], локус rs11540149 которого ассоциирован с Витамин D-зависимым рахитом II типа с алопецией, являющийся таже сайтом связывания микроРНК (www.targetscan.org); ген белка ионного канала магния (TRPM6), участвующего в остеогенной дифференцировке путем регуляции уровня кальция через изменение уровня сывороточного магния [22], его локусы rs11144134 и rs3824347 ассоциированы с метаболизмом магния [23]; о количественных признаках экспрессии данных локусов не сообщается, однако с локусом rs3824347 ассоциировалось отношение Mg 2+ к креатинину в моче [24].
У обследуемых был произведен забор биоматериала – 10 мл. венозной крови. Выделение ДНК осуществлялось стандартным методом фенольно-хлороформной экстракции. Проведено исследование полиморфных вариантов VDR, LUM, TNXB, GDF5, TRPM6, BMP5 методом Real-time PCR с применением технологии Kasptm на аппаратной платформе QuantStudio. Характеристики исследованных локусов представлены в таблице 2.
Исследование проводилось в соответствии с Хельсинкской декларацией и было одобрено локальным этическим комитетом ФГБОУ ВО БГМУ. Участники были проинформированы о целях исследования, получено информированное согласие на участие. Равновесие Харди-Вайнберга оценивалось с использованием пакета HaploView 4.2. Статистическая обработка данных проводилась с использованием пакетов Excel 2021, Statistica 13.0. Количественные признаки попарно сравнивались с использованием t-критерия Стьюдента, нормальность распределения по критерию Колмогорова-Смирнова. Качественные признаки оценивались с применением критерия χ2 с поправкой Йетса для таблиц сопряженности 2x2. Сила ассоциаций оценивалась в значениях показателя соотношения шансов (Odds Ratio, OR, при p <0,05), поправка на множественность сравнений проводилась методом Бенджамини-Хохберга (FDR).
Результаты и их обсуждение. Клиническое обследование с использованием балльно-количественных методов оценки выявило ГМС у 128 (70,7 %), а ДСТ у 129 (71,3%) человек. Гипермобильность суставов в сочетании с ДСТ была обнаружена у 115 обследованных (63,5%). Полученные данные по частоте аллелей и генотипов представлены в таблице 3. При проведении сравнительного анализа распределения частот аллелей и генотипов полиморфных локусов генов метаболизма соединительной ткани в исследуемых группах были выявлены ассоциации аллеля G и генотипа GG локуса rs3734444 гена BMP5 с наличием ГМС (p=0,001; p*=0,014; OR=3,70; 95% CI 1,72-7,96; p=0,0004; p*=0,002; OR=5,10; 95% CI 2,08-12,29; соответственно), также наблюдалась тенденция к преобладанию аллеля G и генотипа GG в группе с сочетанной патологией (р=0,011; p*=0,154) и (р=0,006; p*=0,09), однако данные ассоциации не сохранили своей статистической значимости после поправки на множественность сравнений (таблица 3). Таким образом, аллель G и генотип GG локуса rs3734444 гена BMP5 вероятнее всего являются маркером изолированной формы ГМС. Также была обнаружена ассоциация аллеля А локуса rs1470527 гена BMP5 и изолированной ГМС, достигнув статистической значимости (p=0,0006; p*=0,008; OR=8,00; 95 % CI 2,51-25,52). Таким образом, локус rs1470527 гена BMP5 является маркером изолированной ГМС.
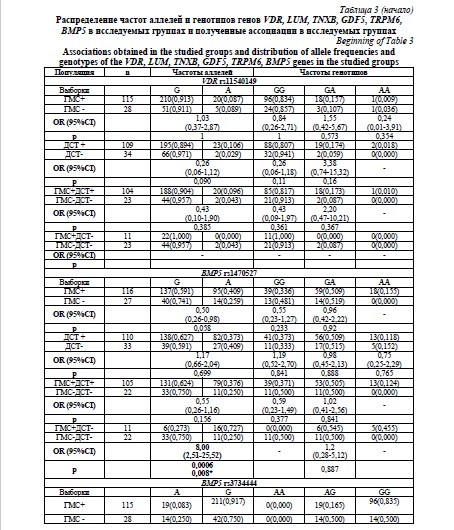
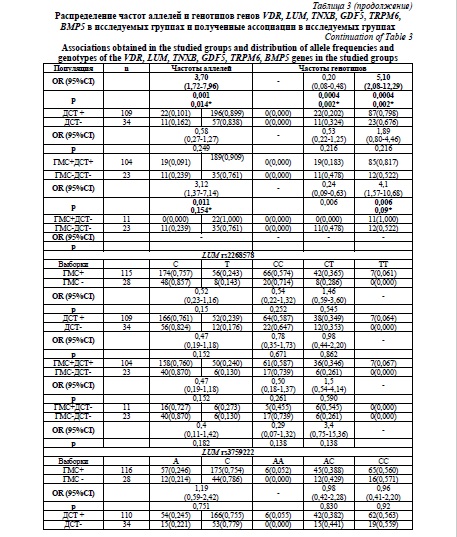
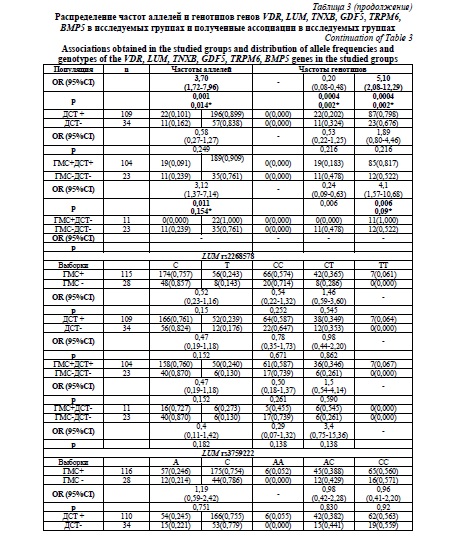
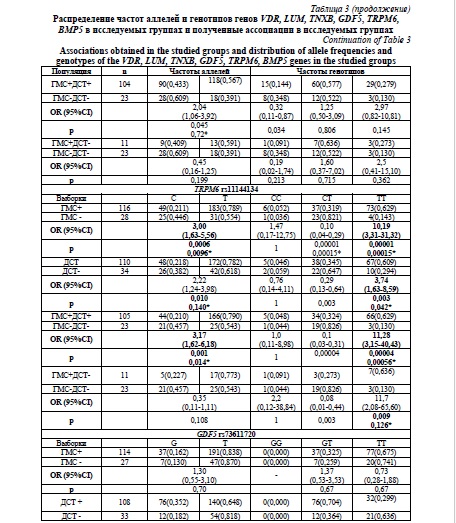
Наибольшее число ассоциаций было обнаружено для локуса rs11144134 гена TRPM6. В группе ГМС преобладал аллель Т и генотип TT (p=0,0006; p*=0,0096; OR=3,00; 95 % CI 1,63-5,56), (р=0,00001; p*=00015; OR=10,19; 95 % CI 3,31-31,32) по сравнению с группой контроля. Данная ассоциация сохраняется и в группе с сочетанной патологией для аллеля Т (p=0,001; p*=0,014; OR=3,17; 95 % CI 1,62-6,18) и генотипа ТТ (р=0,00004; p*=0,00056; OR=11,28; 95 % CI 3,15-40,43). В группе ДСТ сохраняется преобладание генотипа ТТ (р=0,003; p*=0,042; OR=3,74; 95 % CI 1,63-8,59) и аллеля Т (р=0,01; p*=0,14) по сравнению с контролем, но статистическая значимость для аллеля Т не сохранилась после поправки на множественность сравнений, а генотип ТТ, несмотря на тенденцию к преобладанию в группе с изолированной ГМС, также потерял статистическую значимость после введения поправки (р=0,009; p*=0,126), что позволяет считать локус rs11144134 гена TRPM6 маркером риска наличия сочетанной патологии.
Аллель Т локуса rs3824347 гена TRPM6 встречался в 57 % в группе изолированной ГМС, в 56,7 % в группе с сочетанной патологией, выявляю тенденцию к большей частоте по сравнению с группой контроля (39,1 %), однако ассоциация не сохранила статистической значимости после поправки на множественность сравнений (р=0,026; p*=0,42 и р=0,045; p*=0,72; соответственно).
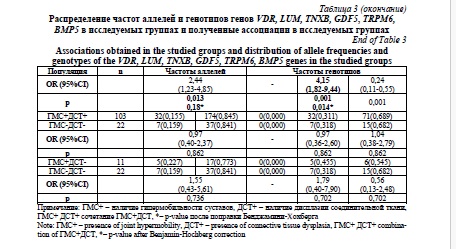
Частота аллеля G локуса rs73611720 гена GDF5 была выше у лиц с ДСТ, однако различия не сохранили статистическую значимость после введения поправки на множественность сравнений (р=0,013; p*=0,182). При этом частота генотипа GT была статистически значимо выше в группе с ДСТ (р=0,001; p*=0,014; OR=4,15; 95% CI 1,82-9,44). Обращает на себя внимание отсутствие гомозиготных генотипов GG как в группах с ГМС и ДСТ, так и в группах контроля, при этом частота минорного аллеля в различных популяциях варьирует от 0,40 до 0,50. Локус rs73611720 гена GDF5 является маркером изолированной ДСТ.
В ходе анализа было обнаружено неравновесие по сцеплению между локусами rs2268578 и rs3759222 гена LUM (D'>0.660), которые сформировали один гаплотипический блок, однако сравнительный анализ не выявил ассоциаций как для данных маркеров, так и для полиморфных вариантов rs11540149 (VDR) и rs3130342 (TNXB). Все полученные результаты схематически представлены на рисунке 1.

Известно, что исследуемый локус rs11540149 (c.*1865G>A) гена VDR является сайтом связывания для нескольких регуляторных микроРНК, например hsa-miR-150–5p, hsa-miR-629–3p, hsa-miR-532–3p и др. Hsa-miR1260a, hsa-miR-1260b, обладающие сродством к аллелю А, являются маркерами ускоренного старения остеобластов [25]. Предполагается, что однонуклеотидная замена с*1865G>A приводит к ухудшению связывания матричной РНК с короткими интерферирующими микроРНК, что и приводит к нарушению активности гена. Ранее нами обнаружена ассоциация аллеля А локуса rs11540149 с переломами у мужчин русской этнической принадлежности [26], в данной работе не было обнаружено статистически значимых ассоциаций с ГМС.
Ген LUM исследовался на модели хронических контрактур суставов у кроликов, где выяснилось, что экспрессия мРНК данного гена повышена в суставных капсулах коленных суставов с контрактурой, что позволяет предположить возможный вклад люмикана в развитие этой патологии [27]. Kelemen LE и соавт. (2008) в исследовании на базе клиники Мейо, в котором приняло участие 798 пациентов, обнаружили ассоциацию генотипа GG локуса rs2268578 гена LUM с раком молочной железы [15]. Далее Couch FJ (2009) в той же клинике Мейо обнаружил тенденцию к ассоциации локуса rs2268578 с раком молочной железы, однако статистическая значимость не была достигнута [28]. Затем Ernest K Amankwah и соавт. (2011) осуществляли поиск ассоциаций некоторых локусов люмикана и декорина с серозно-эпителиальным раком яичников, но для аллеля rs2268578 ассоциаций не было обнаружено [29]. Также Park SH (2013) и соавт. проводили поиск ассоциации локуса rs3759222 гена LUM с миопией различной степени выраженности в корейской популяции и была обнаружена тенденция наличия генотипа СС и аллеля С как протективного фактора, однако статистической значимости не было достигнуто [30]. Далее He M и соавт. (2014) был проведен метаанализ, в который вошли восемь исследований (1425 случаев и 1271 контроль) среди азиатской популяции на предмет связи данного локуса с близорукостью, где данная теория была полностью отвергнута [31].
Kamatani Y (2008) обнаружили ассоциацию локуса rs3130342 аллеля G гена TNXB с системной красной волчанкой в исследовании 178 пациентов японской популяции [20]. Schalkwijk и соавт. (2001) описали отсутствие тенасцина В в сыворотке крови 5 пациентов с классическим подтипом синдрома Элерса-Данло (СЭД), включавшим, в том числе и ГМС. Мутации гена TNXB были выявлены у всех пациентов с дефицитом сывороточного тенасцина; у одного пациента была гомозиготная делеция, один был гетерозиготен по делеции, а у трех других были гомозиготные точковые делеции, что подтверждает причинную роль гена TNXB и рецессивный характер наследования [32]. Далее этой группой исследователей было проведено расширенное обследование 20 пациентов с СЭД. У всех обследованных были обнаруженные значительно сниженные уровни тенасцина в сыворотке крови, и у 17 из них подтверждены гетерозиготные делеции в гене TNXB [33].
Ген TRPM6, помимо регуляции метаболизма магния, также отвечает за остеогенную дифференцировку [34]. Потеря Mg 2+ в организме способствует развитию таких широко распространенных заболеваний, как диабет 2 типа, метаболический синдром, остеопороз и различные типы иммунных, сердечно-сосудистых и неврологических нарушений [35]. Лукманова и соавт. (2019), проведя исследование с участием 250 молодых людей, обнаружили ассоциацию между снижением концентрации сывороточного магния и наличием ДСТ [36] Информация о локусе rs3824347 гена TRPM6 ограничена.
Костные морфогенетические белки (BMP) представляют собой многофункциональные факторы роста, принадлежащие к надсемейству трансформирующих факторов роста-β (TGF -бета) и выполняют двойную функцию. Микроокружение способствует адипогенной или остеогенной дифференцировке, способствуя либо адипогенезу, либо остеогенезу [37]. Sharma AC и соавт. (2017) в Индии (г. Лахнау) в исследовании с участием 499 пациентов с рентгенологически подтвержденным ОА коленного сустава и 458 пациентами группы контроля, обнаружили ассоциацию ОА и генотипами CT и TT локуса rs1470527 гена BMP5, что не противоречит полученным нами данным [13]. В исследовании локуса rs3734444 Huang SP и соавт. (2012) описали ассоциации комбинации генотипов AA+AG с риском прогрессирования рака предстательной железы и смертностью от всех причин [14], а Liang W и соавт. (2014) в исследовании китайской ханьской популяции в выборке из 510 человек с ОА коленного сустава и 520 человек группы контроля не обнаружили значимых ассоциаций генотипов CT и СС и наличием ОА [38], что не согласуется с полученными нами результатами.
В исследовании Meyer TE и соавт. (2010) аллель T локуса rs11144134 гена TRPM6 ассоциировался с более низким уровнем магния в сыворотке и более высокой минеральной плотностью костной ткани шейки бедра и поясничного отдела позвоночника [23], что не противоречит полученным нами данными. Так же Cheng WW и соавторы (2019) подтвердили ассоциацию rs11144134 в гене TRPM6 с более низкими уровнями Mg и более высокой минеральной плотностью костной ткани [39], но подробно ассоциации полиморфных вариантов и концентрация магния авторами описаны не были.
Tyurin A и соавт. (2021) в исследовании с участием 417 женщин обнаружили ассоциацию аллеля Т локуса rs73611720 гена GDF5 c наличием остеоартрита в группах смешанной национальности и малых этнических групп [40], что согласуется с полученными нами данными. Вариант с аллелем Т по результатам биоинформатического прогнозирования имеет сродство к микроРНК miR-3929, miR-4419b, miR-4478, miR-485-5p, miR-6884-5p, в то время как к редкому варианту аллеля имеется сродство к miR-25-5p и hsa-miR-6087. miR-3929 регулирует активность эпидермального фактора роста Cripto-1, который, в свою очередь, имеет решающее значение для раннего эмбрионального развития, он связан с недифференцированным статусом эмбриональных стволовых клеток человека. miR-4478, miR-485-5p, miR-6884-5p сильно ассоциированы с пролиферацией клеток на различных уровнях специализации и влияют на их дифференцировку. Таким образом, полиморфизм сайта связывания микроРНК в гене GDF5 может потенциально влиять на регуляцию созревание и рост клеток соединительной ткани [41, 42, 43].
Заключение. Аллель G локуса rs3734444 гена BMP5 является потенциально рисковым маркером ГМС в целом, аллель А локуса rs1470527 – изолированной ГМС, генотип GT локуса rs73611720 гена GDF5 – маркером изолированной ДСТ, аллель Т локуса rs11144134 гена TRPM6 – маркером ГМС в сочетании с ДСТ.
Информация о финансировании
Грант в форме субсидий из бюджета Республики Башкортостан для государственной поддержки молодых ученых – аспирантов и кандидатов наук (шифр конкурса – НОЦ-ГМУ-2023)





















Список литературы