Варианты генов Mycobacterium tuberculosis, ассоциированные с лекарственной устойчивостью к фторхинолонам (обзор литературы)
Aннотация
Актуальность: Распространение лекарственной устойчивости M. tuberculosis к фторхинолонам представляет угрозу для их долгосрочной клинической эффективности. Понимание механизмов формирования лекарственной устойчивости к фторхинолонам, основанное на информации о генах, ассоциированных с лекарственной устойчивостью M. tuberculosis, важно для оптимизации режимов химиотерапии туберкулеза. Цель исследования:Изучить имеющиеся в мировой литературе данные о наиболее значимых вариантах генов M. tuberculosis, ассоциированных с лекарственной устойчивостью к фторхинолонам. Материалы и методы:Для достижения поставленной цели проводился анализ источников отечественной и иностранной литературы по данной проблеме преимущественно за последние 5 лет. Использовались базы данных научных электронных библиотек PubMed, Elibriary. Результаты:Устойчивость микобактерий к фторхинолонам связана с мутациями генов gyrA и gyrВ, кодирующих субъединицы GyrA и GyrВ ДНК-гиразы, основной мишени действия фторхинолонов. В фторхинолон-связывающем кармане каталитического центра «ДНК-гираза+ДНК» молекула фторхинолона поддерживается участками gyrA и gyrВ, определяющим устойчивость к фторхинолонам (QRDR-A и QRDR-B). Модификация любого из составляющих фрагментов этих участков влияет на уровень устойчивости к ФХ. Молекулы хинолонов небольшого размера (налидиксовая кислота), имеют высокую МИК в отношении Mtb и других бактерий, а молекулы ФХ больших размеров (спарфлоксацин, ситафлоксацин, гатифлоксацин, левофлоксацин и моксифлоксацин) плотно прилегают к фторхинолон-связывающему карману, и их МИК ниже. Модификация структуры ДНК может изменять пространственную структуру самого кармана, что приводит к дестабилизации фторхинолона внутри него. Таким образом, наличие гетерорезистентности возбудителя туберкулеза к фторхинолонам свидетельствует об активном формировании его устойчивости к этой группе препаратов в современных условиях. Заключение:Анализ современных исследований показывает зависимость лекарственной устойчивости микобактерий от концентрации фторхинолонов, при этом чаще всего резистентность к низким концентрациям фторхинолонов ассоциирована с заменами в гене gyrB, а к высоким – с мутациями в гене gyrA. Также установлено и описано, что помимо основных изученных регионов генов gyrA и gyrB, ассоциированных с фенотипической лекарственной устойчивостью к фторхинолонам, есть участки, недостаточно изученные на данный момент. Эти участки невозможно диагностировать в условиях клинической работы бактериологических лабораторий противотуберкулёзных учреждений
Введение. По последним статистическим данным, в России отмечалосьснижение эпидемических показателей заболеваемости туберкулезомв период 2020-2021 гг. Однако, при этом имеет место увеличение показателей лекарственной устойчивости Mycobacterium tuberculosis (Mtb) к существующим противотуберкулезным препаратам (ПТП) [1, 2, 3]. Напряженная эпидемическая ситуация по туберкулезу как в России, так и в мире, прежде всего связана с увеличением числа случаев заболевания, вызываемых штаммами Мtb с множественной и широкой лекарственной устойчивостью (МЛУ и ШЛУ) возбудителя [3]. Согласно данным ФГБУ «Центральный НИИ организации и информатизации здравоохранения» Минздрава России, в 2021 г. среди всех заболевших туберкулезом 26 473 (37,7%) пациентаимеют штамм с множественной лекарственной устойчивостью (МЛУ) возбудителя [3].
Лечение больных туберкулезом с лекарственной устойчивостью возбудителя (ЛУ-ТБ) требует длительного применения ПТП второго ряда, среди которых высокий терапевтический потенциал имеют фторхинолоны (ФХ), пероральные антибактериальные препараты широкого спектра действия. Однако, в последние годы все чаще встречаются публикации о распространённости штаммов Mtb с устойчивостью к ФХ [4, 5, 6]. Кроме того, ФХ используются для лечения бактериальных инфекций дыхательных, мочевыводящих путей, желудочно-кишечного тракта, а также заболеваний, передающихся половым путем, что дополнительно способствует повышению уровня устойчивости к ним у Mtb. По мнению ряда авторов, высокий уровень первичной лекарственной устойчивости Mtb к ФХ может наблюдаться среди пациентов в тех территориях, где препараты интенсивно применяются в общей терапевтической практике [4, 5,7]. Во многих странах ФХ до сих пор относятся к безрецептурным препаратам, что неминуемо ведет к их бесконтрольному использованию, а в дальнейшем способствует развитию лекарственно устойчивых (ЛУ) форм заболеваний, в том числе туберкулеза. Распространение лекарственной устойчивости M. tuberculosis к фторхинолонам представляет угрозу для их долгосрочной клинической эффективности. В то же время (по данным ВОЗ) мировой охват тестированием на определение чувствительности к фторхинолонам (ФХ) является низким и составляет около 50% от числа выявленных случаев туберкулеза в мире [4, 6, ,8,9].
Цель исследования. Изучить имеющиеся литературные данные о наиболее значимых вариантах генов M. tuberculosis, ассоциированных с лекарственной устойчивостью к фторхинолонам.
Материалы и методы исследования. Для достижения поставленной цели проводился анализисточников отечественной и иностранной литературы по данной проблеме преимущественно за последние 5 лет. Использовались базы данных научных электронных библиотек PubMed, Elibriary.
Результаты и их обсуждение. ФХ представляют собой синтетические молекулы, содержащие в своем составе кольцевую структуру, включающую в себя 4-оксо-1,4-дигидрохинолин и присоединенную в третьем положении карбоновую кислоту. Предшественниками ФХ были нефторированные хинолоны, первым представителем которых являлась налидиксовая кислота. Налидиксовая кислота и последующие представители этого класса (оксолиниевая кислота, цинокарцин и т.д.) не нашли широкого применения в клинической практике в силу достаточно узкого спектра антимикробного действия. Первые препараты группы фторхинолонов появились в 1962 году после модификации молекулы хинолина путем введения в нее атома фтора. В отечественную фтизиатрическую практику ФХ вошли в начале 2000-х гг. [8, 9].
Фторхинолон второго поколения офлоксацин ранее был эффективен в отношении грамположительных бактерий (особенно Mtb и пневмококков) и использовался в схемах лечения туберкулеза, но из-за развития лекарственной устойчивости (ЛУ) возбудителя к нему в современные схемы лечения включают его l- изомер (энантиомер) – левофлоксацин [10, 11]. Известно, что ЛУ к офлоксацину может сопровождаться развитием лекарственной устойчивости к ФХ последующих поколений. В настоящее время в клинических рекомендациях для лечения ЛУ-ТБ рекомендованы левофлоксацин (3-е поколение) и моксифлоксацин (4-поколение) [12]. Преимуществамилевофлоксацинаявляется способность проникать в макрофаги и меньшее, в сравнении с другими препаратами данной группы, кардиотоксическое действие, регистрируемое в виде удлинения интервала Q-T [12]. Дополнительным преимуществом группы ФХ 3-го поколения является длительный период полувыведения, что определяет возможность 1–2х кратного приема в сутки [8]. Новое (4-е) поколение фторированных хинолонов, таких как моксифлоксацин, гатифлоксацин и др., обладает значительно большей активностью в отношении грамположительных микроорганизмов, в том числе Mtb, относительно предыдущих поколений ФХ [1, 12].
Механизмы резистентности Mtb к ФХ
В ходе эволюционного развития Mtb выработали механизмы защиты от факторов внешней среды: толстая клеточная стенка, способность переключения между метаболическими путями (формирование метаболического шунта или приобретение генов метаболического пути альтернативного тому, который ингибируется антибиотиком), приводящая к модификации мишени действия антибактериального препарата, активный выброс веществ через мембрану посредством эффлюксных помп, инактивация антибактериальных препаратов и т.д. [13, 14, 15]. Формирование ЛУ к антибактериальным препаратам, в том числе и к ФХ, обусловлено селекцией штаммов, обладающих теми или иными геномными мутациями, возникающими в ответ на изменение условий окружающей среды, а именно сочетанного воздействия комплекса антибактериальных препаратов на бактериальную клетку. Резистентность бактерий к ФХ осуществляется по типу хромосомной и связана с мутациями генов, кодирующих бактериальные топоизомеразы II типа (ДНК-гиразу и топоизомеразу II) [16, 17] и отвечающих за регуляцию экспрессии трансмембранного белка-насоса, осуществляющего активный транспорт фторхинолонов из клетки [18, 19].
Бактериальные топоизомеразы необходимы для регуляции внутриклеточных процессов репликации, транскрипции или рекомбинации ДНК за счет энергии АТФ [19, 20]. ДНК-гираза состоит из двух субъединиц А (GyrА) и В (GyrВ), кодируемых генами gyrA и gyrB, соответственно, и образующих каталитически активный гетеротетрамерный центр GyrA2–GyrB2 размером 350 кДа. Субъединица А состоит из N-концевого (breakage-reuniondomain (BRD) и С-концевого доменов, а субъединица B включает в себя домен АТФаза и домен Toprim (топоизомераза - праймаза) [21]. В процессе каталитической активности фермента участок N-концевого домена субъединицы А связывает G-участок ДНК (место разрыва, «N-концевые ворота»).
Mbt обладают только одной ДНК-гиразой, она же и является мишенью действия фторхинолонов. В процессе работы ДНК-гираза связывается с ДНК, и каталитическое ядро образуется субъединицей GyrB, ее доменом Toprim и участком субъединицы GyrA. В этом каталитическом ядреостатки обеих субъединиц фермента расположены близко друг к другу и образуют фторхинолон-связывающий карман (quinolone-bindingpocket), к которому присоединяется молекула ФХ. Образовавшийся комплекс «фторхинолон + гираза + молекула бактериальной ДНК» блокирует репликацию ДНК и приводит к гибели клеток Mtb [22]. Гидролиз тирозил-ДНК-фосфодиэстеразы без лигирования приводит к накоплению двухцепочечных разрывов в хромосоме, что, в конечном счете может являться основной причиной гибели микобактерий [23, 24].
Устойчивость ДНК-гиразы к фторхинолонам у Mtb является результатом изменения вариаций в геномной последовательности, которая приводит к потере ионов магния, обеспечивающих связывание ФХ с субъединицами фермента. Экспериментально подтверждено, что потеря ионов магния, взаимосвязанных с субъединицей GyrA в 94 и 90 кодонах приводит к развитию резистентности к ФХ [23, 25, 26].
В литературе описано, что у грамотрицательных бактерий, имеющих помимо ДНК-гиразы, также топоизомеразу IV, мутации, приводящие к формированию ЛУ, сначала возникают в гене gyrA, в области QRDR ДНК-гиразы, а затем следуют мутации в эквивалентной области гена топоизомеразы IV ParC. У грамположительных микобактерий такие мутации чаще (в 45-85%) возникают в генах, кодирующих ДНК-гиразу, в участке gyrA, определяющем устойчивость к фторхинолонам (quinolone resistance-determining regions gyrA, QRDR-A), и реже (около 7%) – в аналогичном участке gyrB (QRDR-В) [18, 24, 25]. Антимикробная активность моксифлоксацина преимущественно направлена на каталитическую активность ДНК-гиразы, что повышает его эффективности в отношении Mtb. Рядом других исследований было установлено, что только 11,5% штаммов M. tuberculosis, устойчивых к офлоксацину, имеют мутацию в субъединице gyrA, в то время как у 45% штаммов регистрируется мутация в субъединице gyrB [17, 25]. Таким образом, за формирование лекарственной устойчивости у Mbt отвечают обе субъединицы фермента. Так же необходимо отметить, что мутации в gyrB чаще обнаруживали совместно с мутациями в gyrA [26].
Замены в QRDR-A Mtb чаще встречаются в кодонах 94, 89, 90 и 91 и, реже, в кодонах 88 и 74. Замены QRDR-В больше отмечены в кодонах 500, 538, 539 и 540 (кодоны 461, 499, 500 и 501 в новой системе нумерации). При этом замены N538D и E540V ассоциированыс высокимуровенем устойчивости ко всем ФХ, а замена A90V часто ассоциированас устойчивостью к ципрофлоксацину и офлоксацину при их минимальной ингибирующей концентрации (МИК) более 3 мкг/мл. В то же время, такая замена незначительно влияет на устойчивость к моксифлоксацину при МИК менее 0,5-1,0 мкг/мл. Аналогичная тенденция наблюдалась у штаммов с заменой в D94A.
Разница МИК моксифлоксацина и ципрофлоксацина может быть объяснена трехмерной моделью каталитического ядра ДНК-гиразы у Mtb. В фторхинолон-связывающем кармане фторхинолон поддерживается с одной стороны тремя остатками QRDR-A (G88, D89 и A90), а с другой стороны – пятью остатками QRDR-B (D500, R521, N538, T539 и E540 [D461, R482, N499, T500 и E501]). Было показано, что модификация любого из этих остатков влияет на уровень устойчивости к ФХ [27, 28]. Эта модель объясняет, почему хинолоны небольшого размера (налидиксовая кислота), имеют высокую МИК в отношении Mtb и других бактерий, в то время как ФХ больших размеров (спарфлоксацин, ситафлоксацин, гатифлоксацин, левофлоксацин и моксифлоксацин) являющиеся ингибиторами ДНК-гиразы, плотно прилегают к фторхинолон-связывающему карману, и их МИК ниже. Так же это свидетельствует о том, что для молекулы ФХ большого размера, например, моксифлоксацина, любая модификация аминокислот, способствующих положению в фторхинолон-связывающем кармане, приводит либо к прямому, либо к косвенному изменению геометрического положения самого кармана, что влияет на изменение его сродства к ДНК-гиразе. Когда боковая цепь модифицированной аминокислоты меньше, карман становится слишком большим, и стабилизация молекулы фторхинолона невозможна. В то же время, когда боковая цепь модифицированной аминокислоты большая, карман становится слишком маленьким и фиксация молекулы фторхинолон, а также становится невозможной [29, 30]. Наиболее распространенные замены происходят в D94 или A90 в gyrA. Замена серина на аланин в кодоне 90 gyrA адаптирует фторхинолоновый карман под молекулу моксифлоксацина, повышая восприимчивость к нему. Замена на валин, часто наблюдаемая у устойчивых изолятов [29, 30], формирует карман наименьшего размера между боковой цепью и молекулой моксифлоксацина. Тем не менее в литературе не дается объяснение того, почему штаммы, несущие замену A90V, чаще устойчивы к ципрофлоксацину, чем к моксифлоксацину, хотя этот остаток взаимодействует с консервативным участком обоих фторхинолонов [31].
Влияние на пространственную структуру фторхинолонового кармана оказывают аминокислотные замены, локализованные в α-спирали ДНК, которые взаимодействуют с участками «большой бороздки» ДНК. Поскольку молекула ДНК образует комплекс с ДНК-гиразой во фторхинолоновом кармане, модификация структуры ДНК также может изменять пространственную структуру самого кармана, что может привести к дестабилизации фторхинолона внутри него. Этот механизм позволяет объяснить, почему замена аминокислоты с меньшей боковой цепью (аланин или глицин) увеличивает устойчивость до того же уровня, что и замены аминокислотами с большими боковыми цепями, например, такими, как гистидин [31, 32].
Мутации в QRDR, ответственные за приобретенную устойчивость к ФХ, накладываются на исходную первичную устойчивость из-за сродства каталитического ядра ДНК-гиразы M. Tuberculosis к ФХ. Это связано с заменами аминокислот в кодонах 81 и 90 в QRDR-А и 500в QRDR-B [26, 27]. Положение 90 в QRDR-A представлено аланином, а положение 500 – аргинином в QRDR-B Mtb. Обе аминокислоты необходимы для организации пространственной структуры фторхинолонового кармана и, в последующем, необходимы для связывания молекулы фторхинолона [33, 34].
Повышение восприимчивости к ФХ за счет замены лизина на аргинин в положении 521 объясняется более низкими энергетическими затратами на перемещение аргинина в малой бороздке ДНК [33, 34]. Это означает, что створке будет легче открыться и дестабилизировать молекулу фторхинолона, если остаток представлен аргинином, а не лизином.
В литературе встречается описание некоторых мутаций, роль которых в формировании устойчивости к ФХ исследована недостаточно [35]. Например, замена аминокислоты в кодоне A74S не вызывает развитие лекарственной устойчивости штаммов ко всем ФХ, но в случаях, когда обнаруживается замена аминокислот в кодонах A74S и D94G одновременно, то такой мутантный штамм является устойчивым [33-36].Так же описано, что штаммы с более чем одной мутацией в QRDR или с мутациями в gyrA и gyrB обладают высоким уровнем устойчивости, в сравнении со штаммами, имеющими только одну мутацию. Обратная ситуация наблюдается с мутацией T80A в gyrA, которая сама по себе не оказывает влияние на чувствительность к ФХ, но совместно с мутацией A90G повышает восприимчивость штаммов к офлоксацину [37, 38].
Чаще всего кодонами, мутации в которых ассоциированными с ЛУ к ФХ для субъединицы GyrAв гене gyrA, являются 94, 90, 91, 88, 126 кодоны. Мутации в кодонах гена gyrA изолятов M. tuberculosis, устойчивых к ФХ, представлены в таблице 1.
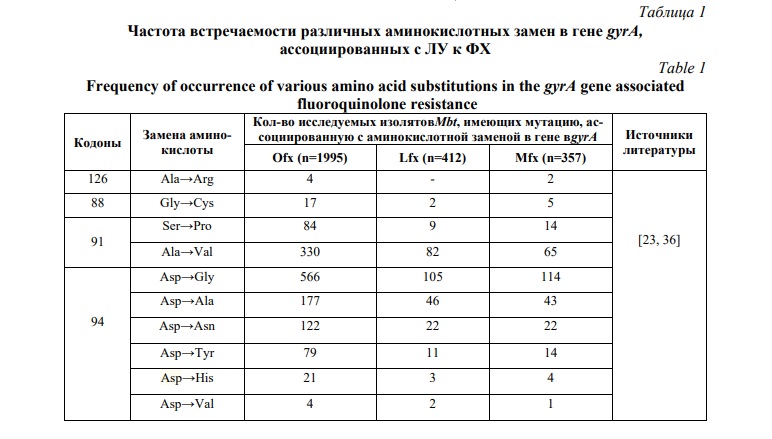
Из приведенной выше таблицы видно, что замена аминокислоты Asp→Gly в 94 кодоне gyrA встречаются наиболее часто. Большинство мутаций обнаружено в кодонах 88-94. Встречаемость мутаций в кодоне gyrA D94G составляет от 21 до 32%, а в кодоне A90V 13-20% в исследованных фторхинолон-устойчивых изолятах и зависит от конкретного тестируемого фторхинолона. Мутации G88C и D94V в субъединице gyrA встречались реже – всего в 1-2% случаев. Мутация D94F приводит к устойчивости к левофлоксацину, но встречается намного реже выше описанных. Также в экспериментах ряда исследователей показано, что известные замены в гене gyrA (G88C, A90V, D94N, D94H, D94A, D94G, D94Y) могут превышать установленные МИК к моксифлоксацину, с 1,0мкг\мл до 3,0 мкг\мл. Что требует оптимизации дозирования приема ФХ, минимизируя потенциальные эффекты лекарственной токсичности [39, 40].
Мутации в кодонах гена gyrВ изолятов M. tuberculosis устойчивых к ФХ представлены в таблице 2.
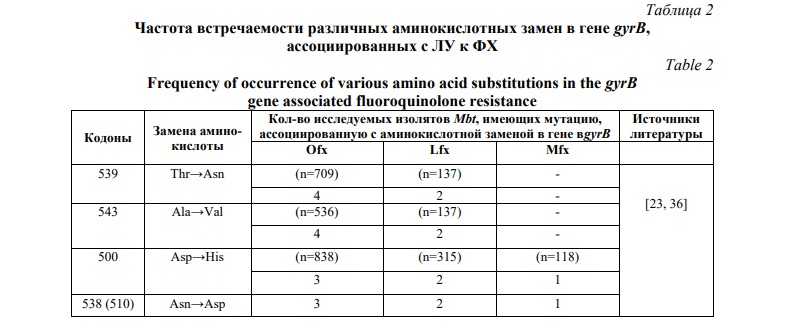
Согласно литературным данным, мутации в gyrB чаще свидетельствуют о наличии устойчивости к офлоксацину и встречаются реже, чем мутации в gyrА [41]. Мутации в кодонах N538D (N510D в зависимости от используемой системы нумерации), D500H, T539N и A543V среди устойчивых к офлоксацину изолятов встречаются крайне редко менее чем в 1% случаев. На территории России наиболее распространена мутация в кодоне D500H в субъединице gyrB [23, 38, 39]. Так же существуют исследования, связывающие о наличие мутаций в других кодонах в этой субъединице, ассоциированные с лекарственной устойчивостью: замена Asp→Ala в 505 и Gly→Ala в 481 кодонах [39, 40].
Так же в литературе встречаются данные о мутациях, возникающих в других участках субъединиц GyrА (Т80А, E21Q и др.) и GyrВ (E501D, D461N, C-165T, M291I и др.), при этом имеющихся данных овзаимосвязи между фенотипической и генотипической лекарственной устойчивостью к современным фторхинолонам недостаточно [24, 38, 39, 40].
С помощью полногеномного секвенирования стало возможным выявить мутации, возникающие за пределами региона QRDR, которые, скорей всего, также связаны с устойчивостью к ФХ, при этом мутации за пределами QRDR-Ввстречаются чаще, чем за пределами QRDR-A [23, 37].
Мутации, происходящие внутри QRDR (особенно в кодонах 88-94) обнаружены у большинства фенотипически устойчивых к моксифлоксацину и офлоксацину изолятов. Поэтому их принято считать gyrA маркерами фенотипической устойчивости Mtb ко всей группе фторхинолонов, что предполагает наличие перекрестной устойчивости ко всей группе препаратов. Мутации в гене gyrB E501D больше ассоциирована с устойчивостью к моксифлоксацину, чем к левофлоксацину. При этом в клинической практике рекомендовано определять лекарственную устойчивость ко всем имеющимся фторхинолонам, несмотря на риск развития перекрестной устойчивости [37].
Недостаточно изученные области генов gyrA и gyrB могут содержать мутации, объясняющие фенотипическую устойчивость штаммов Mtb к ФХ при отсутствии генетических маркеров. Кроме того, 15-18% штаммов Mtb, устойчивых к ФХ, без идентифицированных мутаций, могут обладать альтернативными механизмами устойчивости [37, 42]. Мутации в gyrB преимущественно ассоциированы с мутациями gyrA и чаще всего встречаются в кодонах 500 и 538, что затрудняет оценку их индивидуального вклада в фенотипическую резистентность. В исследовании Malik S. и соавторы. [20] анализ гена gyrB показал, что необходимо включить мутации QRDR гена gyrB в разработку новых тест-систем, направленных на определение лекарственной устойчивости к препаратам группы фторхинолонов. Так же анализ мутаций, возникающих в гене gyrB независимо от гена gyrA, поможет объяснить формирование фенотипической устойчивости изолятов Mtb. В литературе описано, что наличие мутации в QRDR gyrB (в кодонах 500, 538, 539 и 543), не встречаются у диких типов Mtb поэтому можно предположить, что они являются маркерами резистентности ко всей группе фторхинолонов [20, 42].
Мутации, ассоциированные с фенотипической устойчивостью к современным фторхинолонам (левофлоксацину и моксифлоксацину) представлены в каталоге генетических мутаций, собранных ВОЗ [9]. Существуеттак же ряд мутаций, не ассоциированных с развитием лекарственной устойчивости к фторхинолонам, при этомнельзя исключать тот факт, что замены, которые не ассоциированы с лекарственной устойчивостью на данный момент, не будут влиять на ее формирование в будущем. Некоторые из них не влияют на развитие ЛУ только при одиночном возникновении, в то время как при одновременном возникновении с другими мутациями штамм приобретает резистентность.
Устойчивость микобактерий к фторхинолонам связана с мутациями генов gyrA и gyrВ, кодирующих субъединицы GyrA и GyrВ ДНК-гиразы, основной мишени действия фторхинолонов. При этом мутации в gyrB чаще обнаруживали совместно с мутациями в gyrA. В фторхинолон-связывающем кармане каталитического центра «ДНК-гираза+ДНК» молекула фторхинолона поддерживается участками gyrA и gyrВ, определяющим устойчивость к фторхинолонам (QRDR-A и QRDR-B). Модификация любого из составляющих фрагментов этих участков влияет на уровень устойчивости к ФХ. Любая модификация аминокислот, способствующих положению молекулы ФХ в фторхинолон-связывающем кармане, приводит к прямому или косвенному изменению пространственной структуры самого кармана, что влияет на изменение его сродства к ДНК-гиразе. Молекулы хинолонов небольшого размера (налидиксовая кислота), имеют высокую МИК в отношении Mtb и других бактерий, а молекулы ФХ больших размеров (спарфлоксацин, ситафлоксацин, гатифлоксацин, левофлоксацин и моксифлоксацин) плотно прилегают к фторхинолон-связывающему карману, и их МИК ниже. Модификация структуры ДНК может изменять пространственную структуру самого кармана, что приводит к дестабилизации фторхинолона внутри него.
Рядом исследователей показана зависимость лекарственной устойчивости микобактерий к фторхинолонам от концентраций последних, при этом чаще всего резистентность к низким концентрациям фторхинолонов ассоциирована с заменами в гене gyrB, а к высоким – с мутациями в гене gyrA. Мутации, происходящие внутри QRDR (особенно в кодонах 88-94) обнаружены у большинства фенотипически устойчивых к моксифлоксацину и офлоксацину изолятов, поэтому их принято считать 88-94 gyrA маркерами фенотипической устойчивости Mtb ко всей группе фторхинолонов, что предполагает наличие перекрестной устойчивости ко всей группе препаратов. Замены в QRDR-A Mtb чаще встречаются в кодонах 94, 89, 90 и 91 и, реже, в кодонах 88 и 74. Замены QRDR-В больше отмечены в кодонах 500, 538, 539 и 540 (кодоны 461, 499, 500 и 501 в новой системе нумерации). При этом замены N538D и E540V ассоциированыс высокимуровнем устойчивости ко всем ФХ, а замена A90V часто ассоциирована с устойчивостью к ципрофлоксацину и офлоксацину. Наличие мутации в QRDR gyrB (в кодонах 500, 538, 539 и 543), не встречаются у диких типов Mtb, поэтому можно предположить, что они также являются маркерами резистентности ко всей группе фторхинолонов.
В клинической практике рекомендовано определять лекарственную устойчивость ко всем имеющимся фторхинолонам, несмотря на риск развития перекрестной устойчивости. Недостаточно изученные области генов gyrA и gyrB могут содержать мутации, объясняющие фенотипическую устойчивость штаммов Mtb к ФХ при отсутствии генетических маркеров.
С помощью полногеномного секвенирования были выявлены мутации, возникающие за пределами региона QRDR, также связаны с устойчивостью к ФХ, при этом мутации за пределами QRDR-встречаются чаще, чем за пределами QRDR-A. Около 15-18% штаммов Mtb, устойчивых к ФХ, без идентифицированных мутаций, могут обладать альтернативными механизмами устойчивости.
Таким образом, наличие гетерорезистентности возбудителя туберкулеза к фторхинолонам свидетельствует об активном формировании его устойчивости к этой группе препаратов в современных условиях.
Диагностика туберкулёза – процесс многоступенчатый и сложный. Применение молекулярно-генетических и фенотипических (культуральных) методов диагностики позволяет уже до начала лечения оценить риски развития лекарственной устойчивости штаммов M. tuberculosis. Комплексная диагностика основана на комбинации молекулярно-генетических методов и культурального анализа для выявления возбудителя и определения его лекарственной чувствительности.
Заключение. Анализ современных исследований показывает зависимость лекарственной устойчивости микобактерий от концентрации фторхинолонов, при этом чаще всего резистентность к низким концентрациям фторхинолонов ассоциирована с заменами в гене gyrB, а к высоким – с мутациями в гене gyrA. При этом наиболее значимыми полиморфизмами, ассоциированными с устойчивостью к фторхинолонам выделяют замены 88, 90, 91, 94, 126 в кодонах в гене gyrA и 539, 543, 500, 538 в гене gyrB. Также установлено и описано, что помимо основных изученных регионов генов gyrA и gyrB, ассоциированных с фенотипической лекарственной устойчивостью к фторхинолонам, есть участки, недостаточно изученные на данный момент. Эти участки невозможно диагностировать в условиях клинической работы бактериологических лабораторий противотуберкулёзных учреждений.
Повышение эффективности лечения больных туберкулезом с ЛУ возбудителя может быть достигнуто за счет использования в стандартных схемах химиотерапии резервных антибактериальных препаратов - фторхинолонов третьего и четвертого поколений. Однако, бесконтрольное применение фторхинолонов в общей терапевтической практике способствует развитию резистентности у M. tuberculosis и к этим препаратам.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы