Циркулирующие микроРНК тромбоцитарного происхождения как потенциальные биомаркеры STEMI у пациентов с гипертонической болезнью
Aннотация
Актуальность: Циркулирующие микроРНК (ц-микроРНК) тромбоцитарного происхождения в последнее десятилетие активно изучаются как перспективные биомаркеры сердечно-сосудистых заболеваний (ССЗ), так как активация тромбоцитов занимает ключевое место в патогенезе ССЗ. Цель исследования:Сравнить профили ц-микроРНК тромбоцитарного происхождения у пациентов с неосложненной гипертонической болезнью (ГБ) и у пациентов с ГБ и острым инфарктом миокарда с подъемом сегмента ST (STEMI). Материалы и методы:В исследование было включено 20 пациентов с неосложненной ГБ и 15 пациентов с наличием ГБ и STEMI. Не менее 90% участников в каждой группе принимали антиагрегантную терапию. У каждого пациента был взят образец крови в пробирку c антикоагулянтом CTAD и получена плазма крови с помощью двухэтапного центрифугирования. Степень гемолиза образцов плазмы была определена спектрофотометрически. Из образцов плазмы была выделена микроРНК, которая использовалась для обратной транскрипции и определения относительного уровня восьми основных ц-микроРНК тромбоцитарного происхождения (miR-223-3p, miR-126-3p, miR-21-5p, miR-24-3p, miR-320a-3p, miR-191-5p, miR-150-5p и miR-23a-3p) с помощью количественной ПЦР по технологии TaqMan Advanced (Thermo Fisher Scientific Inc., США). Были рассчитаны нормированные относительные уровни экспрессии для каждой ц-микроРНК. Статистически значимыми считались различия при p <0,05 (тест Манна-Уитни). Результаты:Группы пациентов не различались по возрасту, ИМТ, количеству тромбоцитов, липидному профилю и степени гемолиза образцов плазмы. Не было обнаружено различий между соотношением микроРНК тромбоцитарного и эритроцитарного происхождения между группами пациентов. Не было обнаружено статистически значимых различий в относительных уровнях ц-микроРНК между группами исследования. Анализ главных компонент и тепловой карты экспрессии микроРНК в образцах показал деление образцов на группы в большей степени по степени гемолиза, чем по наличию/отсутствию STEMI. Заключение:В исследованной выборке пациентов с ГБ влияние гемолиза образцов плазмы на профили ц-микроРНК тромбоцитарного происхождения было более выражено, чем наличие STEMI
Введение. Ишемическая болезнь сердца (ИБС) является одной из наиболее распространенных причин как общей, так и сердечно-сосудистой смертности в мире [1, 2, 3]. Формой ИБС, требующей неотложной госпитализации, является острый коронарный синдром (ОКС). Как нестабильная стенокардия, так и острый инфаркт миокарда (ОИМ) с подъемом сегмента ST (STEMI) и ОИМ без подъема сегмента ST (NSTEMI) могут привести к фатальному осложнению ИБС – внезапной сердечной смерти (ВСС).
Гипертоническая болезнь (ГБ) является общепризнанным и широко распространенным фактором риска ОКС и сопутствующих фатальных и нефатальных сердечно-сосудистых осложнений [4, 5].
Таким образом, профилактика и оценка риска ОКС являются важнейшими задачами в области общественного здравоохранения. Наиболее распространенной причиной ишемии при ОКС является эрозия нестабильной атеросклеротической бляшки и формирование на ее поверхности окклюзирующего тромба [6]. Ключевую роль в патогенезе ОКС играют тромбоциты, что служит фундаментальной основой для широкого внедрения в настоящее время двойной антитромбоцитарной (антиагрегантной) терапии аспирином и ингибиторами рецепторов P2Y12 [7]. Повышенная активация тромбоцитов является ранним маркером ОКС [8, 9]. Уровень ряда белковых биомаркеров активации тромбоцитов, таких как P-селектин, растворимый гликопротеин V (sGPV), бета-тромбоглобулин (β-TG), липопротеин-ассоциированная фосфолипаза A2 (Lp-PLA2), секреторная фосфолипаза A2 (sPLA2), растворимый лиганд CD40 (sCD40L), а также средний объем тромбоцитов и наличие крупных тромбоцитов, изменены у пациентов с наличием ИБС по сравнению с контрольными группами [10, 11, 12]. Метаболические пути, регулирующие активность тромбоцитов и приводящие к коронарной окклюзии, занимают центральное место в патогенезе ОКС. Поиск новых биомаркеров (в том числе небелковых), отражающих состояние тромбоцитов и их активацию, является приоритетной задачей в исследованиях для диагностики и прогноза ОКС.
Некодирующие РНК представляют большой интерес в качестве небелковых биомаркеров ССЗ, так как они участвуют в регуляции процессов патогенеза ССЗ и могут быть обнаружены в биологических жидкостях [13]. К некодирующим РНК относятся короткие некодирующие РНК (в частности, микроРНК), длинные некодирующие РНК и кольцевые РНК. За последнее десятилетие внеклеточные циркулирующие микроРНК (ц-микроРНК) были описаны как потенциальные биомаркеры различных патологических состояний, что выделило изучение ц-микроРНК для диагностических и прогностических целей как отдельную масштабную область постгеномных исследований для биомедицины [14]. Стабильность микроРНК в плазме, их связь с патогенезом сердечно-сосудистых заболеваний (ССЗ) и специфическое изменение их профилей при различных сердечно-сосудистых патологиях позволяют рассматривать ц-микроРНК в качестве перспективных диагностических биомаркеров в кардиологии. Ассоциация ц-микроРНК с наличием таких ССЗ, как фибрилляция предсердий, сердечная недостаточность, ишемическая болезнь сердца и инфаркт миокарда подтверждается большим количеством исследований, опубликованных за последнее десятилетие [15, 16, 17]. Некоторые микроРНК участвуют в регуляции патологических процессов в атерогенезе [18]. Как и в случае с белковыми биомаркерами ОКС, изменения в циркулирующих уровнях микроРНК могут происходить как в результате различных процессов, связанных с атерогенезом, так и в результате повреждения миокарда [18, 19].
В последнее время особый фокус исследования ц-микроРНК при сердечно-сосудистых заболеваниях сместился на изучение микроРНК как маркеров активации тромбоцитов. Во внеклеточной фракции микровезикул, которые являются одними из основных носителей ц-микроРНК, большую часть представляют микровезикулы тромбоцитарного происхождения [20, 21]. Выделяют отдельную группу ц-микроРНК, ассоциированных с тромбоцитами и их функцией и участвующих в регуляции сосудистого гомеостаза и воспаления. Наиболее часто в этом отношении упоминаются около десятка микроРНК, включая miR-223-3p, miR-126-3p, miR-150-5p, miR-21-5p, miR-24-3p, miR-23a-3p, miR-191-5p и miR-320a-3p, которые также входят в топ 10 микроРНК, обнаруживаемых в тромбоцитах [22-26]. Наличие этих микроРНК в плазме в первую очередь обусловлено их тромбоцитарным происхождением, в частности за счет секреции микроРНК-содержащих микровезикул при активации тромбоцитов [26, 27, 28]. Было показано, что относительные уровни таких микроРНК в плазме изменяются при активации тромбоцитов, а также при приеме лекарственных препаратов, влияющих на функцию тромбоцитов, в частности антикоагулянтов и антиагрегантов [29, 30, 31]. Наиболее распространенной микроРНК в тромбоцитах является miR-223-3p. Она регулирует экспрессию рецептора P2Y12, который имеет решающее значение для агрегации тромбоцитов, секреции гранул, а также роста и стабильности тромба [23, 25, 32]. Для miR-126 также была подтверждена роль в регуляции функций тромбоцитов за счет влияния на экспрессию P2Y12, а также регуляции выработки тромбина [33, 34]. Предположение о том, что микроРНК, ассоциированные с тромбоцитами, могут также быть биомаркерами различных ССЗ, подтверждается рядом исследований. В частности, было показано, что уровни miR-126 и miR-223 коррелируют с функциональными тестами тромбоцитов у пациентов с ОКС и могут быть использованы для оценки реакции на антитромбоцитарную терапию [35, 36, 37]. Было обнаружено, что уровни этих ц-микроРНК в плазме обладают высокой предсказывающей ценностью для сердечно-сосудистых событий у пациентов с ССЗ [38, 39]. Было показано, что уровни miR-223, miR-126 и miR-150 изменены в плазме у пациентов с ОИМ по сравнению с контрольной группой [40]. Кроме того, внутриклеточные уровни экспрессии miR-223 и miR-126 были снижены более чем в 2 раза в тромбоцитах с высокой активацией по сравнению со слабоактивированными тромбоцитами у пациентов с ОКС на фоне приема антиагрегантной терапии, что позволяет предполагать возможность их специфической секреции из тромбоцитов в плазму [41].
Так как на изучение ц-микроРНК могут влиять различные пре-аналитические факторы [23, 42], некоторые предыдущие исследования были сфокусированы на подборе условий для минимизации этого влияния при изучении микроРНК, ассоциированных с тромбоцитами. Было показано, что тип антикоагулянта в пробирке для забора крови при получении плазмы может повлиять на активацию тромбоцитов in vitro и привести к смещению профилей ц-микроРНК тромбоцитарного происхождения [22, 43]. Исследования показали, что при изучении ц-микроРНК предпочтительнее использовать антикоагулянты на основе цитрата. Также крайне важно оценивать степень гемолиза в образцах плазмы, так как избыточное разрушение эритроцитов может привести к смещению профилей ц-микроРНК, увеличивая долю микроРНК эритроцитарного происхождения [43].
В данном исследовании мы изучали, каким образом наличие STEMI – одного из типов ОКС – у пациентов с наличием гипертонии влияет на профили ц-микроРНК, ассоциированных с активацией тромбоцитов и имеющих потенциальное тромбоцитарное происхождение в плазме. Проводя совокупный анализ большинства микроРНК тромбоцитарного происхождения, мы учитывали опыт предыдущих исследований по влиянию пре-аналитических факторов на уровни ц-микроРНК в плазме.
Материалы и методы исследования. Набор участников исследования был проведен в соответствии с этическими принципами Хельсинской декларации. Проведение исследования было одобрено локальным этическим комитетом Сеченовского Университета 07.07.2022, протокол № 14-22. От каждого участника исследования было получено письменное добровольное информированное согласие на участие. Диагноз пациентов ставился врачами-кардиологами Университетской клинической больницы (УКБ) №1 Института клинической медицины им. Н.В. Склифосовского Сеченовского Университета и ГБУЗ города Москвы «Городская клиническая больница имени С.С. Юдина Департамента здравоохранения города Москвы».
В исследование были включены мужчины и женщины в возрасте от 40 до 90 лет, из которых сформированы две группы: пациенты с неосложненной ГБ (эссенциальная форма артериальной гипертензии (АГ)), у которых по результатам амбулаторного обследования (нагрузочное тестирование) не было показаний для проведения коронароангиографии (КАГ) и пациенты c верифицированной ранее ГБ, экстренно госпитализированные в отделение интенсивной терапии и реанимации стационара в связи с развитием ОИМ с подъемом сегмента ST (STEMI).
Проводился стандартный осмотр пациента с регистрацией артериального давления (АД) и суточное мониторирование АД, по результатам которого, в соответствии с клиническими рекомендациями Российского кардиологического общества «Артериальная гипертензия у взрослых» (2020), верифицировалась артериальная гипертензия (АГ). Определялись среднесуточные значения систолического (САД) и диастолического (ДАД) давления, среднесуточная ЧСС, а также среднедневные и средне-ночные значения АД и степень снижения АД в ночные часы. Далее пациентам с АГ назначалась гипотензивная терапия, не препятствующая проведению нагрузочного теста (бета-адреноблокаторы и недигидропиридиновые антагонисты кальция не использовались). После суточного мониторирования АД (СМАД) проводилась трансторакальная эхокардиография (УЗИ сердца), определялись размеры камер сердца, состояние клапанного аппарата, степень регургитации на всех клапанных структурах, наличие диастолической дисфункции левого желудочка, фракция выброса левого желудочка. При этом исключалось наличие нарушений локальной и глобальной сократимости. Пациенты с АГ и гипертрофией миокарда левого желудочка (ГЛЖ) расценивалась, как пациенты со 2 стадией ГБ. После проведения СМАД и УЗИ сердца проводился нагрузочный стресс-тест: в группу пациентов с неосложненной ГБ были отобраны больные, у которых результат этого теста был отрицательным (без признаков стресс- индуцированной ишемии миокарда) и, таким образом, вероятность значимого коронарного атеросклероза была низкой, следовательно, не было показаний к проведению коронароангиографии. У этих пациентов в анамнезе не было инсультов и транзиторных ишемических атак. Ни один из пациентов этой группы не предъявлял жалобы на дискомфорт или давящие боли в области сердца, связанные с нагрузкой. Однако с учётом того, что ГБ является фактором риска ИБС, в том числе немой ишемии миокарда, всем пациентам с ГБ проводился нагрузочный тест.
Критериями исключения из исследования были: любая тяжелая сопутствующая патологии (острая и декомпенсированная хроническая легочная, почечная и печеночная недостаточность; декомпенсированный сахарный диабет); впервые выявленное онкологическое заболевание или рецидив имеющейся ранее злокачественной опухоли; алкогольная и наркотическая зависимость; неспособность или нежелание дать письменное согласие на участие в исследовании.
У каждого участника исследования были проанализированы: пол, возраст, индекс массы тела (ИМТ), степень и стадия ГБ, наличие ОИМ, уровень тропонина при подтверждении ОИМ, показатели липидного спектра крови (общий холестерин; холестерин липопротеидов высокой плотности (ЛПВП) и низкой плотности (ЛПНП)), варианты лекарственной терапии: прием антиагрегантов (клопидогрела и/или аспирина), ингибиторов ангиотензинпревращающего фермента (иАПФ), статинов, β-адреноблокаторов, блокаторов кальциевых каналов, наличие нарушения толерантности к глюкозе или сахарного диабета. Все пациенты со STEMI догоспитально получали клопидогрел и/или аспирин. В соответствии с консенсусом, принятым для универсальной диагностики ОИМ [44], повышение уровня кардиального тропонина выше 99 перцентиля от верхней границы нормы считалось признаком повреждения миокарда. Так как важным параметром, влияющим на активацию тромбоцитов in vivo и на профили микроРНК в плазме, является прием антиагрегантов [29, 30, 31], набор групп был организован таким образом, чтобы более 80% пациентов из каждой группы систематически принимали антиагрегантную терапию (ацетилсалициловая кислота (АСК) и/или клопидогрел) во время участия в исследовании. Такая особенность набора групп была введена для минимализации возможного сдвига профилей микроРНК из-за неоднородности групп по фактору наличия антиагрегантной терапии, так как данный вид терапии присутствует у подавляющего большинства пациентов с ИБС и ОИМ.
Для забора крови использовались вакуумные пробирки VACUETTE (Greiner Bio-One, Австрия) с CTAD-системой (лимонная кислота, теофиллин, аденозин и дипиридамол) с двойной стенкой 3,5 мл, крышка голубая, 13х75 мм. Ранее было показано, что данный тип пробирок вносит наименьший сдвиг между ц-микроРНК тромбоцитарного и эритроцитарного происхождения и приводит к наименьшей активации тромбоцитов invitro [22, 43]. У каждого участника исследования единовременно натощак в утреннее время (с 08:00 до 12:00) был произведен забор венозной крови. Забор крови производился в строгом соответствии с протоколом. У пациентов с наличием STEMI забор крови производился в течение 10 минут после госпитализации до назначения антиагрегантов-ингибироров P2Y12, рекомендованных при лечении STEMI (тикагрелор или прасугрел) в стационаре, и до проведения коронароангиографии с внутривенным введением гепарина. Сразу после забора крови пробирка переворачивалась как минимум 10 раз и хранилась при комнатной температуре до первого центрифугирования. Пробирки были подвергнуты центрифугированию на скорости 2500 g в течение 10 мин при комнатной температуре в портативной настольной центрифуге Apexlab 80-2S. После центрифугирования, верхняя фаза плазмы над лейкоцитарной пленкой для каждого образца была перенесена в стерильную коническую пробирку объемом 15 мл. Пробирки были подвергнуты вторичному центрифугированию на скорости 2500 g в течение 10 мин при комнатной температуре в центрифуге Apexlab 80-2S. После центрифугирования, две аликвоты надосадочной жидкости в количестве 600 мкл от каждого образца были перенесены в две микроцентрифужные пробирки объемом 2 мл. Эти пробирки были подписаны и помещены в низкотемпературный холодильник, и хранились при температуре -80°C до выделения микроРНК. Отдельная аликвота плазмы от каждого образца объемом 20 мкл была отобрана в микропробирку объемом 200 мкл и использовалась для спектрофотометрической оценки степени гемолиза эритроцитов с использованием системы NanoDrop 2000 (Thermo Fisher Scientific Inc., США). 2 мкл плазмы помещались на кювету спектрофотометра, и проводилось измерение оптической плотности на длинах волн 385 нм (референсное значение) и 414 нм (пик оксигемоглобина). На основании этих значений для каждого образца был рассчитан коэффициент гемолиза (Hemolysis score, HS) в соответствии с методикой Appierto и соавторов [45]. Коэффициенты гемолиза приведены в таблице 1 с метаданными участников исследования. Критерием исключения для образцов плазмы являлось наличие визуально детектируемого гемолиза в образце плазмы (красный или розоватый оттенок образца) и/или значение HS, превышающее 0,2.
Для выделения микроРНК использовался набор NextPrep Magnazol cfRNA Isolation Kit (Perkin Elmer, США). Фракция ц-микроРНК была выделена из 600 мкл плазмы в соответствии с рекомендациями производителя набора. Финальный объем образца микроРНК составлял 15 мкл. Образцы микроРНК были помещены в низкотемпературный холодильник и хранились при температуре -80°C до этапа анализа экспрессии микроРНК с помощью количественной ПЦР.
Образцы микроРНК в количестве 2 мкл были использованы для синтеза кДНК с помощью набора TaqMan Advanced miRNA cDNA Synthesis Kit (Thermo Fisher Scientific Inc., США). Были проанализированы 10 микроРНК, для которых ранее были показаны наиболее вероятные источники происхождения в плазме: 8 микроРНК тромбоцитарного происхождения (miR-223-3p, miR-126-3p, miR-150-5p, miR-21-5p, miR-24-3p, miR-23a-3p, miR-191-5p и miR-320a-3p) и 2 микроРНК эритроцитарного происхождения (miR-451a и miR-92a-3p), а также референсная микроРНК miR-16-5p.
С помощью наборов ТaqMan Fast Advanced Master Mix и TaqMan Advanced miRNA Assays A25576 (Thermo Fisher Scientific Inc., США) была проведена количественная ПЦР с использованием прибора QuantStudio 5 в 96-луночных ПЦР-планшетах MicroAmp с оптической пленкой, в режиме "Fast" со следующей программой: активация фермента -20 с при 95 °C; 45 циклов, денатурация – 1 с при 95 °C, отжиг/элонгация – 20 с при 60 °C. Данные ПЦР получали с помощью программы QuantStudio Design and Analysis Software v1.4.1 (Thermo Fisher Scientific, США). Значения пороговых циклов (Cq) рассчитывали с использованием автоматического значения "Baseline" и экспериментально установленного значения "Threshold", равного 0,1 для всех анализируемых мишеней микроРНК. Измерения Cq проводились в одной технической копии для каждой мишени микроРНК в отдельном образце. При отсутствии сигнала и кривой амплификации, значение Cq принималось равным 45. Расчет относительных уровней экспрессии ц-микроРНК приоизводился на основе их значений Cq и значения Cq референсной микроРНК miR-16-5p по формуле: exp(miRNA) = 2^(Cq(микроРНК) – Cq(miR-16-5p)), где exp(miRNA) – относительный уровень экспрессии микроРНК, Cq(miRNA) – пороговый цикл амплификации данной микроРНК, Cq(miR-16-5p) – пороговый цикл амлификации референсной микроРНК. В качестве референсной микроРНК была выбрана miR-16-5p, так как ее уровень относительно стабилен в плазме, и она широко используется в качестве референсной микроРНК в исследованиях ассоциации ц-микроРНК с патологиями [46, 47]. Однако, использование данной микроРНК в качестве референсной имеет свои ограничения. Из литературных данных известно, что уровень miR-16-5p может повышаться вследствие гемолиза образцов, так как miR-16-5p входит в топ 10 микроРНК эритроцитов [48, 49]. Использование данной микроРНК в качестве референсной является ограничением данного исследования, однако оно частично преодолевается тем фактом, что мы измеряли степень гемолиза образцов с помощью спектрофотометрии, а также оценивали влияние гемолиза на соотношение микроРНК эритроцитарного и тромбоцитарного происхождения во всех исследованных образцах. Влияние гемолиза эритроцитов на ц-микроРНК оценивалось на основе выявленного методом ПЦР соотношения miR-451a и miR-23a-3p как разницы между значениями Cq по формуле: miR Ratio = Cq(hsa-miR-23a-3p)-Cq(hsa-miR-451a), как было описано ранее Blondal и соавторами [50]. Соотношение между микроРНК эритроцитарного и тромбоцитарного происхождения (RBC-Platelet miRNA Ratio), рассчитывалось как разница между средними значениями Cq всех анализируемых микроРНК, потенциально ассоциированных с эритроцитами (miR-451a, miR-92a-3p и miR-16-5p), и всех микроРНК, потенциально ассоциированных с тромбоцитами (miR-223-3p, miR-126-3p, miR-150-5p, miR-21-5p, miR-24-3p, miR-23a-3p, miR-191-5p и miR-320a-3p).
Статистический анализ и визуализация данных проводились с помощью программы IBM SPSS Statistics (версия 26) и программной среды R с использованием пакетов PCATools, pheatmap и ggplot2. Для проверки нормального распределения сравниваемых величин использовался тест Колмогорова-Смирнова (при p >0,05 гипотеза об отсутствии нормального распределения отвергалась). Для величин с нормальным распределением для получения статистической значимости различий между группами исследования использовался t-тест (t-критерий Стьюдента), для величин с отсутствием нормального распределения (относительные уровни микроРНК) – непараметрический тест Манна-Уитни. Коэффициенты статистической значимости различий для порядковых качественных величин были получены с помощью Хи-квадрат. Статистически значимыми считались различия при p <0,05 для каждого использованного статистического теста. Для всех образцов в данном исследовании использовался один и тот же лабораторный процесс и протокол анализа данных.
Результаты и их обсуждение. Были сформированы следующие группы исследования:
1. Пациенты с наличием неосложненной ГБ без ИБС (n = 20, код группы: HT);
2. Пациенты с наличием ГБ и STEMI (n = 15, код группы: MI).
Общие и клинические характеристики групп пациентов приведены в таблице 1. Пациенты с наличием STEMI имели более высокий средний возраст (p <0,05, t-тест), что согласуется с эпидемиологическими данными по представленности ОИМ в различных возрастных группах [3]. Между группами исследования не было выявлено статистически значимых различий в ИМТ, количестве тромбоцитов, параметрами липидного профиля и степени гемолиза образцов плазмы (p >0,05, t-тест). Распределение вышеуказанных характеристик в группах исследования приведено на рисунке 1. В каждой группе не менее половины пациентов имели гиперхолестеринемию (повышенный уровень холестерина более чем 5 ммоль/л). Подавляющее большинство пациентов с неосложненной ГБ принимали аспирин, статины и ИАПФ. В отличие от пациентов с неосложненной ГБ, большинство пациентов с наличием STEMI помимо аспирина принимали клопидогрел как компонент двойной антиагрегантной терапии.
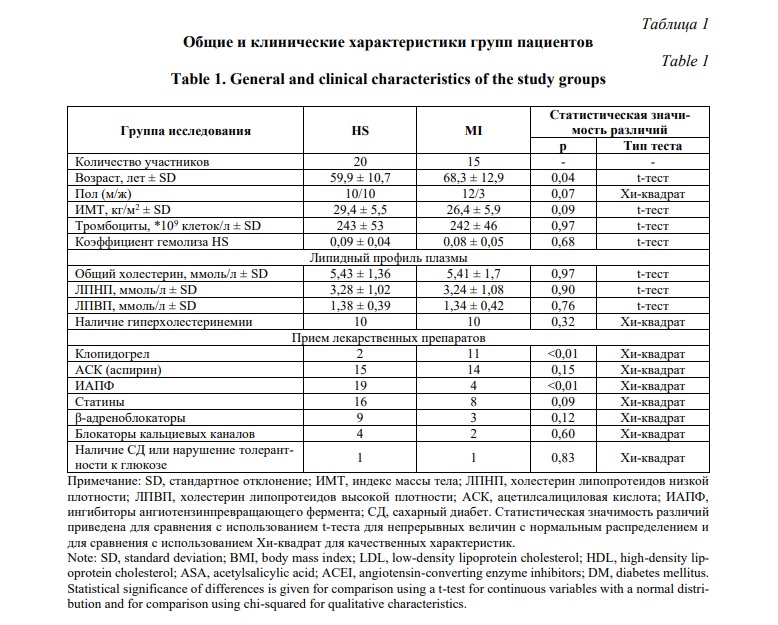
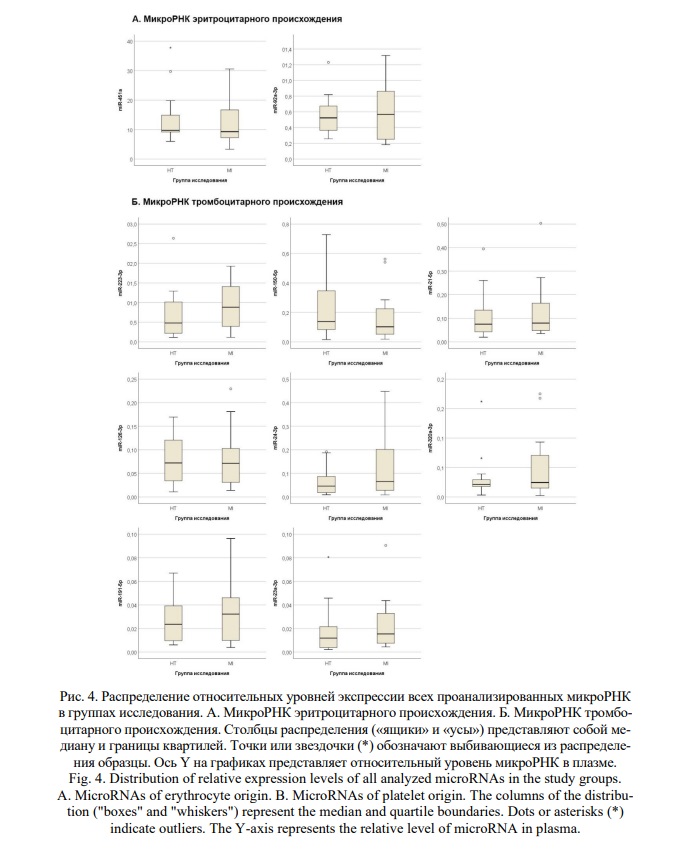
Все микроРНК уверенно детектировались во всех образцах с помощью ПЦР со средними значениями Cq от 15,1 ± 3,3 для микроРНК с наибольшей экспрессией miR-451a до 24,9 ± 3,0 для микроРНК с наиболее низкой экспрессией miR-23a-3p.
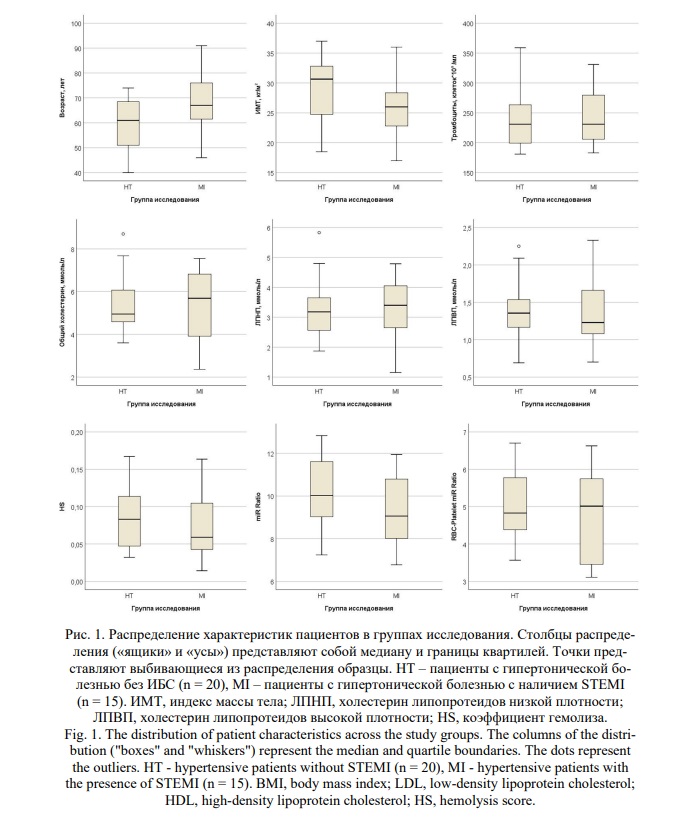
Был проведен анализ главных компонент (PCA) на основании логарифмов нормализованных уровней экспрессии микроРНК. Первая главная компонента (PC1) объясняла 71,4% вариабельности уровней микроРНК в выборке (Рис. 2, А). Визуализация главных компонент PC1 и PC2 (Рис. 2, Б) не показала разделения на кластеры в соответствии с группами исследования. Был проанализирован вклад таких характеристик, как возраст, HS, группа исследования и батч-эффект (номер запуска ПЦР-прибора, в течение которого была одновременно проанализирована каждая группа образцов) в формирование главных компонент в PCA. Было выявлено, что наибольший вклад в вариабельность профилей микроРНК вносит степень гемолиза (HS) (Рис. 2, В).
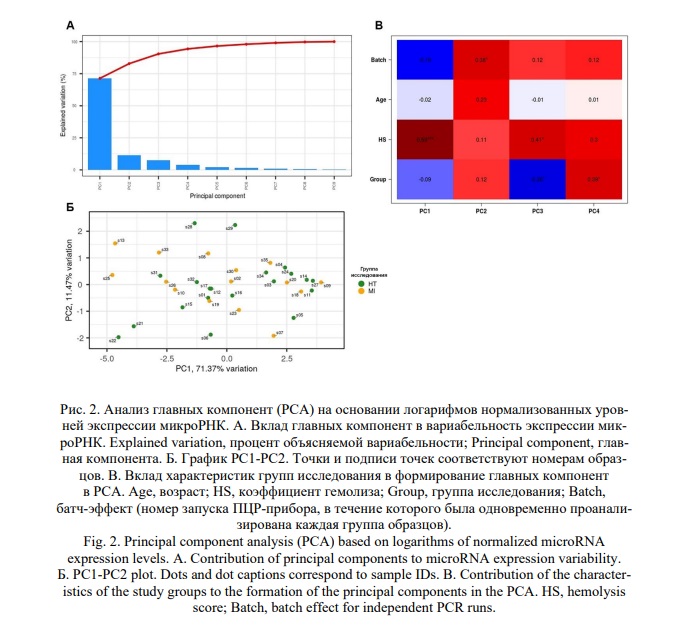
Так как степень гемолиза в образцах плазмы могла влиять на профили микроРНК, мы проанализировали, как степень гемолиза, измеренная спектрофотометрически [45], соотносилась с характеристиками гемолиза, полученными с помощью анализа микроРНК и сдвигом между микроРНК эритроцитарного и тромбоцитарного происхождения (miR Ratio [50] и RBC-Platelet miR Ratio). Между группами исследования не было обнаружено статистически значимых различий для коэффициента гемолиза, измеренного спектрофотометрически (HS), а также для величин miR Ratio и RBC-Platelet miR Ratio (p <0,05, тест Манна-Уитни, распределение величин в группах исследования показано на рисунке 1). Были обнаружены высокие корреляции между HS и данными величинами (коэффициент корреляции по Спирману 0,732 и 0,706, соответственно, p <0,01). На рисунке 3 представлены графики зависимости между HS и miR Ratio (А), и между HS и RBC-Platelet miR Ratio (Б). Полученные данные согласуются с предыдущими наблюдениями о влиянии степени гемолиза на профили ц-микроРНК, в частности с тем, что даже при незначительном повышении степени гемолиза увеличиваются уровни некоторых ц-микроРНК эритроцитарного происхождения [22, 49-52].
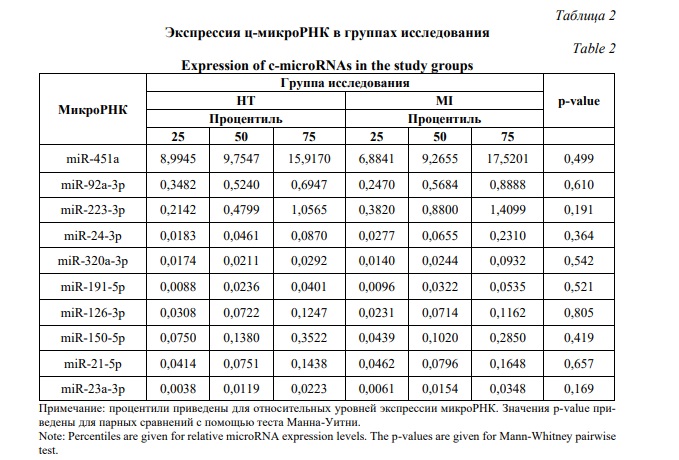
Мы не обнаружили статистически значимых различий в относительных уровнях проанализированных микроРНК между сравниваемыми группами пациентов (тест Манна-Уитни, p <0,05). Распределение относительных уровней всех проанализированных микроРНК в группах исследования показано на рисунке 4. Процентили для относительных уровней экспрессии микроРНК и значения p-value для теста Манна-Уитни приведены в таблице 2. Из всех проанализированных микроРНК, для miR-223-3p обнаруживался наиболее заметный тренд на повышение уровня экспрессии у пациентов со STEMI (повышение на 18%), однако без статистически значимых различий между группами сравнения. Полученные данные не подтверждают данные предыдущих исследований, показавших изменение уровней ряда ц-микроРНК тромбоцитарного происхождения при ОКС [38, 40, 53]. В данном исследовании не оценивалось влияние антиагрегантной терапии на профили ц-микроРНК, так как подавляющее большинство пациентов в каждой группе (более 80%) принимали антиагреганты. Возможно, прием антиагрегантной терапии некоторым образом «сгладил» профили микроРНК тромбоцитарного происхождения у пациентов с наличием и отсутствием STEMI за счет подавления активации тромбоцитов.
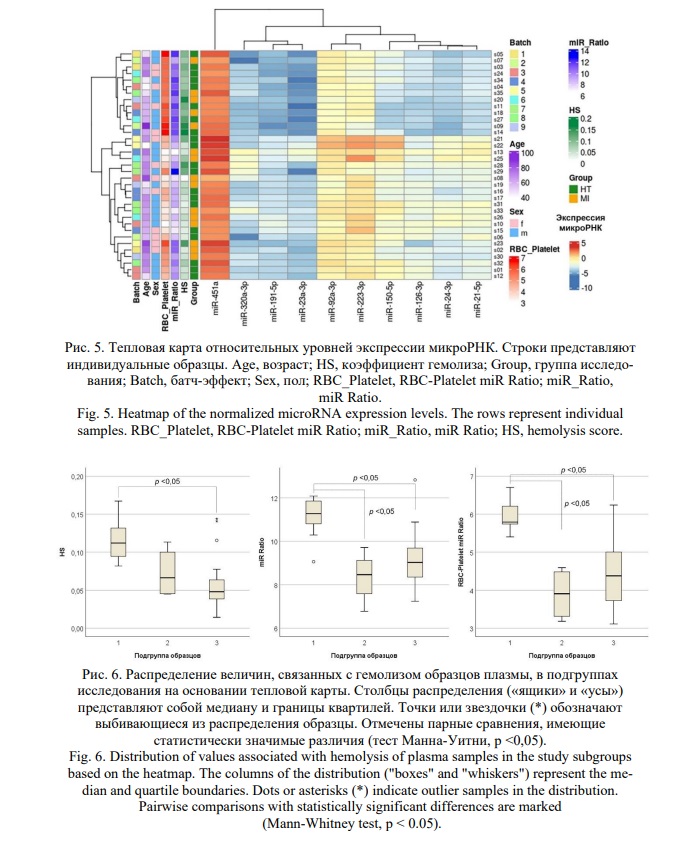
Для того чтобы понять, каким образом образцы распределялись на группы в зависимости от профиля ц-микроРНК плазмы, была построена тепловая карта на основании относительных уровней проанализированных микроРНК в плазме участников исследования (Рис. 5). На тепловую карту были добавлены характеристики групп исследования: пол, возраст, батч-эффект и характеристики, отражающие степень гемолиза: HS, miR Ratio и RBC-Platelet miR Ratio. Кластеризация образцов на тепловой карте не соответствовала делению на группы исследования. Обособленная группа из 13 образцов, составляющая верхнюю часть тепловой карты, характеризовалась сниженными уровнями микроРНК тромбоцитарного происхождения. Данная группа не была однородной ни по полу, ни по возрасту, ни по влиянию батч-эффекта, однако образцы в этой группе имели повышенные значения коэффициента гемолиза и соотношения между микроРНК эритроцитарного и тромбоцитарного происхождения (Рис. 5). Еще одна группа образцов, находящаяся в середине тепловой карты (образцы s21, s22, s13 и s25), имела повышенные уровни практически всех проанализированных микроРНК. Образцы в этой группе имели низкие значения коэффициента гемолиза и соотношения между микроРНК эритроцитарного и тромбоцитарного происхождения. Оставшаяся группа образцов (n = 18), занимающая нижнюю часть тепловой карты, была гетерогенной как по всем характеристикам метаданных, так и по параметрам, характеризующим гемолиз. Проанализировав распределение характеристик, связанных с гемолизом в этих трех подгруппах образцов, мы обнаружили статистически значимое повышение HS, miR Ratio и RBC-Platelet miR Ratio в первой подгруппе (n = 13) по сравнению с другими подгруппами (тест Манна-Уитни, p <0,05, Рис. 6). Таким образом, можно сделать вывод о том, что в исследованной выборке пациентов кардиологической клиники гемолиз образцов плазмы и его влияние на соотношение микроРНК эритроцитарного и тромбоцитарного происхождения были более выраженными факторами влияния на профили микроРНК, чем наличие STEMI у пациентов с гипертонической болезнью.
Данное исследование имеет ряд ограничений. Из факторов, характеризующих состояние тромбоцитов, было проанализировано только их общее количество, которое является одной из характеристик общего анализа крови. Мы не анализировали параметры активации тромбоцитов, их средний объем и долю крупных тромбоцитов, так как данные виды анализа требуют дополнительных условий и не проводятся по умолчанию пациентам кардиологической клиники. Ограничение, касающееся выбора референсной микроРНК для нормализации данных, было описано выше. Кроме того, мы не анализировали кардиоспецифичные микроРНК, такие как miR-1 или miR-133, которые могут быть индикаторами повреждения миокарда по аналогии с сердечными тропонинами [16, 19, 54]. Малая выборка пациентов с наличием STEMI была обусловлена невключением ряда образцов из-за наличия выраженного гемолиза плазмы (визуально обнаруживаемый гемолиз или HS >0,2). Вследствие малого размера выборки пациентов с наличием STEMI, данная группа не была дополнительно стратифицирована по клиническим характеристикам.
Заключение. В данном исследовании мы впервые одновременно проанализировали большую часть спектра микроРНК, ассоциированных с тромбоцитами и их активацией, в группе пациентов с наличием и отсутствием STEMI на фоне ГБ. Методология исследования была построена на новейших знаниях о влиянии пре-аналитических факторов на профили ц-микроРНК. Для снижения потенциального влияния активации тромбоцитов in vitro, при получении плазмы крови использовались пробирки с CTAD. Группы были стандартизованы по критерию приема антиагрегантной терапии. Мы не обнаружили статистически значимых различий в относительных уровнях ц-микроРНК тромбоцитарного происхождения между группами пациентов с неосложненной ГБ без ИБС (n = 20) и пациентов со STEMI на фоне ГБ (n = 15). Было показано, что соотношение между ц-микроРНК тромбоцитарного и эритроцитарного происхождения коррелирует со степенью гемолиза образцов плазмы. Анализ профилей ц-микроРНК показал, что разделение образцов на группы в зависимости от степени гемолиза было более выражено, чем разделение на группы по наличию STEMI. Таким образом, степень гемолиза определяла различия в профилях микроРНК в большей степени, чем наличие STEMI у пациентов с ГБ. Отсутствие различий между группами для некоторых микроРНК тромбоцитарного происхождения, рассматриваемых как потенциальные биомаркеры ОИМ, может быть обусловлено как спецификой методологии данного исследования, так и влиянием пре-аналитических факторов на профили ц-микроРНК плазмы.
Информация о финансировании
Исследование выполнено за счет гранта Российского научного фонда (проект № 21-75-00114).





















Список литературы