Выбор рационального инструментария для анализа полифенолов цветков бессмертника песчаного и листьев артишока колючего в комплексе фармакологических исследований
Aннотация
Актуальность: Патология гепатобилиарной системы включает гетерогенную группу заболеваний печени и желчевыводящей системы, вызванных вирусными, бактериальными и паразитарными инфекциями, новообразованиями, токсичными химическими веществами, в том числе алкоголем, алиментарными погрешностями, нарушениями обмена веществ и сердечной недостаточностью. Одной из базовых групп для фармакологической коррекции данной группы заболеваний является использование гепатопротекторов, препаратов, оказывающих преимущественно избирательное воздействие на печень. Действующим началом большинства растительных гепатопротекторов являются флавоноиды и гидроксикоричные кислоты. К наиболее востребованным растениям – гепатопротекторам, содержащим указанные действующие вещества, можно отнести артишок колючий – Cynara scolymus (L.) и бессмертник песчаный – Helichrysum arenarium (L.) Moench, растение, обладающее желчегонным действием, также способное проявлять гепатопротекторную активность. Цель исследования:Разработка и сравнительная характеристика методик анализа полифенольного состава цветков бессмертника песчаного и листьев артишока колючего в комплексных фармакологических исследованиях с помощью методов ВЭЖХ и капиллярного электрофореза. Материалы и методы:Сумму полифенольных соединений подвергали хроматографическому разделению в градиентном режиме элюирования. Капиллярный электрофорез проводился в варианте мицеллярной электрокинетической хроматографии (МЭКХ). В качестве буферного раствора использовали смесь: боратный буфер 20мМ (рН – 9,3) – бета-циклодекстрин 20 мМ – спирт этиловый (10:10:5). Результаты:Электрофореграммы разделения экстракта из листьев артишока методом МЭКХ, показали наличие 7 компонентов, принадлежащие оксикоричным кислотам и флавоноидам. Доминирующими являются кислота хлорогеновая и лютеолин-7-глюкозид. Аналогичные результаты получены методом ВЭЖХ. На электрофореграмме экстракта цветков бессмертника обнаруживается 9 компонентов, из которых доминирующий принадлежит изосалипурпозиду. Хроматографический анализ экстракта цветков бессмертника показал присутствие тех же компонентов. Заключение:Результаты анализа полифенольного комплекса листьев артишока и цветков бессмертника с помощью капиллярного электрофореза согласуются с данными, полученными в ходе хроматографирования методом ВЭЖХ. Это позволяет сделать вывод, что метод МЭКХ позволяет идентифицировать и проводить количественную оценку каждого компонента в листьях артишока и цветках бессмертника наряду с ВЭЖХ. Причём исполнение анализа с помощью КЭ является более экономически оправданным, по сравнению с ВЭЖХ, поскольку не требует затрат растворителей для подвижной фазы и наличия набора колонок
Ключевые слова: высокоэффективная жидкостная хроматография, капиллярный электрофорез, артишок колючий, бессмертник песчаный, флавоноиды, гидроксикоричные кислоты
Введение. Печень выступает одним из ключевых органов обмена веществ и вовлечена в более чем 500 различных метаболических функций. Она контролирует обмен белков, жиров, углеводов, витаминов, участвует в секреции желчи, детоксикации ксенобиотиков, синтезе жирных кислот, фосфолипидов, холестерина и липопротеидов. Поэтому нарушение функционирования данного органа отражается на работе всего организма в целом. Большинство функций печени осуществляется за счёт клеток её паренхимы – гепатоцитов.
Патология гепатобилиарной системы включает гетерогенную группу заболеваний печени и желчевыводящей системы, вызванных вирусными, бактериальными и паразитарными инфекциями, новообразованиями, токсичными химическими веществами, в том числе алкоголем, алиментарными погрешностями, нарушениями обмена веществ и сердечной недостаточностью. Отличительные особенности терапии подобных заболеваний заключаются в поддержании регенеративного потенциала печени и улучшении обменных процессов в гепатоцитах. Поэтому одной из базовых групп для фармакологической коррекции данной группы заболеваний является использование гепатопротекторов, препаратов, оказывающих преимущественно избирательное воздействие на печень.
Гепатопротекторы ускоряют восстановление клеточной мембраны и, следовательно, самого гепатоцита.
Гепатопротекторы достаточно разнородная группа препаратов, включающая средства, различающиеся как по происхождению, так и по механизму действия. Среди гепатопротекторов на фармацевтическом рынке в настоящее время преобладают гепатопротекторы растительного происхождения.
Действующим началом большинства растительных гепатопротекторов являются флавоноиды и гидроксикоричные кислоты. К наиболее востребованным растениям – гепатопротекторам, содержащим указанные действующие вещества можно отнести расторопшу пятнистую - Silybum marianum (L.) Gaertn. и артишок колючий – Cynarascolymus (L.). Однако, некоторые растения, традиционно используемые как желчегонные, также способны проявлять гепатопротекторную активность, в частности бессмертник песчаный – Helichrysum arenarium (L.) Moench.
У S. marianum (L.) Gaertn. гепатопротекторный эффект реализуется посредством флаволигнанов, компонентов, включающих флавоноидный компонент, сопряжённый с лигнановым.
Единым фармакологическим началом C. scolymus (L.) и H. arenarium (L.) Moench. являются флавоноиды и оксикоричные кислоты, родственные группы соединений, имеющие близкое химическое строение.
H. arenarium (L.) Moench. широко применяется в медицине в качестве желчегонного средства, его цветки являются составной частью различных сборов из них также вырабатывается препарат «Фламин».
Препараты C. scolymus (L.) в последние годы приобрели широкую популярность в отечественной и зарубежной медицине, благодаря своим выраженным гепатопротекторным, желчегонным и гиполипидемическим свойствам и возможности использования в педиатрической практике.
Характерным свойством обоих растительных объектов является их предельно низкая токсичность при выраженной фармакологической активности. Единственным противопоказанием для их назначения является непроходимость желчных путей.
Несмотря на несомненную широкую популярность и терапевтическую значимость, стандартизация настоящих растительных объектов требует оптимизации и совершенствования. Это связано с тем, что согласно отечественной фармакопее, присутствие флавоноидов в цветках бессмертника обнаруживают методом ТСХ, а их количественное содержание рекомендуется проводить методом УФ-спектрофотометрии по реакции с алюминия хлоридом в пересчёте на изосалипурпозид. Однако, с помощью настоящего метода нельзя судить о количестве отдельных компонентов в анализируемом объекте, а только о сумме флавоноидов в целом.
Что касается C. scolymus L., то настоящий объект не включён в отечественную фармакопею, а его стандартизация проводится согласно требованиям Европейской фармакопеи и фармакопеи Великобритании, которые регламентирует содержание в листьях не менее 0,8% хлорогеновой кислоты, определяемой методом ВЭЖХ.
Учитывая нижесказанное, следует отметить, что актуальность настоящего исследования определяется необходимостью разработки методик анализа выбранных объектов, которые позволили бы одновременно охарактеризовать качественный состав основных полифенольных соединений выбранных растительных объектов и проводить оценку количественного содержания ключевых компонентов, являющихся носителями фармакологической активности.
Как известно, любой растительный объект представляет собой многокомпонентную систему, обычно содержащую несколько групп действующих веществ. Из-за такой поликомпонентности возникают трудности в объективной стандартизации того или иного сырьевого объекта. Решение данной проблемы невозможно без глубокого изучения химического состава сырьевого источника с использованием самых эффективных физико-химических методов. Только привлечение современных методов анализа, обеспечивающих разделение и одновременную детекцию позволяет с высокой степенью точности выявлять в составе растительного сырья многочисленных индивидуальных соединений, и обнаруживать из них терапевтически значимые, по которым можно проводить стандартизацию анализируемого образца [1, 2]. К таким методам относится и высокоэффективная жидкостная хроматография.
Однако, в качестве альтернативного и экономически значительно более доступного метода можно использовать капиллярный электрофорез в варианте мицеллярной электрокинетической хроматографии. Настоящий метод не требует применения токсичных растворителей, применяемых в ВЭЖХ как компонентов подвижной фазы, набора дорогостоящих колонок, длительного времени анализа. Применение настоящего метода в фитохимическом анализе в настоящее время ограничено из-за низкой востребованности в практике аналитических лабораторий вследствие исторически сложившегося доминирования метода ВЭЖХ, однако имеет несомненную перспективу.
Цель исследования. Разработка и сравнительная характеристика методик анализа полифенольного состава цветков бессмертника песчаного и листьев артишока колючего в комплексных фармакологических исследованиях с помощью методов ВЭЖХ и капиллярного электрофореза.
Как известно, количественное содержание терапевтически значимых компонентов в растительной матрице коррелирует со степенью выраженности фармакологической активности любого растительного объекта. Поэтому предварительно было необходимо провести анализ и систематизацию литературных данных о фармакологической активности выбранных объектов и обозначить компоненты, ответственные за их терапевтическое действие. Поскольку именно такой подход обеспечит возможность чёткой, объективной оценки качества растительного объекта.
Материалы и методы исследования. В качестве объектов исследования использованы сухие экстракты цветков бессмертника и листьев артишока колючего, при изготовлении которых учитывалась традиционная схема получения сухих экстрактов. Перед анализом сухие экстракты в количестве 0,1 г растворяли в 25 мл спирто-водной смеси и пропускали через фильтр AcrodiscCRPTFE, с мембраной из нейлона (размер пор 0,45 мкм) для освобождения от взвешенных частиц. Полученными растворами заполняли виалы и подвергали хроматографированию.
Хроматографический анализ выполняли на жидкостном хроматографе «AgilentTechnologies 1200 Infinity» с диодно-матричным детектором в обращённо-фазном варианте и градиентном режиме элюирования. Разделение осуществлялось с помощью стальной хроматографической колонки Ascentisexpress C18 100 мм × 4,6 мм, 2,7 мкм (Supelсo).
Градиентное элюирование велось, используя подвижную фазу: (А) – 1%-ный водный раствор кислоты муравьиной, (Б) – спирт этиловый, начальная концентрация фазы А 90% - 0 мин, конечная А 10% - 40 мин;
скорость подвижной фазы – 0,5 мл/мин;
температура колонки – +35оС;
объём вводимой пробы – 10 μl.
Детекцию проводили при рабочих длинах волн: 290 нм, 325 нм, 355 нм, 380 нм, пропорциональных максимумам поглощения искомых компонентов.
Оценку пригодности хроматографической системы осуществляли по регламентируемым в фармакопее параметрам, а именно: числу теоретических тарелок (N), коэффициенту разделения Rs, коэффициенту асимметрии (As), формулы расчёта которых приведены ниже.
Число теоретических тарелок находили по формуле 1:

где µ0,05 – ширина пика на высоте 5.0% от базовой линии, мм;
ƒ – расстояние от начала пика на высоте 5,0% от базовой линии до перпендикуляра, проведенного из его вершины, мм.
Капиллярный электрофорез проводился на приборе для капиллярного электрофореза Agilent 7100 CE, в варианте мицеллярной электрокинетической хроматографии (МЭКХ) с диодно-матричным детектированием.
Подготовка образцов для проведения электрофореза такая же, как и в случае хроматограирования.
Электролитом служила смесь: боратный буферный раствор 20мМ (рН – 9,3) – бета-циклодекстрин 20 мМ – спирт этиловый (10:10:5).
Капилляр
Напряжение на капилляре Сила тока (макс.) Мощность (макс.) Температура капилляра Цикл кондиционирования | :
: : : : : | кварцевый с общей длиной 40 см и эффективной длиной 30 см, внутренний диаметр = 50 µm; +15 кB; 300 мкА; 6 Вт; 20 ± 1°С; 5 мин. 10%-ным раствором кислоты уксусной; 5 мин 0,1 М раствором натрия гидроксида; 5 мин фосфатным буферным раствором; | |
Детектор Длина волны детектирования Реферируемая длина волны | : : : | Диодно-матричный; 325/4 нм; 380/4 нм; 350/4 нм 360/100 нм; |
|
Ввод пробы | : | Гидродинамический – 100 мбар/5 сек; |
|
Время анализа | : | около 30 мин. |
|
Результаты и их обсуждение. Бессмертник песчаный – Helichrysumarenarium (L.) Moench., многолетнее травянистое войлочно-шерстисто-опушенное растение семейства сложноцветные – Asteraceae, широко распространённое по всей степной зоне и в южных районах лесной зоны европейской части России, южных районах Западной Сибири, в степных районах Казахстана. Медицинское значение имеют соцветия, заготавливаемые в начале цветения, а также используемые для производства препарата «Фламин».
Полифенольными компонентами цветков H. arenarium (L.) Moench. являются флавоноиды, представленные флаваноном нарингенином и его 5-моноглюкозидом салипурпозидом в виде двух изомеров (гелихризин А и гелихризин В). Также присутствуют халконовый гликозид изосалипурпозид (изогелихризин), флавон апигенин и его 5-О-глюкозид, флавонол кемпферол в виде 3-диглюкозида и 3-моноглюкозида (астрагалин) [3].
Бессмертник песчаный повышает продукцию желчи, увеличивает холато-холестериновый коэффициент, усиливает тонус желчного пузыря. Расслабляет сфинктеры желчного пузыря и желчевыводящих протоков, увеличивает текучесть желчи. Повышает выделение панкреатического секрете, улучшает кровообращение в кишечнике [4].
Установлено гепатопртекторное действие флавоноидного комплекса бессмертника на модели острой токсичности поражения печени, вызываемое четыреххлористым углеродом, поскольку данная модель по морфологическим и биохимическим показателям подобна жировой дистрофии печени человека. В качестве препарата сравнения использовался «Силибор». Установлено сопоставимое гепатопротекторное действие экстракта бессмертника с препаратом расторопши.
Полифенольный комплекс бессмертника уменьшает процессы цитолиза гепатоцитов, очевидно за счет снижения ПОЛ, что в свою очередь ведет к нормализации желчеобразовательной функции печени [5].
Суммарный полифенольный комплекс цветков бессмертника обладает выраженным гипохолестеринемическим и гипобеталипопротеидемическим свойствами, одновременно существенно снижая содержание холестерина в тканях аорты [6, 7].
Многочисленными исследованиями доказано, что препараты бессмертника в отношении острой токсичности относятся к практически безвредным [8].
Также установлено, что при ежедневном 6-месячном введении препаратов бессмертника лабораторным животным (крысы, кролики) отсутствовали патологические изменения со стороны жизненно важных органов и систем [9].
Артишок колючий – растение, длительное время, использовавшееся в народной медицине многих стран мира, особенно популярное в Латинской Америке, а научный интерес к настоящему объекту возник, когда в 1929 году в его листьях был обнаружен инулин. Первые научные исследования, подтверждающие наличие у артишока активности при атеросклерозе и дискинезии желчевыводящих путей, датируются 50-ми годами 20-го века [10].
Последние научные данные показывают, что препараты артишока стимулируют тонус желчевыводящих путей, способствуя оптимизации эвакуации желчи. Оказывая антиоксидантное и гипохолестеринемическое действие, компоненты артишока проявляют гепатопротекторное действие. Составляющие листьев артишока оказывают противомикробные свойства, в том числе в отношении патогенных грибков [3, 11].
Установлено, что действующей группой веществ в листьях артишока служат вещества фенольного характера, которые увеличивают антиоксидантный потенциал плазмы [12], оберегают от оксидативного стресса, оказывая онкопротекторное действие [13], стимулируют выработку эндотелием оксида азота, важнейшего эндогенного вазодилататора [11].
Кроме того, активация глутатионпероксидазы посредством полифенольных компонентов листьев артишока, предотвращает окисление липопротеидов низкой плотности [14].
Результаты, полученные в испытаниях invivo, показывают, что препараты листьев артишока приводят к существенному спаду печёночных трансаминаз, увеличению концентрации глутатиона в плазме крови лабораторных животных, что улучшает структуру печёночной ткани после её повреждения тетрахлорметаном [3].
Химический состав артишока представлен такими оксикоричными кислотами как: хлорогеновая кислота (3-кофеоилхинная кислота), 1-,3-,4-, и 5-кофеоилхинные кислоты, 1,5-ди-О-кофеоилхинная кислота (цинарин), 1,3-ди-О-кофеоилхинная кислота. Также присутствуют флавоноиды: лютеолин-7-О-рутинозид (сколимозид), лютеолин-7-глюкозид (цинарозид), горький сесквитерпеновый лактон группы гвайанолида – цинаропикрин, придающий горечь артишоку. Из всей суммы полифенолов, доминирующим компонентом является кислота хлорогеновая. Кроме того, в листьях накапливается полифруктозан – инулин [10].
Изучение метаболитов препаратов артишока в ходе фармакокинетических исследований свидетельствует о том, что составные элементы полифенольного комплекса – оксикоричные кислоты и флавоноиды находятся в плазме крови в виде метилированных производных [15].
Изучение механизма действия суммарных извлечений из артишока показывают выраженный желчегонный, гепатопротекторный, антиоксидантный, диуретический и гипохолестеринемический, канцеропротективный эффекты [13, 16].
Перечисленный ряд эффектов реализуется посредством компонента цинарина, оказывающего повышение выделения желчи, уменьшает вязкость желчи и усиливает сократительную активность желчевыводящих путей, а также противосклеротическую и мочегонную виды активности.
О выраженном антиоксидантном действии артишока свидетельствует снижение потери внутриклеточного глутатиона при его употреблении [14].
За антиоксидантное и противовоспалительное действие артишока в первую очередь ответственен флавоноид цинарозид (лютеолин-7-О-глюкозидом).
Препараты артишока блокируют биогенез холестерина в печени. Принято считать, что данный вид активности обусловлен агликонами флавоноидов и кислотой хлорогеновой. Причём указанное действие зависит от активности фермента бета-глюкозидаза, который способствует расщеплению гликозидированных форм флавоноидов [17].
Ингибирование биосинтеза холестерина проявляется за счёт инактивации фермента 3-гидрокси-3-метил-глутарил-КоА-редуктазы инсулином, не воздействуя на другие инсулинзависимые звенья. Причём, инактивация особенно эффективна в экстрактах с большой концентрацией цинарозида, тогда как хлорогеновая кислота менее эффективна [18, 19].
Клинические испытания экстрактов артишока позволили выявить снижение общего содержания холестерина плазмы крови у взрослых пациентов с гиперхолестеринемией, улучшение состояния больных с синдромом раздражённой кишки [20].
Как следует из вышесказанного, основные фармакологические эффекты исследуемых объектов реализуются посредством флавоноидов и оксикоричных кислот, содержание которых как в растительных объектах, так и в биологических жидкостях в основном контролируется с помощью метода ВЭЖХ. Поэтому на следующем этапе настоящих исследований нами проведён сравнительный анализ эффективности определения вышеупомянутых компонентов в исследуемых растительных объектах с помощью методов ВЭЖХ и КЭ. Перспективность такого исследования вызвана необходимостью продемонстрировать возможности метода КЭ наряду с ВЭЖХ, поскольку КЭ отличает от ВЭЖХ в первую очередь значительная экономическая целесообразность.
Электрофореграмма разделения экстракта листьев артишока методом МЭКХ, зарегистрированная при длине волны 350 нм показала наличие 5 компонентов, имеющих одинаковые УФ-профили, принадлежащие оксикоричным кислотам (Рис. 1). Причём зафиксированные УФ-профили отличаются от типовых, характерных для этого класса соединений. Это связано с тем, что разделение проводилось в среде боратного буфера, имеющего рН – 9,2, в котором происходит батохромный сдвиг основной полосы поглощения оксикоричных кислот с 325 нм до 350 нм (Рис. 2).
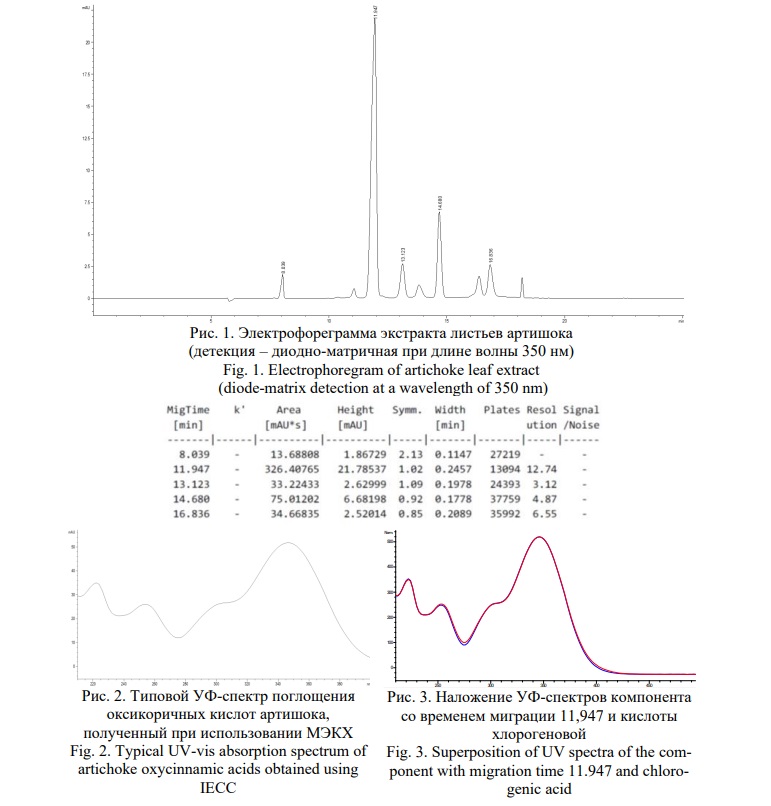
Доминирующий пик на электрофореграмме, имеющий время миграции – 11,946 мин соответствует кислоте хлорогеновой, это доказывается по совпадению времени миграции анализируемого и стандартного образца и полному соответствию УФ-профилей (Рис. 3). Пик со временем миграции 14,680 мин соответствует цинарину. Остальные пики принадлежат изомерам указанных кислот.
Электрофореграмма того же образца, зафиксированная при длине волны 380 нм приведена на рисунке 4.
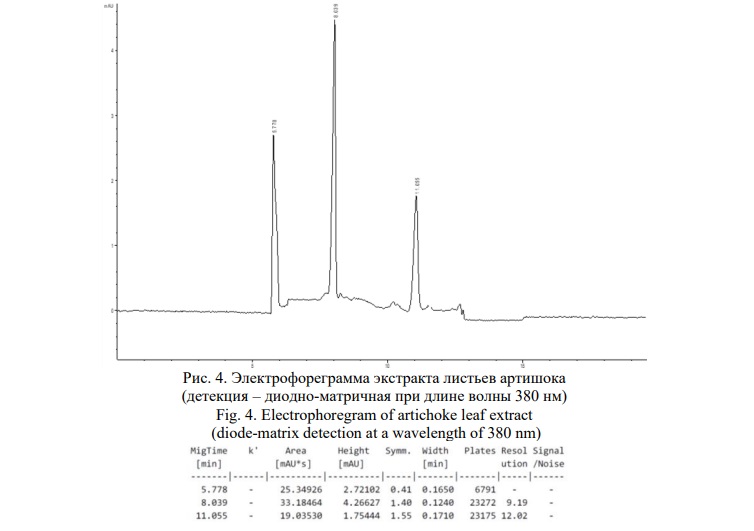
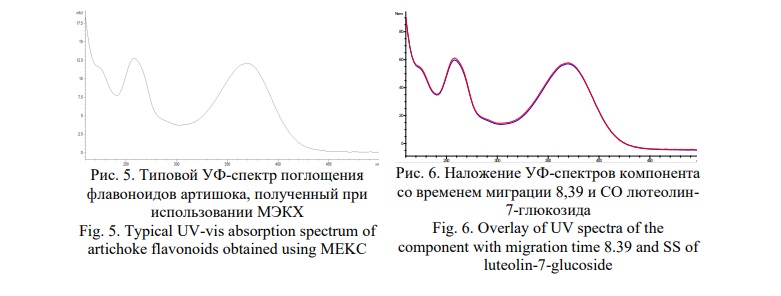
В данном случае зафиксировано 2 компонента, имеющих одинаковый УФ-профиль, приведённый на рисунке 5, соответствующий гликозидам лютеолина – лютеолин-7-глюкозиду (цинарозиду) и лютеолин-7-рутинозиду (сколимозиду), о чём свидетельствует совпадение времён миграции и УФ-спектров компонентов с соответствующими стандартными образцами (Рис. 6).
На рисунках 7 и 8 приведены хроматограммы, полученные в ходе хроматографирования экстракта артишока методом ВЭЖХ. Хроматограмма на рисунке 7 зарегистрированная при длине волны 325 нм показывает присутствие оксикоричных кислот.
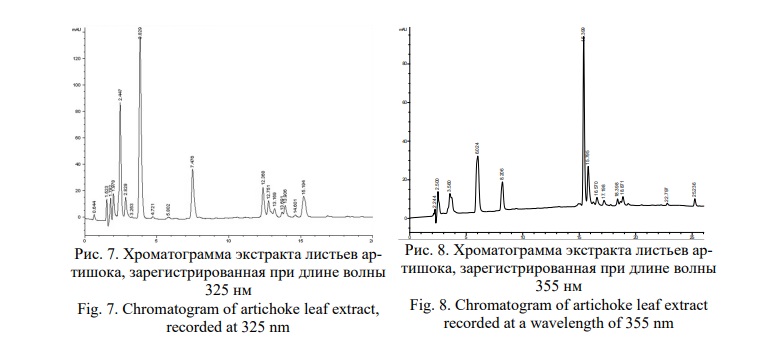
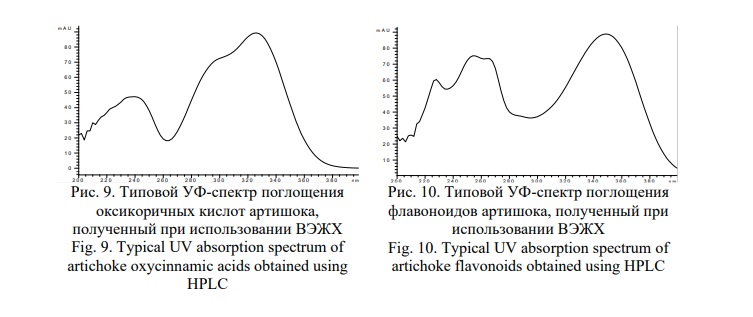
На хроматограмме видно, что доминируют два компонента со временем удерживания 3,829 мин и 7,476 мин, имеющие одинаковые УФ-профили, соответствующие оксикоричным кислотам (Рис. 9).
Компонент со временем удерживания 3,829 мин по времени удерживания совпадает со СО кислоты хлорогеновой, а компонент со временем удерживания 7,476 мин соответствует цинарину. Остальные минорные компоненты принадлежат изомерам данных кислот.
На хроматограмме, зарегистрированной при длине волны 355 нм обнаруживаются два компонента, со временем удерживания 15,399 мин и 15,795 мин соответствующие по времени удерживания и УФ-профилям лютеолин-7-глюкозиду и лютеолин-7-рутинозиду с явным доминированием первого (Рис. 10).
Таким образом, из всего вышесказанного можно сделать вывод, что оба метода пригодны для обнаружения компонентного состава артишока колючего. Коэффициенты разделения, полученные в ходе электрофоретического и хроматографического разделения позволяют проводить количественную оценку каждого компонента. Однако, метод КЭ потенциально более выгоден для анализа биологически активных веществ и их метаболитов в объектах биологического происхождения из-за его поливалентности.
Электрофореграмма разделения полифенольного комплекса цветков бессмертника песчаного приведена на рисунке 11.
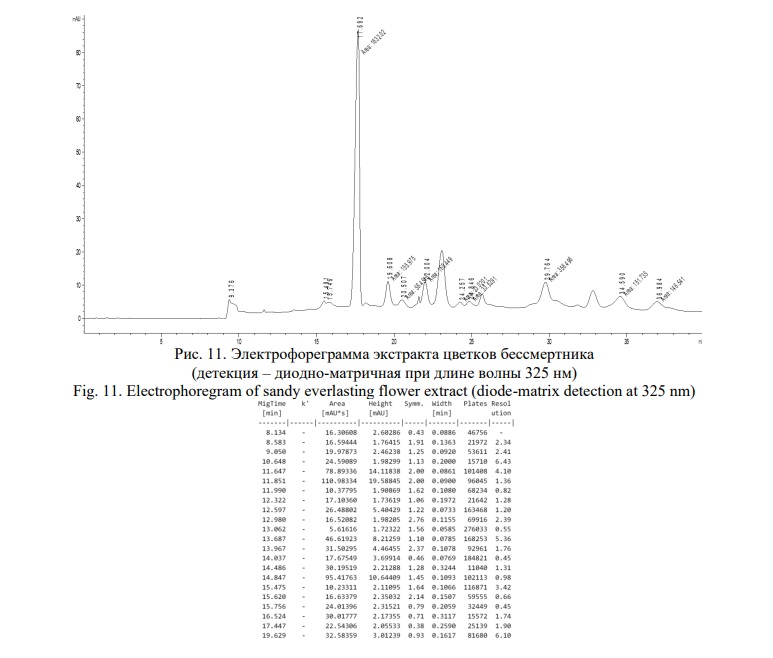
На электрофореграмме обнаруживается 9 компонентов, из которых доминирующий имеет время миграции 17,692 мин с УФ-профилем поглощения, представленным на рисунке 12. Данный компонент по времени миграции и УФ-спектру поглощения соответствует СО изосалипурпозида (Рис. 12).
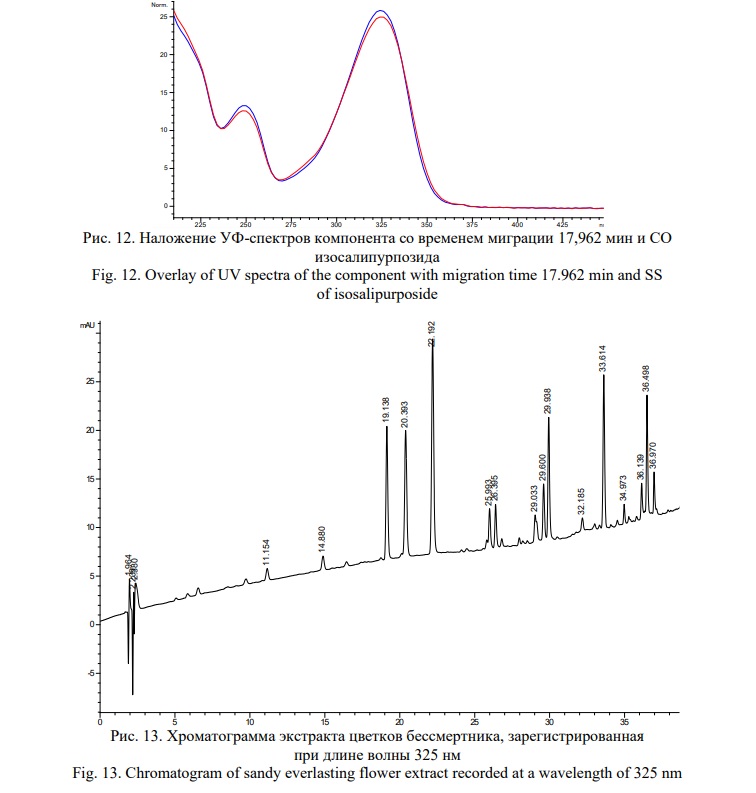
Как видно на представленном рисунке, доминирующий пик хорошо отделяется от остальных компонентов системы, что позволяет проводить количественную оценку его содержания в пробе.
Известно, что изосалипурпозид, являясь флаваноном, имеет максимум поглощения при 290 нм. Однако в данном случае, поскольку разделение проводилось в среде буферного раствора, то происходит батохромный сдвиг до 325 нм.
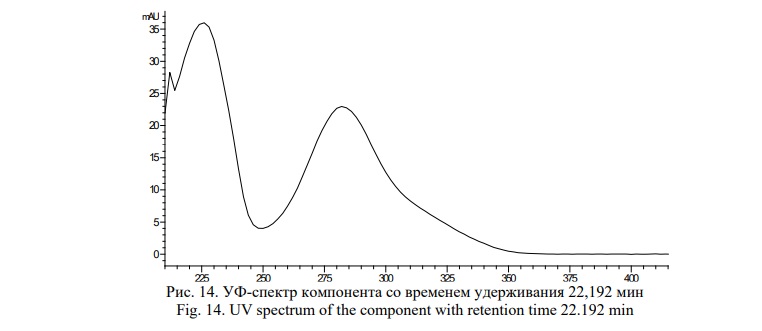
На представленной хроматограмме присутствует 10 значимых компонентов, из которых доминирующим является пик со временем удерживания 22,192 мин. По УФ-спектру поглощения (Рис. 14) и времени удерживания данный компонент соответствует изосалипурпозиду.
По основным параметрам пригодности, использованная хроматографическая система позволяет адекватно разделять компоненты экстракта бессмертника. Поэтому данные условия позволяют проводить количественную оценку каждого компонента в фитокомплексе.
Заключение. Результаты анализа полифенольного комплекса экстракта листьев артишока и цветков бессмертника с помощью капиллярного электрофореза согласуются с данными полученными в ходе хроматографирования методом ВЭЖХ. Это позволяет сделать вывод, что метод капиллярного электрофореза в варианте мицеллярной электрокинетической хроматографии позволяет идентифицировать и проводить количественную оценку каждого компонента в листьях артишока и цветках бессмертника наряду с ВЭЖХ. Причём исполнение анализа с помощью капиллярного электрофореза является более экономически оправданным, по сравнению с ВЭЖХ, поскольку не требует затрат растворителей для подвижной фазы и наличия набора колонок.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы