Геронтологические особенности влияния новой коронавирусной инфекции на показатели интерлейкинового профиля, воспаления и эндогенной интоксикации у пациентов зрелого и пожилого возраста с ишемической болезнью сердца
Aннотация
Актуальность: Ишемическая болезнь сердца (ИБС) рассматривается как независимый фактор риска COVID-19, но показатели гериатрического, интерлейкинового профиля, воспаления и эндогенной интоксикации у пациентов с ИБС через 3-4 недели после выздоровления от COVID-19 не являлись предметом научных исследований. Цель исследования:Оценка геронтологических особенностей влияния перенесенной новой коронавирусной инфекции на показатели интерлейкинового профиля, воспаления и эндоогенной интоксикации пациентов зрелого и пожилого возраста с ишемической болезнью сердца в ранние сроки выздоровления. Материалы и методы:В исследование включено 58 пациентов зрелого возраста с ИБС через 3-4 недели после выздоровления от COVID-19 средней степени тяжести, составивших группу сравнения. Основная группа пациентов была представлена 62 лицами пожилого возраста с ИБС, перенесших новую коронавирусную инфекцию, и обследованных также, как и предыдущая группа, через 3-4 недели после выздоровления. Уровень С-реактивного белка и высокочувствительного С-реактивного белка в крови исследовали с помощью экспресс-анализатора «Никомед-ридер», а антистрептолизина-О – посредством иммунотурбидиметрического метода на анализаторе Cobas 600 (Швейцария). Уровень в крови билирубина, мочевины, креатинина и сиаловых кислот изучали на биохимическом анализаторе ROKI. Содержание системных цитокинов определяли аппаратом «Beckton Dickinson FACS Canto 2 (USA)» методом проточной цитометрии. Уровень тревожности и депрессии изучался по шкале HADS. Результаты:Через 3-4 недели после выздоровления от COVID-19 содержание антистрептолизина-О варьировало в диапазоне от 120,9 МЕ/мл до 208,1 МЕ/мл. Существенные изменения среди рассматриваемых параметров воспаления и эндогенной интоксикации у пациентов с ИБС в пожилом возрасте в процессе выздоровления от новой коронавирусной инфекции выявлены в содержании в периферической крови высокочувствительного С-реактивного белка. В ранние сроки выздоровления после перенесённого COVID-19 у пациентов пожилого возраста с ИБС концентрация многих изученных цитокинов в плазме крови оставалась повышенной по сравнению с лицами 45-59 лет. Превышение референсных значений в обеих группах установлено для IL-17, TNF-α и IFN-α, а среди пожилых пациентов – для IL-3, IL-4, IL-6, IL-7, IL-17. Заключение:Антистрептолизин-О, высокочувствительный С-реактивный белок, С-реактивный белок можно считать маркерами выздоровления пациентов с сочетанной ИБС в ранние сроки после перенесенной новой коронавирусной инфекции
Ключевые слова: новая коронавирусная инфекция, ишемическая болезнь сердца, показатели воспаления, эндогенная интоксикация, интерлейкины, возраст пациентов
Введение. Инфекция SARS-CoV-2, вызывающая COVID-19, затронула более 670 миллионов человек по всему миру до января 2023 года. Примечательно, что примерно 7 миллионов случаев смерти связаны с COVID-19, и все больше доказательств также подтверждают существование длительного COVID-19, клинически проявляющегося в виде стойких симптомов и / или отсроченных или долгосрочных осложнений, лабораторных и метаболических изменений, сохраняющихся после выздоровления от COVID-19 [1]. Вскоре после начала пандемии было признано, что тяжесть заболевания коррелирует с сопутствующими факторами риска сердечно-сосудистых заболеваний и самим заболеванием, но также и с тем, что инфекция COVID-19 вызывает повышение уровня тропонина у 20-30% госпитализированных пациентов с COVID-19. Последнее может ухудшить клинические исходы у пациентов с уже существующими сердечно-сосудистым заболеванием [2]. Предполагается, что как прямые, так и косвенные последствия заражения SARS-CoV-2 лежат в основе этих неблагоприятных сердечно-сосудистых эффектов и значительно увеличивают бремя заболеваемости и смертности, связанных с COVID-19. Клиническая значимость двунаправленной взаимосвязи между COVID-19 и сердечно-сосудистыми заболеваниями была недавно подчеркнута публикацией Американского колледжа кардиологов «Пути принятия консенсусных решений экспертами о CV-последствиях COVID-19 у взрослых» [3].
Поражение сердца у пациентов с инфекцией COVID‐19 средней и тяжёлой степени тяжести варьирует от бессимптомного поражения миокарда до миокардита и инфаркта миокарда, вторичного по отношению к ишемической болезни сердца (ИБС) [4]. ИБС довольно часто встречается у пациентов, госпитализированных по поводу COVID‐19.
К основным хроническим заболеваниям среди пожилого населения России и зарубежных стран в настоящее время относится ИБС, выступающая ведущей причиной преждевременной смертности и существенно сокращающей продолжительность активной жизнедеятельности пациентов [5, 6, 7].
Наличие ИБС у пожилых пациентов с COVID-19 достоверно, как показано в современных исследованиях [8-11], увеличивает риск развития различных сердечно-сосудистых осложнений, вызывающих инвалидизацию и смертельные случаи. Прогноз течения коронавирусной инфекции у лиц с сопутствующей ИБС во многом зависит от уровня цитокинового шторма – ведущего патогенетического звена COVID-19 [12, 13]. Однако параметры системных цитокинов изучаются преимущественно в остром периоде инфекционного заболевания, что не отражает процесс реконвалесценции пациентов. Также показатели воспаления и эндогенной интоксикации у пациентов с ишемической болезнью сердца (ИБС) через 3-4 недели после выздоровления от COVID-19 не являлись предметом научных исследований.
Цель исследования. Оценка геронтологических особенностей влияния перенесенной новой коронавирусной инфекции на показатели интерлейкинового профиля, воспаления и эндоогенной интоксикации пациентов зрелого и пожилого возраста с ишемической болезнью сердца в ранние сроки выздоровления.
Материалы и методы исследования. Настоящее исследование выполнено среди 58 пациентов зрелого возраста с ИБС через 3-4 недели после выздоровления от COVID-19 средней степени тяжести, составивших группу сравнения. Основная группа пациентов была представлена 62 лицами пожилого возраста с ИБС, перенесших новую коронавирусную инфекцию и обследованных также, как и предыдущая группа, через 3-4 недели после выздоровления.
В исследование включались пациенты с документально подтверждённым перенесенным COVID-19 средней степени тяжести и отрицательным тестом на вирус SARS-CoV-2. Выявление и диагностика ИБС в обследованных группах пациентов выполнялась в соответствии с критериями Клинических рекомендациях «Стабильная ишемическая болезнь сердца», подготовленной специалистами Российского кардиологического общества [14]. При диагностике ИБС среди пациентов 45-59 лет и 60-74 лет учитывались ранее перенесенные случаи острого инфаркта миокарда, стабильной стенокардии напряжения, острого коронарного синдрома, а также патогномоничные субъективные и объективные клинические симптомы, результаты эхокардиографического, электрокардиографического и биохимических исследований.
Среди показателей воспаления и эндогенной интоксикации у пациентов зрелого и пожилого возраста, страдающих ИБС, и перенесших новую коронавирусную инфекцию, для выделения в последующем среди них потенциальных биологических маркеров определяли:
- С-реактивный белок,
- высокочувствительный С-реактивный белок,
- серомукоид,
- мочевину,
- билирубин,
- креатинин,
- антистрептолизин-О,
- сиаловые кислоты.
Уровень С-реактивного белка и высокочувствительного С-реактивного белка в крови исследовали с помощью экспресс-анализатора «Никомед-ридер», а антистрептолизина-О – посредством иммунотурбидиметрического метода на анализаторе Cobas 600 (Швейцария). Уровень в крови билирубина, мочевины, креатинина и сиаловых кислот изучали на биохимическом анализаторе ROKI.
При оценке раннего периода выздоровления пациентов 45-59 лет и 60-74 лет с наличием ИБС и переболевших новой коронавирусной инфекции по прошествии 3-4 недель исследовали показатели системного цитокинового профиля с выделением среди последних возможных биологических маркеров. В плазме крови изучали содержание следующих провоспалительных и противовоспалительных цитокинов:
- IL-2,
- IL-3,
- IL-4,
- IL-6,
- IL-7,
- IL-10,
- IL-15,
- IL-17,
- IL-18,
- TNF-α,
- IFN-α,
- IFN-γ.
Содержание системных цитокинов определяли аппаратом «Beckton Dickinson FACS Canto 2 (USA)» методом проточной цитометрии с применением специальных наборов CBA (BO Biosciences, USA).
У пациентов среднего и пожилого возраста с ИБС, с перенесённой новой коронавирусной инфекцией изучен психологический домен по уровню тревоги и депрессии. Уровень тревоги и депрессии определялся по госпитальной шкале тревоги и депрессии – Hospital anxiety and depression scale (HADS). При анализе результатов данной шкалы придерживались следующих критериев: 0-7 баллов – отсутствие тревоги и депрессии, 8-10 баллов – субклиническая тревога и депрессия,11 баллов и более – клинически выраженная тревога и депрессия.
Исследование осуществлялось с соблюдением общепринятых этических норм и принципов надлежащей клинической практики «Good Clinical Practice». Пациенты включались в исследование после получения письменного информированного согласия.
Статистическая обработка результатов исследования выполнена на ЭВМ типа «Pentium» с использованием стандартного прикладного пакета «Statistica 10.0». Для оценки информативности полученных показателей интерлейкинового профиля, эндогенной интоксикации и воспаления рассчитана информативность Кульбака по общепринятым формулам. Для выявления связей между изученными показателями проводился корреляционный анализ в программе «Statistica 10.0».
При сравнении анализируемых параметров пациентов зрелого и пожилого возраста использовался критерий Х2 с учётом числа степеней свободы и различие принималось статистически значимым при p<0,05.
Результаты и их обсуждение. Оценка степени выраженности тревоги и депрессии по госпитальной шкале тревоги и депрессии показала статистически значимые различия среднего уровня тревоги и депрессии среди пожилых пациентов с ИБС и перенесённым COVID-19, чем у пациентов среднего возраста, перенесших COVID-19 (Рис. 1).
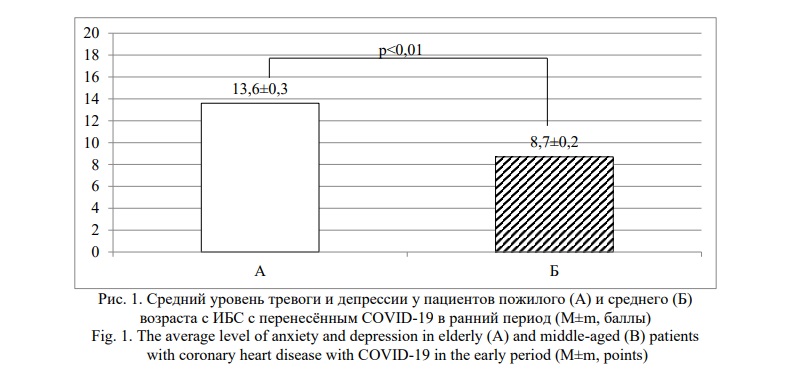
Среди пожилых пациентов с ИБС, перенёсших новую коронавирусную инфекцию, диагностирована по шкале HADS в ранний период выздоровления клинически выраженная тревога и депрессия, тогда как у пациентов 45-59 лет с ИБС и новой коронавирусной инфекцией в анамнезе выявлена субклиническая тревога и депрессия.
Оценка восстановительного периода пациентов с ИБС в пожилом возрасте через 3-4 недели после выздоровления от новой коронавирусной инфекции по показателям воспаления и эндогенной интоксикации свидетельствует о том, что многие вышеназванные показатели по прошествии заболевания оставались выше аналогичных показателей контрольной группы со статистически значимым различием. Так, среди обследованных представителей основной группы на момент проведения лабораторных исследований значимо и наиболее существенно был повышен уровень антистрептолизина-О и высокочувствительного С-реактивного белка (Табл. 1).
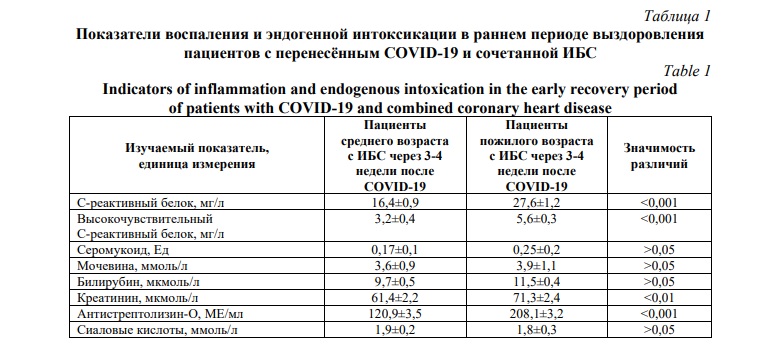
Уровень антистрептолизина-О у пациентов с ИБС пожилого возраста после выздоровления оставался повышенным относительно пациентов 45-59 лет с ИБС и новой коронавирусной инфекцией в анамнезе и на момент обследования. Содержание антистрептолизина-О варьировало в диапазоне от 120,9 МЕ/мл до 208,1 МЕ/мл, что указывает на сопряжённость данного параметра воспаления и эндогенной интоксикации с новой коронавирусной инфекцией и ранним периодом восстановления после этого заболевания.
Существенными изменениями среди рассматриваемых параметров воспаления и эндогенной интоксикации у пациентов с ИБС в пожилом возрасте в процессе выздоровления от новой коронавирусной инфекции сопровождалось изменение содержания в периферической крови высокочувствительного С-реактивного белка. Его уровень варьировал в диапазоне от 3,2 мг/л до 5,6 мг/л, что также, как по отношению к антистрептолизину-О, указывает на сопряжённость данного параметра воспаления и эндогенной интоксикации с новой коронавирусной инфекцией и ранним периодом восстановления после этого заболевания.
Таким образом, у пациентов с ИБС пожилого возраста в раннем реконвалесцентном периоде сохраняются после перенесённой новой коронавирусной инфекции по сравнению с пациентами среднего возраста с ИБС, переболевшими COVID-19, существенные изменения параметров воспаления и эндогенной интоксикации и особенно антистрептолизина-О и высокочувствительного С-реактивного белка.
Количественная оценка информативности обсуждаемых показателей выявила, что она наиболее значительна для высокочувствительного С-реактивного белка и антистрептолизина-О с небольшими параметрами в разнице информативности Кульбака между этими двумя показателями (Табл. 2).
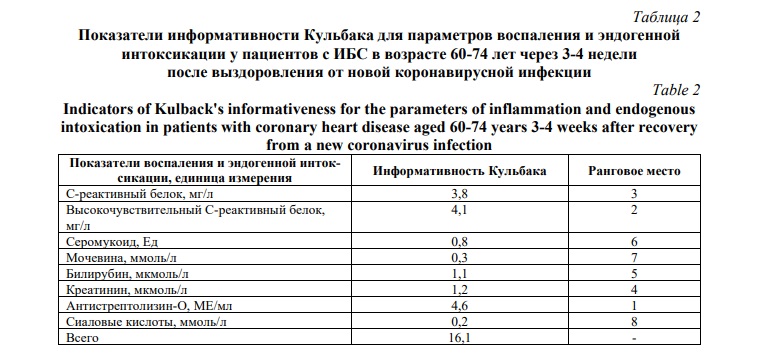
Несколько уступает по величине информативности Кульбака исследованный нами и широко используемый в клинической практике С-реактивный белок, величина информативности которого значительно ниже таковой антистрептолизина-О, но менее существенно отличается от информативности, установленной для С-реактивного белка.
Среди анализированных параметров воспаления и эндогенной интоксикации у обследованных пациентов с ИБС в раннем реконвалесцентном периоде после заболевания новой коронавирусной инфекцией информативными показателями являются также, наряду с указанными выше, содержание в периферической крови креатинина и билирубина. Однако уровень мочевины, серомукоида и сиаловых кислот в периферической крови рассматриваемой группы пожилых пациентов не обладает информативностью.
Оценка раннего реконвалесцентного периода пожилых пациентов после перенесенной новой коронавирусной инфекции и с наличием сочетанной ИБС по показателям цитокинового профиля на системном уровне выявила, повышенную концентрацию многих изученных цитокинов в плазме крови (Табл. 3).
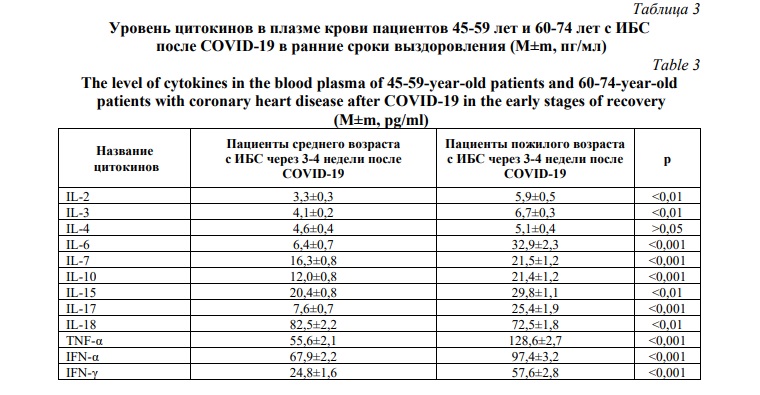
Таким образом, через 3-4 недели после перенесенного COVID-19 у пожилых пациентов с ИБС в плазме крови сохранялись повышенные уровни большинства исследованных цитокинов, за исключением IL-4 и IL-18. При этом наиболее повышенными в названной группе пациентов оставались уровни IL-6, IL-17, TNF-α и IFN-γ, которые на наш взгляд, можно использовать в качестве ведущих маркеров восстановления пожилых пациентов с ИБС в раннем периоде выздоровления.
Использование показателей информативности изученных системных цитокинов для оценки протекания раннего реконвалесцентного периода у пожилых пациентов с наличием ИБС и ранее перенесенной новой коронавирусной инфекции показало, что практически все цитокины являются информативными, поскольку расчётные значения превышали 1,0.
Вместе с тем информативность исследованных цитокинов крови для обозначенной задачи оказалась неодинаковой и варьировала существенно – от 1,2 для IL-18 до 8,7 для IL-6.
Среди исследованных системных цитокинов крови информативными являются также IFN-α, IL-7, IL-10, IL-2, IL-17, TNF-α, IL-8. Только один цитокин, а именно противовоспалительный IL-4, оказался неинформативным для оценки раннего периода реконвалесценции анализируемой группы пациентов.
Следовательно, полученные показатели информативности Кульбака свидетельствуют о возможности применения в качестве биомаркеров раннего реконвалесцентного периода пациентов с ИБС пожилого возраста, перенесших новую коронавирусную инфекцию, следующих системных цитокинов: IL-6, IL-17, TNF-α, IFN-γ.
Изменение биохимических показателей у пациентов после перенесенной новой коронавирусной инфекции находятся в стадии интенсивного изучения, но большинство исследований посвящено по-прежнему острой фазе заболевания. Jurado A. et al. обнаружили, что во время госпитализации по поводу COVID-19 уровни интерлейкина 6, С-реактивного белка, ферритина, D-димера, лейкоцитов и нейтрофилов у всех пациентов были выше референсных значений [15]. Метаанализ данных 1745 пациентов с COVID-19 из шести исследований показал, что у 16% пациентов в остром периоде COVID-19 повышены уровни аланинаминотрансферазы и аспартатаминотрансферазы в кровотоке. У 34% пациентов уровень альбумина был ниже нормы, а у 6% пациентов был повышен уровень общего билирубина. Уровни креатинина повышены у 8% пациентов, уровни креатинкиназы были выше нормы у 13% пациентов и у 52% пациентов повышен уровень лактатдегидрогеназы, которая признана маркером тяжести COVID-19 [16]. Наше исследование продемонстрировало, что в меньшей степени сопоставляемые когорты различались достоверно по уровню серомукоида, билирубина и креатинина.
Наиболее диагностически значимым маркером тяжести COVID-19 является С-реактивный белок. Tan C. et al [17] выявили, что С-реактивный белок обладает хорошей диагностической точностью для раннего прогноза тяжелой формы COVID-19 при пороговом значении 20,42 мг/л. Объединенные результаты для новой комбинации маркеров показали значительное увеличение соотношения нейтрофилов и лимфоцитов и снижение индекса лимфоцитарно-С-реактивного белка у госпитализированных пациентов с тяжелыми и умеренно тяжелыми случаями. В нашем исследовании значительным оказалось различие и в содержании в крови обследованных после выздоровления уровня С-реактивного белка с повышенной концентрацией в основной группе (27,6±1,2 мг/л).
Также повышенный уровень С-реактивного белка напрямую коррелирует с уровнем воспаления и тяжестью заболевания. Следовательно, это важный биомаркер в диагностике и оценке тяжести инфекционных заболеваний. Результаты настоящего исследования согласуются с другими небольшими когортными исследованиями, которые положительно связывают повышенный уровень С-реактивного белка с тяжестью заболевания COVID-19 [18], в том числе у пациентов с ИБС. Таким образом, можно предположить, что С-реактивный белок может быть наиболее эффективным и чувствительным биомаркером для прогнозирования прогрессирования заболевания COVID-19.
Креатинин, как известно, является маркером функции почек в проспективном когортном исследовании, проведенном с участием 701 пациента с COVID-19, обнаружено, что во время госпитализации частота острого повреждения почек и смерти была значительно выше у пациентов с повышенным исходным уровнем креатинина в сыворотке крови, чем у пациентов с нормальными исходными значениями [19]. Предполагается, что механизм, с помощью которого это происходит, заключается в гематогенном распространении и накоплении вируса в почках, вызывающем некроз почечных клеток. Нами продемонстрировано, что сопоставляемые когорты различались достоверно по уровню креатинина, хотя и в меньшей степени, чем по другим показателям эндогенной интоксикации и воспаления.
В исследовании [12] показано, что через 30-100 дней после выздоровления от COVID-19, у 69 пациентов от 19 до 61 года не обнаружено значимой корреляционной связи между концентрациями цитокинов в плазме крови переболевших COVID-19 и тяжестью течения инфекционного заболевания [12]. Участие системных интерлейкинов в развитии коронавирусной инфекции и реконвалесцентном периоде свидетельствует, что вирусная инфекция в легочной ткани может вызвать активацию эпителиальных клеток легкого, эндотелиальных клеток легкого, фибробластов легкого и альвеолярных макрофагов во время COVID-19 [20]. Белки теплового шока (HSP60, HSP70) являются важными агентами, стимулирующими иммунитет хозяина к TH17 и незаменимыми реактивными белками в ситуациях, описанных выше. В частности, HSP60 и HSP70 могут активировать связанные с TH17 Toll-подобные рецепторы. Таким образом, запускаются TH17-ассоциированные цитокины, такие как IL-17, IL-1, TNF-α и IL-6, а также TH17-ассоциированные хемокины, такие как IL-8. Новая коронавирусная инфекция может индуцировать выделение легочными эпителиальными клетками хемокинов и цитокинов. Цитокины TH17 активируют иммунитет TH17, включая эффекторную функцию, инактивирующую вирус.
Адаптивные Т-клетки, В-клеточный иммунитет со специфическими антителами и TCR-ответы против вирусов могут не запускаться. Однако предыдущее исследование выявило аутоантитела к IL-8 у пациентов с COVID-19. В частности, IL-8 и лейкотриен B4 являются основными химиопривлекателями в легочных тканях. Первоначально этот хемокин был идентифицирован в линиях гигантских клеток легких. IL-8 обладает высоким сродством к связыванию с гепаринсульфатом и хондроитинсульфатом, которых много в легких. IL-8 в тканях легких может затем рекрутировать другие цитокины. Это может объяснить, почему IL-8, вырабатываемый в отдаленных участках, таких как поджелудочная железа, во время воспаления, может привести к негативным последствиям.
Сообщалось о нескольких дефектах аутоантител к IL8. Во-первых, комплекс анти-IL-8-IL-8 был обнаружен в сыворотках 55% здоровых контрольной группы. Не было обнаружено существенной разницы в количестве комплекса IL-8-анти-IL-8 между пациентами с ОРДС и здоровой контрольной группой. Во-вторых, аутоантитело к IL8 может подавлять активность связывания IL-8 с нейтрофилами и хемотаксисную активность. Таким образом, важность аутоантител к IL8 в патогенезе COVID-19 неоднозначна [20].
Учитывая, что высокие уровни интерлейкина-6 (IL-6) были обнаружены при нескольких высокопатогенных заболеваниях, вызванных коронавирусом, таких как тяжелый острый респираторный синдром в 2022 году, ближневосточный респираторный синдром в 2012 году и COVID-19, значение IL-6 стал ключевым в патогенезе этого гипервоспалительного состояния [21].
Заключение. Новая коронавирусная инфекция оказывает существенное влияние на гериатрический статус, повышая уровень тревожности и депрессии, на восстановление параметров воспаления и эндогенной интоксикации выздоравливающих пациентов как зрелого, так и пожилого возраста, но особенно среди последних, когда многие рассмотренные показатели далеки от референсного уровня – С-реактивный белок, высокочувствительный С-реактивный белок, антистрептолизин-О. Наиболее информативно выздоровление пациентов после перенесенной коронавирусной инфекции характеризуют антистрептолизин-О, высокочувствительный С-реактивный белок, С-реактивный белок и имеющие существенную прогностическую значимость. Антистрептолизин-О, высокочувствительный С-реактивный белок, С-реактивный белок можно считать маркерами выздоровления пациентов с сочетанной ИБС в ранние сроки после перенесенной новой коронавирусной инфекции. Через 3-4 недели после перенесенного COVID-19 у пожилых пациентов с ИБС в плазме крови сохранялись повышенные уровни большинства исследованных цитокинов, за исключением IL-4 и IL-18. При этом наиболее повышенными в названной группе пациентов оставались уровни IL-6, IL-17, TNF-α и IFN-γ, которые на наш взгляд, можно использовать в качестве ведущих маркеров восстановления пожилых пациентов с ИБС в раннем периоде выздоровления.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы