Генетические варианты глобулина, связывающего половые гормоны, и гормональный профиль больных генитальным эндометриозом
Aннотация
Актуальность: Эндометриоз относится к хроническим воспалительным, дисгормональным заболеваниям, важную роль в развитии которого играют генетические факторы. Для возникновения, роста и распространения эндометриоидных гетеротопий важное значение играет гормональный дисбаланс половых гормонов. Цель исследования:Изучение ассоциации полиморфизма генов, связанных с уровнем глобулина, связывающего половые гормоны (ГСПГ), с гормональным профилем пациенток с генитальным эндометриозом. Материалы и методы:Проведено исследование на выборке из 103 женщин с генитальным эндометриозом. Каждой пациентке выполнен анализ уровня половых гормонов (дегидроэпиандростерон (ДГЭА), эстрадиол, фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), прогестерон, пролактин и тестостерон). Проведено генотипирование девяти однонуклеотидных полиморфизмов (SNP), значимых для уровня ГСПГ по данным полногеномных исследований (genome-wide association study, GWAS): rs12150660 гена SHBG, rs10454142 гена PPP1R21, rs780093 гена GCKR, rs17496332 гена PRMT6, rs3779195 гена BAIAP2L1, rs440837 гена ZBTB10, rs7910927 гена JMJD1C, rs4149056 гена SLCO1B1, rs8023580 гена NR2F2. Используя программу gPLINK, с помощью метода линейной регрессии произведена оценка ассоциации вышеперечисленных локусов с уровнем половых гормонов у женщин с генитальным эндометриозом. Результаты:Выявлены генетические варианты, связанные с уровнем ГСПГ, определяющие гормональный профиль больных эндометриозом. С содержанием дегидроэпиандростерона и тестостерона ассоциированы полиморфные локусы rs440837 ZBTB10 (аллель G, β=-0,266 - -0,334, pperm≤0,050 и β=-0,322 - -0,215, pperm≤0,050, соответственно), эстрадиола – rs3779195 BAIAP2L1 (аллель А, β=-0,282 - -0,318, pperm≤0,050) и rs440837 ZBTB10 (аллель G, β=-0,264, pperm=0,048), прогестерона – rs780093 GCKR (аллель Т, β=-0,380 - -0,269, pperm≤0,050), rs10454142 PPP1R21 (аллель С, β=0,568, pperm=0,049), rs8023580 NR2F2 (аллель С, β=-0,289, pperm=0,050)иrs12150660 SHBG (аллель Т, β=-1,071, pperm=0,028). Заключение:Установлены ассоциации полиморфизма генов, связанных с уровнем ГСПГ по данным GWAS, с уровнем половых гормонов у пациенток с генитальным эндометриозом
Введение. Эндометриоз – это хроническое дисгормональное, иммунозависимое, генетически обусловленное заболевание, которое определяется наличие эндометриоподобной ткани за пределами полости матки [1]. Эндометриоз встречается у 190 млн женщин во всем мире, однако его истинная распространенность остается неизвестной, поскольку треть пациенток имеют бессимптомную форму данного заболевания и окончательный диагноз требует хирургической визуализации эндометриоидных очагов с последующим их гистологическим исследованием [2, 3]. Литературные данные говорят о высокой распространенности эндометриоза среди пациенток с бесплодием (до 50%) и хронической тазовой болью (ХТБ) (до 49%), а также среди женщин, у которых ХТБ не поддается лечению (до 75%) [4]. Эндометриоз – «многоликое» заболевание, которое отличается гетерогенностью симптомов: от тазовой боли, нарушений менструального цикла, дисменореи, диспареунии, бесплодия до иных проявлений, характерных для эндометриоза нетипичных локализаций (эндометриоз легких, мочевого и желудочно-кишечного трактов и т.д.) [2, 5]. При этом конечные причины и механизмы возникновения эндометриоза остаются до конца неизученными [3]. Согласно данным литературы, в развитии и распространении эндометриоза участвуют гормональные, иммунологические, анатомические факторы [6]. Также велика роль генетических факторов в этиологии эндометриоза [7-11]. Результаты проведенных близнецовых, семейных, ассоциативных и полногеномных исследований показывают, что генетические влияния на развитие эндометриоза значительны и составляют до 47% [7, 12]. Полногеномные исследования позволили установить около 200 полиморфных локусов, ассоциированных с возникновением эндометриоза [12]. Однако, до сегодняшнего дня не определена роль конкретных генетических вариантов, способствующих развитию данного заболевания.
В патогенезе эндометриоза большую роль играют половые гормоны [13]. Уровень биологически активных гонадостероидов в организме регулирует ГСПГ [14]. Оказывая влияние на уровни тестостерона и эстрогенов, ГСПГ способен изменить функционирование всей гипоталамо-гипофизарно-гонадной оси, и, следовательно, выработку других половых гормонов [15]. Поскольку ГСПГ отвечает за транспортировку и связывание гонадостероидов логичным является предположение о том, что GWAS-значимые полиморфные локусы, ассоциированные с уровнем ГСПГ, могут быть вовлечены в развитие эндометриоза и связаны с уровнями половых гормонов. На сегодняшний день проведенные ассоциативные и полногеномные исследования позволили выявить взаимосвязь между полиморфизмом генов половых гормонов, а также уровнем репродуктивных гормонов и развитием эндометриоза [16-19]. Однако, работы, посвященные изучению вклада генетических детерминант уровня ГСПГ в гормональный профиль пациенток с генитальным эндометриозом, не были проведены, что определяет актуальность данного исследования.
Цель исследования. Изучить ассоциации полиморфных локусов, связанных с уровнем ГСПГ на полногеномном уровне значимости (rs12150660 SHBG, rs10454142 PPP1R21, rs780093 GCKR, rs17496332 PRMT6, rs3779195 BAIAP2L1, rs440837 ZBTB10, rs7910927 JMJD1C, rs4149056 SLCO1B1, rs8023580 NR2F2), с гормональным профилем пациенток с генитальным эндометриозом.
Материалы и методы исследования. В исследование были включены 103 пациентки с генитальным эндометриозом. Все женщины, включенные в исследование, – русские, жительницы Центрального Черноземья РФ. Средний возраст женщин составил 33,01 лет, индекс массы тела – 24,91 кг/м2. Выборка была сформирована в гинекологическом отделении перинатального центра ОГБУЗ «БОКБ Святителя Иоасафа» (Белгород). Диагноз был установлен после проведенного оперативного лечения (подтвержден в результате морфологического исследования). Каждой пациенткой было подписано информированное согласие на участие в научном исследовании.
Каждой пациентке выполнен анализ уровня половых гормонов (дегидроэпиандростерон (ДГЭА), эстрадиол, фолликулостимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), прогестерон, пролактин и тестостерон). Для проведения молекулярно-генетического исследования были использованы образцы ДНК, выделенные из лейкоцитов венозной крови фенольно/хлороформным методом экстракции. Для генотипирования были отобраны 9 GWAS-значимых полимофрных локусов, связанных с уровнем ГСПГ: rs12150660 SHBG, rs10454142 PPP1R21, rs780093 GCKR, rs17496332 PRMT6, rs3779195 BAIAP2L1, rs440837 ZBTB10, rs7910927 JMJD1C, rs4149056 SLCO1B1, rs8023580 NR2F2. Методом полимеразной цепной реакции (технология real-time ПЦР) на амплификаторе BioRad CFX96 с использованием локус-специфических наборов реагентов (производства ООО ТестГен, г. Ульяновск) выполнено генотипирование вышеописанных SNPs. Отбор полиморфных локусов производился исходя из их выраженного регуляторного потенциала и влияния на экспрессию генов (оценка проведена с помощью биоинформатического ресурса HaploReg). Для оценки ассоциаций SNPs с гормональным профилем пациенток с генитальным эндометриозом использована программа gPLINK и метод линейной регрессии (для расчетов были использованы трансформированные значения т.е. приведенные к нормальному распределению показателей содержания гормонов) с проведением расчетов в 4-х генетико-статистических моделях: аллельной, доминантной, рецессивной и аддитивной. В качестве ковариат в расчеты были введены следующие параметры: возраст, ИМТ, наличие сочетанных пролиферативных заболеваний матки (гиперплазия эндометрия, миома матки). Пермутационный тест был использован для коррекции на множественные сравнения.
Результаты и их обсуждение. Установлено, что распределение генотипов изучаемых девяти молекулярно-генетических маркеров (rs12150660 SHBG, rs10454142 PPP1R21, rs780093 GCKR, rs17496332 PRMT6, rs3779195 BAIAP2L1, rs440837 ZBTB10, rs7910927 JMJD1C, rs4149056 SLCO1B1, rs8023580 NR2F2) соответствует равновесию Харди-Вайнберга (р>0,05).
Важной характеристикой эндометриоза является гормональный статус пациентки. Нами проанализирована вовлеченность полиморфизма генов ГСПГ в формирование особенностей гормонального статуса женщин с эндометриозом. В таблицах 1-7 отображены полученные результаты. Установлена ассоциация полиморфизма rs440837 (A>G) ZBTB10 с уровнем дегидроэпиандростерона (DHEAS) согласно аддитивной (β=-0,266; р=0,046; pperm=0,049) и доминантной (β=-0,334; р=0,048; pperm=0,050) генетических моделей (Табл. 1).

С концентрацией эстрадиола (ESTR) связаны 2 полиморфных локуса – rs3779195 (T>A) BAIAP2L1 и rs440837 (A>G) ZBTB10 (Табл. 2). Однонуклеотидный полиморфизм rs3779195 (T>A) BAIAP2L1 ассоциирован с уровнем данного гормона согласно аддитивной (β=-0,282; р=0,043; pperm=0,045) и доминантной (β=-0,318; р=0,031; pperm=0,032) генетических моделей. Полиморфный локус rs440837 (A>G) ZBTB10 в рамках доминантной генетической модели (β=-0,264; р=0,047; pperm=0,048) связан с содержанием ESTR в сыворотке крови больных эндометриозом.
Четыре молекулярно-генетических маркера – rs780093 (C>T) GCKR, rs10454142 (T>C) PPP1R21, rs8023580 (T>C) NR2F2 и rs12150660 (G>T) SHBG вовлечены в формирование уровня прогестерона (PG) у больных эндометриозом (Табл. 3). Локус rs780093 (C>T) GCKR связан с концентрацией данного гормона в рамках доминантной (β=-0,380; р=0,037; pperm=0,038) и аллельной (β=-0,269; р=0,049; pperm=0,050) генетических моделей. Полиморфизмы rs10454142 (T>C) PPP1R21 и rs12150660 (G>T) SHBG определяют содержание PG в сыворотки крови пациенток с эндометриозом согласно рецессивной модели (β=0,568; р=0,049; pperm=0,049 и β=-1,071; р=0,027; pperm=0,028 соответственно) и локус rs8023580 (T>C) NR2F2 ассоциирован с уровнем PG в рамках аллельной генетической модели (β=-0,289; р=0,049; pperm=0,050). Следует отметить, что минорный аллель С полиморфизма rs10454142 (T>C) PPP1R21 связан с более высокой концентрацией PG в сыворотке крови пациенток с
эндометриозом (β>0), тогда как минорные аллели других трех вышеуказанных SNPs (аллель Т rs780093 (C>T) GCKR, аллель С rs8023580 (T>C) NR2F2 и аллель Т rs12150660 (G>T) SHBG) маркируют низкий уровень данного гормона.
Концентрация тестостерона (TEST) у пациенток с эндометриозом детерминируется полиморфизмом rs440837 (A>G) ZBTB10 согласно двух генетических моделей – доминантной (β=-0,322; р=0,028; pperm=0,030) и аллельной (β=-0,215; р=0,050; pperm=0,050) (Табл. 4).
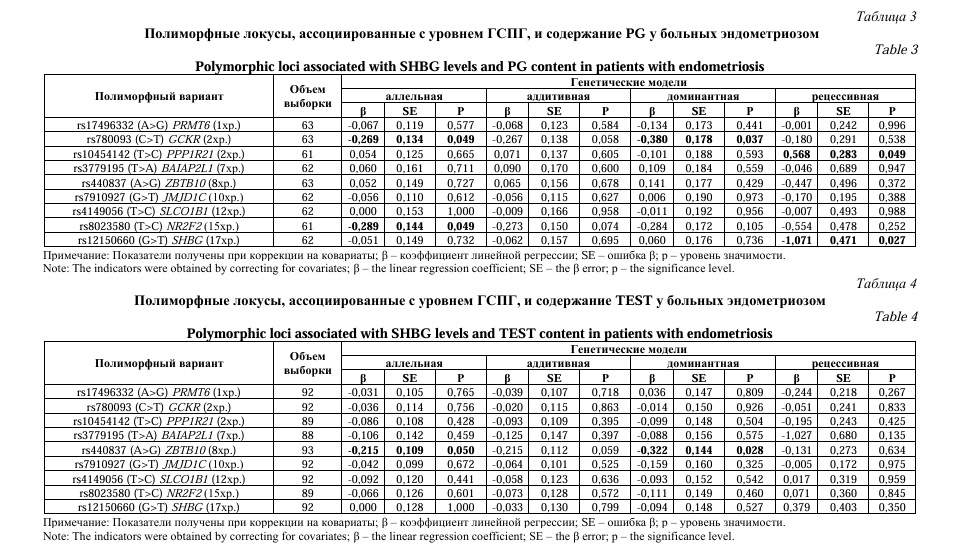
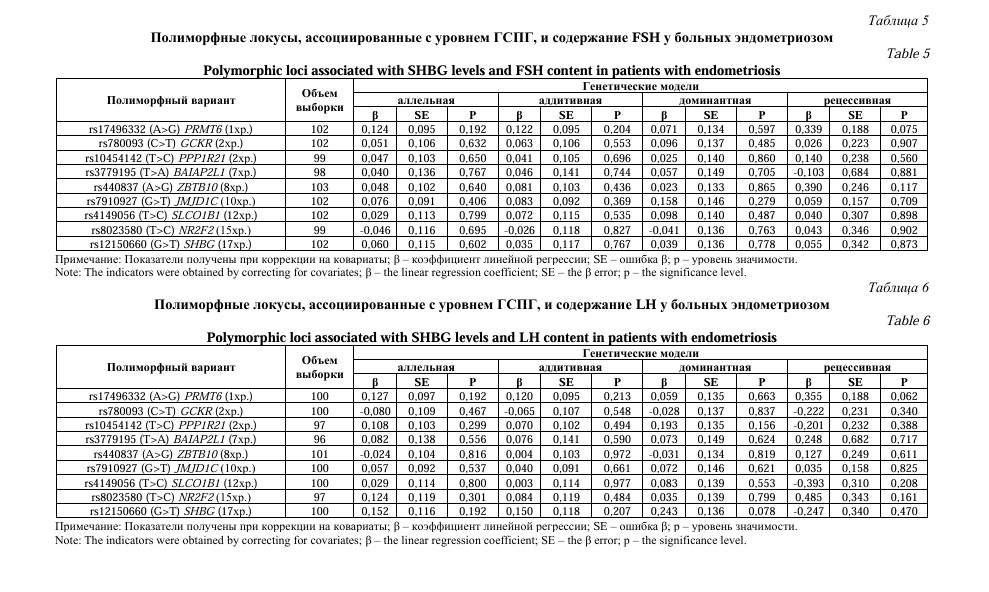
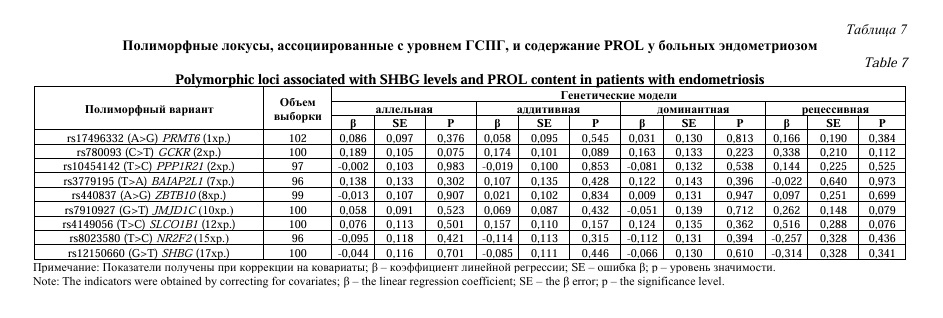
Таким образом, нами выявлены генетические варианты, связанные с уровнем ГСПГ, определяющие гормональный профиль больных эндометриозом. С содержанием DHEAS и TEST ассоциирован полиморфный локус rs440837 (A>G) ZBTB10, с концентрацией ESTR – rs3779195 (T>A) BAIAP2L1 и rs440837 (A>G) ZBTB10, с содержанием PG – rs780093 (C>T) GCKR, rs10454142 (T>C) PPP1R21, rs8023580 (T>C) NR2F2 и rs12150660 (G>T) SHBG.
Согласно литературным данным полиморфные локусы rs440837 ZBTB10 и rs3779195 BAIAP2L1 оказывают различные плейотропные эффекты, которые связаны с функционированием женской репродуктивной системы как в норме, так и при различных гинекологических заболеваниях. Так, полиморфизм гена ZBTB10 ассоциирован с гормон-зависимыми опухолями как рак молочной железы [20] и рак яичников [21]. Ген BAIAP2L1 ассоциирован с такими гормон-зависимыми заболеваниями, как рак молочной железы (установлено, что BAIAP2L1 способствует прогрессированию РМЖ) [22], рак щитовидной железы [23] и рак яичников [24].
По данным двух GWAS, полиморфный локус rs440837 ZBTB10 (аллель G по данным нашего исследования связан с низкими концентрациями дегидоэпиандростерона, эстрадиола и тестостерона) ассоциирован с уровнями ГСПГ [25, 26]. В исследовании Coviello A.D. et al. аллельный вариант А маркировал низкие уровни ГСПГ (β=-0,030, p=3×10-9) [25], в то время как в анализе Harrison S. et al. аллельный вариант G был связан с высокими уровнями ГСПГ (β=1,43) [26]. Вышеописанный полиморфизм функционально активен в печени, которая является основным местом синтеза ГСПГ [14]. ГСПГ – это гликопротеин плазмы крови, который специфически связывает андрогены и эстрогены, транспортирует их в метаболически неактивной форме и определяет соотношение свободной и белок-связанной фракций этих гормонов в плазме [15]. ГСПГ оставляет свободным только 1-2% тестостерона и 2% эстрадиола, в то время как 65% тестостерона и 38% эстрадиола связывается с ГСПГ, остальное- с альбумином [14, 15]. Таким образом уровни ГСПГ обратно коррелируют с концентрациями половых гормонов в крови: высокий ГСПГ приводит к низким уровням тестостерона и эстрогенов [27].
Полученные нами данные согласуются с данными проведенных полногеномных исследований. Так, генетический вариант G rs440837 ZBTB10, ассоциированный по нашим данным с низкими концентрациями ДГЭА, эстрадиола и тестостерона, связан по данным GWAS с высокими уровнями ГСПГ, и, следовательно, с низким уровнем тестостерона и эстрадиола [26]. Из литературных материалов известно, что для гормонального профиля пациенток с эндометриозом характерны изменения уровней половых гормонов: снижение уровня ЛГ, увеличение концентрации ФСГ, снижение соотношения ЛГ/ФСГ, увеличение уровня ГСПГ, снижение тестостерона, высокие концентрации эстрадиола в эндометриоидных очагах и нормальные или низкие уровни сывороточного эстрадиола, повышение соотношения эстрадиол/тестостерон и т.д. [28, 29]. Данные гормональные изменения способствуют росту и распространению эндометриоидных гетеротопий [30, 31]. Описанные колебания уровня гормонов при эндометриозе тождественны полученным нами данным о низких уровнях эстрадиола у женщин с наличием аллеля А полиморфизма rs3779195 BAIAP2L1.
Результаты настоящего исследования согласуются с работой Dinsdale N. et al., в которой было выдвинуто предположение, что эндометриоз возникает из-за атипичного функционирования гипоталамо-гипофизарной оси в пренатальный период, и при этом ключевое значение в развитии заболевания имеет низкий уровень пренатального тестостерона [28]. Сбой в функционировании гипоталамо-гипофизарной системы обусловлен изменением чувствительности гипоталамуса к стероид-индуцированной обратной отрицательной связи и приводит к формированию определенного гормонального профиля, предрасполагающего к развитию эндометриоза (сниженный уровень ЛГ по сравнению с ФСГ, повышенный уровень ГСПГ, сниженный системный/яичниковый тестостерон и другие изменения) [28, 32]. Ввиду того что ГСПГ транспортирует андрогены в крови, а также регулирует их доступ к тканям-мишеням, то можно предположить, что высокие уровни ГСПГ влияют на снижение уровня свободного тестостерона. В последующем низкие уровни пренатального и постнатального тестостерона способствуют раннему возрасту наступления менархе, укорочению менструальных циклов, развитию меноррагии, которые, как известно, являются одними из факторов риска развития эндометриоза [28]. Вышеуказанные факторы риска способствуют увеличению вероятности заброса менструальной крови и последующего развития эндометриоза, согласно гипотезе ретроградной менструации [33]. Кроме того, некоторые авторы указывают на активацию стволовых клеток посредством воздействия низких уровней тестостерона с последующим развитием эндометриоза в соответствии с теорией стволовых клеток [14]. В последующей статье Crespi et al. выявлена положительная корреляция между низкими уровнями тестостерона и основными симптомами эндометриоза, такими как тазовая боль и повышенная чувствительность к боли [29].
Проведенный в 2024 году анализ, посвященный изучению ассоциации ГСПГ-связанных генов с раком молочной железы (РМЖ), показал вовлеченность полиморфного локуса rs10454142 PPP1R21 в возникновение РМЖ у женщин без отягощенной наследственности и у женщин, не имеющих мутаций в генах BRCA1/CHEK2 [34]. В данной работе показано, что аллель С rs10454142 PPP1R21 является фактором риска развития РМЖ у женщин, не имеющих отягощенного семейного анамнеза по РМЖ (OR=1,32, pperm=0,027), и у женщин у которых отсутствовали мутации в генах BRCA1/CHEK2 (OR=1,34-1,74, pperm<0,050) [34]. В соответствии с литературными данными, прогестерон участвует в регуляции пролиферации и дифференцировке паренхиматозных клеток молочной железы [35]. Рак молочной железы – гормон-зависимая опухоль, важную роль в патогенезе которой играют половые гормоны (эстрогены, прогестерон, пролактин и др.) [34, 35]. Исследование, посвященное изучению уровня гормонов периферической крови у пациенток с РМЖ показало, что уровень прогестерона у пациенток в менопаузе превышал нормальные значения [36]. Эти данные согласуются с результатами нашего исследования, в котором установлено, что минорный аллель С полиморфизма rs10454142 PPP1R21 связан с более высокой концентрацией прогестерона в сыворотке крови пациенток с эндометриозом.
В исследовании Golovchenko I.O. et al., посвящённом изучению связи полиморфизмов, влияющих на уровни половых гормонов (панель из 9 локусов, взятая из GWAS Ruth et al. [37]), с эндометриозом (работа выполнена на этой же выборке пациентов), были выявлены следующие результаты. Во-первых, была установлена протективная роль аллеля C rs11031005 FSHB, ассоциированного с повышением уровня общего/свободного тестостерона. Во-вторых, была показана вовлеченность в предрасположенность к эндометриозу (в рамках межгенных взаимодействий) SNPs, ассоциированных с уровнем циркулирующего ГСПГ (rs1641549 TP53, rs727428 SHBG), свободного (биодоступного) тестостерона (rs112295236 SLC22A10, rs727428 SHBG) и ДГЭА [38]. В последующем исследовании Головченко И.О. была продемонстрирована корреляция уровней тестостерона у пациентов с эндометриозом с полиморфизмами rs148982377 ZNF789 и rs34670419 ZKSCAN5 [39].
Заключение. Таким образом, в результате проведенного исследования установлено, что среди пациенток с генитальным эндометриозом уровни дегидроэпиандростерона и тестостерона маркируются полиморфным локусом rs440837 ZBTB10, концентрации эстрадиола – rs3779195 BAIAP2L1 и rs440837 ZBTB10, содержание прогестерона – rs780093 GCKR, rs10454142 PPP1R21, rs8023580 NR2F2 и rs12150660 SHBG.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы