Ассоциация полиморфизмов генов нейромедиаторных систем мозга с риском развития психических нарушений у детей, оставшихся без попечения родителей
Aннотация
Актуальность: Социальные сироты имеют разнообразные поведенческие и интеллектуальные расстройства. Ряд определенных полиморфизмов генов дофаминовой и серотониновой нейромедиаторных систем мозга имеет патогенетическое значение в формировании различных психических заболеваний. В связи с чем, изучение генов-кандидатов, связанных с риском возникновения эмоциональных и поведенческих нарушений, является на сегодняшний день наиболее актуальным и перспективным в плане дифференцированного подхода к последующей психопрофилактике и лечению психической патологии у детей, оставшихся без попечения родителей. Цель исследования:Изучение вклада полиморфных вариантов генов TPH1, MAOA, HTR2A, DRD4, COMT, DBH, DRD2 в развитие психических нарушений у детей, оставшихся без попечения родителей. Материалы и методы:Было проведено клиническое обследование 516 социальных сирот в период с 2018 г. по 2020 г., которое также включало молекулярно-генетическое типирование следующих генов: rs1800532 TPH1(A218C), rs6323 MAOA (R297R), rs6313 HTR2A (T102C), rs1800955 DRD4 (C-521T), rs4680 COMT (G472A), rs1611115 DBH (C-1021T), rs1800497 DRD2 (Taq1A), проведенное путём анализа ДНК, полученной из лейкоцитов периферической крови. Были определены частоты генотипов и аллелей данных генов. Распределение частот генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди–Вайнберга с помощью критерия хи-квадрата Пирсона (χ2). Различия считались достоверными при уровне значимости р<0,05. Результаты:В группе детей-сирот с поведенческими нарушениями генотип АА и аллель А полиморфного маркера rs1800532 гена TPH1(A218C) встречались чаще, чем в группе контроля (p=0,006). Генотип АА и аллель А rs4680 гена COMT (G472A) и генотип Т/Т и аллель Т rs1800497 гена DRD2 (Taq1A) также имели значимые различия в исследуемых группах: они чаще встречались у социальных сирот, имеющих поведенческие психические расстройства (p=0,01 и p=0,003 соответственно). Заключение:Наличие полиморфизмов генов rs1800532 TPH1(A218C),rs4680 COMT (G472A) и rs1800497 DRD2 (Taq1A) у социальных сирот сопровождается повышением риска возникновения психических нарушений в 1,65 и более раз
Ключевые слова: дети, оставшиеся без попечения родителей, социальные сироты, полиморфизм генов, TPH1, MAOA, HTR2A, DRD4, COMT, DBH, DRD2
Введение. Состояние здоровья детей, оставшихся без попечения родителей, значительно отличается от здоровья детей, проживающих в полных семьях. Воспитанники интернатных учреждений имеют крайне негативные показатели психического и физического здоровья [1, 2]. Так, результаты зарубежных и отечественных исследований показывают, что сироты имеют разнообразные поведенческие и интеллектуальные нарушения [3, 4], они отличаются склонностью к агрессивности, делинквентности и употреблению психоактивных веществ [5, 6].
При этом в качестве причин формирования психических расстройств выделяют не только средовые и социальные факторы, но и генетическую предрасположенность [7, 8, 9]. В настоящее время наиболее важные патогенетические механизмы психических расстройств связаны с нарушениями нейромедиаторных систем мозга. Исследования показали, что ряд определенных полиморфизмов генов дофаминовой и серотониновой нейромедиаторных систем может иметь патогенетическое значение в формировании различных эмоциональных и поведенческих нарушений [8, 10, 11, 12]. Так, авторы относят к категории высокого риска по развитию склонности к антисоциальному поведению, депрессии, тревожности и алкоголизации наличие следующих полиморфизмов генов: rs1800532 TPH1(A218C), rs6323 MAOA (R297R), rs6313 HTR2A (T102C), rs1800955 DRD4 (C-521T), rs4680 COMT (G472A), rs 1611115 DBH (C-1021T), rs1800497 DRD2 (Taq1A)[12, 13, 14].
Полиморфизм гена триптофангидроксилазы 1 (TPH1) тесно ассоциирует со склонностью к суицидальному поведению, с развитием депрессивных психозов и высокой тревожностью [13]. Мутации в дофаминовых рецепторах второго и четвертого типов DRD2 и DRD4 могут являться маркерами импульсивности, делинквентного поведения и употребления ПАВ [15, 16]. Ассоциация гена СОМТ (катехол-О-метилтрансферазы) c агрессивным поведением установлена многими учеными [8, 11, 12]. Полиморфные варианты гена DBH (дофамин-β-гидроксилазы) влияют на развитие зависимости от алкоголя [17]. Исследования зарубежных авторов выявили также связь суицидального поведения с полиморфизмом гена рецептора 2А серотонина – HTR2A [18]. Ген моноаминоксидазы А (MAOA) является наиболее изученным, его особенности привлекают повышенное внимание исследователей в виду наличия его патогенетической связи с формированием агрессивного поведения [19, 20]. Полиморфизм гена МАОА считается вероятным геном-кандидатом антисоциального поведения и склонности к алкоголизации [7, 21, 22, 23].
В связи с вышеперечисленным по-прежнему остается актуальным исследование полиморфизмов генов нейромедиаторных систем мозга. Потребность в более глубоком анализе также объясняется тем, что наиболее точное, научное представление о психогенетических механизмах, которые находятся в основе возникновения психических расстройств, будет способствовать оказанию своевременной профилактики и помощи социальным сиротам.
Цель исследования. Изучение вклада полиморфных вариантов генов TPH1, MAOA, HTR2A, DRD4, COMT, DBH, DRD2 в развитие психических нарушений у детей, оставшихся без попечения родителей.
Материалы и методы исследования. На первом этапе исследования в период с 2018 г. по 2020 г. было проведено клиническое обследование 516 детей из 15 Центров помощи детям, оставшимся без попечения родителей (ЦПДОПР). После чего было проведено молекулярно-генетическое типирование исследуемых генов 400 воспитанникам из ЦПДОПР (основная группа). В группу контроля были включены 100 детей и подростков, обучающихся в общеобразовательной школе и проживающих в своих биологических полных семьях. Группы были сопоставимы по возрастной структуре (U=23870,5, p=0,23). Для клинической интерпретации психических и поведенческих расстройств применялись критерии МКБ-10.
Молекулярно-генетическое типирование для выявления однонуклеотидных полиморфизмов (ОНП) генов rs1800532 TPH1(A218C), rs6323 MAOA (R297R), rs6313 HTR2A (T102C), rs1800955 DRD4 (C-521T), rs4680 COMT (G472A), rs1611115 DBH (C-1021T), rs1800497 DRD2 (Taq1A) проведено путём анализа ДНК, полученной из лейкоцитов периферической крови («Синтол», НПФ «Литех», г. Москва) с использованием SNP-наборов, соответствующих заявленному полиморфизму («Синтол», НПФ «Литех», г. Москва). Метод исследования: PCR-EPh, PCR-Rt – полимеразная цепная реакция с детекцией продукта амплификации в агарозном геле (PCR-EPh) либо в режиме реального времени (PCR-Rt) (амплификаторы «ДТ-96», НПФ «ДНК-Технология», г. Москва).
При проведении статистического анализа авторы руководствовались принципами Международного комитета редакторов медицинских журналов (ICMJE) и рекомендациями «Статистический анализ и методы в публикуемой литературе» (SAMPL). Номинальные данные описывались с указанием абсолютных значений и процентных долей. Для оценки соответствия распределений генотипов ожидаемым значениям при равновесии Харди-Вайнберга и для сравнения распределений частот генотипов и аллелей в исследуемой и контрольной группах использовали критерий хи-квадрат Пирсона (χ2). Оценка значимости различий показателей проводилась также за счет определения отношения шансов (OR). Статистическая значимость отношения шансов оценивалась исходя из значений 95 % доверительного интервала (95 % СI) [24]. Значения уровня p<0,05 рассматривались как статистически значимые. Статистическая обработка результатов исследования осуществлялась с помощью пакета программ «IBM SPSS Statistics Version 25.0» (International Business Machines Corporation, США).
Этический аспект. В работе соблюдали этические принципы, предъявляемые Хельсинкской декларацией Всемирной медицинской ассоциации и Правилами клинической практики в Российской Федерации. От всех обследованных несовершеннолетних в возрасте 15-17 лет было получено письменное добровольное информированное согласие на участие в исследовании. Информированное согласие детей младше 15 лет подписывалось родителями, для детей-сирот – директорами (законными представителями) ГУСО ЦПДОПР Забайкальского края (Государственное учреждение социального обслуживания «Центр помощи детям, оставшимся без попечения родителей»). Данное исследование было одобрено этическим комитетом ФГБОУ ВО «Читинская государственная медицинская академия» Минздрава России (протокол № 87 от 30.11.2017 г.).
Результаты и их обсуждение. Результаты проведенного исследования показали, что социальные сироты и дети из полных семей отличаются по важным клинико-эпидемиологическим параметрам. Воспитанники ЦПДОПР имеют отягощенную алкоголизмом родителей наследственность, безнадзорное воспитание, низкую школьную успеваемость и поведенческие нарушения (p<0,001). Сравнительный анализ основных клинико-эпидемиологических показателей представлен в таблице 1.
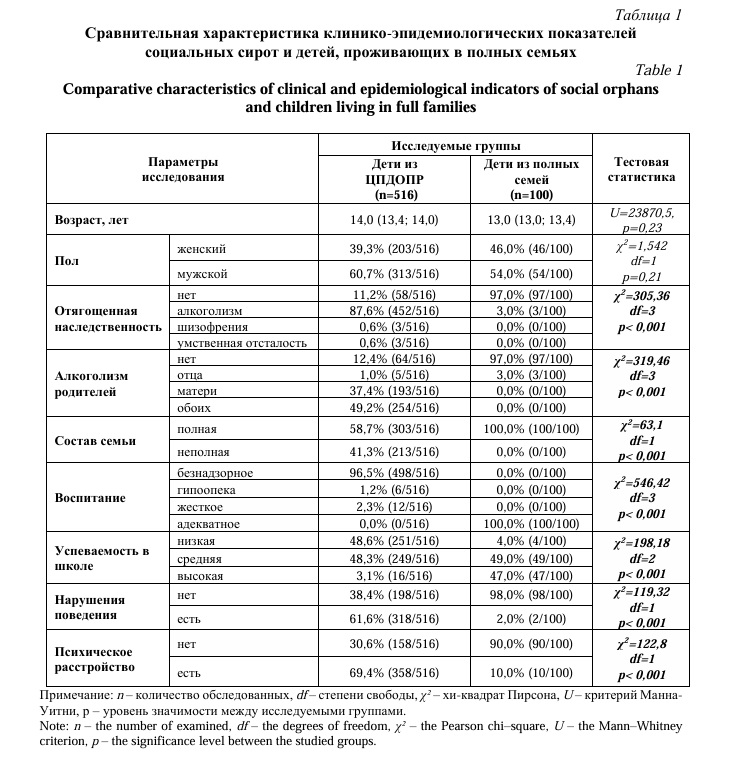
У 69,4% (358/516) воспитанников ЦПДОПР были диагностированы различные психические расстройства, структура выявленных психических нарушений была представлена следующим образом (по МКБ-10): ведущее место занимают «Органические легкие когнитивные расстройства» (F06.7) – 33,8% (121/358) и «Социализированное расстройство поведения» (F91.2) – 25,2% (90/358). Также часто у воспитанников диагностировались «Смешанные специфические расстройства развития» (ЗПР) (F83) – 18,2% (65/358). Небольшая доля приходилась на «Тревожное расстройство поведения» (F92.8) – 6,2% (22/358), «Органическое непсихотическое расстройство в связи со смешанными заболеваниями» (F06.82) – 5,3% (19/358), «Гиперкинетическое расстройство» (F90.1) – 4,7% (17/358) и «Депрессивное расстройство поведения» (F92.0) – 4,4% (16/358). В меньшей степени у детей было выявлено «Несоциализированное расстройство поведения» (F91.1) – 2,2% (8/358). Кроме того, у детей-сирот определены следующие наркологические расстройства: употребление алкоголя с вредными последствиями (F10.1) диагностировано в 18,0% случаев (93/516), употребление каннабиноидов с вредными последствиями (F12.1) – в 1,9% (10/516) случаев, употребление летучих растворителей с вредными последствиями (F18.1) – в 1,4% (7/516) случаев.
При обследовании учащихся общеобразовательной школы подавляющее большинство детей – 90,0% (90/100) было отнесено к группе здоровых, 10,0% (10/100) имели следующие нарушения: «Расстройство адаптации» (F43.2) – 3,0% (3/100), «Гиперкинетическое расстройство» (F90.1) – 2,0% (2/100), «Несоциализированное расстройство поведения» (F91.1) – 2,0% (2/100), «Преимущественно навязчивые мысли или размышления» (F42.0) – 1,0% (1/100), «Специфические расстройства речевой артикуляции» (F80.0) – 1,0% (1/100) и «Специфическое расстройство чтения» (F81.0) – 1,0% (1/100), т.е. грубых интеллектуальных и эмоционально-поведенческих психических расстройств у детей из полных семей зарегистрировано не было. Также, как и отсутствуют у них наркологические расстройства. Так при проведении теста «AUDIT» от 0 до 7 баллов (безопасное употребление алкоголя) набрали 100,0% (100/100) опрошенных.
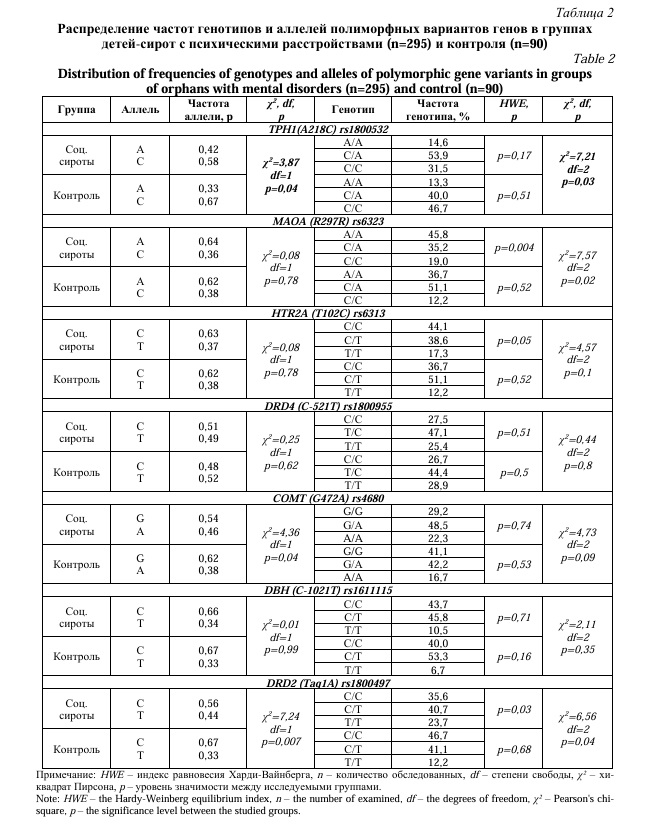
На втором этапе проведено исследование образцов ДНК 400 социальных сирот (основная группа) и 100 детей из полных семей (контрольная группа). После распределения исследуемых групп по критерию наличия/отсутствия психической патологии, было проведено сравнение частот генотипов в подгруппах детей-сирот с психическими расстройствами (n=295) и детей из полных семей, не имеющих психических нарушений (здоровые) (n=90). Статистически значимые различия частот генотипов в исследуемых подгруппах были выявлены только для полиморфного варианта rs1800532 гена TPH1(A218C)(p=0,03). При применении мультипликативной модели наследования показано, что частота аллеля А полиморфного маркера rs1800532 гена TPH1(A218C) была значимо выше в основной группе (0,42), чем в контрольной (0,33), что может указывать на ассоциацию данного аллеля с увеличением вероятности развития психических нарушений у социальных сирот (OR = 1,42 [95 % CI: 1,00-2,02], p=0,04). Аллель С, напротив, встречался чаще у детей из полных семей (0,67), чем у основной группы (0,58), что указывает на протективную роль данного аллеля в отношении развития психических расстройств (OR=0,70 [95 % CI: 0,50-1,00], p=0,04). Распределение частот генотипов генов rs6323 MAOA (R297R) и rs1800497 DRD2 (Taq1A) не соответствовало равновесию Харди-Вайнберга в основной группе, в отличии от контрольной, где уровень значимости был более 0,05 для генотипов всех исследуемых генов. Поэтому данные гены rs6323 MAOA (R297R) и rs1800497 DRD2 (Taq1A) были проанализированы только с применением общей модели (Табл. 2).
Для более точного выявления ассоциаций полиморфных вариантов генов TPH1, MAOA, HTR2A, DRD4, COMT, DBH, DRD2 с психическими расстройствами, основная группа была разделана по ведущей симптоматике на подгруппы: 167 детей-сирот с интеллектуальными (F06, F83) и 128 детей с поведенческими нарушениями (F90, F91, F92), после чего было проведено сравнение частот аллелей и генотипов этих подгрупп с детьми из полных семей, не имеющих психических расстройств (n=90). Сравнение частот генотипов детей-сирот с интеллектуальными нарушениями и контроля не выявило статистически значимых отличий (Табл. 3).
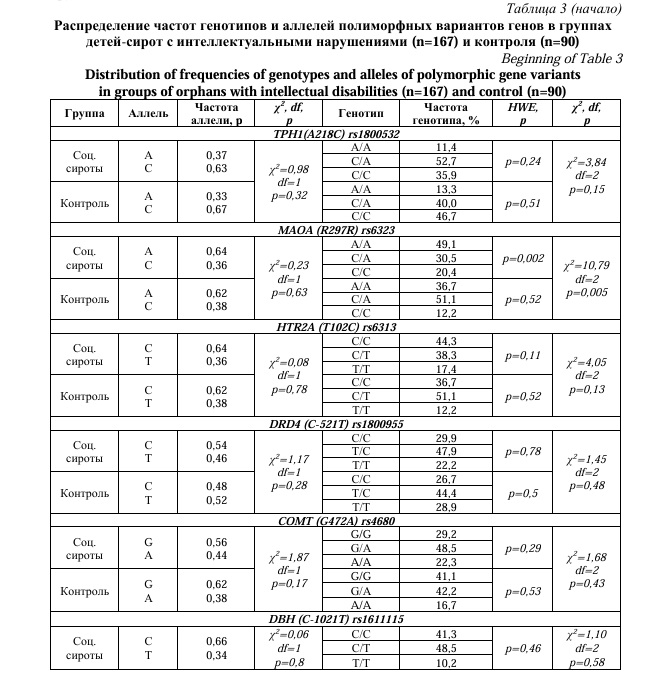
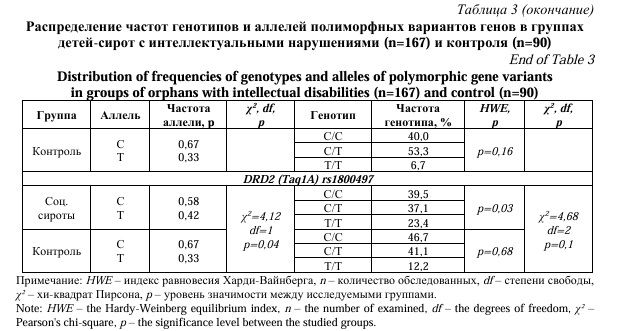
Однако при сравнительном анализе частот генотипов по полиморфным вариантам генов между группой детей-сирот с поведенческими нарушениями и контроля был выявлен ряд различий. Так значимое отличие частот генотипов показали полиморфизмы следующих генов: rs1800532 TPH1(A218C), rs4680 COMT (G472A) и rs1800497 DRD2 (Taq1A) (Табл. 4).
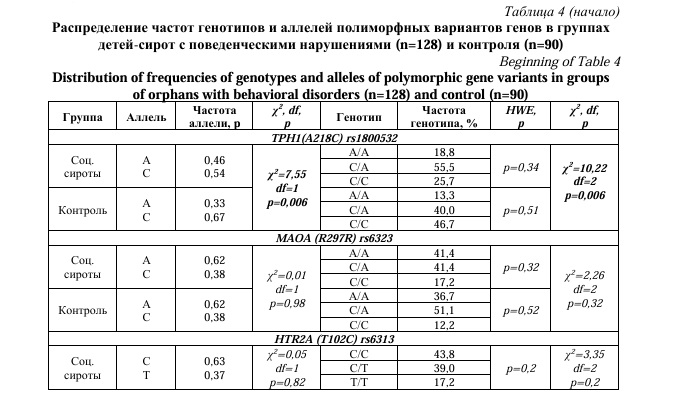
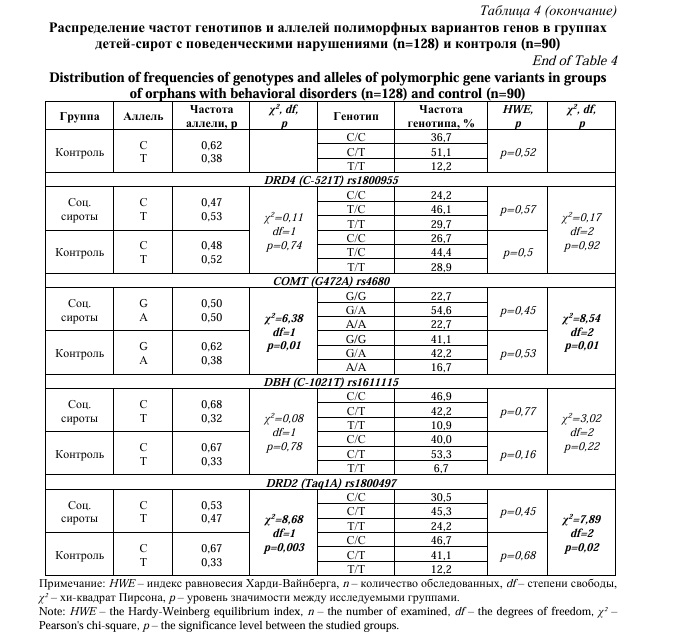
При анализе rs1800532 гена TPH1(A218C) было выявлено, что в группе сирот с поведенческими нарушениями частота встречаемости генотипа А/А была выше на 5,5%, чем в контрольной. Частота генотипа C/C была выше в группе детей из полных семей практически в два раза (p=0,006). Статистически значимые различия в частоте генотипов выявлены у rs4680 гена COMT (G472A): так, в контрольной группе здоровых детей генотип G/G встречался чаще на 18,4%, а у детей-сирот с поведенческими нарушениями частота встречаемости генотипа А/А была выше на 6,0% (p=0,01). В основной клинической группе генотип Т/Т полиморфного маркера rs1800497 гена DRD2 (Taq1A) встречался чаще на 12,0%, а частота генотипа С/С была ниже на 16,2% по сравнению с группой контроля (p=0,02).
Аллели и генотипы генов, соответствующие равновесию Харди-Вайнберга и имеющие значимые отличия, далее были проанализированы с применением мультипликативной модели наследования (Табл. 5).

Частота аллеля А полиморфного маркера rs1800532 гена TPH1(A218C) была выше в группе социальных сирот с поведенческими нарушениями, чем в контрольной группе. Аллель С встречался чаще у детей из полных семей (p=0,006). Результаты научных исследований показывают, что ген TPH1 кодирует триптофангидроксилазу 1, которая играет ключевую роль в регуляции синтеза серотонина, в тоже время полиморфный маркер rs1800532 гена TPH1(A218C) может менять экспрессию гена TPH1 [13]. Известно, что у носителей аллеля А имеется повышение синтеза фермента триптофангидроксилазы [25, 26], что может быть связано со склонностью к гиперактивности, повышенной тревожности и суицидальности [25, 27]. В связи с этим, полученные данные подтверждают, что полиморфный маркер rs1800532 гена TPH1(A218C) может быть связан с развитием эмоционально-поведенческих нарушений.
Ген COMT отвечает за активность фермента катехол-О-метилтрансферазы, который в свою очередь принимает участие в процессе деградации дофамина. Установлено, что аллель А снижает функциональную активность фермента и, таким образом, у носителей с мутацией А/А уровень дофамина выше, чем у людей с «условно нормальным» генотипом G/G [28]. В связи с чем, исследователи ассоциируют наличие мутантного аллеля А и генотипа А/А гена COMT со склонностью к гетероагрессии и криминальному поведению [29, 30], с предрасположенностью к алкоголизации [31] и паническим расстройствам [32]. Согласно проведенному исследованию, частота аллеля А полиморфного варианта rs4680 гена COMT (G472A) была выше у социальных сирот, имеющих поведенческие психические расстройства, тогда как G-аллель чаще встречался в группе здоровых детей (p=0,01).
Были также обнаружены отличия в частотах аллелей гена rs1800497 DRD2 (Taq1A). Аллель Т гораздо чаще встречался у детей-сирот с поведенческими нарушениями, чем у контрольной группы, где доминировал аллель С (p=0,003). Ряд исследований доказывают связь генетического полиморфизма дофаминового рецептора второго типа DRD2, а именно наличие Т-аллеля с патологическим агрессивным поведением [33], повышенной суицидальности и алкоголизации [34].
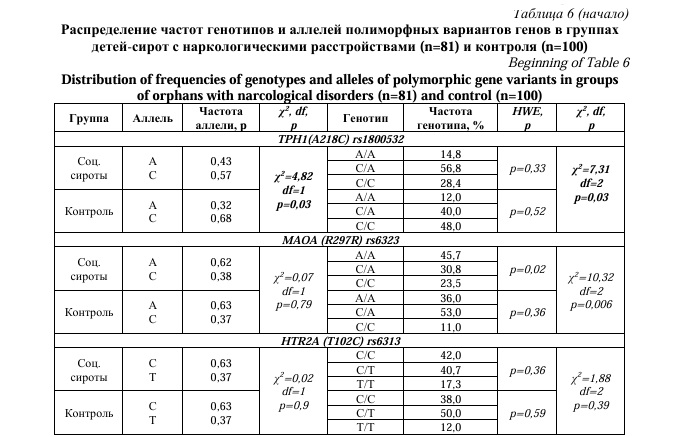
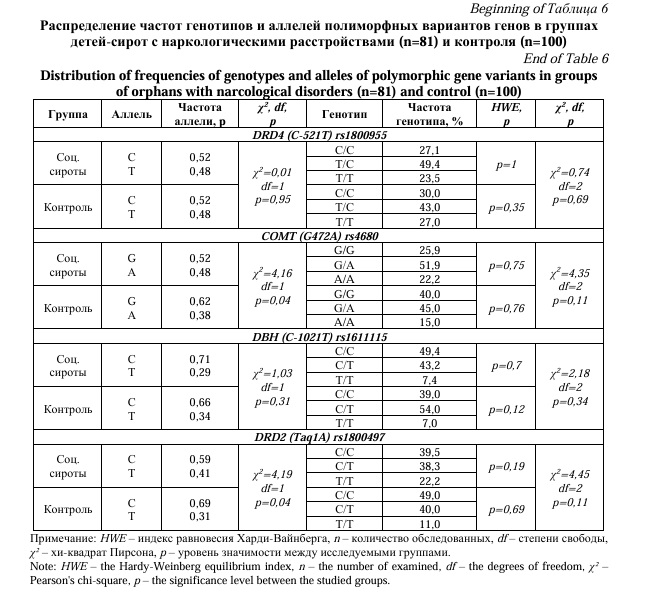
Далее был проведен сравнительный анализ частот генотипов по полиморфным вариантам генов между группой социальных сирот с наркологическими расстройствами (употребление алкоголя с вредными последствиями – F10.1) (n=81) и группой детей из полных семей, не имеющих данных расстройств (n=100). Статистически значимые различия частот генотипов были обнаружены только для гена TPH1(A218C)(p=0,03) (Табл. 6). При применении мультипликативной модели наследования выявлено, что частота аллеля А полиморфного маркера rs1800532 гена TPH1(A218C) была выше у детей-сирот с алкогольными расстройствами (0,43), чем в контрольной группе (0,32), отношение шансов составило 1,62 [95% CI: 1,05-2,49]. При этом аллель С встречался чаще у детей из полных семей (0,68), чем у социальных сирот (0,57), что может также свидетельствовать о его протективной роли в развитии наркологической патологии (OR=0,62 [95% CI: 0,40-0,95], p=0,03). Исходя из вышеизложенного, можно предположить, что наличие аллеля А гена TPH1(A218C) может быть связано не только с эмоционально-поведенческими нарушениями, но и являться также предиктором алкогольных расстройств.
Заключение. Таким образом, проведенное исследование полиморфизмов генов нейромедиаторных систем мозга свидетельствует о важной роли полиморфных вариантов генов rs1800532 TPH1(A218C), rs4680 COMT (G472A) и rs1800497 DRD2 (Taq1A) в развитии психических расстройств у социальных сирот. Наличие указанных полиморфизмов сопровождается повышением риска возникновения поведенческих психических нарушений в 1,65 и более раз.
Значимость полученных результатов исследования продиктована не только установлением генетических полиморфизмов в качестве предикторов развития психических заболеваний, но и оценкой риска развития отдельных нозологических единиц в зависимости от конкретного полиморфного маркера гена, что в дальнейшем будет иметь место в разработке дифференцированной психопрофилактики и лечения эмоционально-поведенческих психических нарушений.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы