Ассоциации полиморфных локусов генов-кандидатов с уровнем половых гормонов у больных гиперплазией эндометрия
Aннотация
Актуальность: Гиперплазия эндометрия (ГЭ) является одним из распространенных гинекологических заболеваний, в патофизиологии которого важное значение имеют половые гормоны. Возникновение гиперэстрогении на фоне недостатка прогестерона имеет ключевое значение в индукции ГЭ. Генетические факторы, связанные с уровнем половых гормонов в организме, могут иметь существенное значение в патогенетике заболевания. Цель исследования:Дать характеристикугормонального профиля больных ГЭ и оценить связь полиморфных локусов генов-кандидатов с уровнем половых гормонов. Материалы и методы:На выборке из 66 больных ГЭ оценены ассоциации девяти SNP генов-кандидатов (в ранее проведенных полногеномных исследованиях (GWAS) показали значимые ассоциации с уровнем половых гормонов) с уровнем половых гормонов в сыворотке крови (эстрадиол, прогестерон, фолликулостимулирующий и лютеинизирующий гормоны, тестостерон, пролактин, дегидроэпиандростерон). Анализ ассоциаций проводился методом линейной регрессии в программе gPLINK (в расчетах использовались трансформированные значения концентраций половых гормонов) в рамках трех генетических моделей – аллельной, аддитивной и доминантной с учетом ковариат и пермутационных процедур. Результаты:С уровнем половых гормонов у пациенток с ГЭ ассоциированы следующие полиморфизмы: C>G rs112295236SLC22A10 (эстрадиол; β=-0,647, pperm≤0,013), T>C rs148982377 ZNF789 (тестостерон; β=-0,870 - -0,917, pperm≤0,021 и прогестерон; β=1,051 - 1,571, pperm≤0,049) и G>T rs34670419ZKSCAN5 (тестостерон; β=-0,870 - -0,934, pperm≤0,013 и прогестерон; β=1,025, pperm≤0,041), T>A rs11031002FSHB (фолликулостимулирующий гормон; β=0,466, pperm=0,050) иT>C rs11031005FSHB (фолликулостимулирующий гормон; β=0,469, pperm≤0,050), C>T rs727428SHBG (лютеинизирующий гормон; β=-0,335 - -0,357, pperm≤0,050), C>T rs1641549TP53 (фолликулостимулирующий гормон; β=-0,295 - -0,373, pperm≤0,049 и лютеинизирующий гормон; β=-0,319 - -0,362, pperm≤0,033). Выявлены ассоциации с концентрацией половых гормонов следующих гаплотипов: тестостерон - TG*rs148982377-rs34670419 (β=0,952, pperm=0,001) и CT*rs148982377-rs34670419 (β=-0,858, pperm=0,042); прогестерон - CT*rs148982377-rs34670419 (β=1,570, pperm=0,029) и TG*rs148982377-rs34670419 (β=-1,030, pperm=0,047); фолликулостимулирующий гормон - AC*rs11031002-rs11031005 (β=0,466, pperm=0,050) и TT*rs11031002-rs11031005 (β=-0,466, pperm=0,050). Заключение:GWAS-значимые полиморфные локусы генов-кандидатов ассоциированы с уровнем половых гормонов у больных ГЭ
Введение. Гиперплазия эндометрия (ГЭ) является одним из распространенных гинекологических заболеваний, при котором происходит выраженная пролиферация желез эндометрия, обусловливающее увеличение железисто-стромального соотношения [1-4]. Частота выявления ГЭ у женщин в возрасте 18-90 лет составляет 132 на 100 000 женщин-лет, среди которых простая гиперплазия регистрируется в 58 случаях на 100 000 женщин-лет, сложная ГЭ – в 63 и атипичная – в 17 на 100 000 женщин-лет [5]. Распространенность простой и сложной гиперплазии наиболее высока у женщин в возрасте 50-54 лет (142 и 212 на 100 000 женщин-лет соответственно), а встречаемость атипичной гиперплазии имеет максимальные значения у женщин в возрасте 60-64 лет (54 на 100 000 женщин-лет) [5]. Распространенность ГЭ в целом является минимальной у женщин в возрасте до 30 лет (6 на 100 000 женщин-лет), неуклонно увеличивается с каждым 5-летним интервалом между 30 и 54 годами и достигает наиболее высоких значений у женщин в возрасте 50-54 лет (386 на 100 000 женщин-лет) [5]. При прогрессии ГЭ вероятность развития рака эндометрия в 4 раза выше при атипичной ГЭ (как простые, так и сложные варианты) по сравнению с ГЭ при отсутствии атипии [6].
В патофизиологии ГЭ важное значение имеют половые гормоны – возникновение гиперэстрогении на фоне недостатка прогестерона имеет ключевое значение в индукции ГЭ [7-15]. Эстрогены, взаимодействия со своими «специфическими» рецепторами, способствуют повышенной пролиферативной активности клеток эндометрия [10,15,16]. Генетические факторы, связанные с уровнем половых гормонов в организме, могут иметь существенное значение в патогенетике заболевания. В литературе имеются многочисленные данные полногеномных исследований (GWAS) о связи ряда полиморфных локусов (T>C rs148982377 ZNF789, G>T rs34670419 ZKSCAN5, T>A rs11031002 FSHB, T>C rs11031005 FSHB, C>G rs112295236 SLC22A10, C>A rs117585797 ANO2, A>C rs117145500 CHD9, C>T rs727428 SHBG, C>T rs1641549 TP53 и др.) с содержанием половых гормонов (эстрадиол, прогестерон, тестостерон, глобулин, транспортирующий половые гормоны, лютеинизирующий гормон, фолликулостимулирующий гормон, дегидроэпиандростерон, индекс свободных андрогенов) и их метаболитов в организме [17-27]. Исходя из вышеприведенных данных можно предположить наличие потенциальных связей между GWAS-значимыми для уровня половых гормонов полиморфными локусами и содержанием половых гормонов у больных ГЭ.
Целью исследования. Дать характеристику гормонального профиля больных ГЭ и оценить связь полиморфных локусов генов-кандидатов с уровнем половых гормонов.
Материалы и методы исследования. На выборке из 66 больных ГЭ оценены ассоциации SNP генов-кандидатов с уровнем половых гормонов в сыворотке крови (эстрадиол, прогестерон, фолликулостимулирующий и лютеинизирующий гормоны, тестостерон, пролактин, дегидроэпиандростерон). В изучаемой выборке 66 женщин с ГЭ лишь 13,63% индивидов (n=9) имели изолированную ГЭ, тогда как подавляющее большинство исследуемых женщин (86,37%, n=57) имели различные сочетанные гиперпластические заболевания матки: сочетание ГЭ и миомы – 25,76% (n=17), ГЭ и эндометриоза – 40,91% (n=27), ГЭ, миомы и эндометриоза – 19,70% (n=13). У 10% (n=6) обследуемых женщин было зарегистрировано ожирение. Таким образом, исследование гормонального профиля и ассоциаций SNP генов-кандидатов с уровнем половых гормонов нами проводилось в группе женщин, имеющих в основном сочетанные пролиферативные заболевания матки (более 86%) и не имеющих в подавляющем большинстве ожирения (90%).
Для молекулярно-генетического исследования нами были отобраны ряд полиморфных локусов (9 SNP): T>C rs148982377 ZNF789 (7 хр), G>T rs34670419 ZKSCAN5 (7 хр), T>A rs11031002 FSHB (11 хр), T>C rs11031005 FSHB (11 хр), C>G rs112295236 SLC22A10 (11 хр), C>A rs117585797 ANO2 (12 хр), A>C rs117145500 CHD9 (16 хр), C>T rs727428 SHBG (17 хр), C>T rs1641549 TP53 (17 хр), которые в ранее проведенных полно-геномных исследованиях показали ассоциации с содержанием половых гормонов (эстрадиол, прогестерон, тестостерон, глобулин, транспортирующий половые гормоны, лютеинизирующий гормон, фолликулостимулирующий гормон, дегидроэпиандростерон, индекс свободных андрогенов) и их метаболитов в организме [17-27]. Для генотипирования использовалась ДНК, хранящаяся в биобанке кафедры медико-биологических дисциплин НИУ БелГУ (хранение ДНК осуществляется в кельвинаторах при температуре -80℃). Генотипирование SNP выполнялось в режиме «real-time PCR» на оборудовании кафедры медико-биологических дисциплин НИУ «БелГУ» (амплификаторы CFX-96 Touch (BioRad, США)) с использованием специально изготовленных «Тест – Ген» (г. Ульяновск) для тестирования этих полиморфизмов наборов реагентов (содержат специфические праймеры и зонды).
Анализ ассоциаций проводился методом линейной регрессии в программе gPLINK (версия 2.050) в рамках трех генетических моделей – аллельной, аддитивной и доминантной. Параметры рецессивной модели не рассчитывались в связи с низкой частотой полиморфных (альтернативных) вариантов по подавляющему числу рассмотренных локусов. В связи с тем, что, распределение количественных характеристик (концентрация в сыворотке крови) вышеуказанных половых гормонов отличалось от нормального (оценивалась стандартным способом с помощью критерия Шапира-Уилка) для линейного регрессионного анализа использовались их трансформированные значения. Процедура трансформации количественных характеристик (приведение их к нормальному распределению) была выполнена в программной среде R (версия 3.4.0, дата доступа 15.12.2023) с использованием команды QQ-plot функции «b<-qqnorm(a,plot=F)$x» [28].
Ассоциации SNP с уровнем половых гормонов оценивались на основе рассчитанных при линейном регрессионном анализе показателей коэффициентов регрессии (β) и их ошибок (SE), «описывающих» направленность изменения трансформированных значений уровня отдельных половых гормонов на один минорный аллель. При проведении вычислений были использованы следующие ковариаты: возраст женщины, ее ИМТ, наличие различных коморбидных гиперпластических заболеваний матки (эндометриоз, миома матки). Для коррекции на множественные сравнения был использован пермутационный тест [29], и в качестве «порогового» уровня выделения статистически значимых результатов было выбрано значение рperm≤0,05 [30]. Пермутационные процедуры проводились для каждой из трех рассмотренных генетических моделей в программе gPLINK (версия 2.050).
Результаты и их обсуждение. Проведено исследование показателей гормонального статуса 66 женщин с ГЭ. Средний возраст рассматриваемой выборки составил 35,51±5,94 лет (варьировал от 22 до 53 лет), средний ИМТ был равен 24,03±4,54 (варьировал от 18 до 37). Характеристика гормонального профиля изучаемой выборки с ГЭ приведена в таблице 1.
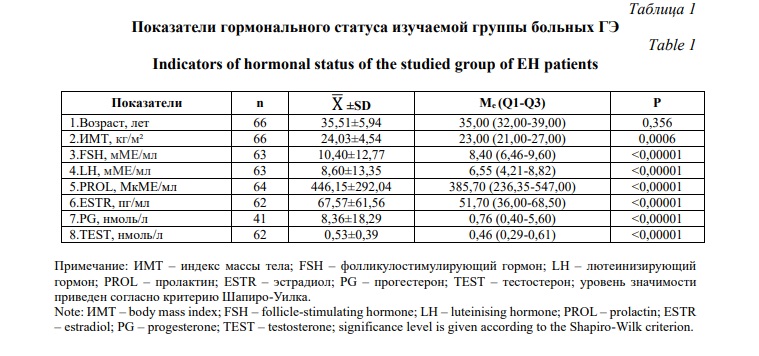
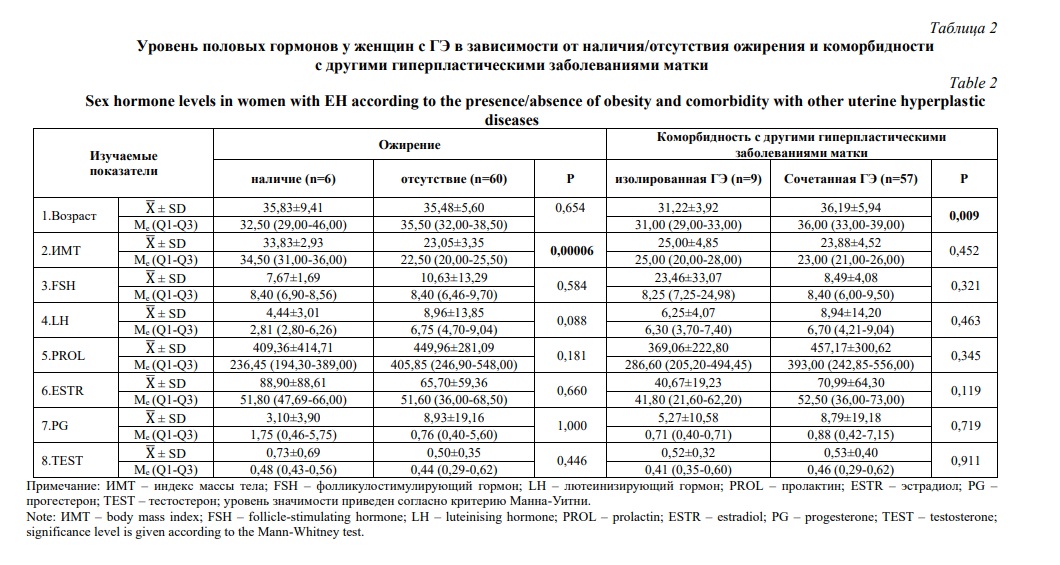
Для всех рассматриваемых гормонов распределение не соответствовало нормальному (при оценке характера распределения использовался критерий Шапиро-Уилка) (р<0,00001) (Табл. 1). В соответствии с этим при дальнейшем сравнительном статистическом анализе мы использовали критерий Манна-Уитни. Статистически значимых различий в уровне изучаемых половых гормонов в группах женщин с наличием/отсутствием ожирения и группах женщин с изолированным и сочетанным ГЭ мы не обнаружили (Табл. 2).
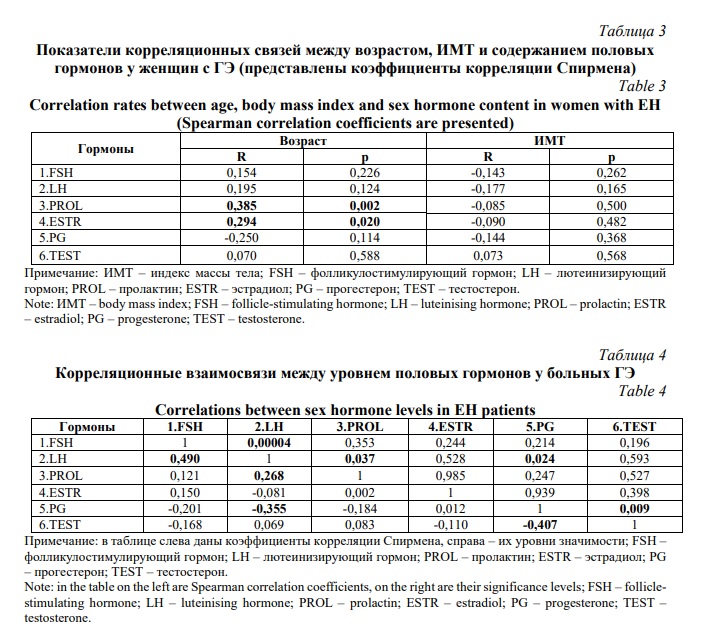
Выявлены положительные корреляционные связи между возрастом больных ГЭ и уровнем эстрадиола (R=0,294 р=0,020) и пролактина (R=0,385 р=0,002) (Табл. 3). Проведенный анализ корреляционных связей между содержанием половых гормонов в изучаемой выборке 66 женщин с ГЭ показал следующие статистически достоверные результаты: а) уровни фолликулостимулирующего и лютеинизирующего гормонов положительно коррелировали между собой (R=0,490 р=0,00004); б) уровень лютеинизирующего гормона положительно коррелировал с уровнем фолликулостимулирующего гормона (указано выше), пролактина (R=0,268 р=0,037) и отрицательно - с уровнем прогестерона (R=-0,355 р=0,024); с) уровень прогестерона положительно взаимосвязан с уровнем лютеинизирующего гормона (указано выше) и отрицательно – с уровнем тестостерона (R=-0,407 р=0,009) (Табл. 4). Итак, в изучаемой нами выборке 66 больных ГЭ (преимущественно имеют сочетанные пролиферативные заболевания матки и не имеют ожирения) обнаружены статистически значимые корреляции разной направленности (положительные и отрицательные) между уровнем ряда половых гормонов (фолликулостимулирующего, лютеинизирующего, пролактина, прогестерона, тестостерона).
В работе Ruth K.S. et al. (выполнена на выборке из 2913 индивидов (90% из которых были женщины) из когорты Twins UK) [17] были установлены следующие взаимосвязи: FAI положительно коррелировал с тестостероном (r=0,69) и отрицательно − с SHBG (r=-0,61), что, как указывают авторы и следовало ожидать, поскольку FAI - это рассчитанный показатель количества андрогенов, не связанного с SHBG. Тестостерон и SHBG не коррелировали между собой (r=0,04). Прогестерон положительно коррелировал с DHEAS (r=0,60) и, в меньшей степени, с тестостероном (r=0,44). Так как прогестерон коррелировал с тестостероном он так же показал взаимосвязи и с FAI (r=0,39) DHEAS также положительно коррелировал с тестостероном (r=0,55) и, как следствие, с FAI (r=0,52). Наблюдалась сильная положительная корреляция между FSH и LH (r=0,63). Эстрадиол менее выраженно положительно коррелировал с тестостероном (r=0,22) и отрицательно коррелировал с FSH (r=-0,24).
Таким образом, наши данные и результаты, полученные Ruth K.S. et al. [17], были в полной мере схожи по корреляциям FSH и LH (R=0,490 и r=0,63 соответственно). Вместе с этим в нашей работе содержание прогестерона отрицательно коррелировало с уровнем тестостерона (R=-0,407), тогда как в работе Ruth K.S. et al. [17] между ними были обнаружены положительные корреляции (r=0,44). Эти различия могут быть обусловлены тем, что в работе Ruth K.S. et al. изучалась выборка относительно здоровых индивидумов [17], а в нашем исследовании изучены женщины с ГЭ, которые преимущественно имели различные сочетания доброкачественных пролиферативных заболеваний матки.
На следующем этапе мы оценили ассоциации SNP генов-кандидатов с уровнем половых гормонов в вышеуказанной группе 66 женщин с ГЭ. При проведении вычислений были использованы следующие ковариаты: возраст женщины, ее ИМТ, наличие различных коморбидных гиперпластических заболеваний матки (миома, эндометриоз).
Данные о распределении изучаемых полиморфных вариантов генов-кандидатов половых гормонов среди 66 женщин с ГЭ представлены в таблице 5. Важно отметить, что распределение всех исследуемых 9 SNP находится в полном соответствии с законом Харди-Вайнберга при рHWE >0,05. Частоты минорных аллельных вариантов по разным локусам находятся в пределах от 0,031 (G>T rs34670419 ZKSCAN5) - 0,032 (C>A rs117585797 ANO2) до 0,395 (C>T rs727428 SHBG).
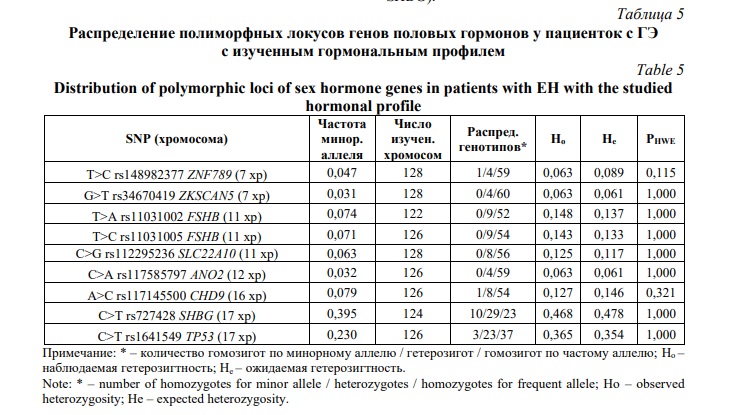
Далее мы провели анализ связи полиморфизма генов-кандидатов половых гормонов с уровнем половых гормонов у 66 женщин с ГЭ; полученные результаты представлены в таблицах 6-11. Следует отметить, что рецессивная модель ассоциаций SNP с содержанием половых гормонов в связи с низким уровнем полиморфизма большинства рассматриваемых локусов (для семи SNP из девяти изучаемых локусов частота минорного аллеля была в пределах 0,031-0,079) нами не рассматривалась.
Согласно полученным данным с уровнем эстрадиола у больных ГЭ был ассоциирован полиморфизм C>G rs112295236 SLC22A10 в рамках аддитивной (β=-0,647, р=0,010, pperm=0,013) и доминантной (β=-0,647, р=0,010, pperm=0,010) моделей (Табл. 6). При этом маркером низкого уровня эстрадиола у женщин с ГЭ является минорный аллель G rs112295236 SLC22A10 (β<0).
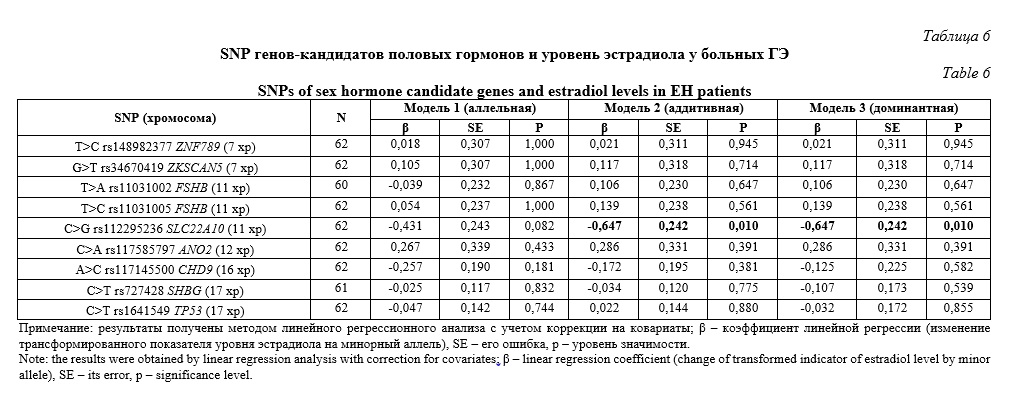
Содержание тестостерона в исследуемой группе женщин было связано с двумя полиморфизмами – T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5 (Табл. 7), в трех генетических моделях – аллельной (β=-0,870, р=0,003, pperm=0,021 и β=-0,870, р=0,003, pperm=0,013 соответственно), аддитивной (β=-0,917, р=0,003, pperm=0,004 и β=-0,934, р=0,003, pperm=0,006 соответственно) и доминантной (β=-0,917, р=0,003, pperm=0,005 и β=-0,934, р=0,003, pperm=0,008 соответственно). Минорные аллельные варианты этих полиморфизмов (C rs148982377 ZNF789 и T rs34670419 ZKSCAN5) маркируют более низкое содержание тестостерона в сыворотке больных ГЭ (β<0). Вместе с этим, с уровнем тестостерона ассоциированы и два гаплотипа вышеуказанных полиморфизмов: гаплотип TG*rs148982377-rs34670419 (частота данного гаплотипа составляет 95,20%) связан с более высокой концентрацией тестостерона (β=0,952, р=0,0007, pperm=0,001), а гаплотип CT*rs148982377-rs34670419 (частота данного гаплотипа составляет 3,22%) связан с более низким содержанием тестостерона (β=-0,858, р=0,016, pperm=0,042).
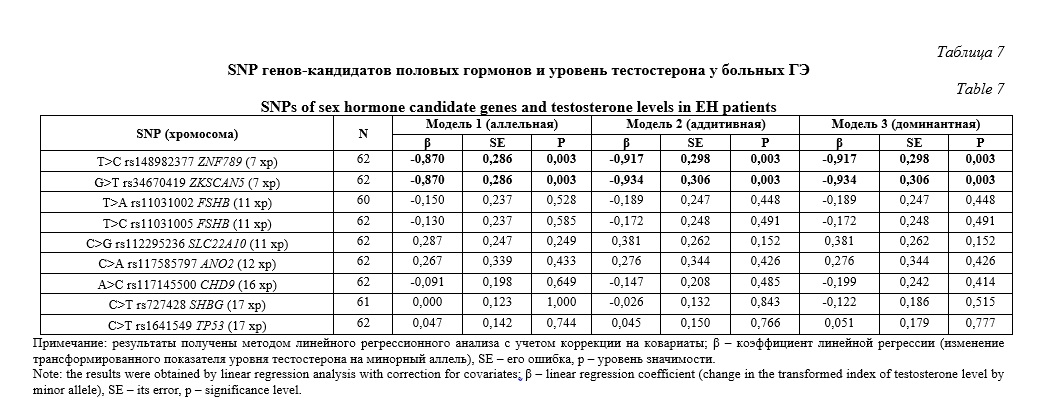
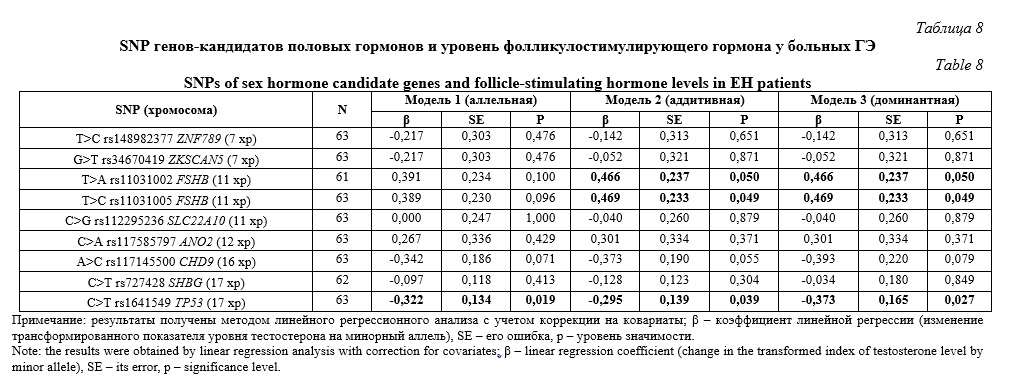
Согласно полученных нами данных содержание фолликулостимулирующего гормона у женщин с ГЭ ассоциировано с тремя полиморфизмами – T>A rs11031002 FSHB , T>C rs11031005 FSHB и C>T rs1641549 TP53 (Табл. 8). Полиморфные локусы T>A rs11031002 FSHB и T>C rs11031005 FSHB ассоциированы с уровнем данного гормона в рамках аддитивной (β=0,466, р=0,050, pperm=0,050 и β=0,469, р=0,049, pperm=0,050 соответственно) и доминантной (β=0,466, р=0,050, pperm=0,050 и β=0,469, р=0,049, pperm=0,049 соответственно) моделей. Так же, два гаплотипа вышеуказанных полиморфизмов связаны с концентрацией фолликулостимулирующего гормона в изучаемой группе женщин с ГЭ: AC*rs11031002-rs11031005 (β=0,466, р=0,050, pperm=0,050) и TT*rs11031002-rs11031005 (β=-0,466, р=0,050, pperm=0,050). SNP C>T rs1641549 TP53 показал ассоциацию с содержанием фолликулостимулирующего гормона в рамках всех трех рассмотренных генетических моделей – аллельной (β=-0,322, р=0,019, pperm=0,033), аддитивной (β=-0,295, р=0,039, pperm=0,049) и доминантной (β=-0,373, р=0,027, pperm=0,028). Важно отметить, что аллельные варианты A rs11031002 FSHB и C rs11031005 FSHB являются маркерами более высокого уровня FSH в организме больных ГЭ (β>0), а аллель T rs1641549 TP53 маркирует пониженное содержание этого гормона (β<0).
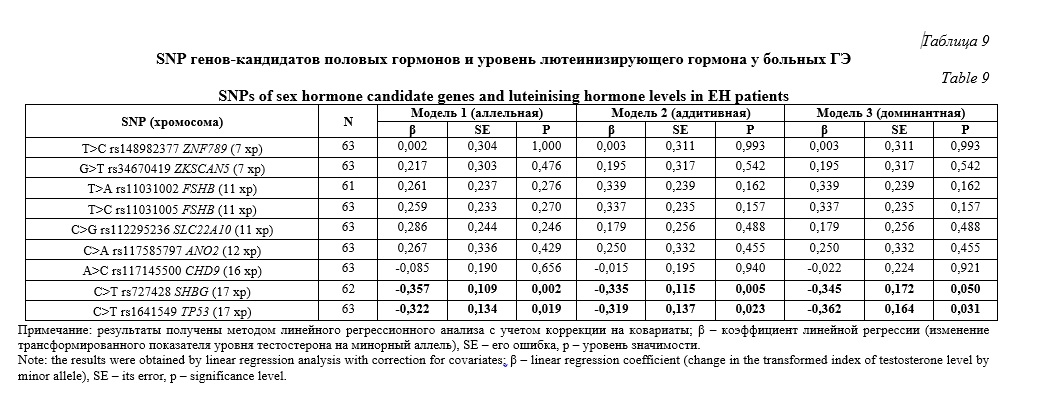
C уровнем лютеинизирующего гормона ассоциированы однонуклеотидные полиморфизмы C>T rs727428 SHBG и C>T rs1641549 TP53 в рамках всех трех рассмотренных генетических моделей (Табл. 9): аллельной (β=-0,357, р=0,002, pperm=0,002 и β=-0,322, р=0,019, pperm=0,041 соответственно), аддитивной (β=-0,335, р=0,005, pperm=0,005 и β=-0,319, р=0,023, pperm=0,024 соответственно) и доминантной (β=-0,345, р=0,050, pperm=0,050 и β=-0,362, р=0,031, pperm=0,033 соответственно). Минорные аллели этих полиморфизмов (аллели T) связаны с низким содержанием лютеинизирующего гормона у пациенток с ГЭ (β<0).
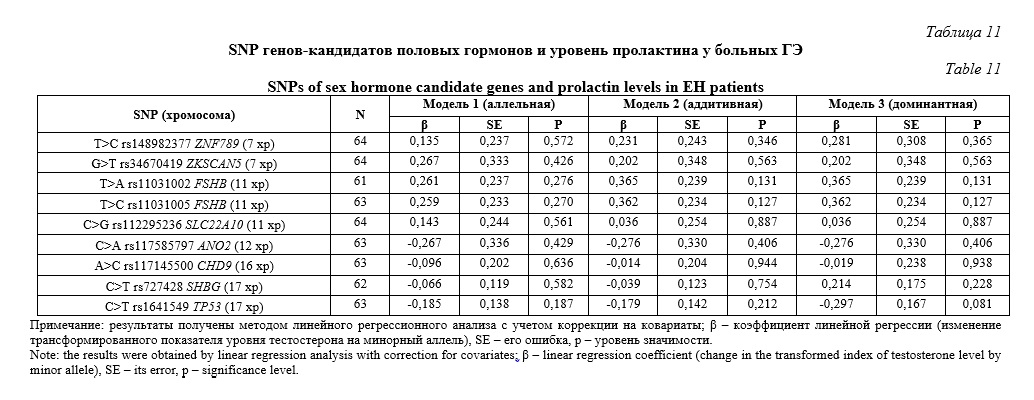
Два рядом расположенных и сильно сцепленных полиморфизма – T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5, «показали» значимые ассоциации с уровнем прогестерона у больных ГЭ (Табл. 10). SNP T>C rs148982377 ZNF789 связан с содержанием прогестерона согласно трех генетических моделей: аллельной (β=1,051, р=0,039, pperm=0,049), аддитивной (β=1,571, р=0,006, pperm=0,012), доминантной (β=1,571, р=0,006, pperm=0,019). Локус G>T rs34670419 ZKSCAN5 был ассоциирован с уровнем данного гормона в рамках аддитивной (β=1,025, р=0,037, pperm=0,039) и доминантной (β=1,025, р=0,037, pperm=0,041) генетических моделей. При этом, альтернативные аллельные варианты этих локусов (C rs148982377 ZNF789 и T rs34670419 ZKSCAN5) являются маркерами более высокого содержания прогестерона у пациенток с ГЭ (β>0). Нами установлена связь с уровнем прогестерона двух гаплотипов этих полиморфизмов: гаплотип CT*rs148982377-rs34670419 (частота этого гаплотипа равна 2,44%) маркирует более высокий уровень прогестерона (β=1,570, р=0,006, pperm=0,029), тогда как гаплотип TG*rs148982377-rs34670419 (частота гаплотипа – 96,30%) является маркером более низкого содержания прогестерона (β=-1,030, р=0,037, pperm=0,047).Статистически значимых ассоциаций, рассматриваемых в настоящей работе девяти полиморфных локусов генов-кандидатов половых гормонов с уровнем пролактина у женщин с ГЭ нами не установлено (Табл. 11).
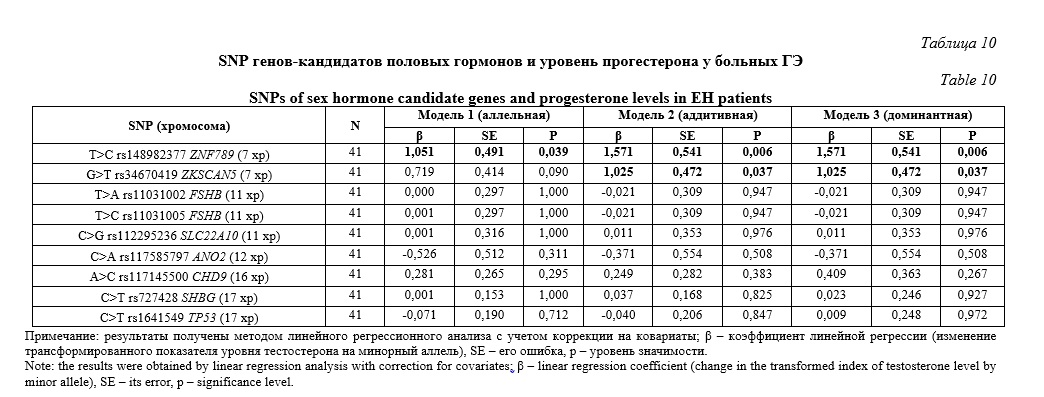
 Итак, следует отметить наличие значительного количества ассоциативных связей, рассмотренных в работе SNP генов-кандидатов половых гормонов с уровнем половых гормонов у больных ГЭ. Семь из девяти изученных SNP «продемонстрировали» вовлеченность в формированием гормонального профиля пациенток с ГЭ (пять из шести рассмотренных гормонов – тестостерон, эстрадиол, прогестерон, фолликулостимулирующий и лютеинизирующий гормоны, были ассоциированы с изучаемыми SNP) и в том числе C>G rs112295236 SLC22A10 (эстрадиол), T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5 (тестостерон и прогестерон), T>A rs11031002 FSHB и T>C rs11031005 FSHB (фолликулостимулирующий гормон), C>T rs727428 SHBG (лютеинизирующий гормон), C>T rs1641549 TP53 (фолликулостимулирующий и лютеинизирующий гормоны). При этом, с более низким содержанием эстрадиола у женщин с ГЭ связан минорный аллель G rs112295236 SLC22A10, тестостерона – C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, гаплотип CT*rs148982377-rs34670419, фолликулостимулирующего гормона – T rs1641549 TP53, гаплотип TT*rs11031002-rs11031005, лютеинизирующего гормона – T rs727428 SHBG и T rs1641549 TP53, прогестерона – гаплотип TG*rs148982377-rs34670419, а с более высокими уровнями прогестерона ассоциированы альтернативные аллели C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, фолликулостимулирующего гормона – A rs11031002 FSHB и C rs11031005 FSHB, гаплотип AC*rs11031002-rs11031005, тестостерона – гаплотип TG*rs148982377-rs34670419.
Итак, следует отметить наличие значительного количества ассоциативных связей, рассмотренных в работе SNP генов-кандидатов половых гормонов с уровнем половых гормонов у больных ГЭ. Семь из девяти изученных SNP «продемонстрировали» вовлеченность в формированием гормонального профиля пациенток с ГЭ (пять из шести рассмотренных гормонов – тестостерон, эстрадиол, прогестерон, фолликулостимулирующий и лютеинизирующий гормоны, были ассоциированы с изучаемыми SNP) и в том числе C>G rs112295236 SLC22A10 (эстрадиол), T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5 (тестостерон и прогестерон), T>A rs11031002 FSHB и T>C rs11031005 FSHB (фолликулостимулирующий гормон), C>T rs727428 SHBG (лютеинизирующий гормон), C>T rs1641549 TP53 (фолликулостимулирующий и лютеинизирующий гормоны). При этом, с более низким содержанием эстрадиола у женщин с ГЭ связан минорный аллель G rs112295236 SLC22A10, тестостерона – C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, гаплотип CT*rs148982377-rs34670419, фолликулостимулирующего гормона – T rs1641549 TP53, гаплотип TT*rs11031002-rs11031005, лютеинизирующего гормона – T rs727428 SHBG и T rs1641549 TP53, прогестерона – гаплотип TG*rs148982377-rs34670419, а с более высокими уровнями прогестерона ассоциированы альтернативные аллели C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, фолликулостимулирующего гормона – A rs11031002 FSHB и C rs11031005 FSHB, гаплотип AC*rs11031002-rs11031005, тестостерона – гаплотип TG*rs148982377-rs34670419.
Обращает на себя внимание факт того, что полимофные варианты C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, гаплотип CT*rs148982377-rs34670419 одновременно связаны с низким уровнем тестостерона и высоким содержанием прогестерона, тогда как гаплотип TG*rs148982377-rs34670419 одновременно коррелирует с высокими концентрациями тестостерона и низкими – прогестерона у пациенток с ГЭ. Так же нами обнаружена связь аллеля T rs1641549 TP53 с более низким уровнем как фолликулостимулирующего гормона, так и лютеинизирующего гормона.
В ранее проведенном исследовании этой же панели SNP у больных эндометриозом из этой же популяции (Центральное Черноземье РФ) Головченко И.О. показал, что генетическими маркерами уровня половых гормонов у женщин с эндометриозом являются rs148982377 ZNF789 и rs34670419 ZKSCAN5 (эстрадиол, тестостерон), rs117585797 ANO2 (лютеинизирующий гормон), rs117145500 CHD9 (прогестерон), rs1641549 TP53 (пролактин) [31]. Следует отметить, «совпадение» наших данных с результатами, полученными Головченко И.О., лишь по вовлеченности полиморфизмов T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5 в формирование уровня тестостерона. Остальные генетические детерминанты, маркирующие уровень отдельных половых гормонов у больных ГЭ (наши данные) и больных эндометриозом (данные Головченко И.О. [31]) отличаются. При этом наши результаты и данные Головченко И.О. «совпадают» не только по факту наличия ассоциаций этих полиморфизмов с содержанием тестостерона у больных женщин (ГЭ – наши данные и эндометриоз – данные Головченко И.О. [31]), но и что более важно - по направленности выявленных ассоциаций. Согласно наших данных полиморфные варианты C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, гаплотип CT*rs148982377-rs34670419 связаны с низким уровнем тестостерона, а гаплотип TG*rs148982377-rs34670419 – с высокой концентрацией тестостерона у больных ГЭ; по материалам работы, проведенной Головченко И.О., гаплотип TG rs148982377 ZNF789 и rs34670419 ZKSCAN5 ассоциирован с более высокой концентрацией тестостерона в сыворотке крови женщин, имеющих эндометриоз (β=0,492) [31]. Так же среди больных эндометриозом, как показано в работе Пономаревой Т.А. [32], уровень тестостерона маркируется полиморфным локусом rs440837 ZBTB10 (аллель G, β=-0,322 – -0,215), являющегося GWAS значимым для содержания SHBG [21]. Дополнительно мы обнаружили связь полиморфных вариантов C rs148982377 ZNF789 и T rs34670419 ZKSCAN5, гаплотипа CT*rs148982377-rs34670419 с высоким содержанием прогестерона, а гаплотипа TG*rs148982377-rs34670419 - с низким уровнем прогестерона у пациенток с ГЭ.
Так же, в ранее выполненном полно геномном исследовании Ruth K.S. et al. [17] на выборке из 2913 индивидов (90% из которых были женщины) из когорты Twins UK показана связь rs34670419 ZKSCAN5 с уровнем прогестерона (согласуется с полученными нами данными), при этом аллель Т rs34670419 был ассоциирован с низким уровнем этого гормона (β=-0,55), а референсный для него аллель G rs34670419 - с высоким уровнем прогестерона (β=0,55) [17]. Отличия в направленности ассоциаций отдельных аллельных вариантов SNP G>T rs34670419 ZKSCAN5 с концентрацией прогестерона между нашими данными и данными Ruth K.S. et al. (по нашим данным аллель T rs34670419 ZKSCAN5 связан с высоким уровнем прогестерона, а по данным Ruth K.S. et al. данный аллель ассоциирован с низким уровнем прогестерона [17]) могут быть связаны с тем, что в работе Ruth K.S. et al. изучалась выборка относительно здоровых индивидуумов [17], тогда как в нашем исследовании рассмотрена когорта женщин с ГЭ (преимущественно имели различные сочетания доброкачественных пролиферативных заболеваний матки). Кроме этого, как отмечается в работе Ruth K.S. et al., они не выявили связи одного из локусов, который так же был ассоциирован с уровнем прогестерона – rs112295236, с различными признаками/заболеваниями для механизмов развития которых важен данный гормон – возраст менархе, возраст менопаузы, ИМТ, рост, вес новорожденного, эндометриоз, и др. [17].
Нами установлено, что ГЭ-значимые полиморфизмы – T>A rs11031002 FSHB и T>C rs11031005 FSHB, ассоциированы с уровнем фолликулостимулирующего гормона у женщин с ГЭ: маркерами низкой концентрации FSH у больных является гаплотип TT*rs11031002-rs11031005, тогда как минорные аллельные варианты этих локусов - A rs11031002 FSHB и C rs11031005 FSHB, и гаплотип AC*rs11031002-rs11031005 коррелируют с высоким уровнем FSH больных. Полученные нами данные отличаются от результатов ранее выполненных полно-геномных исследования Ruth K.S. et al. [17] и Gudjonsson A. et al. [24], в которых аллель A rs11031002 FSHB был ассоциирован с высоким уровнем LH [17] и низким содержанием FSHB [24], а аллель C rs11031005 FSHB был связан с пониженной концентрацией FSH [17]. Следует отметить, что полиморфизм rs11031002 FSHB как показано в других полно-геномных исследованиях, имеет важное значение в регуляции уровня таких половых гормонов в организме (и в том числе женском организме) как общий и биодоступный тестостерон [20,25,26], соотношение тестостерон/SHBG (FAI) [26]. Различия наших результатов с данными Ruth K.S. et al. [17] и Gudjonsson A. et al. [24] по характеру направленности ассоциаций отдельных аллелей могут быть связаны с тем, что в вышеуказанных полно-геномных исследованиях изучались выборки относительно здоровых индивидуумов, тогда как в нашем исследовании рассмотрена группа пациенток с ГЭ (преимущественно имели различные сочетания доброкачественных пролиферативных заболеваний матки).
Литературные материалы так же содержат данные, в которых отмечаются расхождения в оценках характера ассоциаций отдельных SNP (и в том числе расположенных в регионе гена FSHB) с содержанием определенных гормонов [33]. Один из таких «примеров» расхождений в оценке направленности фенотипического эффекта гормон-значимого SNP - rs11031006 FSHB, приведен в обзорной работе McGrath et al. [33]. Авторы отмечают, что rs11031006, находящийся внутри энхансера гена FSHB (данный участок генома является зоной открытого хроматина в гонадотропных клетках гипофиза [34]), определяет повышенную экспрессию FSHBin vitro: минорный аллель A этого локуса способствует «лучшему» связыванию стероидогенного фактора 1 (SF1, является активатором транскрипции значительного количества генов гипоталамо-гипофизарно-гонадной оси [35]) [34]. При этом ассоциация минорного аллеля этого локуса с повышенной экспрессией FSHB была неожиданной, поскольку этот SNP по данным другого исследования, в котором рассматривались генетические факторы развития поликистоза яичников, был связан с более низкими концентрациями циркулирующего FSH [36]. Авторы отмечают, что необходимы дальнейшие исследования, чтобы «устранить» эти различия и определить однозначно направленность фенотипических эффектов гормон-значимых локусов [33].
Заключение. Полученные в работе данные позволяют сделать вывод о том, что с уровнем половых гормонов у пациенток с ГЭ ассоциированы следующие GWAS-значимые локусы: C>G rs112295236 SLC22A10 (эстрадиол), T>C rs148982377 ZNF789 и G>T rs34670419 ZKSCAN5 (тестостерон и прогестерон), T>A rs11031002 FSHB и T>C rs11031005 FSHB (фолликулостимулирующий гормон), C>T rs727428 SHBG (лютеинизирующий гормон), C>T rs1641549 TP53 (фолликулостимулирующий и лютеинизирующий гормоны).
Информация о финансировании
Исследование выполнено за счет гранта Российского научного фонда № 25-25-00034, https://rscf.ru/project/25-25-00034/.





















Список литературы