Остеопротекторный и регенераторный эффекты растительного полифенола ресвератрола при постменопаузальном остеопорозе: экспериментально-фармакологическое исследование
Aннотация
Актуальность: Остеопороз, являющийся одним из основных метаболических возраст-ассоциированных заболеваний скелета, представляет во всем мире серьезную медицинскую и социо-экономическую проблему из-за неуклонного увеличения его распространенности и частоты инвалидизирующих осложнений в виде низкоэнергетических переломов длинных трубчатых костей и компрессионных переломов тел позвонков. В его фармакотерапии актуальным стал поиск средств, интегрально влияющих на механизмы костного ремоделирования, при этом позитивно воспринимаемых пациентами при длительной терапии и имеющих минимальные побочные эффекты. Потенциально к ним относятся фармакологически активные вещества естественного растительного происхождения. Цель исследования:Провести структурно-функциональную оценку костных изменений при экспериментальном эстроген-депривационном остеопорозе и его терапии ресвератролом. Материалы и методы:Исследование выполнено на 15 крысах-самках Wistar в возрасте скелетной зрелости (6 мес). Животные разделены на три группы: 1) ложнооперированные; 2) с моделью остеопороза путем двусторонней овариоэктомии; 3) овариоэктомированные с терапией ресвератролом 2 мг/кг внутрибрюшинно ежедневно. Через 56 суток выполнена рентгеновская абсорбционная денситометрия и гистологическое исследование с компьютерной морфометрией проксимального эпифиза бедренной и проксимальной половины большеберцовой костей. Результаты:Обнаружено остеопротективное и стимулирующее регенерацию действие ресвератрола на костные структуры при экспериментальном остеопорозе. Терапия им снижает остеокластическую резорбцию, стимулирует пролиферацию и дифференцировку остеобластических предшественников и костеобразование, уменьшает повреждения остеоцитов и нарушения внутрикостной микроциркуляции. Данные эффекты определяются как по гистологическим изменениям, так и по нормализации минеральной плотности костей. Заключение:Ресвератрол в дозе 2 мг/кг обладает остеопротективным и активирующим регенераторные процессы действием в проксимальных частях бедренной и большеберцовой костей при вызванном эстрогенной депривацией экспериментальном постменопаузальном остеопорозе. Механизмы фармакологического эффекта обеспечиваются влиянием на клетки – участники костного ремоделирования с ингибированием остеокластической резорбции, стимуляцией остеобластогенеза, цитопротективным для остеоцитов действием, эндотелиопротективным действием с поддержанием ангиокринного обеспечения костного метаболизма. Ресвератрол является перспективным препаратом для комплексной терапии постменопаузального остеопороза вместе с другими остеопротекторами с известными фармакологическими свойствами
Введение. Остеопороз (ОП), являющийся одним из основных метаболических возраст-ассоциированных заболеваний скелета, представляет во всем мире серьезную медицинскую и социо-экономическую проблему из-за неуклонного увеличения его распространенности и частоты инвалидизирующих осложнений в виде низкоэнергетических переломов длинных трубчатых костей, компрессионных переломов тел позвонков. Еще с конца прошлого века по оценкам ВОЗ значимость ОП среди неинфекционных заболеваний находилась на четвертом месте после заболеваний сердечно-сосудистой системы, онкологической патологии и сахарного диабета, и поэтому он получил характеристику как «тихая эпидемия». В России ОП имеют 33,8% женщин и 26,9% мужчин старше 50 лет. По данным ведущих специалистов в данной проблеме, отраженным в материалах последнего международного симпозиума «Актуальные вопросы лечения пациентов с остеопорозом» [1] в связи с существенным постарением населения к 2035 г. прогнозируется значительное увеличение частоты переломов бедренной кости (по расчетной вероятности каждые 3 минуты будет происходить данный перелом). К 2050 году в России ожидается увеличение числа больных ОП на 1/3. В последних клинических рекомендациях, опирающихся на исследования с начала века [2], приведены многочисленные показатели тенденции эпидемиологических характеристик заболевания, подчеркивающие медицинскую и социо-экономическую серьезность проблемы. Приводятся данные, что частота переломов шейки бедренной кости по данным эпидемиологического исследования, проведенного в 16 городах России (общая численность населения в возрасте 50 лет и старше 1749274 человека) в 1992-1997 гг., составила 100,9 на 100 000 населения. При этом достоверно чаще эти переломы зафиксированы среди женщин (1155/100000) по сравнению с мужчинами (77,0/100000). В аналогичном исследовании в четырех городах России через 11 лет (2008-2009 гг.) выявлено, что частота переломов проксимального отдела бедренной кости составляет уже 239 случаев на 100000 населения (276 и 175 случаев у женщин и мужчин, соответственно). В структуре не связанного с другой патологией первичного остеопороза преобладают естественно взаимосвязанные постменопаузальный и сенильный [3], что делает проблему особо актуальной для женского населения. Как стандартные средства терапии, приоритет среди которых принадлежит бифосфонатам [4], так и новейшие методы терапии антителами против конкретных молекулярных мишеней не лишены серьезных осложнений со стороны скелета и висцеральных систем. К тому же иммунотерапевтические средства дорогостоящие и не могут полностью удовлетворить увеличивающийся контингент пациентов с различной степенью снижения минеральной плотности костей. Поэтому по мере расшифровки клеточных и молекулярных механизмов заболевания продолжается разработка фармакотерапевтических средств, направленных на них [5, 6]. Однако, как оказалось, достижения в понимании механизмов заболевания и разработка препаратов, действующих на них, это только одна сторона проблемы профилактики и лечения. Другой является восприятие пациентами длительной терапии синтетическими препаратами, неизбежно имеющими те или иные побочные эффекты. Достаточно давно эта проблема была отражена в крупных зарубежных руководствах по метаболической патологии костей [7] и обращено внимание, что пациентами нередко игнорируется то, что перерыв в лечении, а тем более отказ от него чреваты еще более серьезными последствиями. Причинами разрыва в лечении указывается следующее. Во-первых, ошибочное мнение, что остеопороз – это нормальная часть старения, а не поддающееся лечению заболевание, и что остеопороз поражает только женщин. Во-вторых, тестирование минеральной плотности костей не является общедоступным как технически, так и по цене. Страх перед лекарствами от остеопороза, оцененный в свое время в исследовании NOF (National osteoporosis foundation) в США, в котором приняли участие 853 (3%) респондентов из примерно 28 000 пациентов-участников онлайн-сообщества, дал о многом говорящие результаты. 38% респондентов не принимали назначенные препараты и 79% из них заявили, что причиной отказа явился страх перед побочными эффектами. 43% считают, что риск побочных эффектов при лечении остеопороза был больше, чем польза. Поэтому закономерно предположение о возможном нивелировании данного фактора применением препаратов, содержащих фармакологически активное начало из естественных источников (привычных ингредиентов пищи или добавок). Из данной категории препаратов с широким спектром фармакологического действия до настоящего времени внимание уделяется растительным полифенолам, прежде всего у ресвератролу, в свое время ставшим главным в объяснении так называемого «французского парадокса». Имеются данные и о его остеопротективном эффекте, но преимущественно с методическим и аналитическим акцентами на эндотелий -зависимые механизмы [8, 9]. Между тем, эндотелий внутрикостных сосудов вряд ли является исключительной мишенью препарата. Как минимум, необходимо учитывать доказанную роль в патогенезе ОП механизмов оксидативного стресса [5], иммунологические механизмы в силу зависимости остеокластогенеза от баланса про- и противовоспалительных цитокинов, и другие. Поэтому актуально исследование всех участников костного ремоделирования, нарушенного при ОП.
Цель исследования. Провести структурно-функциональную оценку костных изменений при экспериментальном эстроген-депривационном остеопорозе и их терапии ресвератролом.
Материалы и методы исследования. Исследование выполнено на 15 белых крысах-самках Wistar массой 280-3000 гр., соответствующей биологическому возрасту 6 месяцев – возрасту скелетной зрелости, который рекомендуется для начала подобных экспериментов как в научных публикациях, так и международных рекомендациях по моделированию постменопаузального остеопороза [10]. В качестве объектов исследования выбраны проксимальный эпифиз бедренной кости (головка и шейка), что обосновывается высокой частотой и значимостью остеопоротических переломов этой части скелета и проксимальная половина большеберцовой кости в связи с технической доступностью для остеоденситометрии и исследованием ее в большинстве других имеющихся в литературе работ. Животные были рандомизированы на 3 равные группы.
1. Группа ложно-оперированных животных, у которых выполняли лапаротомию без овариоэктомии и каких-либо последующих воздействий.
2. Контрольная группа с моделированием постменопаузального остеопороза.
3. Экспериментальная группа, с моделью ОП и ежедневным внутрибрюшинным введением ресвератрола на физрастворе в дозе 2 мг/кг.
Всех животных содержали в одинаковых условиях со свободным доступом к воде и смешанному зерно-овощному корму. Все хирургические вмешательства выполнены под общей анестезией внутрибрюшинным введением золетила и медитина. Моделирование остеопороза производили двусторонней овариоэктомией, которая считается «золотым стандартом» модели для оценки средств профилактики и лечения первичного остеопороза [11, 12], выполненной через средне-нижнесрединный лапаротомный доступ.
По завершении эксперимента на 57 день перед выведением животных из него при помощи мультифункциональной лабораторной рентгеновской установки IN-VIVO MS FX PRO (Bruker; США) с системой молекулярной визуализации при помощи лицензированного программного обеспечения – BoneDensitySoftware выполняли денситометрию изучаемых частей скелета с оценкой минеральной плотности кости (g/cm3) по показателю BCD (Bone Column Density), характеризующему степень ослабления рентгеновского излучения на единицу глубины материала. После этого животных выводили из эксперимента цервикальной дислокацией под хлоралгидратным наркозом. Для гистологического исследования экзартикуляцией из тазобедренного сустава выделяли проксимальные половины бедренных костей от головки до середины диафиза и части большеберцовых костей от мыщелков до середины диафиза. Для контроля достижения гипоэстрогении гистологически исследовали матки в месте соединения их рогов. Весь материал фиксировали в 10% забуференном формалине «Histosafe». Основные объекты исследования – костные фрагменты, декальциировали в жидкости «Surgipath DecalcifierII» (Leica, Германия) по рекомендуемому протоколу. Декальцинированные фрагменты автоматическим способом заливали в парафин с последующей окраской гистологических срезов толщиной 7 мкм гематоксилином и эозином и по Маллори. Микропрепараты изучали под микроскопом «Ломо» с видеокамерой «DV1000». Кроме этого, для архивирования микропрепаратов с возможностью последующего гистологического анализа и морфометрии создавали их цифровые аналоги с помощью системы сканирования и архивирования изображений Hamamatsu NanoZoomer-SQ Digital Slide Scanner (Япония), аналитическим модулем NDP. View 2, которой проводили измерение линейных параметров костных структур, изготавливали иллюстрации. Удельные площади костных структур и костномозговых пространств оценивали методом точечного счета по Г.Г. Автандилову с помощью компьютерного аналога прозрачной морфометрической сетки с 50 узловыми точками, проецируемой на изображения.
Количественные данные регистрировали и анализировали с помощью таблиц Ms Exel со статистической обработкой по стандартным формулам и определением статистической значимости отличий по критерию t Стьюдента.
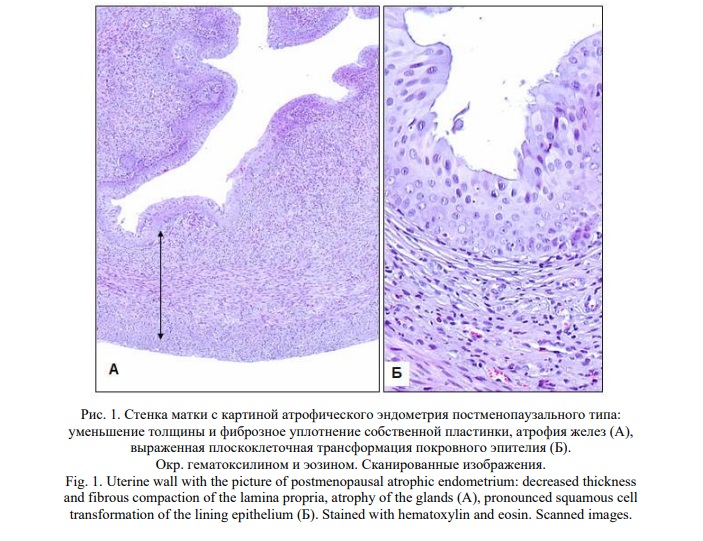
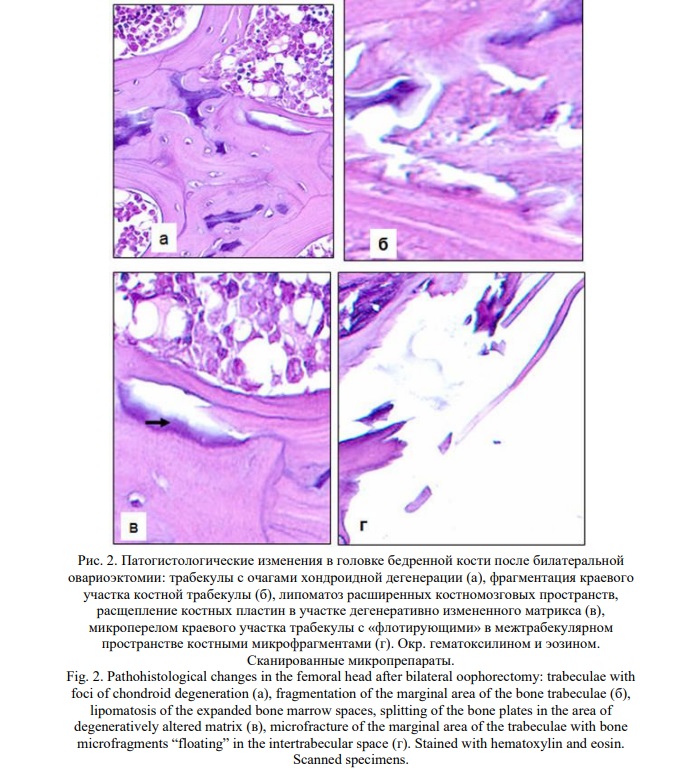
Результаты и их обсуждение. Гистологическое исследование эндометрия как индикатора гормонального статуса животных показало, что через 8 недель после билатеральной овариоэктомии развивается состояние организма, соответствующее постменопаузальной гипоэстрогении, о чем свидетельствует развитие атрофического эндометрия (Рис. 1), подтверждая этим адекватность модели. Спектр выявленных костных гистологических изменений соответствует патоморфологическим критериям остеопороза. Выявлены разрежение общей архитектоники кости, увеличение удельной доли костномозговых пространств (до 30,5+0,1% против 25,0+0,3% у ложнооперированных животных) с нарастанием в них доли жирового компонента, дезорганизация межклеточного вещества кости с наличием очагов хондроидной дегенерации, пластинчатого расщепления трабекул и кортикальной кости и наиболее диагностически значимый признак - микропереломы костных балок (Рис. 2). Данные изменения были однотипными в обеих изученных частях скелета. Закономерно уменьшилась средняя толщина костных трабекул. В головке бедренной кости у овариоэктомированных животных она составила 44,1+1,3 мкм против 57,4+1,9 мкм у ложнооперированных (p<0,05). В проксимальной части диафиза большеберцовой кости соответственно 56,7+3,4 мкм против 67,4+3,4 мкм (p<0,05).
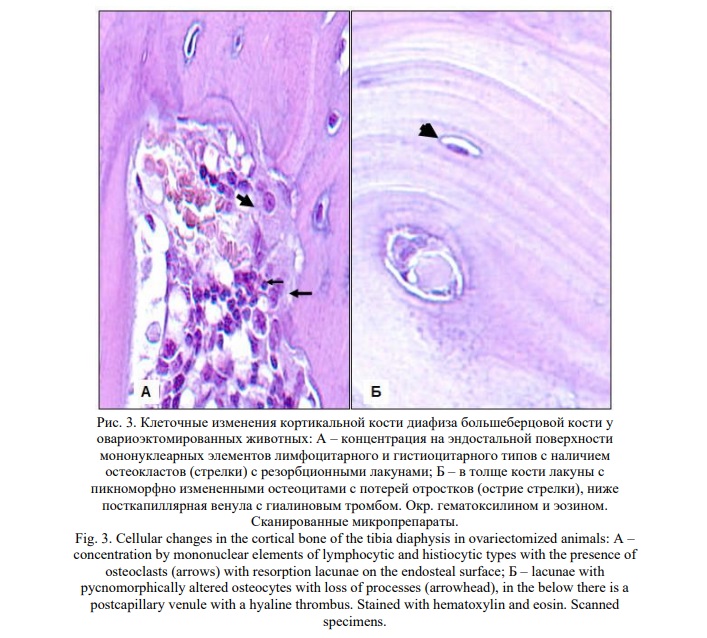
Патоморфологические проявления остеопоротического поражения подтверждены функциональным показателем – минеральной плотностью кости. У овариоэктомированных животных величина BCD достоверно (p<0,05) снизилась (2,58+0,2 g/cm3) в сравнении с ложнооперированными животными (3,1+0,02 g/cm3). Значимым механизмом развития описанных изменений является, как показало гистологическое исследование, активизация отеокластической резорбции. В периваскулярных пространствах имелась концентрация как одноядерных мелких и средних клеточных элементов гистиоцитарного типа, так и более крупных элементов с разной степенью выраженности остеокластической многоядерности. На контактирующих с многоядерными клетками поверхностях костных балок имелись углубления и щелевидные пространства типа резорбционных лакун (Рис. 3). Данные изменения с полиморфизмом клеточного состава вероятнее отражают динамику остеокластогенеза, складывающегося из сочетания слияния моноцитарных элементов в остеокласты и диссоциации последних на временные одноядерные циркулирующие формы, характеризуемые как остеоморфы. Другим патогенетически значимым изменением явилось повреждение остеоцитов, проявившееся пикноморфными изменениями их тел, фрагментацией и часто полной деструкцией отростков с расширением и запустеванием лакунарно-канальцевых полостей, что можно расценить как проявления и следствия апоптотической гибели. Им постоянно сопутствовали микроциркуляторные нарушения в расположенных рядом сосудах.
В экспериментальной серии с терапией ресвератролом и гистологически, и функционально обнаружены проявления не только купирования остеопоротического поражения изученных костей, но и регенерации костных структур. Общая архитектоника костных балок и соотношение с костномозговыми пространствами мало отличались от таковых у ложнооперированных животных. Доля костномозговых пространств была несущественно большей (27,4+0,4%) в сравнении с ложнооперированными животными, но меньшей, чем в модели ОП без лечения.
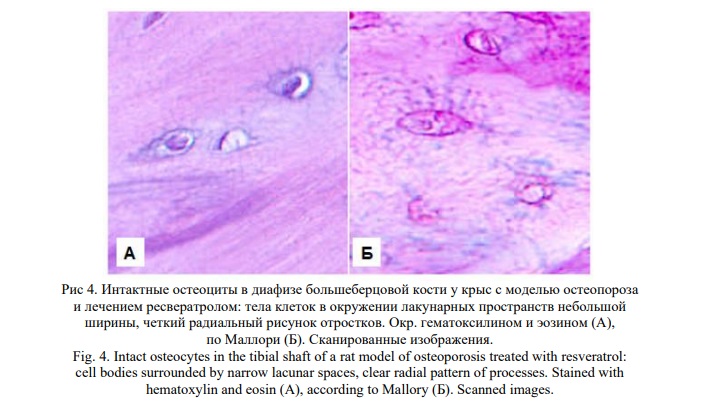
Важной особенностью явилась сохранность структуры остеоцитов при отсутствии значимых микроциркуляторных расстройств (Рис. 4).
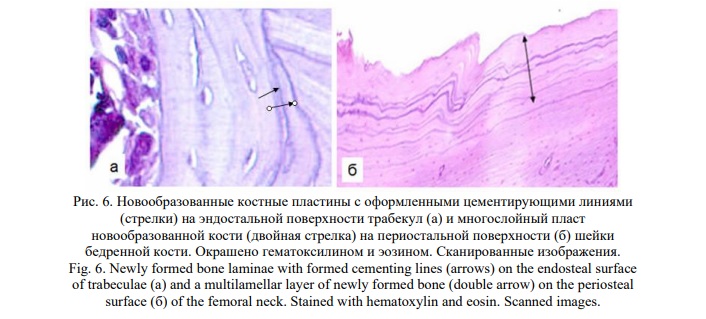
Самыми значимыми явились прямые клеточные и тканевые признаки регенерации костных структур. Клеточные реакции, отражающие остеорепаративные процессы, проявились концентрацией уплощенных кость-выстилающих клеток преостеобластического типа на эндостальных поверхностях костных балок и, что наиболее доказательно, часто обнаруживаемым их митотическим делением (Рис. 5). Пролиферирующие клетки, структурно и по локализации сходные со стромальными, обнаруживались и в костномозговых пространствах. Тканевыми признаками явились участки новообразования костных пластин, принимавших концентрическую ориентацию и разграниченных оформленными цементирующими линиями, что выявлено и на эндостальных поверхностях костных балок, и на периостальной поверхности кортикальной кости (Рис. 6).
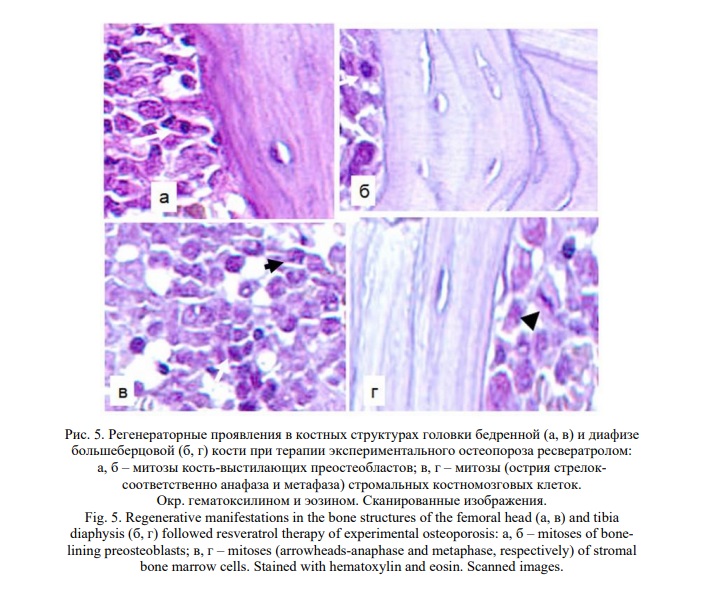
Функциональный признак- минеральная плотность костей, также свидетельствует об остеорепаративных изменениях. Показатель BCD в диафизе большеберцовой кости увеличился до 2,43+0,16 g/cm3, достоверно (p<0,05) превысив его у овариоэктомированных (2,08+0,06 g/cm3) животных и значимо приблизившись к значению у ложнооперированных (2,78+0,03 g/cm3). В шейке бедренной кости этот показатель оказался еще более демонстративным – не только достоверно большим у животных, получавших ресвератрол (3, 23+0,12 g/cm3) в сравнении с овариоэктомированными (2,58+0,2 g/cm3), но даже превысившим его у ложнооперированных (3,1+0,02), хотя и без статистической значимости.
Таким образом, морфологические и функциональные данные, полученные в нашем исследовании, свидетельствуют о наличии у ресвератрола не только остеопротективного эффекта, но и стимулирующего действия на регенераторный резерв костной ткани. Последнее является существенно новым в сравнении со многими ранее выполненными исследованиями других авторов, посвященных преимущественно остеопротекции. Во-вторых, важно то, что показан эффект малой дозы ресвератрола – именно той, для которой доказано эндотелиопротективное действие [13], что позволяет обсуждать данный механизм в общем спектре фармакологической активности препарата. Следует указать, что экспериментально-фармакологические in vivo исследования фармакологической активности полифенолов с использованием полного набора методов документации костных изменений (оценка костной плотности, структурных изменений, другие функциональные тесты) в последние 10 лет немногочисленны. Из них заслуживает внимания исследование китайских авторов [14], выполненное на модели овариоэктомии у достигших скелетной зрелости крыс Sprague-Dawley. Методами in vivo и in vitro оценены эффекты трех пероральных доз ресвератрола: 5мг/кг, 25мг/кг и 45мг/кг в день с началом введения через 7 суток после овариоэктомии на протяжении 8 недель. Морфологически исследован дистальный конец бедренной кости – мыщелки, а компьютерной микротомографией и поясничный отдел позвоночника. Установлено, что активностью обладают средняя (25 мг) и высокая (45 мг) дозы, а низкая (5 мг) проявила малую эффективность по данным иинструментальных (рентгенденситометрия, компьютерная микротомография) и in vitro клеточных (оценка остеобластической дифференцировки в культуре костномозговых стромальных клеток) методов, но по показателям сывороточного уровня щелочной фосфатазы и остеокальцина умеренный позитивный эффект выявлен при всех испытанных дозах. В части микроструктурных изменений данные ограничены описаниями общего характера в субъективных терминах «тоньше», «меньше», «улучшение», без оценки отдельных костных клеточных элементов, других костных микроструктур, и без морфометрии. Больший акцент сделан на методах и результатах, обосновывающих авторскую гипотезу реализации антиостеопоротического эффекта ресвератрола через повышение экспрессии транскрипционного регулятора sirt1, ведущее к ингибированию фосфорилирования и активности ядерного фактора kB. То есть центральная роль отведена остеокласты-регулирующему пути RANK/RANKL, а ресвератрол не только этими, но и другими авторами рассматривается как агонист sirt1. На основании имеющихся в литературе данных о тонких механизмах влияния на костное ремоделирование в норме, при остеопорозе и его фармакокоррекции можно выделить следующие их группы:
- Механизмы регуляции формирования и активности клеточных популяций, обеспечивающих остеорезорбтивные и остеопродуктивные процессы, находящиеся в норме в динамическом равновесии.
- Зависящие от внутрикостных микрососудов, в частности сосудистого эндотелия, механизмы не только трофического, но и регуляторного обеспечения костного гомеостаза. Наиболее интересен и практически значим вопрос о взаимосвязях данных групп. Данные литературы позволяют предполагать, что основными кандидатами на роль связующего молекулярного звена между ними являются транскрипционные регуляторы – сиртуины. Название данных белков происходит от сочетания английских слов «sir-two-ins» по гомологии с белком sir2 (от англ. silent information regulator), впервые изученным у дрожжей. Это класс из 7 белков, обладающих NAD+-зависимой активностью деацетилазы и влияющих через гистоновые и негистоновые белки на транскрипцию генов, имеющих отношение к процессам морфогенеза, в том числе сосудов, клеточной адгезии, воспаления и митохондриального метаболизма. Такой перечень биологической активности, а также экспрессия сиртуинов и в эндотелии, и в гладких миоцитах сосудов определяют концентрацию внимания многих исследователей на их роли в процессах старения, прежде всего в связи с ангио- и кардиопротекцией [15-17]. Повышение экспрессии sirt1 ведет к ингибированию фосфорилирования и активности ядерного фактора – KB, следовательно, к негативной модуляции главного пути стимуляции остеоклатогенеза – RANK/RANKL, что показано и в in vitro части указанного выше исследования [15]. Об ингибировании остеокластогенеза можно вести речь и на этапе миграции их моноцитарных предшественников, так как sirt1 негативно влияет на экспрессию эндотелием адгезивных молекул (CAM-1, VCAM) и этим снижает проникновение через капиллярные стенки остеокластических предшественников. Негативная модуляция ядерного фактора KB снижет продукцию провоспалительных цитокинов и определяет противовоспалительную и антиоксидантную активность сиртуинов. Помимо сиртуинового пути реализация эффектов ресвератрола происходит и через Wnt путь, который не только обеспечивает остеобластическую дифференцировку предшественников, но и тормозит апоптоз остеобластов. Еще в начале века в in vitro исследованиях было показано, что ресвератрол усиливает дифференцировку остеобластов путем активации sir1, который ингибирует транскрипционный рецептор адипогенеза-PAR-гамма. Это удерживает мезенхимальные стволовые клетки (МСК) от дифференцировки в адипоциты и обеспечивает их переключение на остеобластический путь развития [18]. Но необходимо отметить, что данная концепция не является абсолютно новой. Еще в начале 2010х годов одним из ведущих зарубежных исследователей остеопороза с соавторами в контексте клинических перспектив обоснована смена парадигмы патогенеза остеопороза с эстроген-центрической на парадигму костного старения с пристальным вниманием на особенности старения отдельных популяций костных клеток и сиртуиновые регуляторы [19,20]. В совокупности с приведенными литературными данными и наши результаты свидетельствуют, что состояние адипоцитарного компонента костномозговых пространств является не только одним из стандартных критериев диагностики остеопоротических изменений, но и с большой вероятностью характеризует динамику и соотношение направлений дифференцировки костномозговых МСК. Поскольку нами в серии с терапией ресвератролом выявлена пролиферативная активность и на территории костномозговых пространств, и в эндостальных слоях кость-выстилающих клеток, можно вести речь об эффекте стимуляции остеобластогенеза. Другим важным наблюдением являются морфологические проявления остеопластических процессов на периостальной поверхности кортикальной кости. Потеря костной массы происходит за счет трабекул губчатой кости и на эндостальной поверхности кортикальной. Периостальная остеопластическая реакция играет в этой ситуации компенсаторно-приспособительную роль, до определенного времени поддерживая и геометрические, и биомеханические параметры кортикальной кости. На данный феномен увеличения периостального диаметра с такой же его функциональной оценкой обращено внимание и в литературе [21].
Сосудистые (эндотелий-зависимые) механизмы включают в себя следующие аспекты, рассматриваемые в литературе [16, 17, 18]. Во-первых, это механизмы сосудистого старения. Установлено, что активность эндотелиальной NO-синтазы, а значит и выработка важнейшей сигнальной молекулы – NO, зависит от экспрессии sirt1, который деацитилирует и активирует эндотелиальную NO-синтазу в цитоплазме. Кроме этого, он деацетилирует и ингибирует основной триггер апоптоза – белок р53. Во-вторых, эндотелиальные клетки, как показано в достаточном количестве методически различных исследований и отражено в концепции ангиокринной функции [22, 23] являются продуцентами большого набора ростовых и морфогенетических факторов, в том числе определяющих остеобластический путь дифференцировки костномозговых стромальных мезенхимальных предшественников. Важно отметить и регуляторную роль гликопротеина протегерина [24], являющегося представителем суперсемейства рецепторов α-фактора некроза опухоли. Это растворимый рецептор-конкурент RANK, который снижает доступность лиганда RANKL к специфическим рецепторам остеокластов, функционируя как «молекулярная ловушка». Этим ингибируется остеокластогенез и стимулируется апоптоз остеокластов. Значимость этого заключается в том, что остеопротегерин продуцируется не только остеобластами, замыкая таким путем обратные связи между остеорезорбцией и остеопродукцией, но также эндотелиоцитами и гладкими миоцитами сосудистой стенки. Из приведенных литературных данных следует, что в центре регуляторных событий оказываются костные микрососуды, связанные через несколько цепочек молекулярных мессенджеров с клеточными элементами костной ткани. Помимо указанного выше, необходимо отдельно отметить значение выявленного нами цитопротективного для остеоцитов эффекта, так как данные клетки являются трансдукторами механических воздействий на костную ткань и интеграторами взаимодействий между клеточными, матриксными и сосудистым компонентами кости [25, 26].
Резюмируя, основные эффекты ресвератрола можно представить следующим перечнем: ингибирование остеокластогенеза и костной резорбции, стимуляция остеобластогенеза, в том числе за счет костномозговых стромальных предшественников при одновременном подавлении апоптоза, протективное действие на остеоциты, эндотелиопротекция с обеспечением выполнения эндотелием костных сосудов ангиокринной функции путем продукции ростовых, морфогенетических и регуляторных факторов. Последнее звено замыкает цепочку позитивных клеточно-сосудистых взаимовлияний.
Заключение. Ресвератрол в дозе 2 мг/кг обладает остеопротективным и активирующим регенераторные процессы действием в проксимальных частях бедренной и большеберцовой костей при вызванном эстрогенной депривацией экспериментальном постменопаузальном остеопорозе. Механизмы фармакологического эффекта обеспечиваются влиянием на популяции клеток – участников костного ремоделирования с ингибированием остеокластической резорбции при стимуляции остеобластогенеза, цитопротективным для остеоцитов действием, а также эндотелиопротективным действием с ангиокринным обеспечением костного метаболизма.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы