Связь генетических детерминант SHBG с гормональным профилем больных миомой матки
Aннотация
Актуальность: Миома матки представляет собой доброкачественную гормон-зависимую опухоль мышечного слоя матки, поражающую женщин репродуктивного возраста. Генетическим факторам отводится важное значение в возникновении данного новообразования. Гены-кандидаты, ассоциированные с уровнем глобулина, связывающего половые гормоны (SHBG), могут быть вовлечены в патогенетику миомы матки. Цель исследования:Оценитьсвязи полиморфных вариантов генов, ассоциированных с уровнем SHBG, с гормональным статусом пациенток с миомой матки. Материалы и методы:У 83 пациенток с миомой матки, входящих в группу исследования, был изучен гормональный профиль – концентрации в сыворотке крови фолликулостимулирующего и лютеинизирующего гормонов, эстрадиола, тестостерона, пролактина, прогестерона и проведено генотипирование 9 SNPs, ассоциированных с уровнем SHBG. Программа gPLINK использовалась для поиска ассоциаций SNPs, связанных с уровнем SHBG, с уровнем половых гормонов у больных миомой матки (метод линейной регрессии). Тестировались 4 генетические модели (аллельная/аддитивная/доминантная/рецессивная); в расчеты включались трансформированные значения концентраций половых гормонов в сыворотке крови. Результаты:С уровнем эстрадиола ассоциированы три молекулярно-генетических маркера – rs3779195 BAIAP2L1 [T/A] (7хр.) (pperm=0,020 – 0,048; β=-0,372 – -0,394), rs7910927 JMJD1C [G/T] (10хр.) (pperm=0,027 – 0,048; β=-0,228 – -0,379), rs10454142 PPP1R21 [T/C] (2хр.) (pperm=0,050; β=0,318), лютеинизирующего гормона – rs4149056 SLCO1B1 [T/C] (12хр.) (pperm=0,043 – 0,048; β=0,361 – 0,369), а с концентрацией пролактина (pperm=0,021; β=0,968), прогестерона (pperm=0,050; β=-1,276,) и тестостерона (pperm=0,050; β=-0,744) в сыворотке крови больных, имеющих миому матки, связан полиморфный локус rs8023580 NR2F2 [T/C] (15хр.). Заключение:Установлена вовлеченность генов-кандидатов SHBG в гормональный профиль больных миомой матки.
Введение. Миома матки – это доброкачественное новообразование гладкомышечной ткани (миометрия) матки, чувствительное к половым гормонам [1, 2]. Являясь наиболее распространенной опухолью женской репродуктивной системы, миома матки представляет собой серьезную проблему с точки зрения качества жизни каждой конкретной пациентки, вызывая такие симптомы, как обильные менструальные кровотечения, боли в области таза, бесплодие и др. [3]. Кроме того, экономическое бремя, связанное с лечением данного заболевания, создаёт значительную финансовую нагрузку как для самих женщин, имеющих данный диагноз, так и для системы здравоохранения [4]. В 2022 году в США экономические затраты, направленные на лечение женщин с диагнозом миома матки, выросли до 41,4 млрд. долларов (для сравнения 2010 год – 34,4 млрд. долларов) [5].
Генетические факторы влияют на риск развития миомы матки: по оценкам, полученным на основе близнецового метода, наследуемость заболевания составляет 26-63% [6]. На сегодняшний день проведено 13 полно-геномных исследований (GWAS), которые позволили установить несколько десятков генов-кандидатов, имеющих рисковое значение для миомы матки [6, 7]. Среди этих генов-кандидатов важное место занимают гены половых гормонов [8] гормон-зависимых признаков (возраст менархе) [9, 10].
Важное значение в патофизиологии миомы матки отводится половым гормонам, факторам роста, цитокинам, которые оказывают влияние на пролиферацию гладкомышечных клеток матки и способствуют избыточной выработке внеклеточного матрикса [2, 11, 12]. Традиционно считалось, что основными гормонами, вовлеченными в этиопатогенез миомы матки, являются эстрогены, но недавние исследования показали, что важную роль в этом процессе играют как тестостерон [13], так и прогестерон [14]. Следует отметить, что уровень активных форм половых гормонов (эстрогены, тестостерон) в значительной степени определяется SHBG.
Целью исследования. Оценка связи полиморфных вариантов генов, ассоциированных с уровнем SHBG, с гормональным статусом пациенток с миомой матки.
Материалы и методы исследования. У 83 пациенток с миомой матки, входящих в группу исследования, был изучен гормональный профиль – концентрации в сыворотке крови фолликулостимулирующего и лютеинизирующего гормонов, эстрадиола, тестостерона, пролактина, прогестерона. В сформированную выборку исследования вошли больные с изолированной миомой матки (n=24;28,92%), сочетанием миомы матки с гиперплазией эндометрия (n=17;20,48%), эндометриозом (n=29;34,94%) и женщины, имеющие сочетание миомы матки с гиперплазией эндометрия и эндометриозом (n=13;15,66%). Таким образом, сочетанные пролиферативные заболевания матки регистрировались у большей половины исследуемых женщин (71,08%).
Девять полиморфных локусов, ассоциированных с уровнем SHBG (rs17496332 [A/G] (1хр.) PRMT6, rs780093 [C/T] (2хр.) GCKR, rs10454142 [T/C] (2хр.) PPP1R21, rs3779195 [T/A] (7хр.) BAIAP2L1, rs440837 [A/G] (8хр.) ZBTB10, rs7910927 [G/T] (10хр.) JMJD1C, 1 rs4149056 [T/C] (12хр.) SLCO1B, rs8023580 [T/C] (15хр.) NR2F2, rs12150660 [G/T] (17хр.) SHBG) были прогенотипированы на амплификаторах CFX-96. Анализ связей полиморфных вариантов генов, ассоциированных с уровнем SHBG, с гормональным статусом пациенток с миомой матки проводился с помощью программы gPLINK (метод линейной регрессии); тестировались четыре генетические модели (аллельная/аддитивная/доминантная/рецессивная) [15]. Для расчетов использовались трансформированные значения концентрации половых гормонов в сыворотке крови (в связи с тем, что их распределение отличалось от нормального). Выполнение расчетов осуществлялось с применением следующих ковариат: возраст, ИМТ, наличие сопутствующих гиперпластических заболеваний матки (эндометриоз и гиперплазия эндометрия). Коррекция на множественные сравнения была выполнена с использованием пермутационного теста [16]: за статистически значимые принимались результаты при рperm≤0,05.
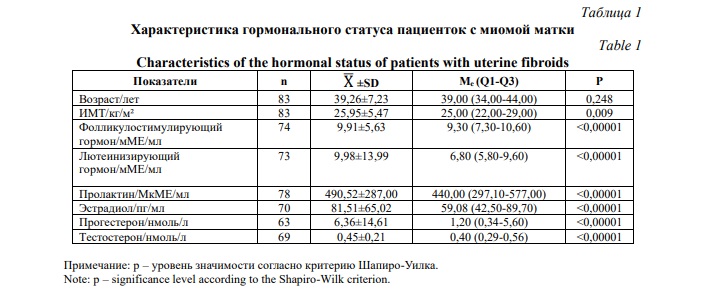
Результаты и их обсуждение. Выполнен анализ показателей гормонального профиля 83 женщин, имеющих миому матки. Средний возраст исследуемой группы был равен 39,26±7,23 лет, среднее значение ИМТ составило 25,95±5,47. Показатели гормонального профиля пациенток с миомой матки приведены в Таблице 1.
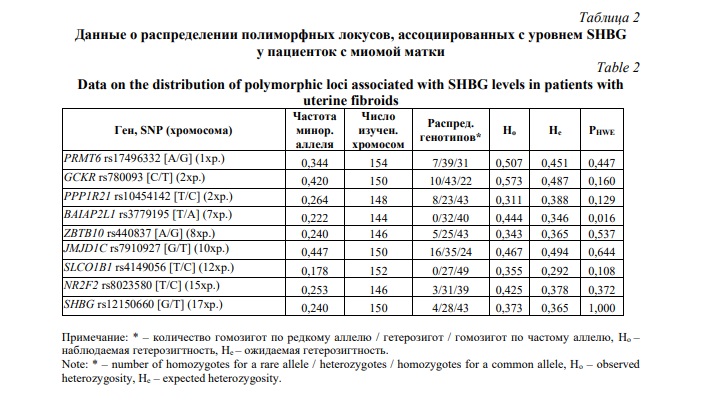
Оценка распределения исследуемых 9 SNPs, связанных с уровнем SHBG, среди 83 больных с миомой матки (Табл. 2) показала, что для всех молекулярно-генетических маркеров выполняется закон Харди-Вайнберга (с учетом дополнительно введенной поправки Бонферони на количество анализируемых локусов (9 SNPs), pHWE(Bonf)≥ 0,006 [0,05/9]).
Далее мы изучили связи генетических детерминант SHBG с гормональным профилем больных миомой матки. В таблицах 3-8 отображены полученные результаты. Установлены ассоциации трех полиморфных локусов генов, связанных с SHBG, с уровнем эстрадиола (ESTR) у пациенток с миомой матки (Табл. 3). Полиморфизм rs3779195 BAIAP2L1 [T/A] (7хр.) вовлечен в формирование уровня эстрадиола в рамках трех моделей: аллельной (β=-0,372, р=0,038, pperm=0,048), аддитивной (β=-0,394, р=0,020, pperm=0,021) и доминантной (β=-0,394, р=0,020, pperm=0,020). Молекулярно-генетический маркер rs7910927 JMJD1C [G/T] (10хр.) также связан с концентрацией эстрадиола согласно аддитивной (β=-0,228, р=0,043, pperm=0,048) и доминантной (β=-0,379, р=0,026, pperm=0,027) моделям. С уровнем эстрадиола ассоциирован полиморфизм rs10454142 PPP1R21 [T/C] (2хр.) согласно доминантной модели (β=0,318; р=0,050; pperm=0,050). Следует отметить, что минорные аллели А rs3779195 BAIAP2L1 и Т rs7910927 JMJD1C связаны с более низким содержанием эстрадиола в сыворотке крови пациенток с миомой матки (β<0), а аллель С rs10454142 PPP1R21 наоборот ассоциирован с более высокой концентрацией данного гормона (β>0).

Уровень лютеинизирующего гормона (LH) у больных с миомой матки детерминируется полиморфным локусом rs4149056 SLCO1B1 [T/C] (12хр.) в рамках аллельной (β=0,361, р=0,038, pperm=0,048), аддитивной (β=0,369, р=0,044, pperm=0,046) и доминантной (β=0,369, р=0,044, pperm=0,043) моделей (Табл. 4). Следует подчеркнуть, что аллель С rs4149056 маркирует более высокую концентрацию лютеинизирующего гормона в сыворотке крови у пациенток с миомой матки (β>0).
Молекулярно-генетический маркер rs8023580 NR2F2 [T/C] (15хр.) ассоциирован с уровнем трех гормонов – пролактина (PROL), прогестерона (PG) и тестостерона (TEST) у больных с миомой матки согласно рецессивным моделям (β=0,968, р=0,014, pperm=0,021 (Табл. 5); β=-1,276, р=0,050, pperm=0,050 (Табл. 6); β=-0744, р=0,050, pperm=0,050 (Табл. 7). При этом аллель С rs8023580 NR2F2 является маркером более высокой концентрации только пролактина в сыворотке крови больных, имеющих миому матки (β>0). С концентрацией фолликулостимулирующего гормона (FSH) у пациенток с миомой матки связей полиморфных локусов SHBG не обнаружено (Табл. 8).


Итак, выявлена связь генов-кандидатов SHBG с гормональным профилем больных миомой матки. С уровнем эстрадиола ассоциированы три молекулярно-генетических маркера – rs3779195 BAIAP2L1 [T/A] (7хр.), rs7910927 JMJD1C [G/T] (10хр.), rs10454142 PPP1R21 [T/C] (2хр.), лютеинизирующего гормона – rs4149056 SLCO1B1 [T/C] (12хр.), а с концентрацией пролактина, прогестерона и тестостерона в сыворотке крови больных, имеющих миому матки, связан полиморфный локус rs8023580 NR2F2 [T/C] (15хр.). Высокое содержание эстрадиола, лютеинизирующего гормона, пролактина в сыворотке крови у пациенток с миомой матки маркируют следующие аллельные варианты – С rs10454142 PPP1R21, С rs4149056 SLCO1B1, С rs8023580 NR2F2 соответственно, а с более низкой концентрацией эстрадиола связаны минорные аллели А rs3779195 BAIAP2L1 и Т rs7910927 JMJD1C, прогестерона и тестостерона – минорный аллель С rs8023580 NR2F2.
Половые гормоны играют важную роль в развитии миомы матки. В литературе не описано случаев её развития в препубертатном периоде, а в постменопаузе данная опухоль встречается редко [17]. Основным митогенным фактором для клеток миометрия считаются эстрогены [2]. Миоматозные клетки демонстрируют повышенную активность в ответ на воздействие эстрогенов по сравнению с клетками нормального миометрия [17]. На ряду с этим, все больше появляется данных, что прогестерон может быть вовлечен в патофизиологию миомы матки [14, 18-21]. При этом, следует подчеркнуть, что механизмы, которые лежат в основе патогенеза миомы матки, вызванного действием прогестерона, в значительной степени неизвестны. Выявлено, что экспрессия рецепторов данного гормона (PRs) выше в миоматозных клетках по сравнению с клетками нормального миометрия [14]. Следует отметить, что уровень прогестерона в изученной нами группе больных миомой матки ассоциирован с полиморфным локусом rs8023580 NR2F2 [T/C] (15хр.).
Прогестерон взаимодействует с факторами роста, такими как трансформирующий фактор роста бета-3 (TGF-β3), эпидермальный фактор роста (EGF) и инсулиноподобный фактор роста-1 (IGF-1), тем самым способствуя пролиферации миоматозных клеток [22]. Следует отметить, что экспрессия TGF-β3 увеличивается во время секреторной фазы менструального цикла (основным гормоном которой является прогестерон) [23]. TGF-β3 задействован в большом количестве процессов в организме, в том числе «регулирует» апоптоз, ангиогенез [24]. TGF-β3 является одним из важнейших факторов роста в патофизиологии опухолей [24]. Также, обращает на себя внимание, «хорошая» эффективность лекарственной терапии пациенток с миомой матки селективными модуляторами прогестероновых рецепторов, что служит дополнительным аргументом в пользу предположения о значимой роли прогестерона в патофизиологии данного заболевания [14, 25]. Также, недавние исследования показали, что при лечении улипристала ацетатом (селективный модулятор прогестероновых рецепторов) уровни транскриптов TGF-β1 и TGF-β3 в миоматозных клетоках были заметно снижены, что косвенно указывает на то, что прогестерон опосредует передачу сигналов TGF-β [26, 27, 28].
Кроме того, прогестерон, взаимодействуя как со своими специфическими PRs, так и с негеномными мембранными рецепторами (mPRs/PGRMCs), активирует ряд сигнальных путей (WNT/β-катенин, PI3K/AKT), которые стимулируют рост/пролиферацию миоматозных клеток, способствуют их «выживанию» (за счёт снижения апоптоза), приводят к определённым сосудистым изменениям, улучшающим кровоснабжение опухоли и вызывающим значимую для миомы матки модификацию внеклеточного матрикса (ключевого компонента структуры опухоли) [14, 18-21]. Таким образом, прогестерон регулирует факторы роста, ангиогенные факторы, компоненты внеклеточного матрикса и апоптотические агенты в миоматозных клетках [20].
Очень важно отметить следующий момент: прогестерон является одним из ключевых метаболических предшественников андрогенов и эстрогенов в организме [29]. В работе Ruth et al. были показаны значимые положительные корреляции между уровнем прогестерона и содержанием дегидроэпиандростерон-сульфата (ДГЭАС) (r=0,60), тестостерона (r=0,44), индексом свободных андрогенов (FAI, рассчитывается как тестостерон/SHBG×100) (r=0,39) и, в меньшей степени, концентрацией эстрадиола (r=0,17) [30]. Интересно, что результаты GWAS, полученные Ruth et al., указывают на наличие общих генетических детерминант уровней ДГЭАС (rs148982377) и прогестерона (rs34670419) (полиморфизмы rs148982377 и rs34670419 сильно сцеплены (r2=1,00, D'=1,00), расположены на расстоянии 56 kb друг от друга в области генов CYP3A4/CYP3A7, участвующих в процессе биосинтеза стероидов) [30]. Следует отметить, что описанные в литературе значимые для миомы матки эффекты генетических полиморфизмов, связанные с уровнем SHBG, реализуемые через тестостерон и эстрогены, в определенной степени могут быть опосредованы эффектами их предшественника – прогестерона [31, 32].
Следует отметить, что эстрогены и прогестерон действуют совместно в процессе формирования миомы матки: в клетках опухоли эстрогены стимулируют повышенную экспрессию PRs, что приводит к повышению «чувствительности» миоматозных узлов к сигналам этих гормонов [18]. В экспериментах (использовались животные модели) показано, что уровень экспрессии PRs в опухолевых клетках выше по сравнению с эстрогеновыми рецепторами [33]. Также есть данные, что у женщин с миомой матки, не получавших терапию агонистами гонадотропин-рилизинг-гормона, содержание PRs было значительно выше, чем содержание эстрогеновых рецепторов [34]. Примечательно, что в секреторную фазу менструального цикла митотическая активность миоматозных клеток выше (преобладает прогестерон), чем в пролиферативную фазу (преобладают эстрогены) [35].
Важное значение в патофизиологии миомы матки принадлежит гормонам гипофиза – лютеинизирующий гормон (передняя доля) и пролактин (задняя доля) [36]. Литературные данные свидетельствуют о том, что риск развития миомы матки возрастает у женщин с более высокими показателями концентрации лютеинизирующего гормона в сыворотке крови [37]. Также, согласно результатам иммуногистохимического анализа обнаружено повышенное содержание пролактина в миоматозных клетках по сравнению с клетками нормального миометрия у женщин с миомой матки и клетками миометрия здоровых женщин. Кроме того, пролактин может оказывать влияние на развитие и рост опухоли посредством активации сигнальных путей STAT5/MAPK в клеточных линиях миометрия крысы и человека [38]. Следует отметить, что уровень лютеинизирующего гормона в рассматриваемой нами выборке больных миомой матки ассоциирован с rs4149056 SLCO1B1 [T/C] (12хр.), а с концентрацией пролактина в сыворотке крови больных, имеющих миому матки, связан полиморфный локус rs8023580 NR2F2 [T/C] (15хр.).
Интересно отметить, что данная генетическая панель (девять локусов, ассоциированных с уровнем SHBG) использовалась ранее в исследованиях нашего научного коллектива при изучении рака молочной железы [39], эндометриоза [40]. Согласно результатам, полученным в работе Пономаревой Т.А., с уровнем эстрадиола у больных эндометриозом связаны молекулярно-генетические маркеры rs3779195 BAIAP2L1 (pperm≤0,050, β=-0,282 – -0,318) и rs440837 ZBTB10 (pperm=0,048, β=-0,264), прогестерона – rs780093 GCKR (pperm≤0,050, β=-0,380 – -0,269), rs10454142 PPP1R21 (pperm=0,049, β=0,568), rs8023580 NR2F2 (pperm=0,050, β=-0,289) и rs12150660 SHBG (pperm=0,028, β=-1,071), а с концентрациями тестостерона и дегидроэпиандростерона ассоциирован полиморфный локус rs440837 ZBTB10 (pperm≤0,050, -0,215 и pperm≤0,050, β=-0,266 – -0,334 соответственно) [40]. Основываясь на этих данных, мы можем заключить, что SNPs rs3779195 BAIAP2L1 и rs8023580 NR2F2 связаны с уровнями эстрадиола и прогестерона соответственно, как у больных с эндометриозом [40], так и с миомой матки (материалы нашего исследования). Значимые ассоциации с уровнями тестостерона, прогестерона, эстрадиола с рядом генов-кандидатов половых гормонов (SLC22A10-rs112295236, ZNF789-rs148982377, ZKSCAN5-rs34670419 и др.) установлено и при гиперплазии эндометрия [41].
Заключение. С уровнем половых гормонов у женщин с миомой матки связаны следующие SHBG-значимые молекулярно-генетические маркеры – rs3779195 [T/A] BAIAP2L1, rs7910927 [G/T] JMJD1C, rs10454142 [T/C] PPP1R21 (эстрадиол), rs4149056 [T/C] SLCO1B1 (лютеинизирующий гормон) и rs8023580 [T/C] NR2F2 (пролактин, прогестерон и тестостерон).
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы