Экспериментальная модель болезни Альцгеймера, вызванная интрагиппокампальным введением натрия азида. Сопоставимость с амилоидной моделью
Aннотация
Актуальность: В настоящее время лечение болезни Альцгеймера является сложной медицинской задачей, требующей постоянного поиска и разработки новых средств для терапии данного состояния. В связи с чем встает вопрос выбора релевантной экспериментальной модели болезни Альцгеймера. Цель исследования:Провести сравнительную оценку двух интервенционных экспериментальных моделей болезни Альцгеймера: индуцированной введением фрагментов β-амилоида и индуцированной введением натрия азида. Материалы и методы:Болезнь Альцгеймера моделировали путем инъекции фрагментов β-амилоида 1-42 (1 ммоль/л) или растворов натрия азида (1М, 2М, 3М и 4М концентрации) в СА1 часть гиппокампа крыс самцов Wistar. По истечении 60 дней у животных оценивали изменение когнитивных функций в тесте Y-образный лабиринт. В ткани гиппокампа определяли изменение концентрации фосфорилированного тау-белка, апоптоз-индуцирующего фактора, реакций аэробного и анаэробного метаболизма, а также активности супероксидисмутазы и концентрации продуктов, реагирующих с тиобарбитуровой кислотой. Полученные результаты обрабатывали статистически, используя программный комплекс StatPlus 7.0. Результаты:Проведенное исследование показало, что введение в гиппокамп животных натрия азида в концентрации 3М и 4М, а также фрагментов β-амилоида способствует развитию сопоставимого по выраженности когнитивного дефицита, повышению концентрации тау-белка в ткани гиппокампа в 4,1; 3,9 и 4,7 раза (все показатели p<0,05 относительно нелеченых животных) соответственно. На фоне инъекции в гиппокамп крыс 3М и 4М растворов натрия азида, а также фрагментов β-амилоида наблюдалось повышение содержания апоптоз-индуцирующего фактора в 3,5 (p<0,05); 3,4 (p<0,05) и 4,0 раза (p<0,05) соответственно, сопровождаемое угнетением аэробного метаболизма и активацией анаэробного, и окислительного стресса. Стоит отметить, что введение натрия азида в концентрации 1М и 2М приводило к статистически значимо меньшим изменениям, чем инъекция 3М и 4М растворов натрия азида, и фрагментов β-амилоида. Заключение:Анализируемые в ходе данной работы экспериментальные модели болезни Альцгеймера демонстрируют формирование сопоставимых патогенетических изменений, при этом оптимальной концентрацией натрия азида для индуцирования болезни Альцгеймера можно считать 3М или 4М
Введение. Болезнь Альцгеймера (БА) – одна и самых распространенных форм деменции, входящая в топ 10 ведущих причин смертности. Согласно статистическим отчетам Всемирной организации здравоохранения БА занимает 7-е место антирейтинге летальности унося ежегодно около 1,8 млн. жизней [1]. В Российской Федерации по данным GlobalBurdenofDisease 2019 заболеваемость БА достигает 1,150 случая на 100 тыс. человек населения [2]. Неутешительными являются и прогностические выкладки по распространенности БА. Так только в США к 2060 году, если не будут разработаны новые методы лечения, предполагается увеличение новых случаев БА до более чем 13 млн. в год [1, 2]. Как правило, в области создания новых средств терапии БА и сосредоточены объединённые исследования специалистов экспериментальной и практической медицины. Однако, в силу комплексного патогенеза, не до конца установленной этиологии и высокой связи с нарушениями функционирования генетического аппарата разработка новых методов лечения БА является сложной задачей. В этой связи острой встает вопрос выбора релевантной экспериментальной модели БА, используемой на этапе доклинических исследований. Dhapolaetal, 2023 в зависимости от патофизиологических особенностей выделяют три группы моделей БА: спонтанные, интервенционные и генетические [3]. Спонтанные модели БА подразумевают использование в качестве биологической модели приматов – павианов и макак, у которых отмечается спонтанное накопление в ткани мозга нейрофибриллярных клубков фосфорилированного тау-белка и конгломератов β-амилоида (Аβ) соответственно, что является отличительным признаком патогенеза БА. Однако, данные модели имеют ряд недостатков, что ограничивает их широкое использование в рутинной экспериментальной деятельности: высокие затраты на содержание приматов, низкий репродуктивный потенциал, сложности с манипуляциями в ходе работы и риск заражения персонала зоонозными инфекциями. Трансгенные животные также являются важным исследовательским инструментом, применяемом при разработке новых средств для лечения БА. Использование методов генной инженерии позволило создать трансгенных мышей p25, воспроизводящих CDK- зависимый фенотип заболевания со склонностью к прогрессирующему нейровоспалению и накоплению тау-белка [4]. Несмотря на это трансгенные животные не находят столь обширного использования в экспериментальной работе в силу их высокой стоимости. В этой связи на первый план среди доклинических моделей БА выходят интервенционные модели, подразумевающие введение химических соединений, вызывающих состояние, схожее по фенотипу с БА. Одной из самых распространенных интервенционных моделей БА, воспроизводящей патогенез и симптоматику заболевания, в том числе спорадической формы, является экспериментальная модель, основанная на инъекции фрагментов Аβ в гиппокамп животных [5]. Однако, и данная экспериментальная модель не лишена недостатков, самым значимым из которых является трудоемкость получения агрегатов Аβ и их стоимость [6]. В тоже время учитывая особенности патогенеза БА, а именно зависимость накопления агрегатов Аβ и тау-белка от уровня внутриклеточного АТФ и, соответственно, функциональной активности митохондрий [7], можно предположить, что введение соединений, оказывающих негативное влияние на митохондрии клетки, будет способствовать формированию фенотипа БА. Одним из таких веществ может являться натрия азид – ингибитор цитохром-с-оксидазы, который оказывает выраженное цитотоксическое действие, индуцируя апоптоз, окислительный стресс, эксайтотоксичность и энергодефицит [8].
Цель исследования. Провести сравнительную оценку Аβ-индуцированной и натрий азид-индуцированной БА в эксперименте,
Материалы и методы исследования. Исследование выполнено на крысах самцах Wistar массой тела 215±10% грамм, 7-недельного возраста. Животные были получены из питомника лабораторных животных «Рапполово» (д.Рапполово, Ленинградская обл.). Перед включением в эксперимент крысы 14 дней содержались в условиях карантинного помещения. Во время исследования животные размещались в полипропиленовых клетках по 5 особей со свободным доступом к воде и полнорационному корму. Условия содержания крыс соответствовали требованиям Директивы ЕU 2010/63 [9]. Дизайн исследования был одобрен локальным этическим комитетом ПМФИ от 15.05.2023 протокол № 5.
Животные были рандомизированны по массе (не более 10% отклонений по массе в группе) на 6 групп (n=10 каждая группа). Первая группа – ложнооперированные животные (ЛО). Остальным экспериментальным группам моделировали БА, при этом выделялись группы: Аβ – группа крыс, которым вводили фрагменты Аβ; натрия азид 1М - группа крыс, которым вводили раствор натрия азида в концентрации 1М; натрия азид 2М - группа крыс, которым вводили раствор натрия азида в концентрации 2М; натрия азид 3М - группа крыс, которым вводили раствор натрия азида в концентрации 3М; натрия азид 4М - группа крыс, которым вводили раствор натрия азида в концентрации 4М. Концентрации растворов натрия азида были выбраны на основании данных предыдущих исследований по изучению гипометаболических реакций в ткани головного мозга животных [10].
БА воспроизводили путем инъекции фрагментов Аβ или натрия азида в СА1 часть гиппокампа (передне-задняя = -3,8 мм, медиально-латеральная = 2,0 мм, дорсально-вентральная = 2,6 мм от брегмы. Стереотаксические координаты определены согласно G. Paxinos, 2013 [11].
Перед введением Aβ1-42 (Sigma-Aldrich, Германия) растворяли при температуре 40С в фосфатно-солевом буфере (pH =7,4). Далее раствор непрерывно перемешивании в течение 36ч при указанной температуре до образования агрегатов. Натрия азид растворяли в воде для инъекций до получения растворов с концентрацией 1М, 2М, 3М и 4М. После приготовления растворов для введения животных наркотизировали хлоралгидратом (интраперитонеально, 350 мг/кг), скальпировали теменную область, проделывали трепанационное отверстие (d=1 мм) и при помощи микро-дозатора с иглой G30 вводили либо фрагменты Aβ1-42 в конечной концентрации 1 ммоль/л и в объеме 2 мкл [12], либо растворы натрия азида в эквивалентном объеме. Иглу фиксировали в месте введения в течении 5 минут, после чего ее извлекали. Рану ушивали и обрабатывали 10%-ным раствором повидон-йода. К животным ЛО группы применялись все последовательные процедуры за исключением введения Аβ или натрия азида Крыс оставляли на 60 дней, после чего производили оценку когнитивного дефицита в тесте Y-образный лабиринт. Тестирование осуществляли на протяжении 8 мин.: животное помещали в центр лабиринта, представляющего собой три рукава, соединенных под углом 1200, и фиксировали число перемещений животных между рукавами (общее количество и спонтанные чередования рукавов лабиринта: 1-2-3, 3-1-2, 2-3-1). На основании полученных данных определяли процент спонтанного чередования, который отражает изменение когнитивных способностей животных [12].
После оценки когнитивного дефицита крыс наркотизировали и декапитировали, извлекали головной мозг, отсекали мозжечок, разделяли полушария и выделяли гиппокамп. Гиппокамп животных гомогенизировали в буферном растворе, состоящим из 1 ммоль ЭГТА + 215 ммоль маннита + 75 ммоль сахарозы + 0,1% раствор бычьего сывороточного альбумина+ 20 ммоль HEPES, с рН 7,2. Гомогенат разделяли на 2 части. В первой оценивали изменение концентрации продуктов, реагирующих с 2-тиобарбитуровой кислотой (ТБК-АП).
Содержание ТБК-АП определяли спектрофотометрическим методом в реакции конденсации с 2-тиобарбитуровой кислотой. В результате реакции образуется окрашенный комплекс с максимумом поглощения при 532 нм, окраска которого прямо пропорциональна концентрации ТБК-АП. Количество ТБК-АП рассчитывали по величине молярного коэффициента экстинкции малонового диальдегида (1,56*105 лмоль-1см-1), полученные результаты выражали в нмоль/мг белка [13].
Вторую часть супернатанта центрифугировали при 1100g в течение 2-х минут. Полученный супернатант разделяли на две части. Первую аликвоту в количестве 700 мкл переносили в пробирки типа Эппендорф и наслаивали 75 мкл 10% раствора перколла (Sigma-Aldrich, Германия), после чего центрифугировали при 18000g в течении 10 минут. Осадок ресуспендировали в 1 мл изолирующей среды и повторно центрифугировали в течение 5 минут при 10 000g. Полученный супернатант использовали для оценки изменения аэробных и анаэробных реакций обмена [14].
Интенсивность аэробного клеточного дыхания определяли по изменению потребления кислорода в анализируемой среде при добавлении 4 - (трифлуорометокси)фенил)гидразоно)малононитрила в концентрации 1 µM/л и пирувата в качестве субстрата (15 ммоль/л). Активность анаэробного обмена оценивали при внесении в среду олигомицина (1 µг/мл) и глюкозы (15 ммоль/л) в качестве субстрата. Потребление кислорода (OCR) регистрировали на лабораторном респирометре АКПМ 1-01Л и выражали в промилле (ррм)/мг белка [15].
Во второй аликвоте первичного супернатанта оценивали изменение концентрации фосфорилированного тау-белка и апоптоз-индуцирующего фактора (АИФ) методом ИФА. При проведении ИФА использовали видоспецифичные наборы реактивов (Cloud clone, США). Также во второй аликвоте супернтанта оценивали активность супероксиддисмутазы (СОД).
Активность супероксиддисмутазы (СОД) оценивали ксантин-ксантиноксидазным методом, основанным на реакции дисмутации супероксидного радикала, образующегося в ходе окисления ксантина и восстановления 2-(4-йодофенил)-3-(4-нитрофенол)-5-фенилтетразолия хлорида. Среда инкубации содержала: ксантин 0,05 ммоль/л; 2-(4-йодофенил)-3-(4-нитрофенол)-5-фенилтетразолия хлорид 0,025 ммоль/л; ЭДТА 0,94 ммоль/л, ксантиноксидаза 80 Ед/л, N -циклогексил-3-аминопропансульфоновой кислоты – 40 ммоль/л. Оптическую плотность смеси регистрировали при 505 нм. Активность СОД выражали в ЕД/мг белка [16]. Во всех случаях концентрацию белка определяли по методу Бредфорда.
Статистическую обработку данных осуществляли с применением возможностей программного комплекса StatPlus 7.0 (AnalystSoft, США). Нормальность распределения данных оценивали с применением теста Шапиро-Уилка. Однородность дисперсий определяли тестом Левена. Статистически значимые отличия между группами оценивали методом ANOVA. Сравнение с ЛО группой осуществляли в тесте Даннета. Достоверные отличия между остальными группами определяли с применением пост-теста Ньюмена-Кейлса (при нормальном распределении данных) или поcт-теста Краскелла-Уоллиса (при распределении данных отличных от нормального) с последующим парным сравнением в тесте Данна. Критический уровень значимости во всех случаях принимали р <0,05.
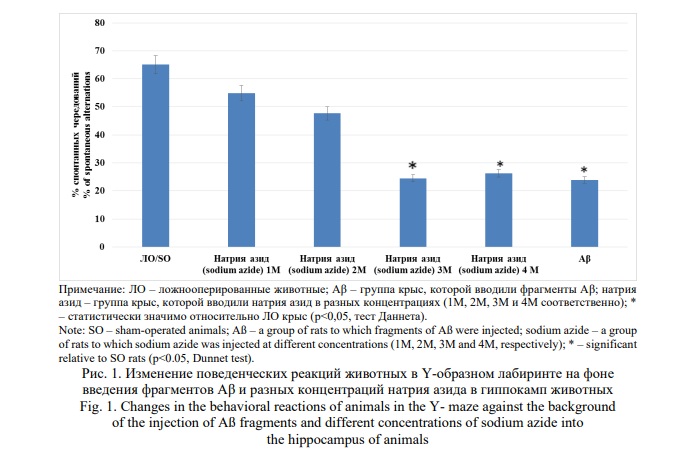
Результаты. В ходе исследования было показано, что при интрагиппокампальном введении животным фрагментов Аβ наблюдалось снижение числа спонтанных чередований в Y-образном лабиринте на 63,3% (p<0,05) по отношению к ЛО группе крыс (Рис. 1). Аналогичная тенденция изменений была отмечена при введении животным 3М и 4М растворов натрия азида, а именно процент спонтанных чередований уменьшился в сравнении с ЛО группой крыс на 62,4% (p<0,05) и 59,6% (p<0,05) соответственно. В тоже время на фоне инъекции 1М и 2М растворов натрия азида достоверных отличий относительно ЛО группы крыс в поведении животных в Y-образном лабиринте не установлено. Стоит отметить, что статистических значимых отличий между группами животных, которым вводили 3М, 4М растворы натрия азида и фрагменты Аβ установлено не было.
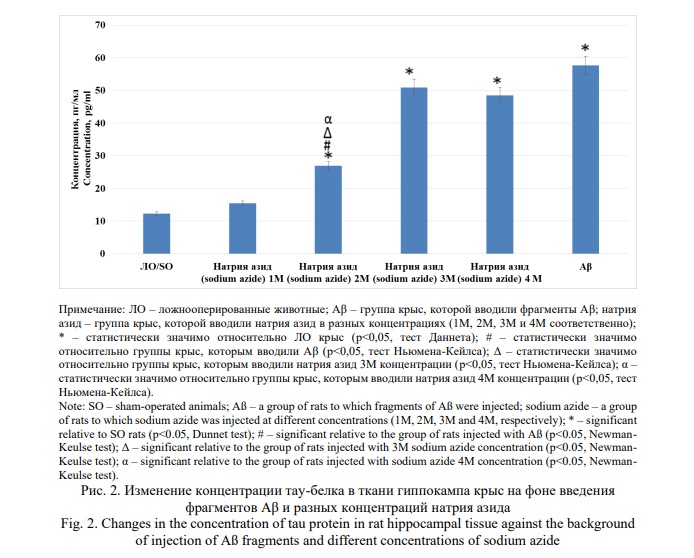
Также было показано, что в ткани гиппокампа крыс, которым вводили фрагменты Аβ, концентрация фосфорилированного тау-белка (Рис. 2) была выше нежели у ЛО животных в 4,7 раза (p<0,05). На фоне инъекции в гиппокамп крыс раствора натрия азида в концентрациях 2М, 3М и 4М содержание тау-белка превосходило аналогичное у ЛО группы крыс в 2,2; 4,1 и 3,9 раза соответственно (все показатели p<0,05). При этом, введение 1М раствора натрия азида не оказало значимого влияния на процесс накопления фосфорилированного тау-белка в гиппокампе животных. Кроме того, содержание тау-белка в ткани гиппокампа у крыс, которым вводили 2М раствор натрия азида было достоверно (p<0,05) меньше такового у животных, которым вводили как фрагменты Аβ, так и натрия азида в концентрации 3М и 4М.
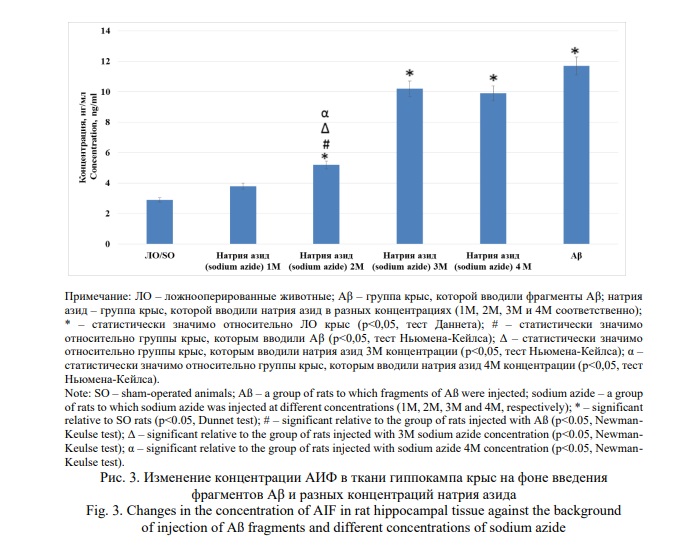
Анализ изменения концентрации АИФ позволил установить, что у крыс, которым вводили натрия азид в концентрациях 2М, 3М и 4М данный показатель превышал аналогичный у ЛО животных в 1,8 (p<0,05); 3,5 (p<0,05) и 3,4 (p<0,05) раза соответственно, тогда как на фоне введения Аβ, содержание АИФ в ткани гиппокампа увеличилось в 4,0 раза (p<0,05) по отношению к ЛО группе крыс (Рис. 3). При этом, у крыс которым вводили 2М раствор натрия азида, концентрация АИФ была достоверно (p<0,05) меньше аналогичной у животных, которым вводили Аβ и 3М/4М растворы натрия азида и статистически значимо не отличалась от показателей ЛО группы крыс. Также стоит отметить, что достоверных отличий между группами животных, которым вводили Аβ и натрия азида в концентрации 3М и 4М, не установлено.
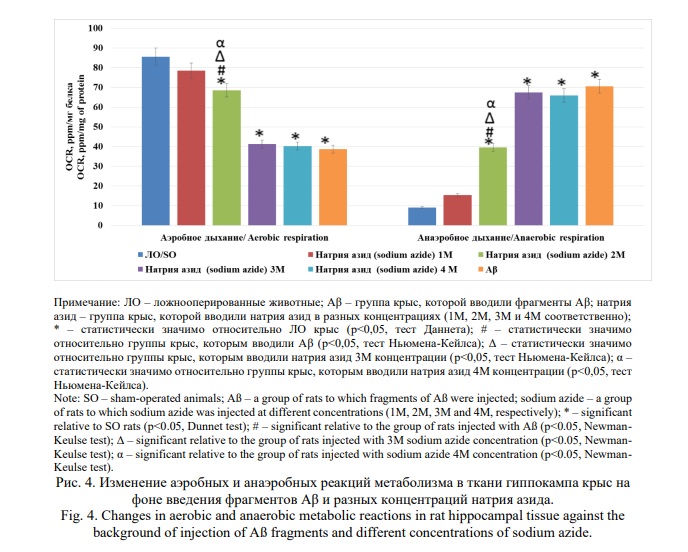
На фоне введения фрагментов Аβ в гиппокамп крыс отмечено снижение (относительно ЛО животных) интенсивности аэробного метаболизма на 54,8% (p<0,05) при сопутствующем повышении анаэробных реакций обмена в 7,8 раза (p<0,05). В тоже время при инъекции натрия азида в концентрациях 2М, 3М и 4М аэробный метаболизм уменьшился в сравнении с ЛО животными на 20,0%; 51,9% и 53,0% соответственно (все показатели p<0,05), тогда как анаэробный метаболизм, напротив, увеличился в 4,4 (p<0,05); 7,4% (p<0,05) и 7,2 (p<0,05) раза соответственно (Рис. 4). Также было показано, что у крыс, которым вводили 2М раствор натрия азида, реакции аэробного обмена были достоверно (p<0,05) ниже, а анаэробного выше, чем у животных, которым вводили Аβ и натрия азид в концентрациях 3М и 4М.
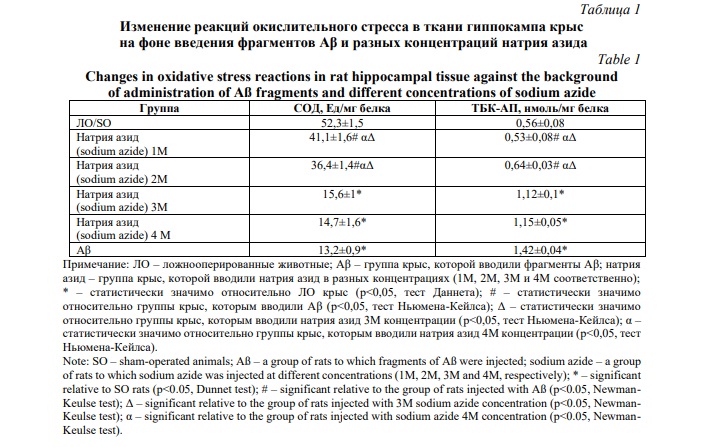
При анализе изменения реакция окислительного стресса в ткани гиппокампа крыс с БА (Табл. 1), было установлено, что при инъекции фрагментов Аβ у животных по отношению к ЛО крысам отмечается снижение активности СОД на 74,8% (p<0,05), при повышении концентрации ТБК-АП в 2,53 раза (p<0,05). В группах крыс, которым БА моделировали путём введения натрия азида в концентрации 1М и 2М, значимых отличий в содержании ТБК-АП и активности СОД в сравнении с ЛО группой крыс установлено не было, хотя была отмечена тенденция к негативному изменению данных показателей (повышение и снижение соответственно). В тоже время на фоне инъекции в гиппокамп крыс раствора натрия азида в концентрации 3М и 4М наблюдалось уменьшение активности СОД на 70,2% (p<0,05) и 71,9% (p<0,05) соответственно, при повышении содержания ТБК-АП в 2,0 (p<0,05) и 2,05 (p<0,05) раза соответственно.
 Обсуждение результатов. Выбор экспериментальной модели нейродегенеративных заболеваний, в частности, БА играет определяющую роль в успешном доклиническом изучении новых фармакологически активных соединений. Наряду с классическими моделями, например, амилоидиной или алюминий-хлоридной, в экспериментальной практике все чаще используются альтернативные подходы, позволяющие воспроизвести отдельные патофизиологические механизмы БА. Silva, et al., 2023 сообщают, что в качестве агента, индуцирующего БА, возможно использование стрептозотоцина. В данной работе при введении в гиппокамп животного стрептозотоцин вызывал усиление нейродегенеративного процесса и активацию ацетилхолинэстеразы, что в свою очередь является одними из ведущих патогенетических элементов БА [17].
Обсуждение результатов. Выбор экспериментальной модели нейродегенеративных заболеваний, в частности, БА играет определяющую роль в успешном доклиническом изучении новых фармакологически активных соединений. Наряду с классическими моделями, например, амилоидиной или алюминий-хлоридной, в экспериментальной практике все чаще используются альтернативные подходы, позволяющие воспроизвести отдельные патофизиологические механизмы БА. Silva, et al., 2023 сообщают, что в качестве агента, индуцирующего БА, возможно использование стрептозотоцина. В данной работе при введении в гиппокамп животного стрептозотоцин вызывал усиление нейродегенеративного процесса и активацию ацетилхолинэстеразы, что в свою очередь является одними из ведущих патогенетических элементов БА [17].
В тоже время, принимая во внимание особенности патогенеза БА, а именно наличие выраженного энергодефицита и митохондриальной дисфункции, можно предположить, что некоторые митохондриальные токсиканты могут выступать в качества БА-индуцируемых соединений. Одним из таких веществ является натрия азид.
Натрия азид представляет собой сопряженное основание с азотистоводородной кислотой. Это белый кристаллический порошок без вкуса и запаха, хорошо растворимый в воде. Натрия азид при контакте с водой превращается в азотистоводородную кислоту. Используется, в первую очередь в промышленности в качестве газогенерирующей среды в пиропатронах для автомобильных подушек безопасности. Также возможно применение натрия азида как катализатора химического синтеза или консерванта. Токсичность натрия азида зависит от дозы и проявляется в виде тошноты, рвоты, гипотонии, тахикардии и головных болей, гипотонии, аритмии, ацидоза, судорог [18].
Тенденция использования натрия азида для моделирования БА прослеживается в работе, представленной Jabeen, et al., 2022. В данном исследовании авторами сравнивались две экспериментальные модели БА: вызванная азидом натрия и алюминия хлоридом. В итоге была продемонстрирована сопоставимость данных экспериментальных техник. Однако, авторами рассматривалось системное воздействие натрия азида на организм животного с вовлечением в патологический процесс печени, сердца и поджелудочной железы, что указывает на формирование коморбидной патологии [19]. В тоже время представляется актуальным локальное введение натрия азида в гиппокамп животного, что вероятно может индуцировать локальные церебральные изменения, характерные для БА.
В ходе исследования было показано, что введение растворов натрия азида в концентрации 3М и 4М в ткань гиппокампа крыс приводит к повышению концентрации гиперфосфорилированного тау-белка, угнетению аэробного, увеличению анаэробного обмена и активации внутреннего пути апоптоза, что выражалось в росте содержания АИФ. Также у крыс наблюдалось угнетение активности СОД с активацией липопероксидативных процессов. В итоге отмечено развитие когнитивного дефицита, что подтверждалось данными, полученными при оценке поведения животных в тесте Y-образный лабиринт. Стоит отметить, что наблюдаемые изменения при введении натрия азида в указанных концентрациях были эквивалентны таковым, отмечаемым на фоне инъекции фрагментов Аβ, тогда как при использовании натрия азида в более низких концентрациях (1М раствор) статистически значимых отличий по отношению к ЛО животным не наблюдалось, либо они были достоверно меньше, чем при применении натрия азида в высоких концентрациях или при введении Аβ (как в случае введения 2М раствора натрия азида). Подобные изменения, наблюдаемые в ткани гиппокампа могут быть связаны с характером действия натрия азида. Данное соединение обладает выраженным цитотоксическим действием, реализуемым по двум молекулярным механизмам: ингибирование цитохром-с-оксидазы митохондриальной дыхательной цепи и каталазы, индуцируя тем самым энергодефицит и окислительный стресс, что особенно негативно сказывается на клетках с высокой метаболической активностью, например, нейронов головного мозга [20]. В тоже время, нарушение синтеза АТФ и сопутствующее подавление АТФ-зависимых процессов приводит к снижению буферной кальциевой емкости митохондрий, инициируя набухание и «блеббинг» митохондрий, в результате активируя внутренний путь апоптоза [21]. Кроме того, было показано снижение активности цитохром-с-оксидазы у пациентов с БА в ткани гиппокампа, что клинически подтверждает развитие митохондриальной дисфункции при БА [22]. Описанные механизмы практически полностью отражают положения «митохондриальной теории» БА [23]. Согласно данной гипотезе. нарушение функционирования митохондрий клетки способствует повышенной агрегации Aβ и тау-белка, что было подтверждено Abyadeh, etal., 2021 [24]. Стоит отметить, что хронологически митохондриальная дисфункция является более ранним патогенетическим механизмом БА, чем формирование агрегатов Аβ [25]. Таким образом, введение натрия азида в гиппокамп крыс в экспериментальных условиях может обеспечить формирование ранних стадий БА, связанных с развитием митохондриальной дисфункции, что в дальнейшем приводит к феноменонимическим изменениям в ткани гиппокампа, выражаемым в накоплении фосфорилированного тау-белка.
Заключение. Проведенное исследование показало, что введение 3М и 4М растворов натрия азида в гиппокамп крыс приводит патофизиологическим изменениям сопоставимыми с аналогичными при инъекции фрагментов Аβ. При этом, отмечается дисбаланс реакций основного обмена, активация апоптоза, окислительного стресса и накопление фосфорилированных форм тау-белка. Таким образом, введение 3М и 4М растворов натрия азида в гиппокамп крыс может представлять собой альтернативный введению фрагментов Аβ экспериментальный подход к моделированию БА.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы