Влияние полиморфизмов генов цитокинов на риск развития преэклампсии
Aннотация
Актуальность: Преэклампсия представляет собой мультисистемное расстройство, в основе которого лежит плацентарная и эндотелиальная дисфункция, приводящая к гипертензии и другим повреждениям органов и систем во время беременности и является основной причиной материнской смертности. Предполагают, что риск развития преэклампсии формируется еще в первые недели беременности, включая инвазию трофобласта, перестройку спиральных артерий эндометрия и иммунную дезадаптацию. В связи с чем, выявление иммунологических и генетических маркеров, предсказывающих преэклампсию на доклиническом этапе, представляет значительный клинический интерес. Цель исследования: Определить значение полиморфизмов rs1143627 (T-31C) гена IL-1β, rs1800629 (G-308A) гена TNFα и rs1800896 (A-1082G) гена IL-10 в прогнозировании риска преэклампсии. Материалы и методы: В исследование включены 231 женщин в сроке беременности 16-28 недель. 1-группу (n=71) составили женщины во II триместре гестации с риском развития преэклампсии; 2-группу (n=50) – пациентки в III триместре гестации с развившейся преэклампсией; контрольную группу (n=50) – с физиологическим течением беременности. Исследованы гематологические и гемостазиологические показатели, концентрация цитокинов IL-1β, TNFα и IL-10 в крови. Генотипирование полиморфизмов rs1143627 (T-31C) гена IL-1β, rs1800629 (G-308A) гена TNFα и rs1800896 (A-1082G) гена IL-10 осуществляли методом полимеразной цепной реакции в режиме реального времени. Результаты: Аллель С гена IL-1β (T-31C) чаще встречался в 1-й группе (ОR=1,6; 95% CI: 1,07-2,49; р=0,02) по сравнению с контролем (41,4%). Ввиду низкой доли мутантного аллеля А и отсутствия генотипа А/А гена TNFα (G-308A) среди лиц узбекской национальности связь данного маркера с риском преэклампсии не подтверждена. Но высокое содержание TNFα в крови у женщин с генотипом G/А 1-й и 2-й групп (р<0,001) указывает на ассоциацию аллеля А данного полиморфизма с гипертензивными нарушениями. Риск развития преэклампсии значимо повышается у носителей низкофункционального генотипа А/А гена IL-10 (A-1082G) (ОR=16,5; 95% CI: 7,78-34,97; р=0,01). Заключение: Аллель С rs1143627 (T-31C) гена IL-1β, аллель А и генотип А/А rs1800896 (A-1082G) гена IL-10 связаны с повышением риска преэклампсии и могут быть использованы в качестве генетических предикторов заболевания.
Введение. Рост акушерских заболеваний в мире становится проблемой не только медицинского, но и социального значения, в том числе осложнения при преэклампсии считаются одними из самыми сложными и тяжелыми в современной акушерской практике, а предотвращение, обусловленной ими материнской смертности, является одним из важных задач современного акушерства. Преэклампсия, характеризующаяся гестационной гипертензией и протеинурией, является серьезным осложнением, которое встречается в 5-8% случаев всех беременностей во всем мире [1]. Несмотря на то, что данная патология анализируется в течение долгих лет, проведенные исследования предоставили ограниченную информацию для прогнозирования преэклампсии.
Проблема ранней диагностики, родоразрешения и лечения беременных с преэклампсией находит отражение в работах ряда исследователей. Определена важность роли плаценты в патогенезе преэклампсии, которая включает атеросклероз сосудов плаценты, склеротическое сужение артерий и артериол, образование очагов фибрина и инфарктов, что приводит к гипоперфузии и ишемии плаценты, в результате чего повышается риск развития преэклампсии [2, 3]. У беременных с риском развития преэклампсии наблюдается дисбаланс уровней растворимой fms-подобной тирозинкиназы-1 (sFlt-1) и плацентарного фактора роста (PlGF) с 10-й недели беременности, а со II триместра беременности начинают проявляться клинические признаки преэклампсии [4, 5]. Определена важная роль эндотелиальной дисфункции в патогенезе преэклампсии. В результате дисфункции sFlt-1, PlGF, D-димера и интерлейкина (IL)-1β эндотелиальные клетки продуцируют прокоагулянты, вазоконстрикторы и факторы роста [6, 7], что приводит к увеличению тромбогенного потенциала стенок кровеносных сосудов [8, 9]. При преэклампсии поверхностная инвазия трофобласта приводит к неадекватной трансформации спиральных артерий матки, в результате чего возникает неправильное распределение крови, с последующим нарушением кровообращения в плаценте, ее ишемией [10], оксидативным стрессом [11, 12], повышенной чувствительностью эндотелиальных клеток к sFlt-1, а повышенный уровень провоспалительного цитокина фактора некроза опухоли-α (TNFα), обусловленный эндотелиальной дисфункцией вызывает мультисистемные повреждения в организме матери [13]. Увеличение количества sFlt-1, TNFa, IL-1β следует интерпретировать, как фактор высокого риска развития эндотелиальной дисфункции и преэклампсии.
Считается, что в патогенез преэклампсии вовлечены как врожденные, так и приобретенные иммунные процессы и предполагается, что Th1-иммунный ответ способствует патологической плацентации и усилению воспалительной реакции и эндотелиальной дисфункции, наблюдаемых при преэклампсии [14]. Имеются сообщения, указывающие на чрезмерную врожденную иммунную активность и изменение в сторону провоспалительного профиля цитокинов при преэклампсии. Например, у пациенток с преэклампсией наблюдаются высокие уровни Th1-цитокинов, TNFα и интерферона-γ (IFN-γ) и низкая продукция IL-4, стимулированных фитогемагглютинином мононуклеарных клеток периферической крови [15, 16]. Кроме того, в плаценте отмечается подавление продукции IL-10 [17], трансформирующего фактора роста β-рецептора 1 (TGF-β1) [7] и измененные соотношения IL-2, IL-2/IL-10 и TNFα/IL-10 [17, 18]. Преэклампсия также связана с увеличением количества клеток Th17, секретирующих IL-17 и играющих важную роль в развитии заболевания [19].
Важно отметить, что продукция цитокинов в определенной мере зависит от наличия полиморфизма их генов. Наличие высоко- или низкопродуцирующих генов-кандидатов могут влиять на установление адекватного иммунного фона в системе мать-плацента-плод. Несмотря на значительные успехи в области молекулярно-генетической основы преэклампсии, она остается сложной патологией. Результаты исследований по ассоциации полиморфизмов генов про- и противовоспалительных цитокинов с риском развития преэклампсии разнонаправленные, что возможно связано с различием в этнических группах, гетерогенностью преэклампсии и включением в исследование с учетом разных патологических механизмов, критерием отбора больных [20, 21]. Следует отметить, что среди лиц узбекской национальности исследования по выявлению молекулярно-генетических маркеров преэклампсии не проводились. Продолжение исследований, интегрирующих геномные, эпигеномные и клинические данные, имеет решающее значение для выявления факторов, способствующих ее развитию и прогрессированию. Полученные данные могут улучшить стратификацию риска, раннее выявление и целевые терапевтические вмешательства, снижая бремя этого значительного акушерского осложнения. В связи с чем, определение молекулярно-генетических предикторов развития преэклампсии имеет особое значение в прогнозировании риска развития данной патологии на ранних этапах беременности.
Цель исследования. Определить значение полиморфизмов rs1143627 (T-31C) гена IL-1β, rs1800629 (G-308A) гена TNFα и rs1800896 (A-1082G) гена IL-10 в прогнозировании риска преэклампсии.
Материал и методы исследования. В исследовании приняли участие 231 женщин узбекской национальности в возрасте от 19 до 42 лет в сроке беременности от 16 до 28 недель. Основную группу составили 121 беременных женщин: 1-группа (n=71) – женщины во II триместре гестации с риском развития преэклампсии (имеющих в анамнезе преэклампсию); 2-группа (n=50) – женщины в III триместре гестации с клиническими проявлениями преэклампсии. Контрольную группу составили 110 женщин с физиологически протекающей беременностью. В соответствии с принципами Хельсинской декларации от каждого участника исследования получено информированное согласие и заполненная анкета, утвержденные Этическим комитетом Бухарского государственного медицинского института (протокол №9 от 30 марта 2021 года).
Изучали клинико-анамнестические данные, гематологические (общий анализ крови) и гемостазиологические показатели (активированное частичное тромбопластиновое время (АЧТВ), протромбиновый индекс (ПТИ), Международное нормализованное отношение (МНО), фибриноген, D-димер) крови. Концентрацию цитокинов IL-1β, TNFα и IL-10 в крови определяли методом твердофазного иммуноферментного анализа.
Выбранные полиморфные локусы rs1143627 (T-31C) гена IL-1β, rs1800629 (G-308A) гена TNFα и rs1800896 (A-1082G) гена IL-10 наиболее часто анализируются в научной литературе, и, располагаясь в промоторной области генов тесно связаны с изменениями транскрипционной активности и уровнями цитокинов в крови [22, 23, 24]. Для исследования вышеуказанных полиморфизмов применен метод полимеразной цепной реакции с детекцией продуктов амплификации в режиме реального времени (ПЦР-РВ). Материалом для молекулярно-генетических исследований послужила цельная кровь, полученная из локтевой вены пациентки, которую помещали в вакуумные пробирки Vacuette 4,0 мл с содержанием антикоагулянта динатриевой соли этилендиамин-тетраацетата. Для выделения ДНК из цельной крови использовали наборы реагентов «Проба-Рапид-Генетика» ООО «НПО ДНК-Технология» (Россия). Детекцию результатов анализа проводили на амплификаторе «ДТпрайм» ООО «НПО ДНК-Технология» (Россия). Для анализа полиморфного участка гена IL-1β использована пара олигонуклеотидных праймеров (F) 5’-CCCCTTTCCTTTAACTTGATTGTG-3’ и (R) 5’- AGGTTTGGTATCTGCCAGTTTCTC-3’; для гена TNFα – (F) 5’-AGGCAATAGGTTTTGAGGGCCAT-3’ и (R) 5’-TCCTCCCTGCTCCGATTCCG-3’; для гена IL-10 (F) 5’-CACAAATCCAAGACAACACTACT-3’ и (R) 5’-GATAGGAGGTCCCTTACTTTCC-3’. Температура отжига праймеров – 60°C. Подбор праймеров проведен с помощью онлайн-программы от NCBI https://www.ncbi.nlm.nih.gov/tools/primer-blast/.
Cтатистический анализ полученных данных проведен с помощью статистического пакета прикладных программ «Statistica 10.0», статистического программного приложения Epi Info 7.2.2.2 и Программного модуля «Расчет доверительного интервала частоты и доли фактора в медицинских исследованиях» (Stud%). Вариационными параметрическими и непараметрическими методами статистики рассчитывали среднее арифметическое значение (M), среднее квадратическое отклонение (σ), стандартную ошибку среднего (m), относительные величины (частота, %) изучаемого показателя, статистическую величину полученных измерений – нормальность распределения по критерию эксцесса и равенства главных дисперсий (критерий Фишера), а вероятность ошибки (р) – по критерию Стьюдента (t).
Проведен анализ соответствия полученных частот генотипов ожидаемым значениям с учетом равновесия Харди-Вайнберга, далее сравнение распределения аллелей и генотипов между группами с использованием корректировки Бонферрони для множественных сравнений. При статистических расчетах использован критерий χ2 (с поправкой Йейтса) и отношение шансов (OR – odds ratio) с 95% доверительным интервалом (95% СI – confidence interval). Значимыми приняты показатели с уровнем достоверности р<0,05.
Результаты и их обсуждение. Возраст наблюдаемых женщин составил 27,2±0,9 лет в основной группе и 25,7±0,7 лет в контрольной группе (р>0,05). Беременные в возрасте 31-35 лет практически в два раза чаще регистрировались в основной группе (р>0,05), 36-40 лет – только в основной группе (Табл. 1). Анализ профессиональной принадлежности женщин показал, что наибольший контингент среди них составили служащие (47,9%) и рабочие (32,2%) в основной группе, служащие (39,1%) и безработные (домохозяйки) (28,2%) – в контрольной группе (р>0,05). В основной группе в 2 раза реже отмечены показатели нормального индекса массы тела (ИМТ) (р<0,01), а количество пациенток с ожирением легкой степени было значительно выше, чем в контрольной группе (р<0,001). По количеству беременностей и репродуктивным исходам исследуемые группы существенно не отличались (р>0,05). Вместе с тем, отмечается повышение частоты встречаемости преждевременных родов в 1-й (р>0,05) и 2-й (р>0,001) группах по сравнению с контрольной группой.
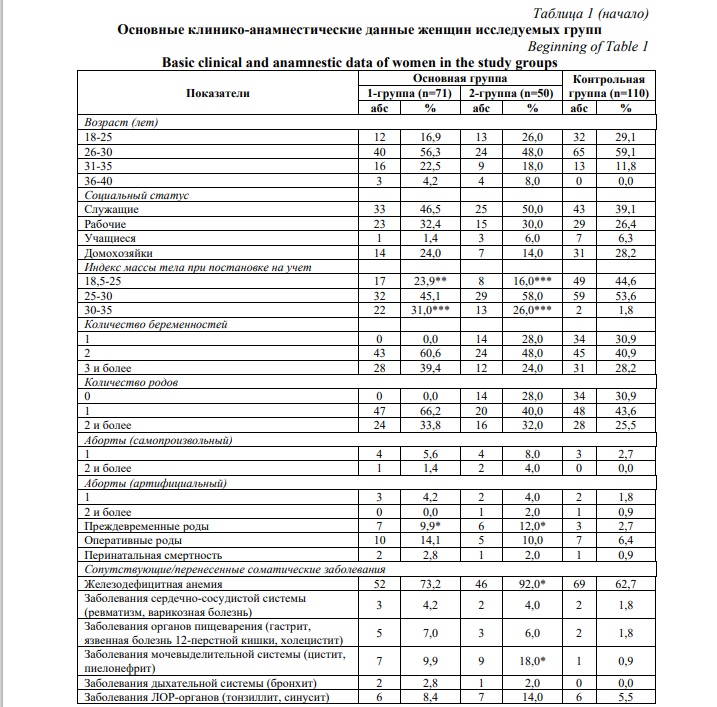
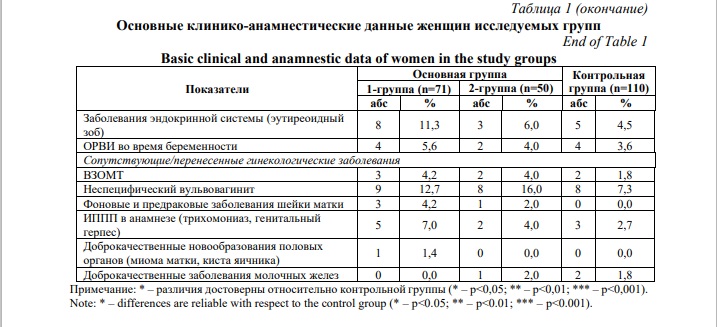
Соматические заболевания являются серьезным фактором риска и неблагоприятным фоном для развития осложнений беременности. Наиболее часто встречаемой соматической патологией явилась железодефицитная анемия различной степени тяжести среди женщин исследуемых групп. Частота ее была значительно высокой у женщин с развившейся преэклампсией по сравнению с контролем (р>0,001). Заболевания мочевыделительной системы в анамнезе чаще регистрировались в основной группе, при этом данная патология встречалась почти у каждой пятой женщины 2-й группы и была значительно выше, чем в контрольной группе (р>0,001). Следует отметить, что в анамнезе женщин основной группы чаще отмечалось заболеваемость инфекционно-воспалительной патологией половых органов, но различия в сравнении с контрольными данными не были статистически значимыми (р>0,05).
Показатель артериального давления в момент исследования составил 120,27±1,9/81,03±1,6 мм рт. ст. в 1-й группе, 138,69±2,4/96,57±2,8 мм рт. ст. – во 2-й группе и 113,06±1,7/80,46±1,3 мм рт. ст. – в контрольной группе. Протеинурия выше 0,033 г/л присутствовала только во 2-й группе.
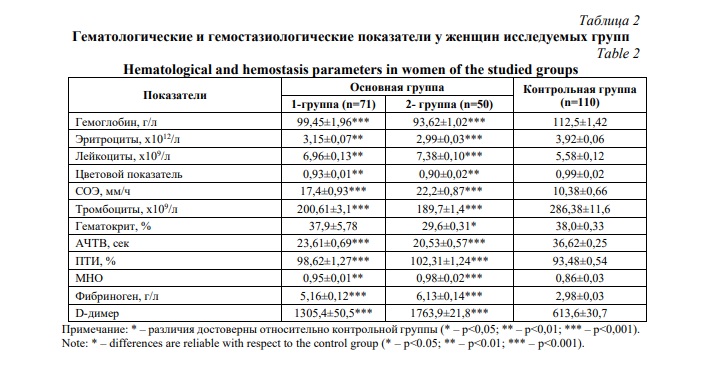
Исследования показали статистически значимое снижение количества гемоглобина и числа эритроцитов и тенденцию к снижению цветового показателя у женщин основной группы (р<0,01) (Табл. 2). Такие изменения свидетельствуют о развитии анемии у беременных. Особенно выраженные изменения наблюдались у беременных 2-й группы. Увеличение числа лейкоцитов и повышение СОЭ у женщин основной группы указывает на присутствие воспалительного компонента при развитии преэклампсии. Выявлено снижение числа тромбоцитарных клеток, укорочение АЧТВ, повышение ПТИ, МНО, содержания фибриногена и увеличение показателя D-димера. Полученные результаты показали наличие отчетливого гиперкоагуляционного сдвига плазменного гемостаза у беременных с риском преэклампсии и развившейся преэклампсией. Определение уровня D-димера в плазме крови может быть использовано для прогнозирования риска осложнений беременности при преэклампсии, так как его изменения свидетельствуют о развитии стаза в системе микроциркуляции мать-плацента-плод.
Изучено частотное распределение аллелей и генотипов полиморфизма rs1143627 (T-31C) гена IL-1β, rs1800629 (G-308A) гена TNFα и rs1800896 (A-1082G) гена IL-10 в группах беременных женщин с риском развития преэклампсии, осложненной преэклампсией и физиологическим течением беременности. Доля мутантного аллеля С гена IL-1β (T-31C) была выше в основной группе, тогда как в контрольной группе была высокой доля аллеля Т. И в основной, и в контрольной группах чаще выявлялся генотип T/С гена IL-1β (T-31C) (Рис. 1).
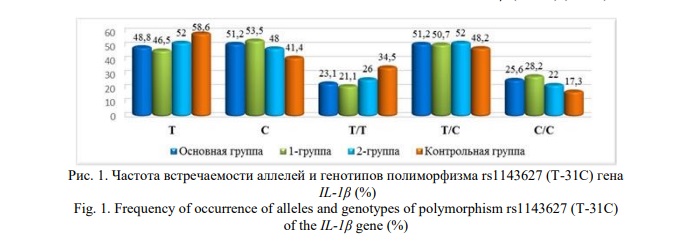
Анализ распределения аллелей и генотипов изучаемого полиморфизма в исследуемых группах выявил следующие особенности (Табл. 3). Наблюдалась значительная статистическая разница в частоте встречаемости аллелей между беременными женщинами с риском преэклампсии и здоровыми беременными. Аллель С достоверно чаще встречался в основной (51,2%; χ2=4,5; р=0,05; ОR=1,5; 95% CI: 1,03-2,15) и 1-й группах (53,5%; χ2=5,1; р=0,02; ОR=1,6; 95% CI: 1,07-2,49) по сравнению с контролем (41,4%). Аллель Т достоверно чаще встречался в контрольной группе (58,6% против 48,8% в основной группе; χ2=4,5; р=0,05; ОR=0,7; 95% CI: 0,46-0,97).
Несмотря на преобладание гетерозиготного генотипа Т/С и мутантного генотипа С/С в основной группе (51,2% и 25,6%; в 1-й группе – 50,7% и 28,2%; во 2-й группе – 52,0% и 22,0%) относительно контрольной выборки (48,2% и 17,3% соответственно), выявленные различия не были статистически значимыми (р>0,05). Вместе с тем, шансы развития преэклампсии при носительстве генотипа С/С возрастали в основной группе (OR от 1,4 до 1,9) (р>0,05). Различия в частоте встречаемости аллелей и генотипов полиморфизма rs1143627 (T-31C) гена IL-1β между 1-й и 2-й группами не были статистически значимыми (р>0,05).
Распределение генотипов локуса rs1800629 (G-308A) гена TNFα в группах соответственно уравнению Харди-Вайнберга показало, что генотип А/А полностью отсутствовал среди лиц узбекской национальности. При изучении распределения аллелей гена TNFα установлено, что дикий аллель G практически доминировал и в основной (90,5%), и в контрольной группах (94,1%). Доля мутантного аллеля А была крайне низкой во всех исследуемых группах. Генотип G/G несколько чаще выявлялся в контрольной группе, а генотип G/А в основной (Рис. 2).
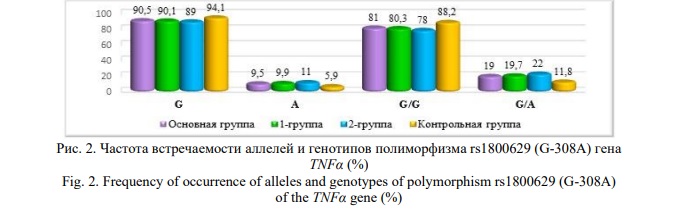
Статистический анализ частоты встречаемости аллелей и генотипов полиморфизма rs1800629 (G-308A) гена TNFα в исследуемых группах не выявил достоверных отличий между группами (Табл. 4). При этом отношение шансов для гетерозиготного генотипа G/A возрастало практически в 2 раза (OR=1,8-2,1; р>0,05) в основной (и 1-й и 2-й группах) группе, указывая на его возможную роль как генетического предиктора развития преэклампсии у лиц узбекской национальности.
Наиболее распространенным аллелем и генотипом полиморфизма rs1800896 (A-1082G) гена IL-10 в основной (1-й и 2-й группах) группе стали низкофункциональный аллель А и его гомозиготный вариант А/А. В контрольной группе в более чем два раза чаще выявлялся полиморфный аллель G (75,9% против 31,8% в основной группе) и генотип G/G (57,3% против 12,4% в основной группе) (Рис. 3).
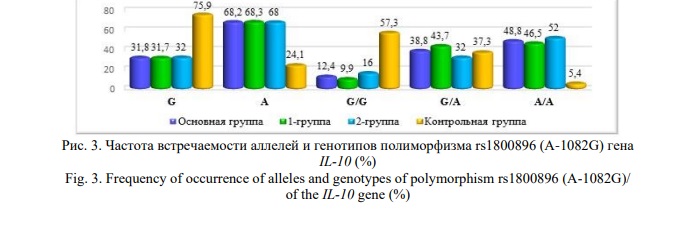
Сравнительный анализ частоты встречаемости аллелей и генотипов изучаемого полиморфизма в исследуемых группах выявил ряд существенных различий (Табл. 5). Аллель А достоверно преобладал в основной (68,2%; χ2=89,9; р=0,01; ОR=6,8; 95% CI: 4,55-10,02), 1-й (68,3%; χ2=69,5; р=0,01; ОR=6,8; 95% CI: 4,33-10,66) и 2-й группах (68,0%; χ2=56,4; р=0,01; ОR=6,7; 95% CI: 4,08-11,01) по сравнению с контролем (24,1%). А частота встречаемости аллеля G была статистически значимо высокой в контрольной выборке (75,9%; χ2=89,9; р=0,01; ОR=0,1; 95% CI: 0,10-0,22), чем в основной (1-й и 2-й) группе.
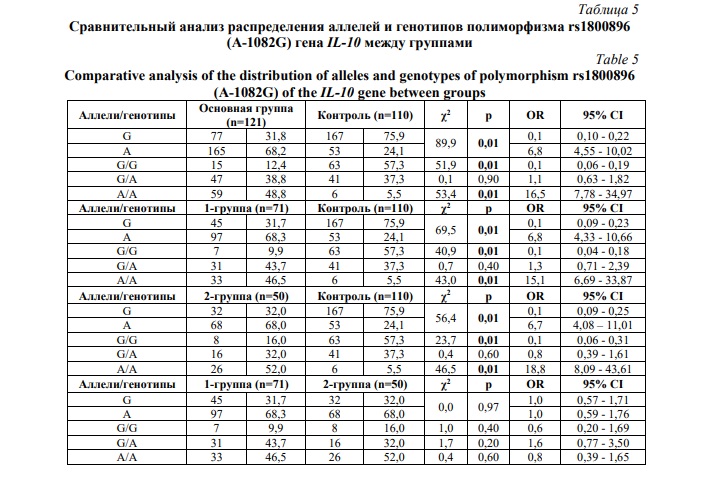
Шансы развития преэклампсии многократно повышаются при носительстве генотипа А/А для основной (48,8%; χ2=53,4; р=0,01; ОR=16,5; 95% CI: 7,78-34,97), 1-й (46,5%; χ2=43,0; р=0,01; ОR=15,1; 95% CI: 6,69-33,87) и 2-й (52,0%; χ2=46,5; р=0,01; ОR=18,8; 95% CI: 8,09-43,61) групп. Для контрольной выборки характерным являлась значимо высокая встречаемость генотипа G/G (57,3%; χ2=51,9; р=0,01; ОR=0,1; 95% CI: 0,06-0,19), что указывает на его возможно протективную роль в отношении развития преэклампсии.
Таким образом, полученные нами данные показывают, что аллель С полиморфизма rs1143627 (T-31C) гена IL-1β, аллель А и гомозиготный генотип А/А полиморфизма rs1800896 (A-1082G) гена IL-10 достоверно связаны с повышением риска развития преэклампсии во время беременности.
Анализ ассоциаций между полиморфизмами генов цитокинов IL-1β, TNFα и IL-10 и содержанием соответствующих цитокинов в крови выявил значимые различия в уровне экспрессии гена в зависимости от наличия генотипов в исследуемых группах (Табл. 6). Как видно из представленных данных, концентрация IL-1β в крови была значительно высокой у носителей генотипа С/С полиморфизма rs1143627 (T-31C) гена IL-1β, как в 1-й, так и 2-й группах, при этом различия более резко проявились во 2-й группе (р<0,001). Содержание TNFα в крови было наиболее высоким у женщин с генотипом G/А полиморфизма rs1800629 (G-308A) гена TNFα в группе с развившейся преэклампсией (р<0,001). Несмотря на активацию провоспалительного звена иммунитета у женщин основной группы нами выявлено снижение продукции противовоспалительного цитокина IL-10 с заметным проявлением у женщин с генотипом А/А соответствующего гена (р<0,05). Такой выраженный дисбаланс Th1/Th2 уровня цитокинов может приводить к системной воспалительной реакции, что во время беременности может провоцировать эндотелиальную дисфункцию с последующим нарастанием гемодинамических нарушений в системе маточно-плацентарно-плодового кровообращения.

В последние годы все больше данных свидетельствуют о том, что генетические факторы способствуют развитию гипертензивных нарушений во время беременности. Несколько исследований выявили, что полиморфизмы отдельных нуклеотидов, в том числе полиморфизмы генов цитокинов участвуют в патогенезе преэклампсии [20, 21, 25].
Одним из наиболее распространенных полиморфизмов гена IL-1β в различных популяциях является полиморфизм rs1143627 (T-31C) гена IL-1β, расположенный в промоторе гена и представляющий замену цитозина (C) на тимин (T) в позиции -31 нуклеотида, и который, как сообщается, имеет регуляторную функцию и связан с дифференциальной экспрессией и активностью IL-1β, что следовательно, может влиять на важные биологические и клинические процессы, которые модулируют восприимчивость к различным заболеваниям [26]. Выявлена ассоциация полиморфизма rs1143627 (T-31C) гена IL-1β с высоким риском преэклампсии у женщин китайской популяции, при этом риск формирования гипертензии во время беременности повышался почти в 2 раза при носительстве генотипа С/С [22]. Исследование El Azizy HM, et al (2017) не выявило статистически значимой связи полиморфизма IL-1β (T-31C) с риском развития преэклампсии [25]. Вместе с тем, другие авторы выявили значительную связь между полиморфизмом гена IL-1β (T-31C) и снижением риска гестационных нарушений при присутствии генотипов Т/C или Т/Т против C/C [27]. Значительные ассоциации наблюдались между преэклампсией и полиморфизмами rs16944 (C-511T) и rs 1143634 (С3954T) гена IL-1β [28].
В представленном нами исследовании мы не выявили связь генотипов данного полиморфизма с риском развития преэклампсии, однако у носителей аллеля С риск ее развития был достоверно высоким, что позволяет обозначить его как предиктор преэклампсии. Анализ уровня экспрессии гена по содержанию его конечного продукта-белка выявил достоверное повышение уровня IL-1β в крови у женщин основной группы (р<0,05), что позволяет подтверждать позицию аллеля С, как высокопродуктивного неблагоприятного аллеля при развитии гипертензивных нарушений во время беременности. Важно подчеркнуть, что более значительное повышение уровня IL-1β было отмечено во 2-й группе независимо от наличия того или иного генотипа соответствующего полиморфизма (р<0,001). При этом максимальное содержание IL-1β было характерным для носителей гомозиготного генотипа по аллелю С.
Ген, кодирующий TNFα, расположен в области класса III главного комплекса гистосовместимости на хромосоме 6 и редкий аллель –308А гена TNFα связан с увеличением содержания периферического белка цитокина [23]. TNFα является мощным паракринным и эндокринным медиатором воспалительных и иммунных функций. Физиологически действие TNFα направлена на регулирование воспалительного процесса, однако несоответствующая его продукция может способствовать чрезмерному проявлению воспалительной реакции с переходом на патологический уровень.
Хотя, в нашем исследовании мы не установили связь полиморфизма rs1800629 (G-308A) гена TNFα с риском развития преэклампсии, в ряде работ было показано, что полиморфизм в позиции -308 G/A повышает риск гипертензивных нарушений [29, 30]. В исследованиях Zubor P, et al (2014), аллель A чаще встречался в случаях преэклампсии увеличивая риск заболевания (OR=2,73), а уровни TNFα в крови матери показали тенденцию к росту с генотипом мутантного аллеля [31]. В работе Khodadadi A, et al (2022) содержание TNFα у женщин с преэклампсией было значительно выше, чем у здоровых беременных (p<0,001), хотя авторы не наблюдали никакой корреляции между полиморфизмом TNFα (G-308A) с частотой преэклампсии [23]. Метаанализ Wang L, et al (2018), изучавший на основе 22 исследований потенциальное влияние полиморфизма гена TNFα (G-308A) на преэклампсию показал, что значимая связь между данным полиморфизмом и восприимчивостью к преэклампсии существовала в аллельной модели A против G (OR=1,37, 95%CI: 1,06-1,77) [20]. Вместе с тем, нами выявлено достоверное повышение содержания TNFα в крови при наличии генотипа G/А у пациенток основной группы, что подтверждает негативную ассоциацию аллеля А с гипертензивными расстройствами.
Замена нуклеотидной последовательности в гене IL-10 проявляется в 1082 положении промотора появлением гуанина (G) вместо аденина (A). Аллель A rs1800896 (A-1082G) гена IL-10 является низкофункциональным и определяет снижение продукции белковой молекулы цитокина IL-10 [24]. Результаты ряда исследований показали связь полиморфизма гена IL-10 (A-1082G) с повышенным риском преэклампсии. Метаанализ 21 исследования случай-контроль показал, что полиморфизм гена IL-10 (A-1082G) был значительно связан с повышенным риском преэклампсии в рамках рецессивной модели (A/A против A/G+G/G: OR=1,19, 95% CI=1,018-1,394, р=0,029) [21]. Метаанализ Nath MC, et al (2020), выявил значительные различия в уровнях IL-10 между случаями с преэклампсией и нормотензивной беременностями. Эти результаты подтверждают роль сниженнего уровня IL-10 в патофизиологии преэклампсии, что обусловлено носительством низкопродуктивных генотипов промоторного гена IL-10 [32]. Риск развития преэклампсии по результатам наших исследований значительно повышался при присутствии генотипа А/А (OR=16,5, 95% CI=7,78-34,97, р=0,01). Также содержание IL-10 в крови у носителей генотипа А/А было достоверно ниже в 1- и 2-группах относительно контрольных значений (р<0,05). Как известно, роль противовоспалительного цитокина IL-10 заключается в сдерживании провоспалительных стимулов, что представляется весьма важным для обеспечения физиологического иммунокомпромиссного фона во время беременности. Чрезмерная активация провоспалительного звена цитокинов с неадекватным ответом противовоспалительного компонента, опосредованный полиморфизмом генов цитокинов, возможно играет одну из ключевых ролей в развитие эндотелиальной дисфункции, гипертензивных расстройств и последующих полиорганных нарушениях.
Заключение. Полиморфизмы генов цитокинов и обусловленная ими продукция цитокинов играют ключевую роль в развитии преэклампсии. Аллель С полиморфизма rs1143627 (T-31C) гена IL-1β, аллель А и гомозиготный генотип А/А полиморфизма rs1800896 (A-1082G) гена IL-10 связаны с повышением риска развития преэклампсии и могут быть использованы в качестве генетических предикторов заболевания. Повышенная экспрессия генов провоспалительных цитокинов наряду со снижением уровня противовоспалительного звена цитокинов отражает нарушение Тh1/Тh2 баланса, что провоцирует формирование системной воспалительной реакции, эндотелиальной дисфункции и развитие преэклампсии во время беременности.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы