СРАВНИТЕЛЬНЫЙ АНАЛИЗ ЭКСТРАГИРУЮЩЕЙ СПОСОБНОСТИ РАЗЛИЧНЫХ КОНЦЕНТРАЦИЙ СПИРТА ЭТИЛОВОГО ДЛЯ ИЗОЛИРОВАНИЯ КОМПЛЕКСА ФЛАВОНОИДОВ ИЗ ПЛОДОВ JUNIPERUS COMMUNIS L.
Aннотация
Одним из растений, которое уже на протяжении долгого времени не попадает во внимание исследователей, является можжевельник обыкновенный - Juniperus communis L. Результаты изучение фармацевтического рынка фитопрепаратов, свидетельствуют об отсутствии лекарственных средств из указанного растения. J. communis L. позиционируется как эфиромасличное растение, однако в суммарном фармакологическом эффекте растения участвует полифенольный комплекс, который изучен недостаточно полно. В литературе также отсутствуют сведения об оптимальном растворителе, способном наиболее полно извлекать комплекс полифенольных соединений. Изучен химический состав плодов J. communis L. с помощью метода обращённо-фазной высокоэффективной жидкостной хроматографии. Установлено наличие 19 компонентов флавоноидной структуры. Основными компонентами являются гликозиды апигенина, скутелляреина и бифлавоноиды. Проведён сравнительный анализ экстрагирующей способности спиртов для извлечения флавоноидов J. communis L. Установлено, что спирт этиловый 95% наиболее полно извлекает гликозиды апигенина. Спирт этиловый 40% концентрации, лучше извлекает гликозиды скутелляреина. Бифлавоноиды активнее переходят в разбавленный спирт. Равномерный выход всех групп флавоноидов наблюдается при экстракции спиртом этиловым 70% концентрации. Наибольший суммарный выход флавоноидов наблюдается при экстракции 95% спиртом этиловым. По результатам исследований сделан вывод, что наиболее подходящим экстрагентом для флавоноидов плодов J. communis L. является спирт этиловый 95%.
Ключевые слова: плоды можжевельника, флавоноиды, экстракция, обращённо-фазная высокоэффективная жидкостная хроматография
Введение. Подавляющее количество лекарственных средств, применяющихся в современной медицине, приходится на соединения, изготавливаемые методами органического синтеза. Однако растения по-прежнему продолжают оставаться важнейшим источником сырья для получения лекарственных препаратов. Причём удельный вес фитопрепаратов составляет 25 – 30% от аптечного ассортимента. Количество растительных препаратов с каждым годом возрастает, что свидетельствует об их значительном спросе вследствие экономической и терапевтической целесообразности. В процесс создания новых лекарственных растительных средств вовлекается всё большее количество растений, по причине появляющихся уточнённых данных об их химическом составе и клинических данных. Растущая потребность в растительных препаратах, свидетельствует о необходимости поиска новых сырьевых источников или более подробном изучении ранее известных. Одним из растений, которое уже на протяжении долгого времени не попадает во внимание исследователей, является можжевельник обыкновенный - Juniperuscommunis L. Результаты изучение фармацевтического рынка фитопрепаратов, свидетельствуют об отсутствии лекарственных средств из указанного растения. Однако, разнообразный химический состав, широкий спектр фармакологических свойств свидетельствуют об актуальности таких исследований. Известно, что J. communis L. позиционируется как эфиромасличное растение, поскольку основным классом, ответственным за проявление фармакологического эффекта являются терпены, состав которых в растении изучен достаточно подробно [4,5]. Наряду с терпенами в суммарном фармакологическом эффекте растения участвует полифенольный комплекс [1]. Среди полифенолов J. communis L. характерно наличие достаточно редких групп: 6-оксифлавнонов и бифлавоноидов [2, 3]. Вместе с тем полифенольный комплекс данного объекта изучен в значительно меньшей степени, чем терпенов. В литературе также отсутствуют сведения об оптимальном растворителе, способном наиболее полно извлекать комплекс полифенольных соединений.
Учитывая вышесказанное, целью настоящего исследования явилось изучение химического состава полифенолов плодов J. communis L. и подбор оптимального экстрагента для их извлечения.
Экспериментальная часть. В качестве объекта исследования использованы воздушно-сухие плоды J. communis L. Подготовку образцов для анализа проводили следующим образом. По 1,0 г измельчённых, воздушно-сухих плодов J. communis L. помещали в 3 плоскодонные колбы вместимостью 100 мл, в каждую добавляли по 25 мл спирта этилового в разных концентрациях: 95%, 70%, 40% и экстрагировали на ультразвуковой водяной бане при температуре 80ºС в течении 2-х часов. Полученные извлечения фильтровали через бумажные фильтры в мерные колбы объёмами по 100 мл и операцию экстракции повторяли ещё 3 раза, каждый раз фильтруя извлечения в мерные колбы. Полученные таким образом 95%, 70% и 40% извлечения далее хроматографировали.
Хроматографические исследования проводили на хроматографическом приборе фирмы «AgilentTechnologies 1200 Infinity» производства США c автоматическим пробоотборником Agilent 1200, вакуумным микродегазатором, градиентным насосом и термостатом той же серии. Электронные спектры поглощения регистрировали с помощью спектрофотометрического детектора с диодной матрицей серии Agilent 1200 (диапазон длин волн от 190 до 950 нм, кювета с длиной оптического пути 10 мм; объемом 13 мкл), шаг сканирования - 2 нм.
Для регистрации и обработки спектральных данных и хроматограмм использовали программное обеспечение «Agilent Chem Station».
Для приготовления подвижных фаз использовали следующие растворители: воду сверхчистую (для жидкостной хроматографии), спирт этиловый (по ГОСТ Р 51652), кислоту муравьиную (квалификация х.ч. по ГОСТ 61).
Эффективность колонки определяли вычислением числа теоретических тарелок N. Чем выше эффективность, тем больше эта величина и меньше расширение пика первоначально узкой полосы по мере продвижения ее через колонку, тем уже пик на выходе из колонки. В качестве оптимального критерия эффективности колонки использована величина - не менее 5000.
Расчет числа теоретических тарелок проводили по формуле 1:
N=5.545x(t/µ0.5)2
где t- время удерживания определяемого вещества мм;
µ0.5 - ширина на половине высоты пика, мм.
Основным критерием оценки адекватного разделения соседних пиков служил коэффициент разделения Rs, который должен быть не менее 1,5 согласно Европейской Фармакопее. При этом пики должны быть разделены по базовой линии.
Коэффициент разделения пиков Rs вычисляли по формуле 2:

где l - расстояние между вершинами двух соседних пиков мм;
µ0.5(1),µ0.2(2) - ширина на половине высоты пиков двух компонентов мм.
Форму хроматографического пика, характеризующую перегрузку хроматографической колонки, определяли путём расчёта коэффициента асимметрии пика (Тf) по формуле 3:
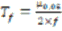
где µ0,05 – ширина пика на высоте 5.0% от базовой линии (мм);
ƒ – расстояние от начала пика на высоте 5.0% от базовой линии до перпендикуляра, проведенного из его вершины (мм).
Оптимальной величиной коэффициента асимметрии Тf принят показатель – менее 2 [6].
Суммы полифенольных комплексов и антоцианов подвергали хроматографическому разделению в следующих условиях:
подвижная фаза: 1.0% водный раствор кислоты муравьиной (А) – спирт этиловый 95% (Б) в градиентном режиме элюирования;
колонка: Ascentis express C182.7μм × 100 мм × 4.6 мм.
скорость подвижной фазы – 0,5 мл/мин;
температура колонки +35 оС;
объём вводимой пробы 1 μl.
Состав подвижной фазы программировали в условиях, указанных в таблице 1.
Таблица 1
Условия градиентного элюирования флавоноидов плодов J. communis L.
Table 1
Terms gradient elution flavonoids fruits J. communis L.
Время, мин | А,% | Б,% |
0 | 90 | 10 |
10 | 80 | 20 |
20 | 70 | 30 |
30 | 50 | 50 |
40 | 10 | 90 |
Детектирование осуществляли при длинах волн: 230, 260, 325, 340 и 350 нм.
Идентификацию компонентов осуществляли по совпадению времён удерживания анализируемых веществ со СО зафиксированных в аналогичных условиях эксперимента и по результатам диодно-матричного детектирования.
Относительное содержание индивидуальных флавоноидов определяли как отношение площади хроматографического пика и суммы площадей пиков всех идентифицированных флавоноидов по формуле 4:
где Si – среднее значение площади пика компонента на хроматограммах суммы;
∑S – среднее значение суммы всех площадей пиков на хроматограммах.
Результаты и их обсуждение. Хроматограмма 95% спиртового извлечения из плодов J. communis L. представлена на рисунке 1.
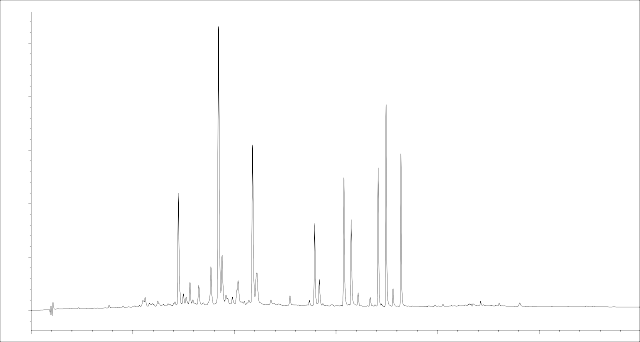
Рисунок 1 – Хроматограмма 95% этанольного извлечения из плодов
J. communis L. (детекция диодно-матричная при λ= 340 нм)
Figure 1 - Chromatogram 95% ethanolic extract of the fruits of
J. communis L. (diode array detection at λ = 340 nm)
Эффективность хроматографической системы оценивали по критериям, результаты расчёта которых приведены в таблице 2.
Таблица 2
Показатели пригодности хроматографической системы для определения
Table 2
Indicators of system suitability for determining
tR | S | N | Rs | Tf | Wb |
14.476 | 836.5 | 226751 | >1.5 | 0.647 | 0.1216 |
15.616 | 149.8 | 300754 | >1.5 | 0.834 | 0.1139 |
16.476 | 148.5 | 273145 | >1.5 | 0.809 | 0.1261 |
17.681 | 336.7 | 250524 | >1.5 | 1.039 | 0.1413 |
18.785 | 403.9 | 288887 | >1.5 | 0.885 | 0.1398 |
19.806 | 59 | 344897 | >1.5 | 0.701 | 0.1349 |
20.368 | 191.5 | 356247 | >1.5 | 0.922 | 0.1365 |
21.781 | 1292.6 | 429760 | >1.5 | 0.727 | 0.1329 |
22.203 | 458.5 | 140425 | >1.5 | 0.953 | 0.237 |
25.456 | 65.3 | 779905 | >1.5 | 0.858 | 0.1153 |
27.897 | 524.8 | 1160153 | >1.5 | 0.713 | 0.1036 |
28.355 | 188 | 967655 | >1.5 | 0.756 | 0.1153 |
30.771 | 865.2 | 1296438 | >1.5 | 0.636 | 0.1081 |
31.495 | 605 | 1281188 | >1.5 | 0.599 | 0.1113 |
32.179 | 84.6 | 1543638 | >1.5 | 0.956 | 0.1036 |
34.152 | 848.6 | 1866174 | >1.5 | 0.722 | 0.1005 |
34.926 | 1190.1 | 2131050 | >1.5 | 0.676 | 0.0957 |
35.605 | 103.8 | 2300439 | >1.5 | 0.622 | 0.0939 |
36.388 | 841.3 | 2680605 | >1.5 | 0.649 | 0.0889 |
tR - абсолютное время удерживания, S - площадь пика, N - число теоретических тарелок, Rs - коэффициент разделения пиков, Tf - коэффициент асимметрии, Wb - ширина пика на базовой линии
Как показывают данные, приведённые в таблице 2, основные критерии (N>5000, Rs >1,5, Tf <2) соответствуют требованиям пригодности. Поэтому использованная хроматографическая система может считаться эффективной для определения флавоноидов в 95% спиртовом извлечении из плодов J. communis L.
Результаты хроматографирования 70% этанольного извлечения из плодов J. communis L. представлены на рисунке 2.
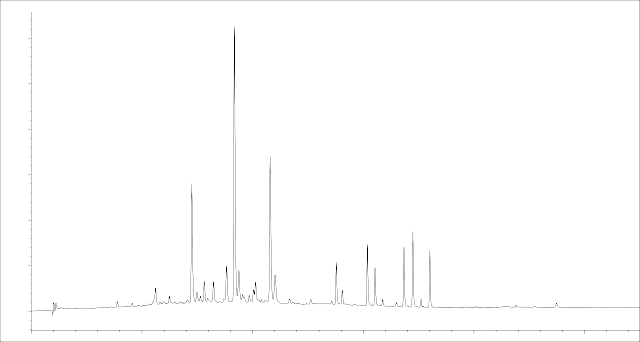
Рисунок 2 – Хроматограмма 70% этанольного извлечения из плодов
J. communis L. (детекция диодно-матричная при λ= 340 нм)
Figure 2 - Chromatogram 70% ethanolic extract of the fruits of
J. communis L. (diode array detection at λ = 340 nm)
Результаты расчёта критериев проверки пригодности использованной хроматографической системы приведены в таблице 3.
Таблица 3
Показатели пригодности хроматографической системы для определения
Table 3
Indicators of system suitability for determining
tR | S | N | Rs | Tf | Wb |
14.496 | 1091.4 | 214376 | >1.5 | 0.619 | 0.125 |
15.631 | 169.8 | 290020 | >1.5 | 0.818 | 0.1161 |
16.467 | 187.3 | 266887 | >1.5 | 0.726 | 0.1275 |
17.646 | 353.9 | 274585 | >1.5 | 0.856 | 0.1347 |
18.352 | 2524.1 | 321327 | >1.5 | 0.707 | 0.1295 |
18.753 | 298.7 | 313366 | >1.5 | 0.926 | 0.134 |
19.698 | 62.6 | 374806 | >1.5 | 0.688 | 0.1287 |
20.085 | 93.7 | 492325 | >1.5 | 1.038 | 0.1145 |
20.267 | 171.5 | 382962 | >1.5 | 0.934 | 0.131 |
21.562 | 1360.7 | 432145 | >1.5 | 0.741 | 0.1312 |
28.107 | 112.8 | 1114422 | >1.5 | 1.053 | 0.1065 |
30.369 | 454.2 | 1399072 | >1.5 | 0.676 | 0.1027 |
31.060 | 302.1 | 1323352 | >1.5 | 0.629 | 0.108 |
31.750 | 47.8 | 1612900 | >1.5 | 0.806 | 0.1 |
33.673 | 432.5 | 1778446 | >1.5 | 0.756 | 0.101 |
34.474 | 542.1 | 1967869 | >1.5 | 0.701 | 0.0983 |
35.225 | 51.1 | 2478425 | >1.5 | 0.818 | 0.0895 |
36.010 | 365.9 | 2660999 | - | 0.698 | 0.0883 |
tR - абсолютное время удерживания, S - площадь пика, N - число теоретических тарелок, Rs - коэффициент разделения пиков, Tf - коэффициент асимметрии, Wb - ширина пика на базовой линии
Как свидетельствуют данные таблицы 3, рассчитанные критерии пригодности хроматографической системы укладываются в допустимые пределы, что доказывает её пригодность для определения флавоноидов в 70% извлечении из плодов J. communis L.
Хроматограмма 40% спиртового извлечения из плодов J. communis L. представлена на рисунке 3.
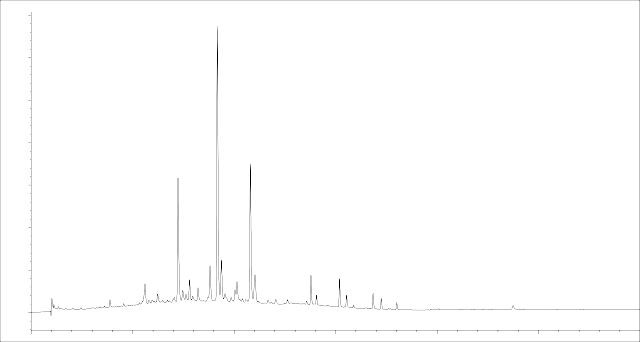
Рисунок 3 – Хроматограмма 40% этанольного извлечения из плодов
J. communis L. (детекция диодно-матричная при λ= 340 нм)
Figure 3 - Chromatogram 40% ethanolic extract of the fruits of
J. communis L. (diode array detection at λ = 340 nm)
Эффективность хроматографической системы оценивали по критериям, результаты расчёта которых приведены в таблице 4.
Таблица 4
Показатели пригодности хроматографической системы для определения
Table 4
Indicators of system suitability for determining
tR | S | N | Rs | Tf | Wb |
14.462 | 1204.72 | 214512 | >1.5 | 0.615 | 0.1249 |
15.600 | 181.5 | 281549 | >1.5 | 0.81 | 0.1176 |
16.441 | 134.4 | 261513 | >1.5 | 0.722 | 0.1286 |
17.622 | 376.5 | 271415 | >1.5 | 0.884 | 0.1353 |
18.335 | 2705.9 | 318269 | >1.5 | 0.706 | 0.13 |
18.740 | 403.1 | 323465 | >1.5 | 0.923 | 0.1318 |
20.089 | 98.0 | 482358 | >1.5 | 1.022 | 0.1157 |
20.277 | 189.8 | 389260 | >1.5 | 0.917 | 0.13 |
21.596 | 1375.4 | 437502 | >1.5 | 0.747 | 0.1306 |
22.046 | 381.8 | 229940 | >1.5 | 0.983 | 0.1839 |
24.102 | 60.83 | 375637 | >1.5 | 0.66 | 0.1573 |
27.566 | 231.1 | 1166315 | >1.5 | 0.741 | 0.1021 |
28.114 | 81.55 | 1100463 | >1.5 | 0.978 | 0.1072 |
30.385 | 222.9 | 1425420 | >1.5 | 0.693 | 0.1018 |
31.076 | 95.3 | 1453626 | >1.5 | 0.763 | 0.1031 |
31.759 | 15.94 | 19448816 | >1.5 | 0.776 | 0.091 |
33.695 | 121.2 | 1816564 | >1.5 | 0.76 | 0.1007 |
34.50 | 89.3 | 1904400 | >1.5 | 0.663 | 0.1007 |
tR - абсолютное время удерживания, S - площадь пика, N - число теоретических тарелок, Rs - коэффициент разделения пиков, Tf - коэффициент асимметрии, Wb - ширина пика на базовой линии
Из представленных данных таблицы 4 следует, что критерии пригодности (N>5000, Rs >1,5, Tf <2) не выходят за пределы допустимых значений, следовательно, хроматографическая система пригодна для анализа флавоноидов в 40% извлечении из плодов J. communis L.
В результате хроматографирования 95% спиртового извлечения из плодов J. communisL. было установлено, что его флавоноидный состав представлен разными группами: бифлавоноиды, 6-оксифлавоны, флавоны, флавонолы. Необходимо было определить при какой длине волны диодно-матричного детектирования оценивать удельный вес каждой группы флавоноидов. В результате изучения спектров поглощения этих соединений было установлено, что для всех перечисленных групп флавоноидов существует общая полоса поглощения, по которой можно оценить их содержание на хроматограмме, лежащая в максимуме поглощения при λ = 340 нм, как показано на рисунке 4.
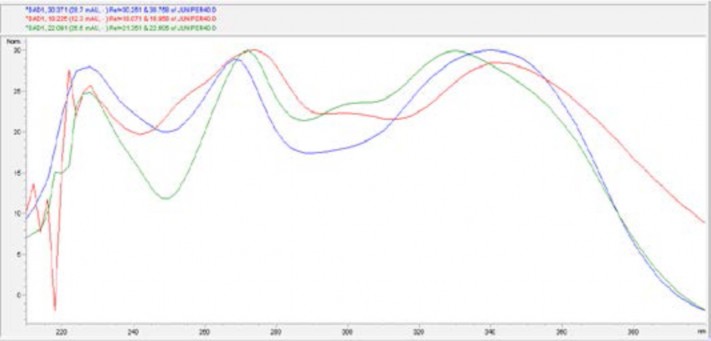
Рисунок 4 – Электронные спектры поглощения основных представителей флавоноидов плодов J. communis L.
Figure 4 - Electronic absorption spectra of the main representatives of the fruits of flavonoids J. communis L.
В результате хроматографирования спиртовых извлечений из плодов J. communis L. установлено, что доминирующими группами флавоноидов являются гликозиды апигенина, бифлавоноиды и гликозиды скутелляреина. В небольшом количестве встречаются гликозиды кверцетина и лютеолина. По количеству компонентов в каждой группе флавоноидов оказалось следующим: 4 бифлавоноида, 3 гликозида скутелляреина, 2 гликозида кверцетина, 2 гликозида лютеолина и 9 гликозидов апигенина.
Компонентный состав флавоноидов плодов J. communis L. представлен в таблице 5.
Таблица 5
Компонентный состав полифенолов плодов J. communis L.
Table 5
Component composition of fruit polyphenols J. communis L.
Процентное распределение флавоноидов в 95% извлечении представлено на рисунке 5.
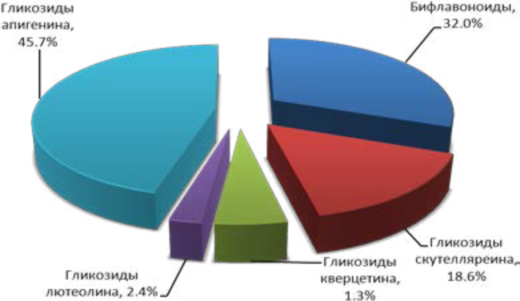
Рисунок 5 – Процентное распределение флавоноидов J. communis L. в 95% этанольном извлечении
Figure 5 - Percentage distribution of flavonoids J. communis L. in 95% ethanol-extraction
На рисунке 5 видно, что основной удельный вес флавоноидов плодов J. communis L. приходится на гликозиды апигенина (45.7%) и в меньшей степени на бифлавоноиды (32.0%).
В 70% спиртовом извлечении из плодов J. communis L. процентное распределение флавоноидов составило следующие результаты, как это представлено на рисунке 6.
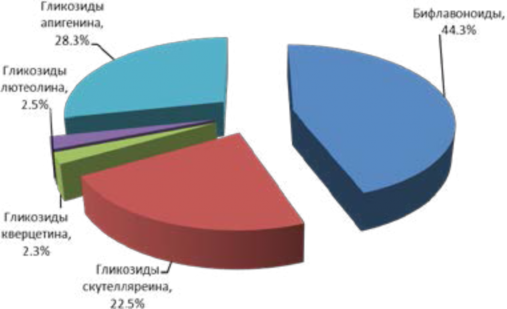
Рисунок 6 – Процентное распределение флавоноидов J. communis L. в 70% этанольном извлечении
Figure 6 - Percentage distribution of flavonoids J. communis L. in 70% ethanol-extraction
В 70% этанольном извлечении наибольший удельный вес флавоноидов приходился на бифлавоноиды (57%).
Общее процентное распределение флавоноидов в 40% этанольном извлечении из плодов J. communis L. показано на рисунке 7.
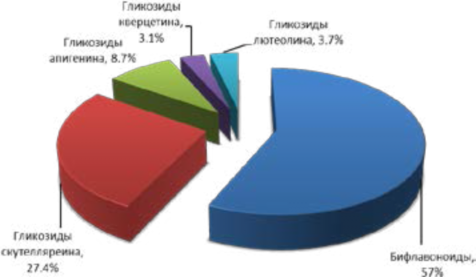
Рисунок 7 – Процентное распределение флавоноидов в плодах J. communis L. в 40% этанольном извлечении
Figure 7 - Percentage distribution of flavonoids J. communis L. in 40% ethanol-extraction
Данные, представленные на рисунке 7, свидетельствуют о наилучшей экстрагирующей способности 40% этанола в отношении бифлавоноидов и гликозидов скутелляреина, но малопригодной для извлечения гликозидов апигенина.
На основании полученных результатов об экстрагирующей способности спиртов различной крепости для извлечения флавоноидов можно сделать следующий вывод. Выход разных групп флавоноидов в спирты различной концентрации оказался неравномерным. Более разбавленный спирт этиловый 40% концентрации лучше извлекает гликозиды скутелляреина, поскольку агликон скутелляреин по сравнению с другими флавоноидами J. communis L. более насыщен гидроксильными группами, а, следовательно, полярнее. Гликозиды апигенина лучше переходят в более крепкий 95% спирт, так как агликон апигенин включает меньше гидроксильных групп. Экстрагируемость бифлавоноидов при уменьшении крепости спирта возрастает. Более равномерно все группы флавоноидов J. communis L. экстрагируются спиртом этиловым 70% концентрации (рисунок 8).
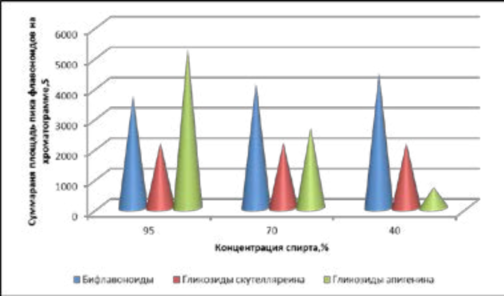
Рисунок 8 – Степень извлечения групп флавоноидов плодов J. communis L. спиртами различной крепости
Figure 8 - The recovery group of flavonoids fruits J. communis L. alcohols of varying strength
Однако следует заметить, что суммарный выход флавоноидов оказался наиболее высоким при экстракции 95% спиртом, тогда как наименее эффективным растворителем был 40% спирт этиловый (рисунок 9).
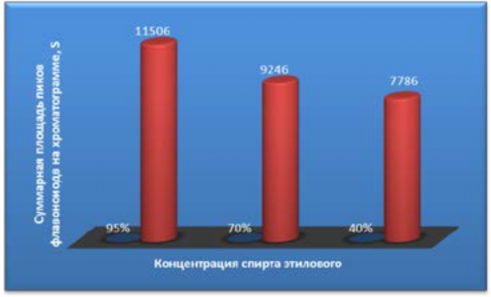
Рисунок 9 – Суммарный выход флавоноидов при экстракции плодов J. communis L. спиртами различной крепости
Figure 9 - The total yield of flavonoids in the extraction of fruit J. communis L. alcohols of varying strength
На приведённом рисунке видно, что выход флавоноидов при извлечении 95%-ным спиртом в 1,5 раза выше, чем спиртом этиловым 40% концентрации.
Выводы:
- Методом высокоэффективной жидкостной хроматографии в обращённо-фазном варианте изучен химический состав плодов J. communis L. Установлено, что плоды содержат около 19 компонентов флавоноидной структуры, причём доминирующими являются гликозиды апигенина, скутелляреина и бифлавоноиды. В небольшом количестве встречаются гликозиды кверцетина и лютеолина. Разнообразие компонентов в каждой группе оказалось следующим: 4 бифлавоноида, 3 гликозида скутелляреина, 2 гликозида кверцетина, 2 гликозида лютеолина и 8 гликозидов апигенина.
- Сравнивая экстрагирующую способность спиртов разной концентрации, оказалось, что спирт этиловый 95% - наиболее полно извлекает гликозиды апигенина. Спирт этиловый 40% концентрации, лучше извлекает гликозиды скутелляреина. Бифлавоноиды лучше переходят в разбавленный спирт. Равномерный выход всех групп флавоноидов наблюдается при экстракции спиртом этиловым 70% концентрации.
- Наибольший суммарный выход флавоноидов наблюдается при экстракции 95% спиртом этиловым. Учитывая всё вышеизложенное можно утверждать, что наиболее подходящим экстрагентом для флавоноидов плодов J. communis L. является спирт этиловый 95%.





















Список литературы