ХИМИЧЕСКОЕ ИЗУЧЕНИЕ СОСТАВА АНТОЦИАНОВ ТРАВЫ OCIMUM BASILICUM L.
Aннотация
Базилик обыкновенный – Ocimum basilicum L. содержит широкий спектр биологически активных соединений, в их числе эфирные масла, фенольные соединения, включая флавоноиды и антоцианы. Фиолетовая разновидность является богатым источником ацилированных и гликозилированных антоцианов и может представить интерес в качестве уникального источника стабильных красных пигментов для пищевой промышленности. Методом высокоэффективной жидкостной хроматографии определён химический состав антоцианов - O. basilicum L. Установлено, что в его составе присутствует 12 антоциановых гликозидов, причём данные соединения находятся в виде депсидов с оксикоричными кислотами, о чём свидетельствуют их характерные УФ-профили. Агликоном антоциановых гликозидов является цианидин, что было подтверждено кислотным гидролизом. Причём 11 антоциановых гликозидов представлены в виде депсидов с п-кумаровой кислотой. Один из антоциановых гликозидов находится в виде депсида с кофейной кислотой. Количественное определение антоцианов проводили методом рН – дифференциальной спектрофотометрии. Установлено, что в свежем сырье O. basilicum L. суммарное содержание антоцианов составило - 0,48±0,054%.
Ключевые слова: базилик обыкновенный, депсиды антоциановых гликозидов, высокоэффективная жидкостная хроматография
Введение. Антоцианидины — это производные катиона флавилия. Особенностью строения антоцианидинов является наличие в гетероциклическом кольце четырехвалентного кислорода (оксония) и свободной положительной валентности. Антоцианы отвечают за окраску плодов, цветков и других частей растений от оранжевого до синего [1].
На окраску антоцианидинов влияет число и природа заместителей: гидроксильные группы, несущие свободные электронные пары, обуславливают батохромный сдвиг при увеличении их числа. Гликозидирование, метилирование или ацилирование гидроксильных групп антоцианидинов приводит к уменьшению или исчезновению батохромного эффекта [2,3].
Большие различия между природными антоцианами связаны с разнообразием углеводных фрагментов, присоединенных к агликону по гидроксильным группам, как правило, в положении 3, реже одновременно в двух положениях – 3 и 5. Кроме того, большей частью разнообразие антоцианов обусловлено различием производных, в которых некоторые из гидроксильных групп углеводного фрагмента ацилированы уксусной, малоновой, кумаровыми, кофейной и другими кислотами [4, 7, 10].
Для антоцианов в настоящее время доказаны следующие виды фармакологической активности:
- антиоксидантная – высокая антирадикальная активность антоцианов во много раз превышает таковую других классов флавоноидов [12].
- вазопротекторная – уменьшают ломкость и проницаемость капилляров, улучшая функцию эндотелия [6].
- противовоспалительная – способствуют стабилизации выработки коллагена, ингибируют агрегацию тромбоцитов и стимулируют выработку эндотелием простагландинов. Кроме того, установлена способность антоцианов гасить воспалительные процессы в легких, снижая активность ферментов [8].
- противоопухолевая – антоцианы уменьшают скорость деления раковых клеток [11].
- фунгицидная и антимикробная активность – антоцианы способны [13].
Базилик душистый обыкновенный - Ocimum basilicum L. – однолетнее травянистое растение семейства Lamiaceae, образующее ветвящийся куст около 50 см в высоту.
Трава O. basilicum L. содержит широкий спектр биологически активных соединений, в их числе эфирные масла, фенольные соединения, включая флавоноиды и антоцианы.
В ряде зарубежных сообщений указывается, фиолетовый базилик является богатым источником ацилированных и гликозилированных антоцианов и может представить интерес в качестве уникального источника стабильных красных пигментов для пищевой промышленности [9].
Учитывая вышесказанное, целью настоящего исследования явилось изучение химическое изучение состава антоцианов O. basilicum L.
Материалы и методы. Для определения антоцианов 2,5 г свежей травы O. basilicum L., измельчили и помещали в плоскодонную колбу вместимостью 100 мл, заливали 25 мл экстрагента – 1%-ного раствора кислоты хлористоводородной в спирте этиловом 95%-ном, колбу присоединяли к обратному холодильнику и нагревали на магнитной мешалке при температуре 80°С в течение 30 минут. Полученное извлечение декантировали и оставшееся сырьё заливали свежей порцией того же экстрагента в количестве 25 мл. Всего было сделано четыре экстракции. Извлечение каждый раз фильтровали в мерную колбу вместимостью 100 мл. Содержимое мерной колбы доводили экстрагентом до метки. Полученный фильтрат далее исследовали на содержание антоцианов.
Для разделения исследуемого объекта использовали метод ОФ ВЭЖХ.
Хроматографические исследования проводили на хроматографическом приборе фирмы «AgilentTechnologies 1200 Infinity» производства США c автоматическим пробоотборником Agilent 1200, вакуумным микродегазатором, градиентным насосом и термостатом той же серии. Электронные спектры поглощения регистрировали с помощью спектрофотометрического детектора с диодной матрицей серии Agilent 1200 (диапазон длин волн от 190 до 950 нм), шаг сканирования - 2 нм.
Для регистрации и обработки спектральных данных и хроматограмм использовали программное обеспечение «Agilent Chem Station».
Для приготовления подвижных фаз использовали следующие растворители: воду сверхчистую (для жидкостной хроматографии), спирт метиловый, кислоту муравьиную.
Идентификацию компонентов осуществляли по совпадению времён удерживания анализируемых веществ со СО зафиксированных в аналогичных условиях эксперимента и по результатам диодно-матричного детектирования.
Сумму антоцианов подвергали хроматографическому разделению в следующих условиях: подвижная фаза - (А) – 1%-ный водный раствор кислоты муравьиной, (Б) – спирт этиловый в градиентном режиме элюирования; колонка - Ascentisexpress C182,7μм × 100 мм × 4,6 мм; скорость подвижной фазы – 0,5 мл/мин; температура колонки +35 оС; объём вводимой пробы 1 μl; детекция диодно-матричная – 520 нм.
Состав подвижной фазы программировали в условиях, указанных в таблице 1.
Таблица 1
Условия градиентного элюирования антоцианов
Table 1
Terms gradient elution anthocyanins
Время, мин | А,% | Б,% |
0 | 90 | 10 |
10 | 80 | 20 |
20 | 70 | 30 |
30 | 50 | 50 |
40 | 10 | 90 |
Идентификацию компонентов осуществляли по совпадению времён удерживания анализируемых веществ со СО зафиксированных в аналогичных условиях эксперимента и по результатам диодно-матричного детектирования.
Результаты и выводы. Хроматограмма разделения суммы антоцианов травы O. basilicum L. представлена на рисунке 1.
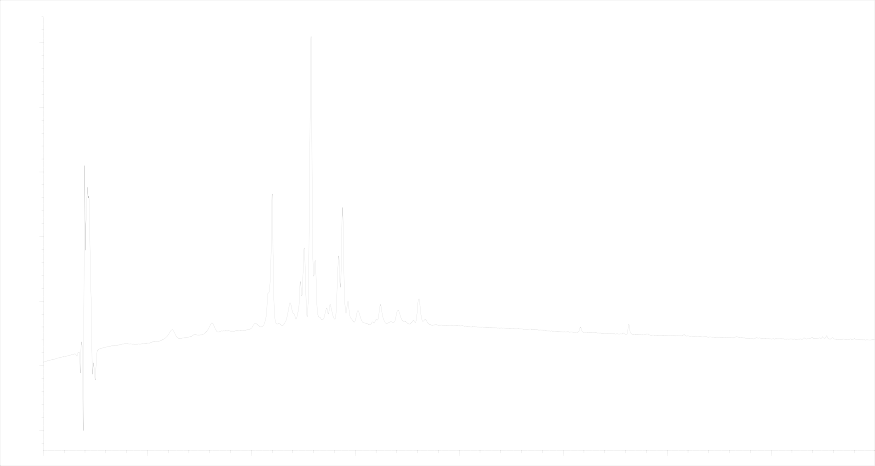
Рисунок 1 - Хроматограмма антоцианов базилика (детекция диодно-матричная λmax = 530 нм)
Figure 1 - Chromatography anthocyanins basil (diode array detector λmax = 530 nm)
В результате хроматографирования установлено присутствие в траве базилика 12 антоциановых гликозидов, причём данные соединения находятся в виде депсидов с оксикоричными кислотами, о чём свидетельствуют их характерные УФ-профили. Агликоном антоциановых гликозидов является цианидин, что было подтверждено кислотным гидролизом. Причём 11 антоциановых гликозидов представлены в виде депсидов с п-кумаровой кислотой, УФ-профиль, одного из компонентов представлен на рисунке 2.
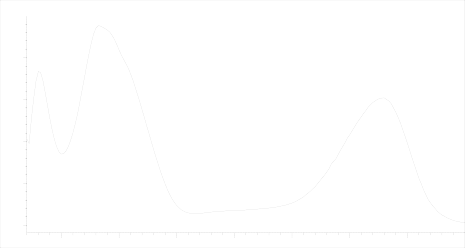
Рисунок 2 – УФ-профиль депсида антоцианового гликозида с п-кумаровой кислотой
Figure 2 - UV-profile depsides anthocyanins glucoside with p-coumaric acid
Один из антоциановых гликозидов находится в виде депсида с кофейной кислотой (рисунок 3).

Рисунок 3 – УФ-профиль депсида антоцианового гликозида с кофейной кислотой
Figure 3 - UV -profile depsides anthocyanins glycoside with caffeic acid
Количественное определение антоцианов проводили методом рН – дифференциальной спектрофотометрии [4].
Содержание суммы антоцианов в пересчете на цианидин-3-глюкозид в процентах (Х) вычисляли по формулам 1 и 2:
где W1– общий объем извлечения из сырья, мл;
W2 – объём разведения, мл;
m - масса сырья, г;
V- аликвота, взятая для разбавления, мл;
MM – молярная масса цианидина-3-глюкозида, равная 449,17;
l – толщина кюветы, см;
ε – молярный коэффициент поглощения, равный 26900;
B – влажность сырья.
В результате установлено, что в свежем сырье O. basilicum L. суммарное содержание антоцианов составило - 0,48±0,054%.
Проведённые исследования позволяют рекомендовать траву O. basilicum L. в качестве источника биологически активных антоцианов.





















Список литературы