СОВРЕМЕННЫЙ ОБЗОР: HELICOBACTER PYLORI И РИСК РАЗВИТИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА
Aннотация
В статье анализируются данные зарубежной и российской литературы о связи хеликобактерной инфекции и риска развития кардиоваскулярной патологии. Анализируются варианты патогенетических механизмов формирования корреляции Helicobacter pylori и риска развития ИБС. Появляется все больше доказательств того, что отдельные микробные агенты могут иметь этиопатогенетическию роль в развитии атеротромбоза. Helicobacter pylori (H. pylori) - бактерия, которая вызывает язвенную болезнь, была предложена в качестве одного из микробов, участвующих в развитии атеротромбоза. Эта гипотеза основывается на следующих наблюдениях: более высокая распространенность инфекции H. pylori у пациентов с ишемической болезнью сердца, инфарктом миокарда, цереброваскулярными заболеваниями; связь инфекции H. pylori и сердечно-сосудистых факторов риска, таких как концентрации триглицеридов и холестерина в сыворотке и фибриногена в плазме; уровень H. pylori коррелирует с уровнем острофазовых белков, ассоциированных с повышенным риском коронарных заболеваний, таких как C-реактивный белок; и противоречивые ПЦР исследования, указывающие на присутствие инфекции H. pylori в атеромах. Анализ научных данных свидетельствует о том, что инфицирование H. pylori может косвенно способствовать развитию и осложнить атеротромбозы и сердечно-сосудистые заболевания. По нашему мнению, необходимы очень крупные рандомизированные исследования для того, чтобы доказать достоверность наличия возможной связи между H. pylori и сердечно-сосудистыми заболеваниями.
Ключевые слова: Helicobacter pylori, кардиоваскулярный риск, ишемическая болезнь сердца, атеросклероз
Введение. В настоящее время ученые все чаще изучают коморбидные болезни. Это особенно актуально по отношению к значительно распространенным сердечно-сосудистым заболеваниям (ССЗ) (большая часть из которых - ишемическая болезнь сердца (ИБС) [5, 7]) или цереброваскулярным заболеваниям с патогенным механизмом атеротромбоза, болезням желудочно-кишечного тракта [1]. Среди сочетанных заболеваний внутренних органов около до 52% приходится именно на сочетание ИБС и язвенной болезни (ЯБ), что приводит к атипичному течению заболеваний и поздней диагностике [6]. Взаимное отягощение и прогрессирование рассматриваемых заболеваний основывается на объединении некоторых патологических звеньев [3, 18]. В возникновении сочетания ИБС и язвенной болезни большую роль играют генетическая предрасположенность и общие факторы риска.
В последние годы теория «ответ на повреждение» была предложена в качестве индуктора механизма атеротромбоза; в основном эта теория утверждает, что воспалительные и иммунологические процессы, вызванные вирусной или бактериальной инфекцией, являются основной причиной атеросклеротического процесса [10, 15, 19].
В ряде исследований выявлена корреляция между сердечно-сосудистыми факторами риска, маркерами воспалительных процессов при атеросклеротическом процессе и Helicobacter pylori (H. pylori), приводящая к развитию ишемической болезни сердца (ИБС) [22]. Инфекция Н. pylori активирует как локальный, так и системный воспалительный процесс и может рассматриваться как возможный дополнительный фактор риска развития и обострения ИБС. Результаты многочисленных исследований дают основание предполагать о возможной патогенетической или опосредованной роли инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению. Несмотря на множество исследований, в которых подтверждается роль H. pylori в патогенезе ССЗ, в ряде исследований делаются весьма противоречивые выводы [9].
Основная часть
Цель исследования: изучить имеющиеся литературные данные о роли H. pylori в патогенезе и прогрессировании ИБС и риске сердечно-сосудистой патологии.
Материалы и методы исследования: обзор отечественных и иностранных литературных источников
Результаты исследования и их обсуждение
Н. pylori - это бактерия, которая встречается повсеместно, распространенность которой варьирует в зависимости от социально-экономических условий жизни населения [20]. Она считается этиопатогенетическим агентом как доброкачественных, так и злокачественных гастродуоденальных заболеваний; уничтожение бактерии приводит к рубцеванию пептической язвы, подавлению гастрита, снижению рецидивов язвенной болезни, улучшению симптоматики диспепсии и регрессу роста MALT-лимфомы. Она была классифицирована всемирной организации здравоохранения (ВОЗ), как тип 1 канцероген [20]. Кроме того, в последние годы было предложено, что H. pylori имеет большое значение в атеротромботическом процессе, доказательства этого анализируются ниже.
Изучение связи инфекции H. pylori с сердечно-сосудистыми заболеваниями (ишемической кардиопатии и ишемической цереброваскулярной болезни) были проведены разными следователями.
Возможными механизмами воздействия H. pylori на организм являются: 1) активация воспалительного процесса с продукцией цитокинов, эйкозаноидов и других медиаторов; 2) молекулярная мимикрия между антигенами бактерии и компонентами тканей макроорганизма с дальнейшим их аутоиммунным повреждением; 3) взаимодействие с тучными клетками с последующей секрецией биологически активных веществ, действующих на сосуды, бронхи, другие внутренние органы; 4) развитие аллергических реакций преимущественно немедленного типа; 5) снижение барьерной функции кишечника, приводящее к поступлению токсических продуктов, аллергенов в кровь; 6) поглощение макро- и микроэлементов, в частности железа, для процессов своей жизнедеятельности и, следовательно, обкрадывание макроорганизма [2].
Исследования взаимосвязи между серотипом H.pylori и факторами риска сердечно-сосудистой системы.
Давно изучены факторы, которые повышают риск атеротромбоза, такие как повышение в плазме фибриногена и VII фактора свертывания, гиперхолестеринемия и гипертриглицеридемия. В отношении взаимосвязи данных факторов и хеликобактерной инфекции имеются противоречивые результаты. Niemëla и соавторы [23] обнаружили значимые различия между триглицеридами и ЛПВП среди испытуемых серопозитивных и серонегативных по H. pylori. По мнению Rengström [29] также не было обнаружено существенных различий в плазме уровней фибриногена, холестерина или триглицеридов среди серопозитивных и серонегативных пациентов. В другом крупном исследовании авторы показали значительное увеличение фибриногена у серопозитивных пациентов, но не нашли значительных различий уровня холестерина и триглицеридов в плазме у некоторых серонегативных пациентов [25]. Также в этом исследовании был изучен VII фактор свертывания крови, но никаких существенных различий не было обнаружено среди пациентов, серопозитивных для H.pylori по отношению к серонегативным. В исследовании Pellicano R. выявлена способность бактерии усиливать агрегацию тромбоцитов и стимулировать прокоагулянтную активность компонентов крови [27]. В работе Weydig C. указаны возможные механизмы проагрегационных свойств H.pylori посредством молекул адгезии (L- и P-селектины), гликопротеина Ib, фактора Виллебрандта [31].
Исследования взаимосвязи между серотипом H.pylori и маркерами воспалительного процесса.
Существует все больше доказательств того, что воспаление играет этиопатогенетическию роль в развитии атеросклероза и что некоторые маркеры воспаления связаны с большим риском развития ИБС. Ухудшают прогноз ИБС такие маркеры, как С реактивный белок (СРБ), уровень лейкоцитов в крови, фибриногена в плазме или наличие белков теплового шока (БТШ) [8, 21]. При сравнении серопозитивных пациентов, по отношению к H.pylori, с серонегативными, Patel и соавторы [25] выявили увеличение уровня лейкоцитов в крови и фибриногена. Birnie и др. обнаружили увеличение БТШ бактерий для миоцитов, в частности БТШ-60 и БТШ-65 [11], при этом повышение C реактивного белка было связано с ухудшением прогноза у больных с нестабильной стенокардией или недавно перенесенным инфарктом миокарда. Также была исследована связь коронарной кардиопатии с ФНО-α, также маркером воспаления, но статистически значимых различий при этом не было выявлено.
Присутствие H. pylori в атероматозных бляшках.
Исследования проводились с использованием полимеразной цепной реакции (ПЦР) для обнаружения ДНК H. pylori в исследуемых тканях. Эти исследования, помимо того, что малочисленны (только 2 группы исследователей представили результаты), но и противоречивы. Cunningham и соавторы обнаружили наличие H. pylori в атероматозных бляшках (Первый Европейский конгресс по химиотерапии), в то время как Blasi и соавторы [12], в ходе исследования, проведенной на хирургических образцах аневризмы аорты, не обнаружили наличие H.pylori ни в одном из 51 образцов, несмотря на то, что 47 пациентов были серопозитивными.
С другой стороны, известно, что бактерии, которые противостоят сыворотке, или литической активности сывороточного комплемента, выживают дольше в кровотоке, что позволяет ему колонизировать другие области организма. В этом отношении Н. pylori восприимчива к бактерицидной активности сыворотки крови человека (в основном за счет активации альтернативного пути комплемента), и существуют определенные отличия в соединении разных штаммов к комплименту С3, что делает выживание этой бактерии в потоке крови маловероятным [16]. Тем не менее, в более позднем исследовании, проведенным коллективом под руководством Oshima T., выявлены были бактерии в биоптатах сосудов [24]. Багдадские ученые в 2015г. также обнаружили хеликобактерную специфическую ДНК в атеросклеротической бляшке из материала коронарных артерий. Кроме того, они оценивали роль фактора вирулентности H. pylori (цитотоксин ассоциированный ген (CagА)), липидный профиль, изучили уровень провоспалительных маркеров (С-реактивный белок) в качестве факторов риска ИБС у 70 пациентов с ИБС и наличием H. pylori. В результате получили существенные различия в среднем значении CagА, СРБ и обнаружением хеликобактерной специфической ДНК в атеросклеротической бляшке из материала коронарных артерий. Его ассоциация к позитивности антихеликобактерной терапии и клинических симптомов истолкованы авторами, как свидетельство участия хеликобактерной инфекции в прогрессировании ИБС [21] .
В крупном метаанализе, в котором приняли участие более 1000 больных, изучалась возможность корреляции между факторами риска ИБС и H. pylori. Авторы предполагают, что корреляцию между обнаружением H. pylori и выявлением факторов риска сердечно-сосудистой системы (ССС), можно объяснить преимущественной публикацией только положительных результатов, или случайными совпадениями, или обоими факторами одновременно [4]. В этом плане следует отметить крупное исследование HOPE, которое не подтвердило достоверную ассоциацию между инфекцией H. pylori и риском возникновения патологии сердца и сосудов.
Основываясь на научных данных, мы предлагаем различные механизмы для объяснения ассоциации инфекции H. pylori с сердечно-сосудистыми заболеваниями.
Воспалительная реакция.
Субфебрильная хроническая воспалительная реакция вырабатывается, провоцируя атерогенный процесс через изменения некоторых сердечно-сосудистых факторов риска, таких как свертывающие и липидные факторы, с выделением фибриногена, СРБ, фактора некроза опухоли (ФНО-α) и интерлейкина 6 (ИЛ-6), в дополнение к увеличению количества лейкоцитов в крови, которое может вызвать протромботическое состояние. У взрослых H.pylori индуцирует активный хронический воспалительный процесс с наличием нейтрофилов, Т-лимфоцитов, B-лимфоцитов и плазматических клеток [14]. Специфический клеточный ответ характеризуется образованием Т-хелперных лимфоцитов, приводящих к увеличению цитокинов, особенно ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α и интерферона-γ.
Способность индуцировать цитокины отличается среди различных штаммов H.pylori в частности, по CagA+, CagE+, VacAs1+, VacAm1+, BabA2+ – генам и культуральным свойствам [30]. С CagA+ штаммами наблюдалось продуцирование наиболее интенсивно высвобождающихся цитокинов с большим разнообразием [15]. Ряд исследователей предполагает, что именно вирулентные цитотоксические штаммы H. pylori, в частности с CagA, способны вызывать патологические изменения в сосудах.
Выявлено, что CagA - ассоциированная модификация актина влияет на его сократительную активность и находит свое выражение через каскадный механизм, включающий специфические белки-транспортеры (в частности, CagF) и медиаторное звено, представленное энзимными и неэнзимными компонентами [26]. Анти-CagA антитела обнаруживали в цитоплазме гладкомышечных клеток и они перекрестно реагировали с антигенами интактных и атеросклеротических сосудов; связывание их с антигенами поврежденных артерий, что может способствовать прогрессированию атеросклероза у лиц, инфицированных H. pylori [9]. Видимо CagA является одним из наиболее значимых агентов, обеспечивающих кардиопатогенность H.pylori.
Однако, ни в одном из исследований, отрицающих роль H. pylori в патогенезе ИБС, не оценивали распространенность вирулентных CagA-позитивных штаммов H. pylori среди обследованных пациентов [9]. С другой стороны, было также замечено, что растворимые выделения H.pylori способствуют агрегации бляшек в микроциркуляции слизистой желудка [17].
Симонова Ж.Г с соавторами разработала интегральную схему многогранного патогенного действия микроорганизма в отношении сердечно-сосудистой системы, которую мы представляем на рис. [8]. На ней обозначены основные патогенетические цепи, развивающиеся в результате реализации конкретного фактора вирулентности H. pylori. По ее мнению, превалирующую роль играют антителогенез, действие цитокинов и модуляторов системного воспаления, а запускает патохимический каскад молекулярных агентов, продуцируемых самим микроорганизмом, белок CagA [8].
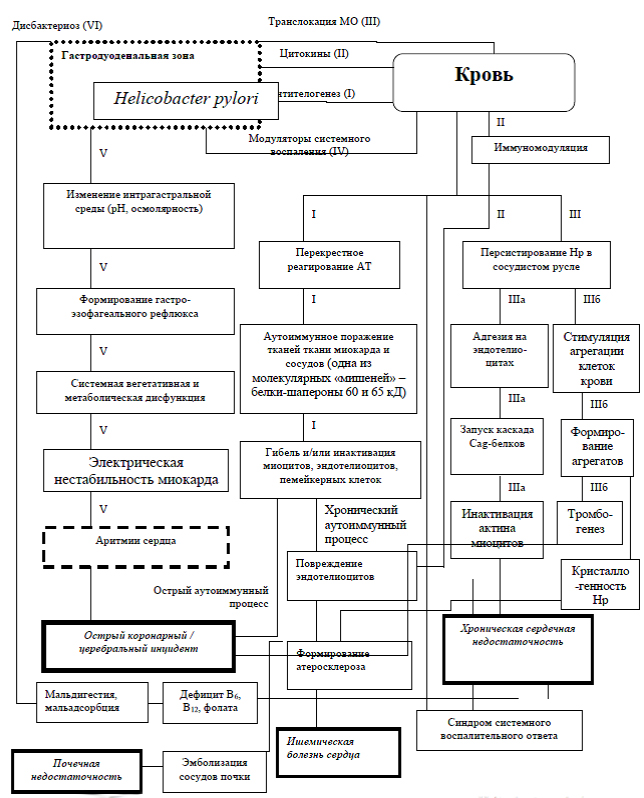
Рис. Патогенетические механизмы развития и прогрессирования H.pylori-ассоциированных заболеваний сердечно-сосудистой системы.
Fig. The pathogenetic mechanisms of development and progression of H.pylori-associated cardiovascular diseases.
Результаты исследования и их обсуждение.
Изменение липидов крови
Инфицирование H.pylori вызывает повышение уровня холестерина и триглицеридов со снижением уровня ЛПВП, способствуя развитию дислипидемии – известный сердечно-сосудистый фактор риска.
Образование окислителей
Ряд авторов предполагают, что формирование окислителей также важно. Было замечено снижение антиоксидантов у пациентов с H. pylori, что может привести к активации перекисного окисления липидов и, следовательно, к развитию атерогенеза, так как окисление липопротеинов низкой плотности (ЛПНП) является первым из основных шагов в атерогенном процессе.
Перекрестная реактивность с антителами белков теплового шока (БТШ)
Другая теория заключается в анти-БТШ антителах с перекрестной реактивностью. Выявлено, что H. pylori вырабатывает БТШ-60 с высокой степенью гомологичной последовательностью с БТШ-60 человека, находящимися в эндотелии.
Гипергомоцистеинемия
Гипергомоцистеинемия достаточно новый сердечно-сосудистый фактор риска, поскольку было замечено, что повышение уровня гомоцистеина связано с увеличением риска сердечно-сосудистых заболеваний. В этом отношении у пациентов с хроническим гастритом, как правило вызванным хеликобактерной инфекцией, наблюдается уменьшение абсорбции витамина В12 и фолиевой кислоты, вызывая тем самым вторичную гипергомоцистеинемию [13].
Эндотелиальная дисфункция
В исследованиях Rasmi Y., Raeisi S.изучался механизм эндотелиальной дисфункции в патогенезе кардиального синдрома Х, обусловленный структурно-функциональными нарушениями эндотелиоцитов в результате воспаления и пролиферативных изменений от H. pylori, приводящих к изменению эластических свойств сосудов через провоспалительные цитокины, молекулы клеточной адгезии, факторы роста и белки острой фазы. [28].
Заключение
Таким образом, механизмы патогенного действия H. pylori на ССС многогранны и способны приводить к формированию острых и хронических заболеваний сердечно-сосудистой системы. Тем не менее, роль H. pylori в этиопатогенезе ССЗ остается до конца не уточненной. В литературе появляются новые сообщения о возможной связи H. pylori и ИБС. Некоторые исследователи считают, что даже если связь существует и претерпевает обратное развитие после эррадикации хронической инфекции, необходимы очень крупные рандомизированные исследования для того, чтобы доказать достоверность наличия возможной связи между H. pylori и ССЗ.
В настоящее время литературные данные о взаимосвязи H. pylori с ИБС, носят разрозненный и противоречивый характер, все же они позволяют дополнить фундаментальные представления о патогенезе заболеваний, которые развиваются в рамках воспалительных и иммунных реакций на уровне различных органов и систем вне пищеварительного тракта, в частности в ССС. Хотя нет точных данных, подтверждающих роль H. рylori в развитии атеросклероза, накопившиеся факты указывают, что наряду с другими факторами патогенеза эти бактерии могут способствовать развитию данного заболевания. Противоречия о неоднозначности роли H. pylori в формировании атеросклероза и ИБС могут быть связаны с их генетической гетерогенностью.
В целом, приведенные выше противоречивые данные, дают основание для дальнейшего изучения этой проблемы с целью выявления достоверных сведений.





















Список литературы