СИНТЕЗ БАКТЕРИОЦИНОПОДОБНОГО ВЕЩЕСТВА ШТАММОМ LACTOBACILLUS PLANTARUM 42, ВЫДЕЛЕННЫМ ИЗ КВАШЕНОЙ КАПУСТЫ
Aннотация
Бактериоцины – рибосомально синтезируемые антибактериальные белковые вещества, выделяемые определенными видами бактерий и активны против как близкородственных видов, так и против представителей других видов. В настоящее время бактериоцины рекомендуются для применения в качестве антимикробных веществ в пищевой промышленности и в медицине. Количество синтезируемого бактериоцина в значительной степени зависит от условий культивирования, таких как рН среды и температура. Бактериоцины могут как выделяться в среду культивирования, так и оставаться прикрепленными к клетке продуцента. Оптимизация условий продукции бактериоцина и увеличения его активности имеет важное экономическое значение для снижения стоимости его получения. Целью данной работы было определение локализации бактериоцина Lactobacillus plantarum 42, активного против Enterococcus faecalis и определение оптимальных условий культивирования, при которых наблюдается его максимальная продукция. Штамм Lactobacillus plantarum 42 синтезирует бактериоцин, активный против Enterococcus faecalis, который выделяется в твердую и жидкую питательную среду, однако в МРС бульоне обнаруживается только при 10-кратной концентрации. Бактериоцин обнаруживается на ранней стационарной фазе роста (18 часов) и продолжает оставаться активным до 76 часов после начала ферментации. Максимальное количество бактериоцина было обнаружено после 48 часов ферментации, при начальном значении рН среды от 5 до 7. Не было отмечено отличий в синтезе при температурах 30оС и 37оС. Данный бактериоцин оказался вторичным метаболитом.
Молочнокислые бактерии (МКБ) выделяют большое количество антимикробных веществ, в том числе органические кислоты, реутерин, диацетил, перекись водорода и бактериоцины, которые способны подавлять рост патогенных микроорганизмов [12]. Бактериоцины – белковые, рибосомально синтезируемые антибактериальные вещества, выделяемые определенными видами бактерий и активны против как близкородственных видов [19], так и против представителей других видов [14]. В настоящее время бактериоцины рекомендуются для применения в качестве антимикробных веществ в пищевой промышленности и в медицине [14, 15]. Разные бактериоцины имеют разный спектр чувствительных микроорганизмов, в том числе вызывающих порчу пищевых продуктов и поэтому они могут служить натуральным заменителем синтетических консервантов [20], в связи с чем в последнее время возрос интерес ученых к поиску новых потенциальных источников этих белковых компонентов. Сообщалось, что продукция бактериоцина зависит от ряда факторов, таких как условия культивирования - рН, температура, состав питательной среды и фазы роста и развития продуцента [10]. Бактериоцины могут как выделяться в среду культивирования [22], так и оставаться прикрепленными к клетке продуцента [11]. Оптимизация условий продукции бактериоцина и увеличения его активности имеет важное экономическое значение для снижения стоимости его получения.
Целью данной работы было определение локализации бактериоцина Lactobacillusplantarum 42, активного против Enterococcusfaecalis и определение оптимальных условий культивирования, при которых наблюдается его максимальная продукция.
Экспериментальная часть
Бактериальные культуры. В работе использовался в качестве продуцента бактериоцин-синтезирующий штамм Lactobacillus plantarum 42 [2], выделенный из квашеной капусты и хранящийся в лаборатории генетики молочнокислых бактерий АН РУз в лиофильно высушенном состоянии. Для проведения исследований культуру восстанавливали путем двукратного пересева в МРС бульон (HiMedia) (количество вносимого инокулята 1%) и культивирования при 37оС в течение 24 часов. Индикаторным штаммом служил типовой штамм Enterococccus faecalis.
Определение локализации синтезированного бактериоцина. Для того чтобы определить, секретируется ли продуцируемый антимикробный пептид во внешнюю среду или остается прикрепленным к клетке, изучали наличие антимикробной активности: а) в толще твердого МРС агара, б) в бесклеточной культуральной среде и в) в лизате клеток. На твердой агаровой среде продукцию бактериоцина изучали методом пятен, описанным Harris и сотр. [3]. Для этого ночную культуру L. plantarum 42, выращенную в МРС бульоне, засевали пятном (7 мкл) на поверхность чашки с МРС агаром и культивировали при 37оС 48 часов при анаэробных условиях для предотвращения синтеза перекиси водорода. Штаммы L. plantarum43 и L. plantarumАТСС были использованы для сравнительного анализа. Для выяснения белковой природы ингибирующего вещества, около пятна выросшей исследуемой культуры помещали каплю (5 мкл) протеаз - пепсина и протеиназы К. Затем чашки покрывали вторым слоем мягкого сердечно-мозгового агара (СМА, HiMedia), в котором было суспендировано 10 мл индикаторной культуры E. faecalis в стационарной фазе роста. После 24-часового культивирования при аэробных условиях проверяли наличие и измеряли диаметр зоны подавления роста в индикаторном слое клеток и наблюдали наличие протеазной активности, которая выражалась в росте индикаторной культуры в точках действия пепсина и протеиназы К.
Для определения антимикробной активности культуральной жидкости, восстановленные клетки выращивали в течение 48 часов при 30оС в МРС бульоне, отделяли от культуральной жидкости центрифугированием при 5000 об/мин в течение 15 минут. Супернатант пропускали через мембранный фильтр с размером пор 0.22 нм для удаления остаточных клеток, концентрировали в 10 раз путем сублимационной сушки с последующим растворением в меньшем количестве воды. Кроме того, из высушенного супернатанта готовили 10% раствор в дистиллированной воде из расчета на массу сухого остатка (100 мкг сухого остатака растворяли в 1 мл стерильной дистиллированной воды.). В качестве контроля использовали питательный МРС-бульон, 10-кратно концентрированный путем лиофильного высушивания с последующим растворением в меньшем количестве воды.
Чтобы определить антимикробную активность лизата клеток, Lactobacillus plantarum 42 восстанавливали путем двухкратного пересева на среду МРС и инкубировали при 30оС 24 часа. Культуру центрифугировали при 5000 об/мин в течение 15 мин, осажденную биомассу ресуспендировали в 300 мл 70% изопропанола и 0.1% трифторуксусной кислоты [11] и перемешивали на магнитной мешалке при комнатной температуре в течение 3 часов. Остатки клеточной стенки удаляли центрифугированием при 5000 об/мин в течение 15 мин и далее из супернатанта выпаривали изопропанол на роторном испарителе.
Сырой экстракт белков из культуральной жидкости L. plantarum 42 получали путем высаливания аммония сульфатом с последующим диализом в диализном мешке с размерами пор 1000 кДа и сублимационной сушкой.
Проверяли антимикробную активность супернатанта, лизата клеток и сырого экстракта белков методом лунок в агаре [4].
Подбор оптимальных условий культивирования для максимального синтеза бактериоцина. Время максимального бактериоцинообразования оценивали методом пятен на агаре по зоне подавления индикаторного штамма E. faecalis после 24, 36, 48, 60 и 72 часов ферментации.
Оптимальная температура культивирования определялась при выращивании бактериоциногенной тест-культуры при 30оС и 37оС с последующим измерением зоны подавления роста индикаторного штамма в двухслойном агаре.
Влияние значения рН среды культивирования на бактериоцинообразование изучали при выращивании культуры продуцента на МРС среде, где начальную рН доводили до значений 4.0, 5.0, 6.0, 7.0 и 8.0 с помощью растворов HCl и NaOH и наблюдали изменение диаметра зоны подавления индикаторной культуры описанным выше методом.
В следующей серии опытов изучено образование бактериоцина при следующем режиме ферментации: температуры 37оС, при перемешивании на качалке (с количеством оборотов не менее 200 оборотов в минуту) в колбах с узким и длинным горлом для создания частичной анаэробности и в динамике роста - через 12, 18, 24, 36 и 48 часов.
Определяли в динамике роста изменения pH среды, накопление живых клеток по оптической плотности бактериальной суспензии при длине волны 600 (OD600), количеству живых клеток в 1 мл среды и антимикробную активность культуральной жидкости по диаметру зоны отсутствия роста индикаторной культуры E. faecalis.
Время начала синтеза бактериоцина. Жидкую культуру L. plantarum 42, выращенную в МRS бульоне, рассевали на твердый МRS агар для получения поверхностных колоний, затем после 12 ч. роста облучали УФ лучами в течении 30 сек для индукции бактериоцинообразования [1]. Из поверхностных колоний получали бактериальную суспензию с плотностью клеток 109 КОЕ/мл путем смыва физиологическим раствором. Затем посевной материал вносили в количестве 5% в в колбы со 100 мл МRS бульона. Время начала синтеза бактериоцина определяли на 6, 12, 18, 24, 36, 48, 60 часы ферментации путем нанесения отцентрифугированного и пропущенного через мембранный фильтр с размерами пор 0.22 мкм супернатанта в количестве 7 мкл на поверхность слоя индикаторной культуры, посеянной в мягкий СМА. После культивирования при 37оС 24 часа отмечали отсутствие роста индикаторной культуры в зоне нанесения супернатанта.
Результаты исследования и их обсуждение
Антимикробная активность L. plantarum 42 на твердой среде, лизата его клеток и супернатанта.
Показано, что вокруг L. plantarum 42 появляется большая зона задержки роста (более 20 мм) у E. faecalis. Антимикробный агент L. plantarum 42 теряет свою активность против энтерококка после обработки пепсином и протеиназой К, что проявляется в виде участка роста культуры в зоне подавления роста. Это указывает на белковую природу вещества (Рис. 1). Другие штаммы L. plantarum (L. plantarum 43 и L. plantarum ATCC) не имеют антимикробной активности против данной культуры.

Рис 1. Антимикробная активность L. plantarum 42, обусловленная бактериоцином, к E. faecalis
1 – зона разрушения бактериоцина пепсином
2 – зона разрушения бактериоцина протеиназой К
Pic. 1. Antimicrobial activity of L. plantarum 42, caused by bacteriocin, against E. faecalis
1 – the zone of bactericon destruction by pepsin
2 - the zone of bactericon destruction by proteinase K
Установлено, что лизат клеток не обладает антимикробной активностью к E. faecalis, в то время как культуральная жидкость проявляет антимикробную активность, обусловленную веществом белковой природы, только при 10-кратном концентрировании. 10% раствор высушенного супернатанта и 10-кратно концентрированный супернатант имеют зону подавления роста Enterococcus faecalis 13 мм и 26 мм соответственно, в то время как концентрированный МРС бульон не обладает антагонистической активностью по отношению к индикаторной культуре (рис. 2).
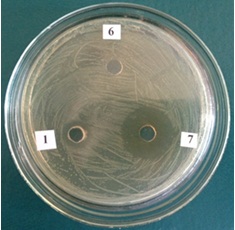
Рис 2. Антимикробная активность культуральной жидкости L. plantarum 42 к E. faecalis
1. 10% раствор сухого остатака супернатанта L. plantarum 42
6. 10-кратно концентрированный МРС бульон
7. 10-кратно концентрированный супернатант
Pic 2. Antimicrobial activity of L. plantarum 42 culture media against E. faecalis
1. 10% solution of dried L. plantarum 42 supernatant
6. 10-times concentrated MRS Broth
7. 10-times concentrated supernatant
Полученный путем высаливания сульфатом аммония из культуральной жидкости сырой экстракт белков L. plantarum 42 в концентрации 2.5% и 25% также проявил антимикробную активность к E. faecalis, при этом наблюдалось увеличение зоны подавления роста индикаторной культуры от 17 до 25 мм.
По литературным данным, в большинстве случаев бактериоцины накапливаются в супернатанте в достаточном количестве, поскольку их активность обнаруживается не только в сыром супернатанте, но и при его разведении в несколько раз [6, 9, 21]. Однако некоторые бактериоцины, такие как плантарицин F [16], лактацин В [5] и плантацин В [23], секретируется в жидкую питательную среду в достаточно малых количествах, поэтому он не обнаруживается без концентрирования супернатанта. Несмотря на это, в твердой питательной среде накопление таких бактериоцинов идет достаточно эффективно, поэтому обнаружение их наличия и активности проводится на агаровой среде. Изучаемый нами бактериоцин L. plantarum 42, также как и плантарицин F, лактацин В и плантацин В, сектретируется преимущественно в твердую питательную среду.
Условия культивирования для максимального накопления бактериоцина
Результаты показали, что наибольшая продукция бактериоцина наблюдается через 48 часов ферментации, к 60 и 72 часам культивирования, бактериоцинообразование снижается. Температура инкубации – 30оС и 37оС – не влияет значительно на синтез бактериоцина (табл. 1).
Таблица 1
Диаметр зоны задержки роста индикаторной культуры бактериоцином L. plantarum 42 в зависимости от времени культивирования и температуры (мм)
Table 1
Diameter of the indicator strain growth inhibition by L. plantarum 42 related to the time of cultivation and temperature
Температура | Время культивирования, ч | ||||
24 | 36 | 48 | 60 | 72 | |
30оС | 12.4±0.31 | 15.2±0.48 | 20.2±0.48 | 19.4±0.31 | 17.6±0.23 |
37оС | 13.4±0.31 | 15.6±0.52 | 19.4±0.31 | 19.6±0.52 | 17.6±0.52 |
Изучение влияния значения рН на синтез бактериоцина показало, что синтез бактериоцина максимален при рН 6, диаметр зоны подавления роста индикаторной культуры составляет 19.6 мм, при рН 5.0 и 7.0 также наблюдается значительный синтез бактериоцина и диаметр зоны подавления роста составляет 17.6 и 17.8 мм. При рН ниже 5 бактериоцинообразования не наблюдается и при рН 8 синтез бактериоцина значительно снижается (табл. 2).
Таблица 2
Влияние рН среды на образование бактериоцина штаммом L. plantarum 42
Table 2
Influence of initial pH of growth media on bacteriocin production by L. plantarum42
рН питательной среды MRS | Диаметр зоны отсутствия роста, мм |
4.0 | - |
5.0 | 17.6±0.52 |
6.0 | 19.6±0.31 |
7.0 | 17.8±0.48 |
8.0 | 12.2±0.26 |
Условия культивирования, такие как начальное значение рН среды и температура, являются важным фактором для продукции бактериоцинов [20].
Определение бактериоцинообразования в динамике роста при ферментации продуцента на качалке показало, что максимальный синтез бактериоцина при данных условиях происходит через 24 часа после начала ферментации, когда наблюдается максимальное количество живых клеток в среде (1.4х109). Диаметр зоны отсутствия роста индикаторной культуры при этом составлял 15.5 мм, тогда как через 48 часов после начала инкубации наряду со снижением количества живых клеток в среде и накоплением кислот (рН среды снижается до 3.5), уменьшается диаметр зоны отсутствия роста до 14.8 мм (табл.3).
Таблица 3
Бактериоциногенная активность L. plantarum 42 в динамике роста и развития
Table 3
Bacteriocinogenic activity of L. plantarum 42 in the dinamics of growth and development
Показатели | Время культивирования, ч | ||||
12 | 18 | 24 | 36 | 48 | |
pH | 4.7 | 4.5 | 3.8 | 3.5 | 3.5 |
Оптическая плотность бактер. суспензии | 2.38 | 2.71 | 2.75 | 2.78 | 3.1 |
Количество живых клеток/мл культуральной среды | 5.5∙108 | 1.2∙109 | 1.4∙ 109 | 9.5∙108 | 7.5∙108 |
Зона бактерицидного действия | 12.2±0.48 | 14.5±0.45 | 15.5±0.45 | 15.1±0.14 | 14.8±0.59 |
Время начала синтеза бактериоцина
При нанесении супернатанта L. plantarum 42 на поверхность слоя с индикаторной культурой было отмечено, что не во всех образцах наблюдается подавление роста E. faecalis на месте нанесения супернатанта. Подавление начинает проявляться в образце, взятом через 18 часов после начала культивирования, что соответствует началу стационарной фазы роста исследуемой культуры. Ингибирующая активность супернатанта сохраняется до 72 часов, после чего наблюдение было остановлено. Сохранение активности в течение длительного времени возможно связано с тем, что культура не образует внеклеточных протеаз.
В отличие от многих бактериоцинов МКБ, активность бактериоцина L. plantarum 42 не обнаруживается в культуральной жидкости до начала стационарной фазы роста. В такой же фазе роста обнаруживаются активность бактериоцина плантарицина F [16], в то время как плантарицин Т, продуцируемый L. plantarumLPC010, обнаруживается только во время поздней фазы стационарного роста [17]. В отличие от них, плантарицины А, BN, C и S [7, 13, 8, 17] – все бактериоцины L. plantarum, обнаруживались в период активного роста, также как и педиоцин АсН, низин, сакацин А и лейконоцин Lcm 1 [24].
Отсутствие активности бактериоцина F во время экспоненциальной фазы роста Paynter и сотр [16] объясняют следующими факторами: либо он не синтезируется в этой фазе роста, либо он синтезируется во время активного роста, но адсорбирован на клетке до тех пор, пока рН не снижается до того уровня, который приводит к десорбции. В нашем исследовании показано, что рН не влияет на десорбцию бактериоцина, так через 12 часов культивирования, когда активности бактериоцина еще не наблюдается и через 18 часов культивирования, когда уже проявляется активность, значение рН отличается незначительно. Это подтверждается отсутствием антимикробной активности лизата клеток L. plantarum 42. Вероятно, синтез бактериоцина начинается только в ранней стационарной фазе роста L. plantarum 42, что означает, что он является вторичным метаболитом. В большинстве случаев, синтез бактериоцинов МКБ происходит во время активной фазы роста [21], но некоторые исследования указывают, что МКБ могут синтезировать бактериоцин в стационарной фазе [16].
Условия культивирования, такие как начальное значение рН среды и температура, являются важным фактором для продукции бактериоцинов [20]. По данным Prema [18], оптимальными условиями накопления бактериоцина тремя штаммами L. plantarum (IZ, A1, F1), выделенными из растительного сырья, является МРС-среда с рН=6.5, температура инкубации 37оС и время ферментации 48 часов. Такие же условия культивирования являются оптимальными для продукции бактериоцина L. plantarum 42, хотя темература в пределах от 30оС до 37оС не изменяла синтез бактериоцина. В другом исследовании синтеза бактериоцина L. plantarum ST194BZ в работе Todorov S.D. и Dicks L.M.T [21] оптимальное значение рН также установлено выше 4.5, хотя оптимальная температура для синтеза равна 30оС. Из полученных нами результатов и литературных данных можно сделать вывод, что оптимальной температурой продукции бактериоцинов L. plantarum является температура в пределах 30оС и 37оС и оптимальное значение рН = 6.
Кроме температуры и рН среды, на синтез бактериоцинов большое влияние оказывает состав питательной среды [21], что будет изучено нами в дальнейших исследованиях.
Заключение
L. plantarum 42, выделенный из квашеной капусты, синтезирует бактериоцин, активный против E. faecalis, который секретируется в питательную среду. Максимальная продукция бактериоцина наблюдается при начальном значении рН среды, равном 6 и при температуре от 30оС до 37оС. Бактериоцин L. plantarum 42 является вторичным метаболитом.
Для дальнейшей оптимизации бактериоцинообразования целесообразным является подбор состава питательной среды.





















Список литературы