ИЗМЕНЕНИЕ ПОКАЗАТЕЛЕЙ ЛИПИДНОГО СОСТАВА КЛЕТОЧНЫХ МЕМБРАН В УСЛОВИЯХ ПЕСТИЦИДНОЙ ИНТОКСИКАЦИИ И СПОСОБЫ ИХ ПРОФИЛАКТИКИ
Aннотация
На сегодняшний день остро стоит проблема применения высокотоксичных веществ в сфере агропромышленного производства в качестве пестицидов. Как следствие, возрастает число отравлений как среди животных, так и среди людей. В первую очередь, токсический эффект находит свое отражение в нарушении метаболизма липидов. Для прогноза возможности нивелирования пагубного действия пестицидов был изучен потенциал профилактического применения препарата мексидол для нормализации показателей липидного обмена крови крыс в условиях хронической пестицидной интоксикации. В ходе работы было установлено протективное действие антиоксиданта в значительной степени для фракций нейтральных липидов: холестерина, триацилглицеридов.
Введение. На сегодняшний день проблема увеличения урожайности сельскохозяйственных культур стоит как никогда остро перед растениеводческими комплексами агропромышленного производства. В число причин низкой урожайности входит пагубное воздействие различных вредителей, среди которых большой экономический ущерб наносят возбудители грибковых заболеваний. Как правило, для борьбы с ними применяют фунгицидные (противогрибковые) агрохимикаты. Наиболее продолжительное время и в значительных объемах из группы фунгицидых веществ применяется тетраметилтиурамдисульфид (ТМТД) в качестве протравителя семян. Безусловно, применение данного фунгицида выгодно с точки зрения экономики, однако данный факт не компенсирует вреда от способности ТМТД сохраняться в продуктах первичной переработки сельскохозяйственных культур. Из этого следует, что тетраметилтиурамдисульфид представляет существенную опасность как для теплокровных животных, так и для человека. Иными словами, современная ситуация складывается таким образом, что экономическая выгода стоит выше всеобщей безопасности. Их данных гигиенической классификации ТМТД является высокотоксичным веществом, летальная доза которого колеблется в интервале от 50 до 200 мг/кг, с выраженной кумуляцией (коэффициент кумуляции 1-3), стойким (0,5-1 год) пестицидом [4].
Поэтому влияние химических факторов может сопровождаться нарушением метаболических реакций организма и структурно-функциональными изменениями клеток [10, 15]. С биохимической точки зрения, липидный обмен является одним из сложнейших энергетических процессов, протекающих в организме человека. Количественное содержание различных видов жиров в тканях и плазме крови регулируется процессами катаболизма и анаболизма, а также реакциями их взаимопревращений [12]. Из всего широкого разнообразия видов липидов наиболее важными – нейтральные липиды. Являясь одним из основных компонентов биологических мембран, они оказывают влияние на проницаемость клеточной стенки и активность работы многих ферментов [18]. Более того, нейтральные липиды участвуют в процессах сокращения мышечной ткани, создании межклеточных контактов в иммунохимических процессах [13, 23]. Согласно данным С.Л. Шриера, для изучения мембранных липидов можно использовать структурно-функциональные характеристики мембраны эритроцитов, которые являются специфическими показателями, свидетельствующими о функциональном статусе других клеточных мембран организма [6, 22]. Препарат мексидол стабилизирует мембранные структуры эритроцитов, повышает содержание полярных фракций липидов, вследствие чего может применяться с профилактической целью в условиях длительного токсического воздействия ксенобиотиков [2].
В связи с этим целью настоящего фрагмента исследования явилось изучение показателей метаболизма нейтральных липидов на фоне хронического пестицидного отравления с разработкой профилактических мероприятий с применением мексидола в качестве антиоксиданта.
Материалы и методы исследования. Исследование было проведено на 150 белых половозрелых крысах-самцах линии Вистар весом 180-200 грамм, содержавшихся на стандартном рационе вивария. Экспериментальные животные были разделены на одну контрольную и две опытных группы. Животные контрольной группы (n=50) оставались интактными. У крыс первой опытной группы (n=50) модель хронической пестицидной интоксикации воспроизводили ежедневным внутрижелудочным введением через зонд 1/50 ЛД50 (4,42 мг/кг) пестицида ТМТД, в течение 28 суток. Животных второй опытной группы (n=50) проводили коррекцию синтетическим антиоксидантом мексидол следующим образом – в течение 14 дней внутрижелудочно, через зонд, вводили ТМТД в дозе 1/50 ЛД50, а затем внутримышечно мексидол в дозе 10 мг/кг в течение 14 дней. В исследовании применяли пестицид ТМТД, соответствующий требованиям ФСП, ГСО N 3738-062-34, выпускаемый НПО «Метрология+». Комплекс исследований был проведен согласно принципам, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986).
Забой осуществляли декапитацией под легким эфирным наркозом. Липидный состав фракций определяли традиционными методами [21]. Хроматографическое исследовани было проведено по методике В.И. Крылова в насыщенных парами растворителей камерами на пластинках отечественного производтва «Silyfol» (Россия) [7]. Идентификация жировых фракций производилась с применением стандартных образцов нейтральных липидов (холестерин (ХС), моноглицериды (МГ), диглицериды (ДГ), свободные жирные кислоты (СЖК), триглицериды (ТГ), эфиры холестерина (ЭХС)) производства фирмы «Sigma» (США), путем определения относительной подвижности фракций. Уровень содержания липидов определяли денситометрическим методом на ПВМ IBM PA/AT с использованием программы «OneDscan» в отраженном свете [7, 8, 11]. Статистическую значимость различий средних величин была расчитана по t-критерию Стьюдента после проверки нормальности распределения изучаемых параметров с помощью программы Statistica 6.0.
Результаты и их обсуждение. По результатам полученных данных удалось установить, что при хронической пестицидной интоксикации происходит увеличение концентрации фракций ХС на 8,53%, моноглицеридов – на 25,75%, диглицеридов – на 21,97%, триглицеридов – на 41,42%. Уменьшение количественной представительности зарегистрировано для фракций свободных жирных кислот на 5,68%, эфиров холестерина – на 12,81%.
Таблица
Содержание нейтральных липидов мембран эритроцитов крови крыс
Table
The content of neutral lipids in rats’ erythrocytes of blood
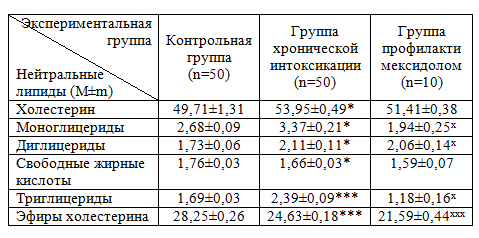
При использовании мексидола с целью профилактики изменений липидного состава клеточных мембран при хронической интоксикации, были получены следующие результаты. Среди спектра нейтральных липидов наблюдалось значительное уменьшение фракции ТГ на 50,62% (p< 0,05) и менее выраженное уменьшение ЭХС и ХС на 12,34% (p<0,001) и 4,7% соответственно.
Заключение.
Таким образом, пестицидная интоксикация теплокровных животных приводит к изменениям в составе нейтральных липидов мембран клеток и их структурной реорганизации, что сопровождается нарушением функционирования их транспортных, ферментных систем [19] и изменением метаболического состояния всей клетки [4]. Среди нейтральных липидов в условиях хронического токсического воздействия происходит достоверное увеличение ЭХС на и ХС на 8,52%. Важнейшим регулятором текучести мембран является холестерин [14, 17]. Повышение микровязкости липидного бислоя мембран может происходить вследствие увеличения уровня холестерина в мембранах эритроцитов [5]. Стоит отметить увеличение уровня триацилглицеридов, данный факт может быть обусловлен усилением периферического липолиза (стрессовая реакция на ксенобиотик), в результате которого происходит поступление жирных кислот и глицерина в печень из жировых депо с последующим их ресинтезом [9, 20].
Использование мексидола с профилактической целью приводило к нормализации исследуемых показателей липидного обмена. Важными компонентами механизма действия мексидола являются его антиоксидантные, мембранотропные эффекты. Мексидол стабилизирует мембранные структуры клеток крови (эритроцитов), повышает содержание полярных фракций липидов.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы
1. Брызгунова С.С., Еремина М.В. Оценка токсикологического влияния пестицидов на организм человека // Успехи соврем. естествознания. 2011. № 8. С. 95-96.
2. Воронина Т.А. Мексидол: Основные нейропсихотропные эффекты и механизм действия // Фарматека. 2009. № 6. С. 35-38.
3. Герунова Л. К., Бойко Т. В. Токсикология пестицидов: учебное пособие. М.: Издательский дом «Научная библиотека», 2013. 200 с.
4. Горшинская И.А. Изменение микровязкости лимфоцитов и эритроцитов крови у онкологических больных // Вопр. мед. химии. 1999. Т.45, № 1. С. 53-57.
5. Козин Г.И., Макарова В.А. Исследование системы крови в клинической практике. М: Мир, 1997. 431 с.
6. Крылов В.И., Виноградов А.Ф., Ефремова С.И. Метод тонкослойной хроматографии липидов мембран эритроцитов // Лаб. дело. 1984. № 4. С. 205-206.
7. Кузнецов В. И., Миронова Н.И. Некоторые показатели липидов плазмы крови и эритроцитарных мембран у больных дифтерией глотки // Казан. Мед. Журн. 1996. № 4. С. 266-269.
8. Липовецкий, Б.М. Клиническая липидология. СПб.: Наука, 2000. 119 с.
9. Момот Т.В., Кушнерова Н.Ф., Фоменко С.Е. Профилактика липидного обмена печени при интоксикации сероуглеродом // Тихоокеанский медицинский журнал. 2013. № 2. С.57-59.
10. Ольшанова К.М. Практикум по хроматографическому анализу / К.М. Ольшанова. М.: Высш. Школа, 1970. 312 с.
11. Серебров В.Ю., Балашов П.П., Шарыпова Н.Г. Спектр липидов плазматических мембран лимфоцитов при абстинентном синдроме у больных опиоидной наркоманией // Клин. лаборат. диагн. 2004. № 4. С. 10-12.
12. Сторожок С. А. Изменения физико-химических свойств биологических мембран при развитии толерантности к этанолу // Вопр. мед. химии. 2001. № 2. С. 42-51.
13. Халилов Э.М. Структурно-функциональный анализ мембран эритроцитов с различным содержанием холестерина // Вопр. мед. химии. 1982. Т.27, вып.1. С. 81-86.
14. Шаповалова В.П., Рыжова Т.В., Рыжов В.М. Состояние липидного обмена при воздействии шума и алюминиевой пыли // Медицина труда и промышленная экология. 2010. № 7. С. 18-20.
15. Шорманов В.К., Маслов С.В., Дурицын Е.П., Баранов Ю.Н. Судебно-химическое определение банкола // Суд.-мед. экспертиза. 2010. № 6. С. 39-41.
16. Rukmini R. [et al.] Cholesterol Organization in Membranes at Low Concentrations: Effects of Curvature Stress and Membrane Thickness // Biophys. J. 2001. Vol. 81. P. 2122-2134.
17. Zhuang L. [et al.] Cholesterol targeting alters lipid raft composition and cell survival in prostate cancer cells and xenografts // J. Clin. Invest. 2005. Vol. 115. P. 959-968.
18. Devaux P.F., Morris R. Transmembrane asymmetry and lateral domains in biological membranes // Traffic. 2004. Vol. 5, N 4. P. 241-246.
19. Yao Q. [et al.] Effect of chronic intermittent hypoxia on triglyceride uptake in different tissues // J. Lipid Res. 2013. 54, N 4. P. 1058-1065.
20. Folch J., Less M., Sloane G. A simple method for the isolation and purification of total lipides from animal tissues // J. Biol. Chem. 1957. Vol. 226. P. 497-509.
21. Nilous T. Molecular basic of membrane disorders // J. Acta Haematol. 2002. Vol. 108, № 4. P. 210-218.
22. Ohvo-Rekila H., Ramstedt B., Leppimaki P. Cholesterol interactions with phosphor-lipids in membranes // Prog. Lipid. Res. 2002. Vol. 41. P. 457-468.
23. Summary of Toxity Studies on Bensultap. (Development Department, Plant Protection Research, Agro Division, Takeda Chemical Industries, Ltd.) // J. Pesticide Sci. 1989. Vol. 14. № 4. P. 523-529.