ИССЛЕДОВАНИЕ СОСТАВА ТРАВЫ ГОРЦА ПОЧЕЧУЙНОГО МЕТОДОМ ГАЗОВОЙ ХРОМАТО-МАСС-СПЕКТРОМЕТРИИ
Aннотация
Семейство гречишные (Polygonaceae), довольно широко распространенное по всей европейской части России, включает большое количество близкородственных видов, схожих по своим морфологическим признакам, но обладающих различным фармакологическим действием. В связи с множественным полиморфизмом рода Polygonum, возникают проблемы при идентификации и заготовке сырья. Учитывая выше изложенное, необходимо проведение более полного изучение компонентного состава представителей данного рода с помощью современных высокоточных методов анализа. C использованием метода газовой хромато – масс- спектрометрии (ГХ-МС) изучена возможность идентификации компонентов состава травы горца почечуйного. Установлено присутствие 62 компонентов, среди которых соединения фенольной природы, сахара, жирные кислоты и др.
Введение. Газовая хроматография – масс-спектрометрия (ГХ-МС) – метод количественного и качественного анализа широкого круга соединений, открывающий большие перспективы во многих областях, таких как токсикология, медицина, фармацевтическая промышленность. ГХ-МС – комбинация двух мощных аналитических инструментов: газовой хроматографии, обеспечивающей высокоэффективное разделение компонентов сложных смесей в газовой фазе, и масс-спектрометрии, позволяющей идентифицировать как известные, так и неизвестные компоненты смеси [1].
Широкий диапазон биологической активности фенольных соединений привлекает внимание исследователей к таксонам, богатым этими веществами. К таковым относятся виды рода Persicaria (сем. Polygonaceae), в том числе и горец почечуйный (Polygonum persicaria L.), которые используются как в народной, так и в официнальной медицине. Согласно более ранним исследованиям, основными группами биологически активных соединений (БАВ), входящими в состав травы горца почечуйного, являются фенольные соединения, витамины, полисахариды, соединения стероидной природы и др. [4, 5, 6, 7, 11]. В последнее время большинство исследований посвящено определению индивидуальных компонентов химического состава лекарственных растений, пищевых добавок, напитков методами хроматографии [2, 3, 9, 10]. Одним из наиболее распространённых является метод ГХ-МС, с помощью которого, при наличии стандартных образцов, возможна идентификация и определение индивидуальных веществ в объектах.
В последнее время метод ГХ-МС все чаще находит свое применение для анализа лекарственного растительного сырья (ЛРС) и лекарственных растительных препаратов [2, 3, 8, 10].
Цель работы – исследование компонентного состава травы горца почечуйного методом ГХ – МС.
Методы исследования. Объектом исследования являлась измельченная высушенная трава горца почечуйного заготовленная в 2016 году в Воронежской области, летом в фазу цветения.
ГХ-МС. Пробоподготовка: Взвешивали 1-10 мг образца в 2 мл реакционной виале (пузырьке), далее прибавляли 1,0 мл абсолютного пиридина (Acros Organics, CAS 11086-1) и 200 мкл силилирующего реагента – BSTFA + 1%TMCS (или N,O-бис(триметилсилил)трифторацетамид + 1,0% триметилхлорсилана) Supelco, Cat. No. 360244-U, смесь выдерживали при 70 градусах в термостате, в течении 30-40 мин. Затем, 50 мкл образца, подготовленного, как описано выше, растворяли в 1,0 мл хлористого метилена. Полученный раствор – анализировали.
Для анализа применяли хроматограф газовый Agilent 7890B с МС-интерфейсом Agilent 5977A MSD. Ионизация – электронный удар, энергия ионизации 70 эВ, сканирование 30-550 а.е.м. (Да). Газ-носитель – гелий (1,0 мл/мин); термостат 50°С – 3 минуты, 50-190°С 10 мин, 190-250° 20 мин, 300°С 10 мин.
Инжекция – 1 мкл, деление потока 80:1. Колонка неполярная HP-5MS UI 30м x 0.25мм, 0.25мкм. Идентификацию соединений проводили по характеристичным m/z с использованием базы спектров встроенной в программную оболочку аналитического оборудования, а также литературных данных [6].
Результаты исследования и их обсуждение. В результате исследования были получены масс спектры 62 веществ органической природы, из которых идентифицировано 22. По данным таблицы 1 видно, что состав обнаруженных соединений очень разнообразен: 3 вещества спиртовой природы (эритритол (tR=13,353 min), глицерин (tR=7,730 min), ксилит (tR=18,205 min)), 4 сахара (D-фруктоза (tR=19,018 min), D-фруктопироноза (tR=19,970 min), галактопироноза (tR= 21,699 min), сахароза (tR=21,699 min)), 2 вещества антоциановой природы (tR= 20,138 и 21,394 min), галловая кислота (tR=22,729 min), изофлавон, 2 жирных кислоты (пальмитиновая (tR= 23,982, 25,270 min), стеариновая (tR= 26,937, 27,042, 27,476 min)), риботимидин (tR=31,495 min), и фитостерол (tR=42,355 min), а также различные органические кислоты (пирослизевая кислота (tR=4,839 min)) (табл. 1).
Таблица 1
Результаты ГХ-МС анализа травы горца почечуйного
Table 1
Results GC-MS analysis of herb polygonum persicaria
№ п/п | Время удерживания | Площадь пика, % | Идентифицированное соединение |
1 | 4,839 | 4,55 | Пирослизиевая кислота |
2 | 6,736 | 1,6 | Мочевина |
3 | 6,96 | 1,56 | Диэтиленгликоль |
4 | 7,73 | 100 | Глицерин |
5 | 10,734 | 3,02 | Гидрокоричная кислота |
6 | 13,171 | 1,01 | Ванилиновая кислота |
7 | 13,353 | 14,92 | Эритритол |
8 | 18,205 | 32,16 | Ксилит |
9 | 18,975 | 1,52 | Не идентифицировано |
10 | 19,081 | 2,76 | D-фруктоза |
11 | 19,97 | 25,48 | D-фруктофураноза |
12 | 20,138 | 5,7 | Не идентифицировано |
13 | 20,194 | 4,83 | Не идентифицировано |
14 | 21,349 | 3,44 | Антоцианы |
15 | 21,699 | 26,96 | Галактопираноза |
16 | 22,224 | 13,37 | Не идентифицировано |
17 | 22,518 | 2,73 | Не идентифицировано |
18 | 22,624 | 3,3 | Не идентифицировано |
19 | 22,729 | 2,13 | Галловая кислота |
20 | 23,513 | 18,85 | Талоза |
21 | 23,982 | 31,74 | Пальметиновая кислота |
22 | 25,27 | 6,44 | Маргариновая кислота |
23 | 26,937 | 51,89 | Линолевая кислота |
24 | 27,042 | 62,67 | Стеариновая кислота |
25 | 27,476 | 5,21 | Стеариновая кислота |
26 | 28,372 | 2,41 | Не идентифицировано |
27 | 30,025 | 1,5 | Не идентифицировано |
28 | 30,452 | 5,62 | Не идентифицировано |
29 | 30,529 | 2,2 | Не идентифицировано |
30 | 31,495 | 11,19 | Риботимидин |
31 | 31,67 | 1,79 | Не идентифицировано |
32 | 31,817 | 2,85 | Не идентифицировано |
33 | 33,428 | 16,57 | Не идентифицировано |
34 | 33,638 | 8,83 | Не идентифицировано |
35 | 33,981 | 1,88 | Не идентифицировано |
36 | 34,506 | 4,23 | Не идентифицировано |
37 | 34,688 | 27,87 | Сахароза |
38 | 35,031 | 4,11 | Не идентифицировано |
39 | 35,241 | 1,88 | Не идентифицировано |
40 | 35,353 | 1,64 | Не идентифицировано |
41 | 35,549 | 2,19 | Не идентифицировано |
42 | 36,775 | 2,8 | Не идентифицировано |
43 | 36,936 | 1,8 | Не идентифицировано |
44 | 37,272 | 6,34 | Не идентифицировано |
45 | 37,678 | 9,3 | Не идентифицировано |
46 | 37,93 | 2,74 | Не идентифицировано |
47 | 38,252 | 1,46 | Не идентифицировано |
48 | 38,378 | 0,76 | Не идентифицировано |
49 | 38,805 | 2,61 | Не идентифицировано |
50 | 39,659 | 1,34 | Катехин |
51 | 39,862 | 2,02 | Не идентифицировано |
52 | 40,037 | 2,14 | Не идентифицировано |
53 | 40,444 | 3,83 | Не идентифицировано |
54 | 40,577 | 1,4 | Не идентифицировано |
55 | 41,088 | 1,42 | Не идентифицировано |
56 | 41,977 | 3,53 | Не идентифицировано |
57 | 42,355 | 5,77 | Фитостерол |
58 | 42,852 | 2,53 | Не идентифицировано |
59 | 43,104 | 36,21 | Не идентифицировано |
60 | 43,706 | 1,15 | Не идентифицировано |
61 | 44,575 | 1,22 | Не идентифицировано |
62 | 45,828 | 2,34 | Не идентифицировано |
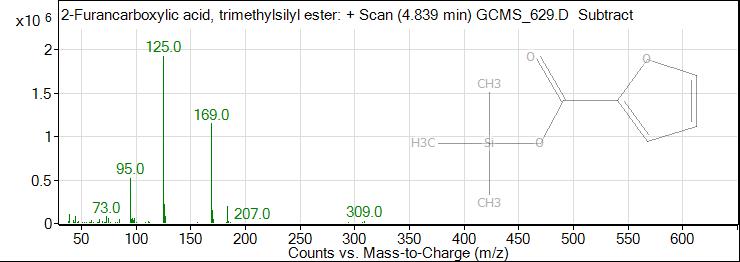
Рис. 1. ГХ-МС хроматограмма пирослизиевой кислоты
Fig. 1. GC-MS chromatogram of pyroslizic acid
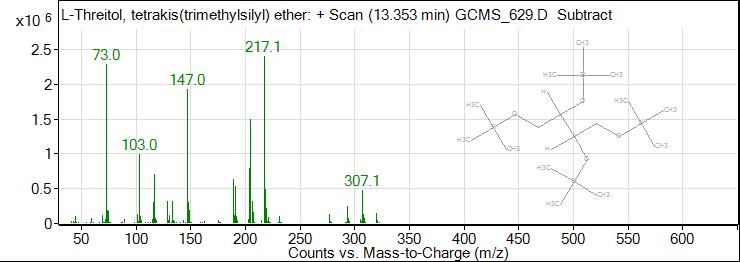
Рис. 2. ГХ-МС хроматограмма эритрола
Fig. 2. GC-MS chromatogram of erythrol
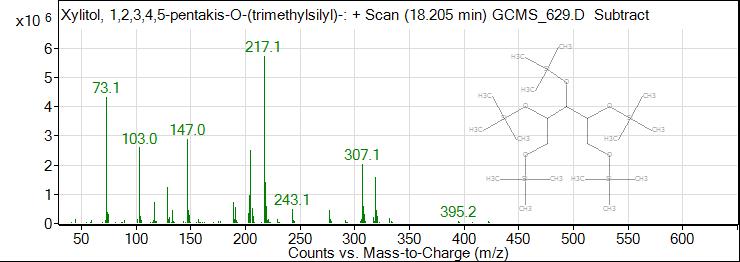
Рис. 3. ГХ-МС хроматограмма ксилитола
Fig. 3. GC-MS chromatogram of xylitol
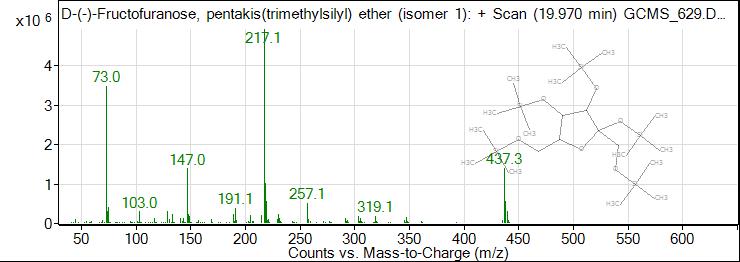
Рис. 4. ГХ-МС хроматограмма фруктофуранозы
Fig. 4. GC-MS chromatogram of fructofuranose
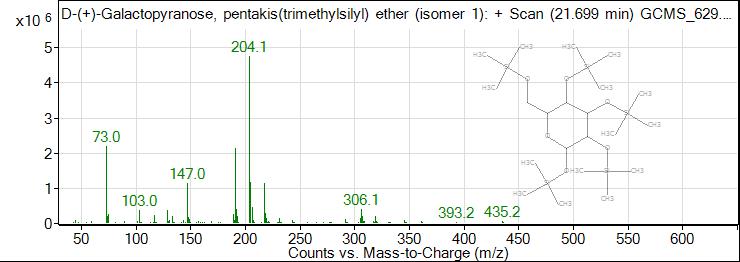
Рис. 5. ГХ-МС хроматограмма галактопиранозы
Fig. 5. GC-MS chromatogram of galactopyranose
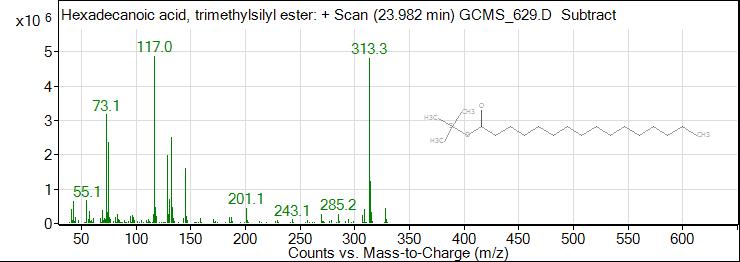
Рис. 6. ГХ-МС хроматограмма пальмитиновой кислоты
Fig. 6. GC-MS chromatogram of palmitic acid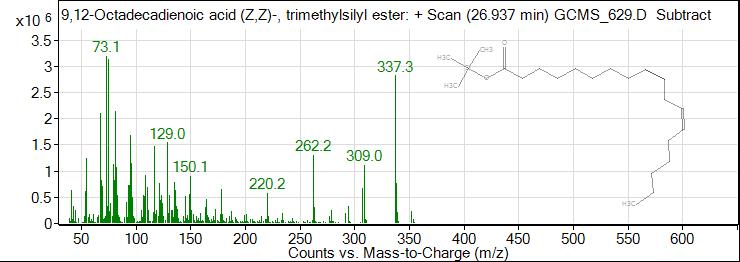
Рис. 7. ГХ-МС хроматограмма линолевой кислоты
Fig. 7. GC-MS chromatogram of linoleic acid
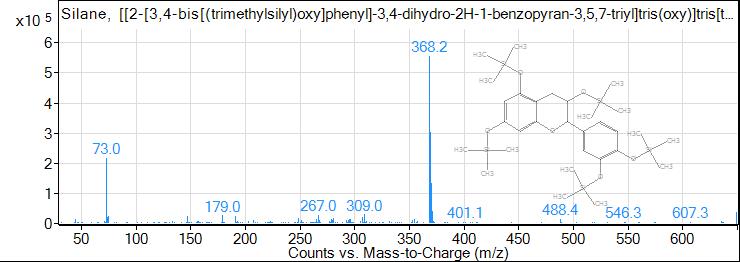
Рис. 8. ГХ-МС хроматограмма катехина
Fig. 8. GC-MS chromatogram of catechin
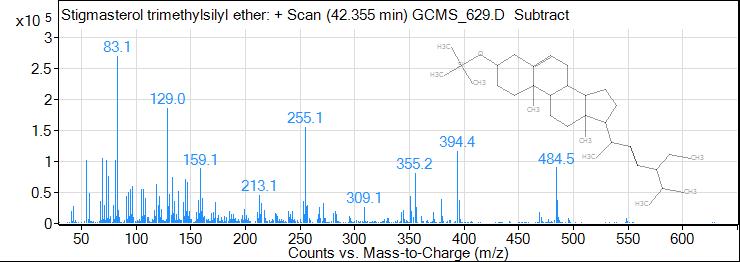
Рис. 9. ГХ-МС хроматограмма фитостерола
Fig. 9. GC-MS chromatogram of phytosterol
Анализируя полученные данные, необходимо отметить, что определение структуры входящих в состав травы горца почечуйного фенольных соединений по осколочным ионам может быть затруднено ввиду сходства путей фрагментации, а также тем, что массы молекулярных ионов триметилсилил-производных ди- и три- кофеилхинных кислот довольно велики, поэтому их идентификация с помощью ГХ-МС лимитируется более подробными исследованиями и вероятно возможностями масс-спектрометра.
Метод ГХ – МС подходит для определения структуры соединений, массы молекулярных ионов которых не столь велики – например, сахаров, как свободных, так и входящих в структуру сложных молекул.
Так как площадь пика на масс-хроматограмме может косвенно служить для определения уровня компонента в пробе, из таблицы 1 видно, что трава горца почечуйного содержит большое количество различных сахарных остатков, а также стероидных соединений и жирных кислот.
Заключение
Впервые для анализа компонентного состава травы горца почечуйного применен метод ГХ-МС. Показана возможность использования метода ГХ-МС для анализа углеводного состава растительного сырья. В результате работы идентифицированы сахарные компоненты травы горца почечуйного: эритритол, глицерин, ксилит, D-фруктоза, галактопироноза, сахароза; фенольные соединения – галловая кислота, изофлавон; стероидные соединения, фитостерол и жирные кислоты – пальметиновая, линолевая, стеариновая кислоты и другие соединения.
В отношении данной статьи не было зарегистрировано конфликта интересов.





















Список литературы