Эффект полиморфизма генов IL10 (rs1800872) и CXCL10 (rs4386624, rs4256246) в развитии инфекционных заболеваний вирусной и бактериальной природы
Aннотация
Актуальность: Контакт человека с патогенными микроорганизмами является необходимым, но недостаточным условием для развития болезни. Иммунный ответ на внедрение патогена в значительной степени контролируется генетическими факторами, исследование которых актуально в связи с высокой распространенностью инфекционных заболеваний, таких как туберкулез (ТБ) и вирусный гепатит С (ХВГС). Цель исследования: Изучить ассоциации полиморфных вариантов генов противоинфекционного иммунного ответа IL10 (rs1800872) и CXCL10 (rs4386624, rs4256246) в развитии инфекционных заболеваний разной этиологии. Материалы и методы: Генотипирование выполнено у пациентов с туберкулезом легких (n=304), вирусным гепатитом С (n=184) и относительно здоровых индивидов (n=255) путем реал-тайм ПЦР с помощью TaqMan-зондов и рестрикционного анализа. Оценку ассоциаций осуществляли с помощью критерия χ2 или точного критерия Фишера. Различия считались значимыми при р<0,05. Результаты: Полиморфизм генов IL10 (rs1800872) и CXCL10 (rs4256264) ассоциирован с развитием инфекционных заболеваний различной этиологии. Генотипы «АС» и «АА» гена IL10 (rs1800872) являются «неблагоприятными» в отношении индукции иммунного ответа на воздействие микобактерии туберкулеза и вируса гепатита С. Частота встречаемости данных генотипов выше в группах больных (ХВГС – 43,1%, р=0,033; ТБ – 44,0% р=0,013) по сравнению с контролем (32,2%). Генотипы «АG» и «GG» гена CXCL10 (rs4256264) так же ассоциированы с изученными инфекционными заболеваниями и распространены с большей частотой в группах больных (ХВГС – 100%, р=0,0079; ТБ – 99,3%, р=0,023) по сравнению с контролем (96,2%). Заключение: Функционально значимые варианты в генах IL10 (rs1800872) и CXCL10 (rs4256264) являются перспективными прогностическими маркерами недостаточности иммунного ответа при воздействии инфекционных агентов бактериальной и вирусной природы.
Введение. Исследования последних нескольких десятков лет показали регулирующую роль цитокинов и хемокинов в иммунном ответе при различных патологических процессах. В зависимости от воздействующего этиологического фактора различается спектр и уровень синтезируемых сигнальных молекул. В частности, важную роль в развитии, течении и исходе бактериальных и вирусных инфекций играет IL10. При туберкулезе легких IL10 ограничивает развитие адекватного иммунного ответа на M. tuberculosis, способствуя повышению восприимчивости к инфекции и устойчивости к противотуберкулезной терапии [1]. Активная форма туберкулеза коррелирует с повышением уровня IL-10 в плевральной жидкости, бронхоальвеолярном лаваже и мокроте [2]. При вирусной инфекции, в том числе при вирусном гепатите С, IL-10 ослабляет продукцию цитокинов Th1, тем самым угнетая развитие противовирусного иммунного ответа [3]. Хемокины так же являются ранними медиаторами воспаления и определяют исход дальнейших реакций организма хозяина на внедрение патогена. При заболеваниях печени показано, что хемокины CXCL10, CXCL11 и CXCL12 являются маркерами воспаления и интенсивности фиброгенеза [4]. При туберкулезе уровень CXCL10 в плазме крови рассматривается как предиктор активной фазы инфекции [5].
Наблюдается высокая гетерогенность в продукции цитокинов и хемокинов у больных, что является одной из причин различий в течении, исходе заболевания и ответе на терапию. В качестве этиологического фактора данного явления рассматривается генетический статус человека, в частности, структурный полиморфизм генов, продукты которых участвуют в патогенезе заболевания. Полиморфные варианты могут использоваться в качестве маркеров для ранней диагностики, особенностей течения, прогнозирования исходов заболевания и ответа на терапию.
Цель исследования. Поиск ассоциаций полиморфных вариантов генов IL10 и CXCL10 с туберкулезом и хроническим вирусным гепатитом С и оценка их регуляторного потенциала с помощью биологических баз данных.
Материалы и методы исследования. В исследование были включены больные туберкулезом легких (ТБ) (304 человека, 197 мужчин и 107 женщин) среднего возраста 30,03±16,12 лет и хроническим вирусным гепатитом С (ХВГС) (184 пациента (130 мужчин и 54 женщины) среднего возраста 40,2±13,9 лет. Формирование выборки пациентов с туберкулезом легких производилось на базе структурных подразделений ОГБУЗ «Томский фтизиопульмонологический медицинский центр». Диагноз туберкулеза легких устанавливался на основании общепринятых критериев. Выборка пациентов с ХВГС была сформирована на базе отделения гастроэнтерологии Областной клинической больницы г. Томска. Диагноз ХВГС был поставлен на основании наличия РНК вируса HCV в крови.
Контрольная группа сформирована относительно здоровыми лицами соответствующего пола и возраста без ХВГС и ТБ в анамнезе (n=255), из которых 60 мужчин и 194 женщины (средний возраст – 44,83 ±21,66).
Все обследованные относятся к славянскому населению г. Томска и Томской области. Протокол исследования одобрен этическим комитетом НИИ медицинской генетики. Для всех участников получены информированные согласия.
В работе использованы образцы ДНК, экстрагированные стандартным методом фенол-хлороформной экстракции из образцов венозной крови. Подбор праймеров осуществлен с помощью программы Primer3 v 0.4.0, доступной онлайн по адресу http://frodo.wi.mit.edu/primer3/. Процедура генотипирования для вариантов генов CXCL10 проведена с помощью ПЦР в режиме реального времени с использованием TaqMan-зондов на амплификаторе CFX96 Touch (“BioRad Laboratories”, США). Для генотипирования полиморфизма гена IL10 (rs1800872) использовали ПЦР-ПДРФ анализ как описано ранее [6].
Анализ различий качественных признаков и частот аллелей и генотипов в двух независимых группах выполняли при помощи критерия χ2 или точного критерия Фишера с двусторонней доверительной вероятностью для таблиц сопряженности 2х2 и его расширения для таблиц большей размерности. При объединении генотипов различия между группами рассчитывали с помощью критерия χ2 для таблиц сопряженности 2х2, а также использовали показатели отношения шансов (OR) с 95% доверительным интервалом. Статистические гипотезы при сравнительном анализе данных проверяли на 5%-ном уровне значимости.
Регуляторный потенциал изученных SNP оценивали с помощью онлайн сервисов rSNPBase (http://rsnp.psych.ac.cn/) и HaploReg (v4.1) (http://archive.broadinstitute.org/mammals/haploreg/haploreg.php). Влияние полиморфизма на экспрессию генов (eQTL) оценивали с помощью данных проекта Genotype-Tissue Expression (GTEx) (http://www.gtexportal.org/) и онлайн сервиса Blood eQTL (https://genenetwork.nl/bloodeqtlbrowser/).
Исследования выполнены на базе Центра коллективного пользования научно-исследовательским оборудованием и экспериментальным биологическим материалом «Медицинская геномика» НИИ медицинской генетики Томского НИМЦ.
Результаты и их обсуждение. Проведенное исследование показало, что распределение частот генотипов по всем изученным локусам во всех в группах больных туберкулезом, ХВГС и контрольной группе соответствовало ожидаемому при равновесии Харди-Вайнберга. Полиморфные варианты генов IL10 (rs1800872) и CXCL10 (rs4256264) показали ассоциации с туберкулезом и ХВГС (Таблица 1). Показано что, несмотря на различие этиологических факторов, приводящих к развитию ТБ и вирусного гепатита, ассоциации к данным патологиям показали одни и те же генотипы и аллели. Так, предрасполагающими к развитию обоих инфекционных заболеваний, являются аллель «А» варианта гена IL10 (rs1800872) и генотипы, несущие данный аллель в гомо- и гетерозиготном состоянии. Протективным относительно развития ТБ и хронизации вирусного гепатита С является генотип «АА» гена CXCL10 (rs4256264) (Таблица 1). Полиморфный вариант rs4386624 гена CXCL10 не показал ассоциаций с изученными патологиями.

Интерлейкин-10, как модулятор противовоспалительного иммунного ответа, играет существенную роль в поддержании баланса про- и противовоспалительных факторов, влияя на развитие, течение и исход многих заболеваний. В случае инфекционных заболеваний, таких как туберкулез и вирусный гепатит экспрессия IL10 приводит к прямо противоположным эффектам. С одной стороны, IL10 подавляет воспалительный ответ, тем самым ограничивая повреждения тканей, с другой – сверхэкспрессия IL10 может иметь негативное влияние на способность контролировать инфекцию [7]. Так, было показано, что при вирусных гепатитах IL10 влияет на восприимчивость к инфекции, спонтанный клиренс и вызванную лечением эрадикацию вируса, обладает антифиброзными свойствами и играет роль в прогрессировании заболеваний печени [8].
Уровни IL-10 сильно различаются между людьми, возможно из-за наличия полиморфных вариантов в нуклеотидной последовательности гена IL-10, которые связаны с дифференциальной экспрессией соответствующего цитокина. Полиморфизм гена IL10 ассоциирован с развитием многих, связанных с нарушением иммунитета болезней (сахарный диабет, рассеянный склероз, бронхиальная астма, туберкулез, острый и хронический гепатит и т.д.), что подтверждает основную идею о том, что геномная регуляция экспрессии IL10 является основой успеха воспалительных реакций. Селективное давление на выбор аллелей гена IL10 со стороны различных патогенов в процессе эволюции позволило сформировать разные структуры гаплотипических блоков, которые в значительной степени влияют на уровень продукции этого цитокина [9]. Изученная в данном исследовании однонуклеотидная замена G>A IL10 (rs1800872) располагается в промоторном регионе гена [http://www.ensembl.org/] и входит в состав гаплотипа (–1082G/A (rs1800896), –819C/T (rs1800871), –592C/A (rs1800872)), ассоциированного с широким спектром заболеваний, включая инфекционные, аутоиммунные и некоторые виды рака [10, 11]. Информация о том, какой именно аллель/генотип rs1800872 гена IL10 влияет на восприимчивость к туберкулезу и ХВГС, противоречива. Так, мета-анализ исследований связи вышеописанных трех промоторных полиморфных вариантов с туберкулезом показал наличие феномена этностпецифической генетической подверженности к заболеванию. Было показано, что rs1800896 ассоциирован с ТБ у европеоидов и не связан с заболеванием в популяциях Азии и Африки [12, 13]. Варианты rs1800871 и rs1800872 напротив ассоциированы с ТБ только в азиатских популяциях [12]. Тем не менее, результаты настоящего исследования показали ассоциацию аллеля «А» и генотипов «АС» и «АА» rs1800872 с ТБ у европеоидов Сибирского региона, что согласуется с ранее опубликованными данными, полученными на выборке меньшего размера [6].
Мета-анализ исследований связи полиморфизма гена IL10 c вирусными гепатитами, проведенный в 2010 году, показал, что генотип «GG» rs1800896 ассоциирован с HCV-инфекцией, тогда как остальные два промоторных SNP - rs1800871 и rs1800872 не вносят вклад в хронизацию вирусного гепатита С [14]. Позднее было показано, что генотип «GG» rs1800896 напротив характеризуется протективным эффектом против HCV, и способствует спонтанному клиренсу инфекции и положительному ответу на терапию у больных в Венгрии [15]. В Индии rs1800871 и rs1800872 ассоциированы с острыми и хроническими гепатитами В и С. Интересным является тот факт, что лица с генотипом «АА» rs1800872 имеют меньшую восприимчивость к острым гепатитам, хронизации HCV и HBV инфекции и развитию тяжелого фиброза печени [16-19]. В Бразилии не было выявлено ассоциаций промоторных полиморфизмов гена IL10 с HCV инфекцией [20]. Результаты настоящего исследования не согласуются с данными, полученными в Индии, и показывают, что с HCV-инфекцией ассоциирован аллель «А» rs1800872 и генотипы, несущие данный аллель в гомо и гетерозиготном состоянии. Результаты настоящего исследования показали, что аллель «А» rs1800872 является неблагоприятным в отношении развития как ХВГС так и ТБ.
Хемокины наряду с цитокинами играют важную роль во многих патофизиологических процессах, при инфекционных, аутоиммунных и других заболеваниях. Уровень хемокинов CXCL10, CXCL11 и CXCL12 в сыворотке крови может различаться в зависимости от выраженности ответа на инфекцию [4]. Повышение уровня CXCL10 в крови наблюдается при многих заболеваниях, включая аутоиммунные, онкологические, инфекционные, в том числе вирусные гепатиты и туберкулез [21, 22]. Уровень CXCL10 в крови отражает экспрессионую активность интерферон-стимулированных генов, что напрямую связано с активностью фибротических процессов в печени и вирусологическим ответом на противовирусную терапию [23].
Ген CXCL10 кодирует хемокин 10 с C-X-C мотивом, также известный как интерферон гамма-индуцированный белок 10, который связывается с рецептором CXCR3 на активированных T-лимфоцитах, клетках естественных киллеров, макрофагах и других типах клеток. Структурный полиморфизм гена CXCL10 гена может быть одним из факторов, определяющих предрасположенность к инфекционным заболеваниям. Так, полиморфные варианты rs1439490 и rs1440802 гена CXCL10 влияют на восприимчивость к вирусным гепатитам В и С, хронизацию и скорость прогрессирования инфекции в Китае [24]. Полиморфные варианты гена CXCL10 (rs4386624 и rs4256246), изученные в настоящем исследовании, ранее рассматривались только на предмет ассоциаций с ТБ у китайцев, но не показали ассоциаций с заболеванием [25].
Анализ онлайн сервисов rSNPBase, HaploReg(v4.1) GTExPortal, и Blood eQTL, проведенный в настоящем исследовании, показал, что изученные полиморфные варианты являются регуляторными SNP (rSNP), изменяющими аффинность связывания транскрипционных факторов, и cis-eQTL локусами, участвующими в регуляции уровня экспрессии различных генов. Например, полиморфный вариант rs1800872 гена IL10 располагается в регионе активных хроматиновых доменов, которые формируются посредством эпигенетической модификации (метилированные – H3K4me3 и ацетилированные H3K9ac) гистонов, и являются «метками» активных промоторов в клетках крови. Наличие аллеля «А», показавшего ассоциации с ТБ и ХВГС в настоящем исследовании, приводит к увеличению эффективности связывания ДНК с транскрипционным факторам T3R и уменьшению уровня экспрессии гена IL10.
Варианты rs4386624 и rs4256246 гена CXCL10 так же являются регуляторными и влияют на связывание эпигенетически модифицированных гистонов в регионах расположения активных промоторов и энхансеров в мононуклеарах. Аллель «С» rs4386624 увеличивает эффективность связывания транскрипционного фактора HMGIY, а аллель «А» rs4256246 снижает эффективность связывания транскрипционного фактора Pou3f1. Кроме этого, генотип «АА» данного локуса, который, по результатам настоящего исследования, является протективным относительно развития ТБ и ХВГС, связан с изменением уровня экспрессии разных генов в различных тканях, а именно: – повышением уровня экспрессии гена нуклеопорина 54 (NUP54) в тканях легких и печени; – повышением уровня экспрессии гена ADP-рибозилтрансферазы 3 (ART3) в гипофизе и понижением уровня экспрессии этого гена в поджелудочной железе; – повышением уровня экспрессии гена CXCL11 в поджелудочной железе (рисунок 1.).
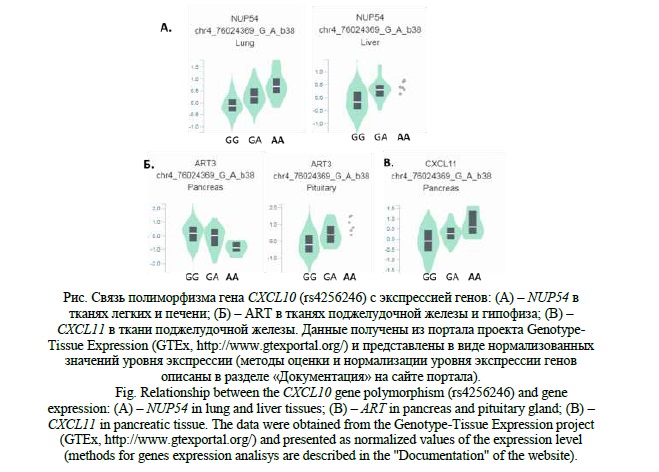
Регуляция экспрессии гена CXCL11 так же связана с хемокиновым ответом организма на внедрение патогена и участие данного белка в патогенезе ТБ, ХВГС и других инфекционных заболеваний достаточно логично. На модельных объектах было показано, что при инфицировании макрофагов внутриклеточным патогеном Mycobacterium marinum наблюдается сверхэкспрессия гена cxcl11aa, который является гомологом гена CXCL11 человека, что приводит к активации врожденного иммунного ответа [26]. При ХВГС уровни CXCL10, CXCL11 и CXCL12 повышаются по мере прогрессирования фиброза печени и данные хемокины предложено использовать в качестве биомаркеров интенсивности фибротических процессов [4].
Связь генов NUP54 и ART3 с изученными заболеваниями остается до настоящего времени не изученной. Результаты некоторых исследований говорят о возможной связи данных белков с заболеваниями. Так, показано, что ядерный поровый комплекс, к которому относится нуклепорин 54, является важной детерминантой в поддержании целостности генома и чувствительности к агентам, вызывающим разрывы ДНК [27]. Экспериментальные исследования показали, что при заражении гриппом полимераза вируса связывается с различными белками клетки хозяина, в числе которых находится нуклеопорин 54, понижение уровня экспрессии которого приводит к снижению репликации вируса [28].
Биологическая функция ADP-рибозил-трансферазы 3, кодируемой геном ART3 в развитии инфекционных заболеваний пока остается непонятной, но известно, что члены семейства рибозил-трансфераз ART1, ART3 и ART4 обладают способностью реагировать на стимуляцию моноцитов компонентами клеточной стенки бактерий и могут играть решающую роль во врожденном иммунном ответе [29, 30].
Заключение. Результаты настоящего исследования показали, что полиморфные варианты генов IL10 (rs1800872) и CXCL10 (rs4256246) ассоциированы с развитием как бактериальной (туберкулез), так и вирусной (ХВГС) инфекций. Причем, с обоими инфекционными заболеваниями, независимо от природы возбудитея, ассоциированы одни и те же аллели и генотипы. Так, «неблагоприятным» относительно развития ТБ и ХВГС является аллель «А» и генотипы «АС» и «АА», связанные с пониженной экспрессией гена. Полученные данные не согласуются с предположением, о том, что пациенты с ХВГС, которые вырабатывают высокие уровни IL-10, имеют меньшую способность контроля инфекции, а у пациентов с низкой секрецией IL-10 наблюдается лучшая способность устранять инфекцию [3]. «Неблагоприятным» относительно развития ТБ и ХВГС явялются генотипы «GG» и «AG» гена CXCL10 (rs4256246), которые связаны с пониженной экспрессией хемокина CXCL11 и нуклеопорина 54, а так же разнонаправленной экспрессией гена рибозил-трансферазы ART3 в разных тканях. Поскольку rs4256246 влияет на изменение уровня экспрессии генов различных функциональных классов, кроме хемокинов, возможно их участие в патогенезе вирусных и бакетриальных инфекций, что требует дальнейшего изучения. На основании полученных результатов можно предположить, что функционально значимые варианты в генах IL10 (rs1800872) и CXCL10 (rs4256264) являются перспективными прогностическими маркерами недостаточности иммунного ответа при воздействии инфекционных агентов бактериальной и вирусной природы.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Работа проведена в рамках выполнения Государственного задания Министерства науки и высшего образования № 075-00603-19-00 (Федеральное государственное бюджетное научное учреждение «Томский национальный исследовательский медицинский центр Российской академии наук»).





















Список литературы