Молекулярно-генетические детерминанты преэклампсии
Aннотация
Актуальность: Преэклампсия (ПЭ) продолжает оставаться одним из наиболее тяжелых осложнений беременности. В формирование ПЭ вовлечены молекулярно-генетические факторы. Цель исследования:Изучить вовлеченность полиморфизма rs3798577, rs2234693 и rs9340799 гена ESR1 в формирование преэклампсии. Материалы и методы:Группу для исследования составили 190 беременных с ПЭ и 324 женщины с физиологическим течением беременности (контрольная группа). Клиническое и клинико-лабораторное обследование беременных проводилось на сроке родоразрешения в Перинатальном центре областной клинической больницы Святителя Иоасафа г.Белгорода. Генотипирование полиморфных локусов rs3798577, rs2234693 и rs9340799 гена ESR1 проводилось методом полимеразной цепной реакции синтеза ДНК с использованием соответствующих праймеров и зондов, меченных флюорохромами. Изучение ассоциаций исследуемых генетических маркеров и их эпистатических взаимодействий с развитием ПЭ осуществлялось методом логистической регрессии в программе PLINK v. 2.050. Результаты:Взаимодействие полиморфных вариантов rs9340799 x rs3798577 гена ESR1 имеет протективное значение для развития преэклампсии (OR=0,56, p=0,004, pbonf=0,012). Данные полиморфные локусы и сильно сцепленные (r2≥0,8) с rs9340799 шесть SNPs имеют значимые регуляторные эффекты: находятся в области более 20 регуляторных мотивов ДНК к факторам транскрипции Foxa, Foxd1, Foxf2, Foxj1, Foxk, Foxo, HDAC2, Sox, TCF12, p300 и др., локализованы в локусах ДНК, взаимодействующих с регуляторными белками (NRSF, SIN3AK20, TCF12), расположены в регионе модифицированных гистонов, маркирующих энхансеры и промоторы, регионе гиперчувствительности к ДНКазе 1 в более 30 различных культурах клеток, тканях и органах, патогенетически значимых для развития ПЭ. Заключение:Эпистатическое взаимодействие полиморфных локусов rs9340799 x rs3798577 гена ESR1 ассоциировано с развитием ПЭ
Введение. Одним из наиболее тяжелых осложнений беременности до настоящего времени остается преэклампсия (ПЭ) [1, 2]. Ежегодно около 40000 рожениц могут умереть из-за преэклампсии и эклампсии [3]. У новорожденных, родившихся у матерей с преэклампсией чаще выявляются врожденные аномалии развития и генетическая патология, отмечаются метаболические нарушения, выше риск инфекционных состояний и гематологических нарушений [4]. Причем тяжесть состояния новорожденных, риск неонатальных осложнений, тяжесть течения инфекционных процессов, гипоксически-ишемических состояний имеют прямую корреляционную зависимость от сроков возникновения и тяжести преэклампсии [4].
Несмотря на многочисленные проведенные исследования ПЭ различными как отечественными, так и зарубежными научными коллективами данное осложнение беременности остается одной из актуальных нерешенных научно-практических проблем в мировом акушерстве. Сложные многофакторные механизмы развития ПЭ, известные к настоящему времени (эндотелиальная дисфункция, глубокие расстройства со стороны сосудистой системы, гемодинамики и микроциркуляции, иммунитета, гемостаза, плацентарная недостаточность, аномальная активация белков системы комплемента с развитием тромботической микроангиопатии, различные нарушения функции печени, почек, легких и др.) [5-8], предполагающие вовлеченность в ее формирование различных факторов риска (генетических, экологических, медицинских, социальных и др.) [1, 8-10] не позволяют дать однозначного ответа о причинах развития ПЭ и соответственно предложить эффективные меры ее профилактики. Одним из перспективных маркеров которые могут быть использованы для формирования среди женщин группы риска по развитию ПЭ являются молекулярно-генетические маркеры [9-14]. Использование генетических детерминант в качестве эффективных маркеров для выделения группы риска по развитию ПЭ определяется их вовлеченностью в этиопатогенез этого осложнения беременности. При этом следует учитывать что наиболее эффективное значение в выделении группы риска эти маркеры будут иметь в тех этно-территориальных группах женщин, для которых установлена их значимая роль в развитии ПЭ. Поэтому одной из актульных задач современных исследований в области акушерства является поиск молекулярно-генетических маркеров генов-кандидатов, ассоциированных с развитием ПЭ в различных этнических и территориальных группах, которые в последующем можно было бы использовать в практическом здравоохранении для формирования среди женщин группы риска по развитию ПЭ в прегравидарный период или в ранние сроки беременности и реализации мероприятий по профилактике этого осложнения беременности в этих группах риска.
Цель исследования. Изучить вовлеченность полиморфизма rs3798577, rs2234693 и rs9340799 гена ESR1 в формирование преэклампсии.
Материалы и методы исследования. Группу для исследования составили 190 беременных с ПЭ и 324 женщины с физиологическим течением беременности (контрольная группа). Общий объем исследуемой выборки составил 514 женщин. В работу включались (критерии включения) индивидуумы русской национальности, проживающие в Белгородской области, родившиеся в Центральном Черноземье России, не являющиеся родственниками. Критерии исключения из исследуемых выборок: наличие заболеваний матки (фибромиома матки, аномалии развития внутренних половых органов), патологии беременности (аномалии прикрепления и расположения плаценты, резус-конфликт, плацентарная недостаточность с синдромом задержки развития плода), патологии плода (врожденные аномалии развития), многоплодной беременности.
Диагноз ПЭ ставился на основании наличия генерализованных отеков, артериальной гипертензии и протеинурии. В контрольную группу включались беременные без диагноза ПЭ. Клиническое и клинико-лабораторное обследование беременных проводилось на сроке родоразрешения в Перинатальном центре областной клинической больницы Святителя Иоасафа г.Белгорода. Выборки формировались за период с 2008 по 2015гг. Средний возраст беременных с ПЭ составил 26,88±5,37 лет, контрольной группы - 26,27±4,88 (р>0,05). Исследование проводилось под контролем этического комитета медицинского института Белгородского государственного национального исследовательского университета. От каждой женщины, включенной в исследование, предварительно было получено информированное согласие на его проведение.
В исследуемых группах женщин (с ПЭ и контрольная группа) проведено молекулярно-генетическое исследование трех полиморфных локусов гена рецептора эстрогена 1 типа – rs3798577, rs2234693 и rs9340799 ESR1. Полиморфные локусы включались в исследование в соответствии с их значимым регуляторным потенциалом. Генотипирование проводилось методом полимеразной цепной реакции синтеза ДНК с использованием соответствующих праймеров и зондов, меченных флюорохромами.
Сравнение частот генетических маркеров между беременными с ПЭ и контрольной группой производилось в таблицах сопряженности 2х2 в программном обеспечении «STATISTICA for Windows 6.0». Изучение ассоциаций исследуемых генетических маркеров и их эпистатических взаимодействий с развитием ПЭ осуществлялось методом логистической регрессии в программе PLINK v. 2.050 (http://zzz.bwh.harvard.edu/plink/).
Функциональное значение рассматриваемых полиморфных локусов и сильно сцепленных с ними SNPs (r2≥0,8) изучалось с помощью программы HaploReg (v4.1) (http://archive.broadinstitute.org/mammals/haploreg/haploreg.php).
Результаты и их обсуждение. Проведенный анализ наблюдаемого распределения генотипов по полиморфным локусам rs3798577, rs2234693 и rs9340799 гена ESR1 среди беременных с ПЭ и в контрольной группе показал его соответствие ожидаемому распределению согласно равновесия Харди-Вайнберга (pHWE>0,05) (таблица 1). Достоверных различий в частотах аллелей и генотипов по изучаемым полиморфизмам у беременных с ПЭ и в контрольной группе не выявлено (p>0,05) (таблица 1).
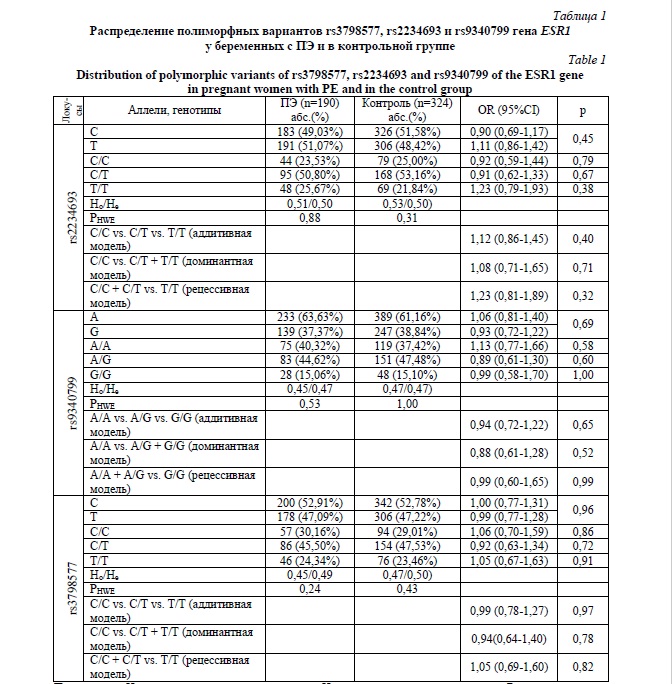
Примечание: Ho – наблюдаемая гетерозиготность, He – ожидаемая гетерозиготность, РHWE – показатель, характеризующий соответствие наблюдаемого распределения генотипов ожидаемому при равновесии Харди-Вайнберга, OR – показатель отношения шансов, 95%CI –его 95% доверительный интервал, р – уровень значимости.
Note: Ho – the observed heterozygosity, He – expected heterozygosity, РHWE – an indicator characterizing the correspondence of the observed distribution of genotypes to the expected one at Hardy-Weinberg equilibrium, OR – the odds ratio indicator, 95%CI – its 95% confidence interval, р – the significance level
На следующем этапе исследования нами были изучены SNPxSNP взаимодействия, ассоциированные с развитием ПЭ. В результате этого анализа установлено статистически значимое эпистатическое взаимодействие полиморфных локусов rs9340799 x rs3798577 (OR=0,56, p=0,004, с учетом поправки Бонферрони на количество возможных двух-локусных моделей с участием 3SNPs pbonf=0,012), ассоциированное с развитием ПЭ. Таким образом, эпистатическое взаимодействие полиморфных вариантов rs9340799 и rs3798577 гена ESR1 имеет протективное значение для развития ПЭ.
Далее с помощью биоинформатического программного обеспечения программы HaploReg (v4.1) проведено изучение функционального значения ПЭ-значимых полиморфных локусов и сильно сцепленных с ними SNPs. Установлено, что полиморфизм rs3798577, находящийся в регионе 3'-UTR гена ESR1 имеет значимый регуляторный потенциал – он расположен в регионе модифицированных гистоновых белков (H3K4me3 и H3K9ac), маркирующих промоторы в адипоцитах, скелетной мышечной ткани женщин, культуре клеток мышечных сателлитов, культуре мезенхимальных стволовых клеток, предшественников жировой ткани и др. Так же этот полиморфный локус находится в регионе модифицированных гистоновых белков (H3K4me1 и H3K27ac), маркирующих энхансеры в более 30 различных культурах клеток, тканях и органах (культуре клеток экто-, энто - и мезодермы, H1 и H9 культурах клеток, предшественников нейронов, мезенхимальных стволовых клетках, мышечной ткани женщин, в различных органах плода (мышечная ткань, сердце, надпочечники, желудок и др.), адипоцитах, головном мозге, яичниках и др.). Следует отметить, что данный полиморфный локус находится в регионе гистоновых белков, маркирующих энхансеры в таких патогенетически значимых для развития ПЭ провизорных органах как амнион и плацента. Сильно сцепленных SNPs (r2≥0,8) с полиморфным локусом rs3798577 нами не установлено.
Результаты изучения функционального значения полиморфизма rs9340799 гена ESR1 и сильно сцепленных с ним 6 SNPs (r2≥0,8) представлены в таблице 2. Полученные данные свидетельствуют о том, что ПЭ-ассоциированный rs9340799 (локализуется в интронном участке гена ESR1) находится в консервативном регионе ДНК и входит в состав двух регуляторных мотивов ДНК (Ets, Hand1). Причем полиморфный вариант G rs9340799 повышает афинность обоих этих регуляторных мотивов ДНК. Среди сильно сцепленных с ним полиморфных локусов (r2≥0,8) наиболее важное регуляторное значение имеет rs62442056 (находится на расстоянии 5kb от полиморфизма rs9340799, r2=0,94, D'=1) – он находится в регионе гиперчувствительности к ДНКазе 1 в 29 различных культурах клеток, тканях и органах (культуре клеток экто-, энто- и мезодермы, мезенхимальных стволовых клетках, мышечной ткани женщин, адипоцитах, головном мозге, яичниках, в различных органах плода (головной мозг плода женского пола, мышечная ткань, сердце, надпочечники и др.), амнионе и плаценте и др.), области ДНК, взаимодействующей с тремя регуляторными белками (NRSF, SIN3AK20, TCF12), регионе 5 регуляторных мотивов ДНК, влияющего на афинность к транскрипционным факторам (CEBPB, Foxa, Foxi1, HDAC2, TCF12). Так же выраженный регуляторный потенциал имеет находящийся в неравновесии по сцеплению с rs9340799 полиморфный локус rs3853251 (находится на расстоянии 2,6 kb от полиморфизма rs9340799, r2=0,94, D'=1). Данный полиморфизм находится в регионе 10 регуляторных мотивов, влияющих на связывание ДНК с транскрипционными факторами Foxa, Foxd1, Foxf2, Foxj1, Foxk, Foxo, HDAC2, Sox, TCF12, p300).
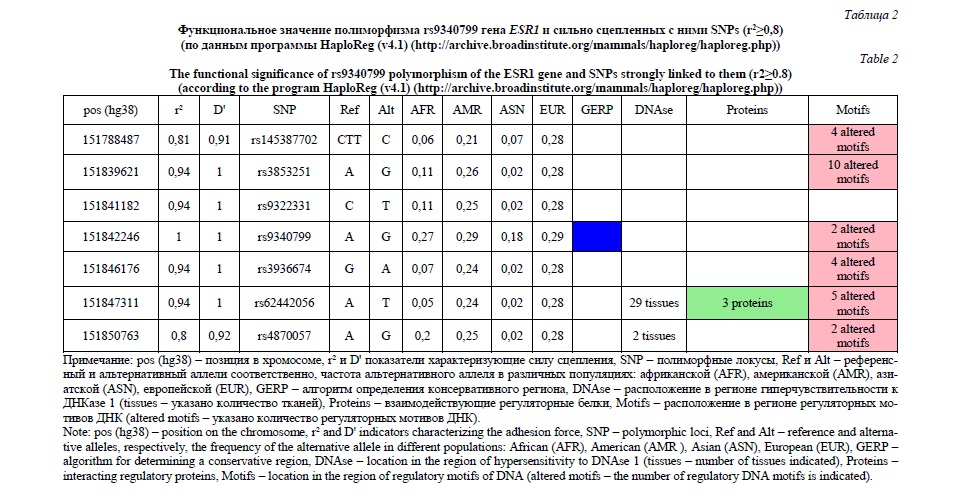
Согласно данных базы GeneCards: The Human Gene Database (http://www.genecards.org/) ген ESR1 кодирует alpha-рецепторы эстрогенов. Данные рецепторы являются трансмембранным белком, в котором С-конец является центром связывания с лигандом, N-конец включает ряд доменов, регулирующих транскрипционную активность ряда генов. Рецепторы эстрогенов (ESR1) потенцируют как различные биологические эффекты эстрогенов в клетках мишенях так и могут активироваться различными факторами роста, инициируя ядерно-ER-опосредованные сигнальные пути, основными из которых являются сигнальные каскады рецептора к тирозинкиназе (RTKs), сигнал-регулируемых внеклеточных киназ (ERK), митоген-активированных протеинкиназ (MAPK) и др. [15], что может иметь важное патогенетическое значение при формировании ПЭ [1-2, 9]. Полученные нами данные согласуются с литературными материалами по этому вопросу. В 2019 г опубликована работа Zhao G. et al. [3], посвященная мета-анализу результатов научных исследований ассоциаций полиморфных локусов rs2234693 (PvuII-397T/C) и rs9340799 (XbaI-351A/G) с формированием преэклампсии легкой и тяжелой степени. Мета-анализ был проведен по материалам 6 работ, представленных в базах данных PubMed, Medline, Embase, China National Knowledge Infrastructure (CNKI) и WanFang до мая 2018 года. Авторы установили, что повышенный риск развития тяжелой преэклампсии связан с полиморфизмом XbaI-351A/G (OR = 1,67, 95% CI = 1,10-2,25, P=0,017 для GG по сравнению с AA+GA; OR = 1,81, 95% CI = 1,17-2,82, P=0,008 для GG по сравнению с GA). На основании полученных данных авторы делают вывод о том, что генотип GG полиморфизма XbaI (rs9340799) гена ESR1 может быть генетическим фактором риска развития тяжелой преэклампсии. Наряду с этим полиморфизм PvuII-397T/C (rs2234693) гена ESR1 не был достоверно связан с риском развития тяжелой преэклампсии. Также не установлено значимых ассоциаций между преэклампсией легкой степени и полиморфизмами PvuII-397T/C и XbaI-351A/G гена ESR1. В ряде работ показана вовлеченность полиморфных локусов гена ESR1 в формирование такого важного показателя, характеризующего функционирование гипоталамо-гипофизарно-яичниковой системы женщины, как возраст менархе [16, 17] и развитие различных нарушений репродуктивной системы женщин (повторные самопроизвольные аборты, бесплодие, рак молочной железы, синдром поликистозных яичников и др.) [18-21]. Следует отметить, что наши результаты дополняют полученные ранее данные о значимой роли молекулярно-генетических факторов в формировании нарушений репродуктивного здоровья женщин Центрального Черноземья России [22-28].
Заключение. Эпистатическое взаимодействие rs9340799 x rs3798577 гена ESR1 ассоциировано с развитием преэклампсии (OR=0,56, pbonf=0,012). Данные полиморфные локусы и сильно сцепленные (r2≥0,8) с rs9340799 шесть SNPs имеют значимые регуляторные эффекты: находятся в области более 20 регуляторных мотивов ДНК, расположены в регионе модифицированных гистонов, маркирующих энхансеры и промоторы, регионе гиперчувствительности к ДНКазе 1 в более 30 различных культурах клеток, тканях и органах, патогенетически значимых для развития ПЭ.
В отношении данной статьи не было зарегистрировано конфликта интересов





















Список литературы