Состояние глутатионового звена антиоксидантной защиты организма при фунгицидной интоксикации и коррекции витамином А и расторопшей
Aннотация
Актуальность: Поступление тирама с пищевой продукцией в ткани, органы животных и человека может приводить к активации процессов свободнорадикального окисления и, как следствие, дисбалансу функционирования системы антиоксидантной защиты организма. Цель исследования: Определение состояния глутатионового звена антиоксидантной защиты организма при фунгицидной интоксикации и коррекции витамином А и расторопшей. Материалы и методы: Проведена субхроническая интоксикация тирамом в дозе 1/50 LD50 (1,6 мг) на протяжении 4 недель при воздействии in vivo на организм 240 крыс линии Вистар в возрасте 2 мес. Исследовано влияние тирама на показатели антиоксидантной защиты организма, на примере вариабельности каталитической активности глутатионпероксидазы (GPX), глутатионредуктазы (GSR), количественного содержания активных форм кислорода (ROS) и подфракций глутатиона (GSH/GSSG). Результаты: Моделирование субхронической интоксикации сопровождалось значимым увеличением содержания ROS, повышением активности GPХ, GSR (р<0,05). В тоже время отмечается значительное снижение соотношения GSH/GSSG в плазме крови и ротовой жидкости крыс в сравнении с группой контроля. После проведения экспериментальной субхронической интоксикации были использованы антиоксиданты – витамин А (ретинола ацетат) и расторопша. Их применение в течение 30 суток привело к восстановлению уровня исследуемых показателей. Заключение: Таким образом, нами показано, что усиление образования свободных радикалов и дисбаланс в функционировании глутатионового пула антиоксидантной защиты происходит вследствие поступления в организм микроколичеств фунгицида тирам. Использование витамина А и расторопши способствует восстановлению прооксидантно-антиоксидантного баланса организма. Полученные результаты могут быть использованы при проведении антиоксидантной терапии для купирования процессов окислительного стресса при пестицидных интоксикациях.
Ключевые слова: тирам, глутатион, глутатионредуктаза, глутатионпероксидаза, ROS, витамин А, расторопша
Введение. В настоящее время широкое применение в агропромышленном комплексе (АПК) получил пестицидный препарат тирам (тетраметилтиурамдисульфид, ТМДТ), который является фунгицидом контактного действия, II класса опасности [1]. Несмотря на высокую экономическую эффективность применения, данный препарат имеет высокие кумулятивные, токсические свойства и способен сохраняться в продуктах переработки агрокультур до полутора лет, в связи с чем представляет экологическую опасность [2, 3]. Поступление тирама в ткани, органы животных и человека приводит к активации процессов свободнорадикального окисления и как следствие, к образованию свободных радикалов (СР) в том числе в виде реактивных форм кислорода (ROS) [4, 5]. Возникновение окислительного стресса происходит в том случае, когда скорость образования активных форм кислорода превышает способность клетки к детоксикации [6]. Ключевым звеном антиоксидантной защиты (АОЗ) организма является система глутатиона, которая включат в себя глутатион и ферменты его метаболизма [7]. Внутриклеточный глутатион представлен в виде 2 форм: восстановленной (GSH), которая синтезируется в цитоплазме клетки, и окисленной (GSSG) [8, 9]. GSH служит низкомолекулярным антиоксидантом. Окисленный глутатион в норме должен поддерживаться на низком уровне. За поддержание высокого соотношения GSH/GSSG, а также защиту клеток от активных форм кислорода (АФК) отвечает глутатионредуктаза (GSR) и глутатионпероксидаза (GPx). Активность GSR регулирует редокс-гомеостаз клетки, функционирование редокс-зависимых белков и защиту клеток от активных форм кислорода (АФК), таких как H2O2, O– и ˙OH [10, 11]. GPx инактивирует суперрадикалы и восстанавливает их в органические гидроперекиси. Однако, влияние тирама на изменение состояния глутатионового звена антиоксидантной защиты организма не до конца изучено [12].
С учетом высокого удельного веса экопатологий в структуре общей заболеваемости необходима разработка методов коррекции антиоксидантного статуса с помощью антиоксидантной терапии [13, 14]. Для торможения процессов окислительной стресса и нейтрализации свободных радикалов перспективным является применение витамина А (ретинола ацетат) и экстракта расторопши [15, 16].
В настоящей работе представлены биохимические исследования плазмы крови и ротовой жидкости крыс, подвергшихся интоксикации фунгицидным препаратом тирам, а также коррекции витамином А и расторопшей.
Материалы и методы исследования. Исследование проводилось на 240 крысах-самцах линии Вистар массой 200-220 грамм. В эксперименте животные были разделены на 8 групп. 1 группа - здоровые, интактные крысы, которые являлись биологическим контролем. 2, 3, 4 и 5 группы получали тирам вместе с гранулированным кормом в дозе 1,6 мг, что является 1/50 LD50, в течение 28 дней. Гранулы комбикорма измельчали в фарфоровой ступке до порошкообразного состояния, добавляли 2 мл дистиллированной воды и взвешенный тирам, формировали гранулы и сушили на открытом воздухе в течение 12 часов. Таким образом, интоксикация достигалась путем естественного кормления исключая физиологический стресс при проведении эксперимента. Забор образцов проводился на 7, 14, 21 и 28 сутки, после декапитации под эфирным наркозом. Шестая группа после 28 дней интоксикации тирамом 30 дней получали обычную еду, согласно их стандартного рациона. В седьмой группе моделировалась субхроническая интоксикация на протяжении 28 суток, с последующим применением антиоксиданта – витамина А в течение 30 суток. В перерасчете на 1 кг веса человека необходимо 0,020 мг/кг препарата. Коэффициент пересчета дозы с отдельного животного на человека составляет – 39,0. Для крысы массой 200 грамм коэффициент пересчета составляет 6,5. Следовательно, расчетная терапевтическая доза витамина А для экспериментальных крыс-самцов линии Вистар массой 200 грамм составляет: (0,020* 39) /6,5 = 0,12 мг/кг* 0,2 = 0,024 мг. В группе восемь проводилась субхроническая интоксикация в течение 28 суток, с последующим использованием антиоксиданта – расторопши, на протяжение 30 суток. В перерасчете на 1 кг веса человека необходимо 2,29 мг/кг препарата. Расчетная терапевтическая доза расторопши для экспериментальных крыс-самцов линии Вистар массой 200 грамм составляет: (2.29 * 39) /6,5 = 13,74 мг/кг *0,2 = 2,75 мг.
Расчет дозы препарата тирам выполнялся исходя из токсикологических данных: LD50 для крыс составляет 400 мг/кг [17]. В связи с тем, что в эксперименте использовались дозы 1/50 LD50, то после расчета доза для экспериментальных крыс-самцов линии Вистар массой 200 грамм составила: 400 мг/кг / 50 = 8мг/кг*0,2 = 1,6 мг [18].
Сроки забора биожидкостей были выбраны для оценки изменений антиоксидантного статуса при острой, подострой и субхронической интоксикации для анализа динамики изменений и компенсаторных возможностей организма.
Исследования проводили с соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986).
Для проведения анализа плазмы крови в течение 30 мин после забора центрифугировали кровь 15 мин на 3000 об/мин при 4°С. Производили забор надосадочной жидкости в микроцентрифужные пробирки в объеме 50 мкл.
Нестимулированная ротовая жидкость была получена путем её забора с помощью микропипетки в чистую пробирку, которую центрифугировали 20 минут на 1500 об/мин. Ротовую жидкость забирали и помещали в микроцентрифужные пробирки, в объеме 50 мкл.
Материалом исследования явилась ротовая жидкость и плазма крови.
После забора и пробоподготовки биообьектов было проведено лабораторное исследование, включающее определение функциональной активности антиоксидантной системы по следующим показателям: глутатион окисленный, глутатион восстановленный, глутатионредуктаза и глутатионпероксидаза, ROS. Для исследования использовались следующие наборы: Catalase Assay Kit, 707002, 96 тестов (Cayman Chemical, USA); Superoxide Dismutases Assay Kit, 706002, 96 тестов (Cayman Chemical, USA); Glutathione Reductase Assay, STA-812, 100 тестов (Cell Biolabs, USA); Glutathione Peroxidase Activity Colorimetric Assay Kit, K762, 100 тестов (BioVision, USA); OxiSelectтм In Vitro ROS/RNS Assay Kit (Green Fluorescence), STA-347, 96 assays (Cell Biolabs, USA); CEA294Ge ELISA Kit for Glutathione (GSH) (Cloud-Clone Corp., USA) и CEK518Ge ELISA Kit for Oxidized Glutathione (GSSG) (Cloud-Clone Corp., USA), Helicon (Москва). Для проведения интоксикации использовали тирам (137-26-8) чистотой 97% (Sigma-Aldrich, USA). Для проведения коррекции использовали витамин А (ретинол ацетат) (Химпитерторг Групп, Россия) и расторопшу (Грин Сайд, Россия).
Определение глутатиона восстановленного
Исследование основано на конкурентном методе иммуноферментного анализа (ИФА). В наборе для исследования использовался микропланшет, сорбированный моноклональными антителами специфичными к GSH. Между GSH, меченным биотином, немеченым GSH (содержащимся в образцах и контроле) и сорбированными антителами специфичными к GSH происходит конкурентная реакция в процессе инкубированния в течение 30 мин при температуре 37° С. Несвязавшийся конъюгат удаляли отмывкой. Затем авидин, конъюгированный с пероксидазой хрена (Horseradish peroxidase, HRP) добавляли в каждую лунку планшета и проводили инкубацию в течение 10 мин при температуре 37° С. Далее тщательно удаляли следы жидкости из планшета и отправляли его в микропланшетный ридер Varioscan Flash (Thermo Fisher Scientific, USA), в котором проводили исследование при длине волны 450 нм. Количество связанного конъюгата пероксидазы хрена обратно пропорционально концентрации GSH в образце.
Определение глутатиона окисленного
Анализ основан на конкурентном методе ИФА. Микропланшет в наборе сорбирован моноклональными антителами специфичными к овальбумину (OVA). Конкурентная реакция происходит в процессе инкубации в течение 30 мин при температуре 37° С между OVA, меченным биотином, немеченым OVA (содержащимся в образцах или контроле) и сорбированными антителами специфичными к OVA. После инкубации не связавшийся конъюгат удаляли отмывкой. Затем в микропланшет добавляли авидин, конъюгированный с пероксидазой хрена (HRP) и проводили инкубацию в течение 10 мин при температуре 37° С. Далее тщательно удаляли следы жидкости из планшета и отправляли его в микропланшетный ридер Varioscan Flash (Thermo Fisher Scientific, USA), для проведения иссследования при длине волны 450 нм. Количество связанного конъюгата пероксидазы хрена обратно пропорционально концентрации OVA в образце.
Определение глутатионпероксидазы
Анализ проводили с использованием набора реагентов фирмы Cell Biolabs на микропланшетном ридере (Varioscan Thermo Fisher Scientific) при длине волны 340 нм. В качестве субстрата использовали гидропероксида кумола. GPХ снижает концентрацию гидропероксида кумола при окислении GSH до GSSG. Одна единица активности GPХ была определена 1 мкмоль NADPH к NADP +.
Определение глутатионредуктазы
Для анализа в 96-луночный планшет добавили 25 мкл раствора 1X NADPH в каждую лунку, а затем по 100 мкл подготовленных стандартов глутатионредуктазы и исследуемых образцов. Затем в каждую лунку микропланшета внесли по 50 мкл 1X хромогена и перемешали. Завершающим этапом было внесение в каждую лунку планшета 25 мкл глутатиона дисульфида (GSSG). После перемешивания планшет немедленно отправляли в микропланшетный ридер Varioscan Flash (Thermo Fisher Scientific, USA) и поводили измерение оптической плотности при длине волны 405 нм с интервалом в 1 минуту в течение 10 минут (кинетический анализ).
Определение ROS
Анализ проводили с использованием набора реагентов фирмы Cell Biolabs на микропланшетном ридере Varioscan Flash (Thermo Fisher Scientific, USA) при длине волны 480 нм. Концентрацию перекиси водорода в опытных пробах определяли по калибровочной кривой.
Статистический анализ. Полученные данные статистически обрабатывались с использованием пакета прикладных программ «STATISTICA 13.0» (Stat Soft, USA). Результаты исследования представлены как среднее значение со стандартной ошибкой (M±m). Для определения статистически значимых различий между группами использовался t-критерия Стьюдента. Различия между группами считались статистически значимыми при р<0,05.
Результаты. В результате анализа полученных данных эксперимента было определено соотношение GSH/GSSG. Данные восстановленного (GSH) и окисленного глутатиона (GSSG) показали значимые различия между контрольной группой и группами с субхронической интоксикацией тирамом (табл. 1).
 Применение тирама привело к значительному снижению показателей GSH и повышению значений GSSG, как в плазме крови, так и в ротовой жидкости. Максимальные изменения были достигнуты в группе 5. На 28 день интоксикации в плазме крови значение восставленного глутатиона снизилось в 2,63 раза, в ротовой жидкости – в 2,27 раза. Окисленный глутатион в группе 5 увеличился в плазме в 3,3 раза, в ротовой жидкости – в 2,61 раза. Возврат к стандартному рациону после проведения субхронической интоксикации тирамом привел к незначительному восстановлению исследуемых показателей. В плазме крови GSH изменился в 1,6 раза по отношению к группе 5 и в 1,64 раза по отношению к контрольным значениям, в ротовой жидкости: в 1,13 раза и в 2,01 раза, соответственно. GSSG в плазме крови был восстановлен в 1,14 раза по отношению к значениям полученным в группе 5 и в 2,88 раза по отношению к значениям в группе 1. При исследовании окисленного глутатиона наблюдалась аналогичная тенденция: в плазме крови значения изменились в 1,42 раза и в 1,84 раза, соответственно. Применение витамина А позволило полностью восстановить показатели GSH и GSSG до контрольных значений в плазме крови. Однако при исследовании ротовой жидкости до контрольных цифр был восстановлен только GSH. В группе 8 контрольные значения не были достигнуты ни в одном из образцов.
Применение тирама привело к значительному снижению показателей GSH и повышению значений GSSG, как в плазме крови, так и в ротовой жидкости. Максимальные изменения были достигнуты в группе 5. На 28 день интоксикации в плазме крови значение восставленного глутатиона снизилось в 2,63 раза, в ротовой жидкости – в 2,27 раза. Окисленный глутатион в группе 5 увеличился в плазме в 3,3 раза, в ротовой жидкости – в 2,61 раза. Возврат к стандартному рациону после проведения субхронической интоксикации тирамом привел к незначительному восстановлению исследуемых показателей. В плазме крови GSH изменился в 1,6 раза по отношению к группе 5 и в 1,64 раза по отношению к контрольным значениям, в ротовой жидкости: в 1,13 раза и в 2,01 раза, соответственно. GSSG в плазме крови был восстановлен в 1,14 раза по отношению к значениям полученным в группе 5 и в 2,88 раза по отношению к значениям в группе 1. При исследовании окисленного глутатиона наблюдалась аналогичная тенденция: в плазме крови значения изменились в 1,42 раза и в 1,84 раза, соответственно. Применение витамина А позволило полностью восстановить показатели GSH и GSSG до контрольных значений в плазме крови. Однако при исследовании ротовой жидкости до контрольных цифр был восстановлен только GSH. В группе 8 контрольные значения не были достигнуты ни в одном из образцов.
Соотношение восстановленного и окисленного глутатиона снижалось на протяжении всего периода моделирования субхронической интоксикации тирамом в плазме крови и ротовой жидкости. Максимальные изменения были отмечены в группе 5: в плазме крови соотношение GSH/GSSG снизилось в 8,71 раза, а в ротовой жидкости – в 5,95 раза, по отношению к контрольным значениям. Незначительное восстановление исследуемого соотношения отмечалось при переходе к стандартному рациону после проведения интоксикации на протяжении 28 дней. В плазме значение изменилось в 1,84 раза по отношению к группе 5 и в 4,74 раза по отношению к контрольному показателю. В сравнении с группой 5 в ротовой жидкости соотношение GSH/GSSG восстановилось в 1,61 раза, а по отношению к группе 1 – в 3,69 раза. При проведении антиоксидантной терапии наибольший восстановительный эффект был отмечен в группе 7, где произошло полное восстановление баланса между восстановленным и окисленным глутатионом, по отношению к контрольной группе, как в плазме крови так и в ротовой жидкости. Экстракт расторопшы также обладает выраженным антиоксидантным действием, но значения контрольной группы достигнуты не были.
В таблице 2 указаны изменения GPX и GSR.

При исследовании активности антиоксидантных ферментов показано, что каталитическая активность глутатионредуктазы на протяжении всего периода хронической интоксикации ТМДТ увеличивалась и на 28 сутки достигла максимальных значений (в плазме крови увеличение произошло в 2,66 раза, в ротовой жидкости - в 2,25 раза, в сравнении с группой контроля). При переходе на стандартный рацион значения GSR незначительно изменились и в плазме крови и в ротовой жидкости. После проведения антиоксидантной терапии витамином А активность глутатионпероксидазы значительно была восстановлена в ротовой жидкости и достигла контрольных значений в плазме крови. При применении экстракта расторопши восстановление до контрольных значений GSR отмечено не было.
Максимальные значения GPX были достигнуты на 28 сутки субхронической интоксикации (в плазме крови в 1,42 раза, в ротовой жидкости в 2,09 раза выше в сравнении с группой 1). Перевод животных на обычное питание незначительно снизило показатель GPX. В плазме крови GPX изменился в 1,12 раза по отношению к группе 5 и в 1,25 раза по отношению к группе 1; в ротовой жидкости: в 1,32 раза и в 1,58 раза, соответственно. После интоксикации проведение антиоксидантной терапии витамином А и экстрактом расторопши дали положительный результат по снижению активности глутатионпероксидазы, но применение ретинола ацетата показало большую эффективность и привело к ее полному восстановлению до контрольных значений в плазме крови и ротовой жидкости.
В таблице 3 указаны изменения ROS.
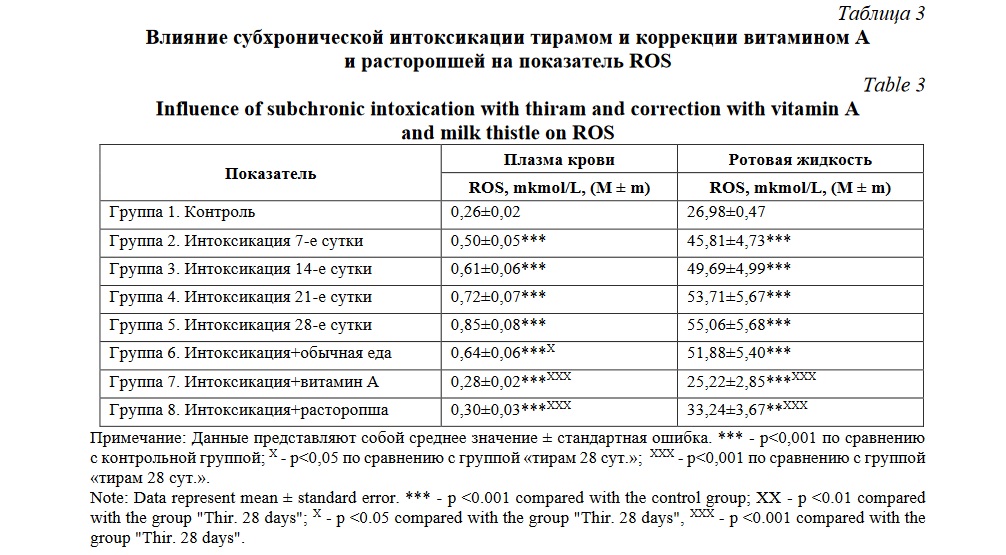
В результате субхронической интоксикации ТМДТ в плазме крови и ротовой жидкости наблюдалось увеличение ROS. Максимальных значений этот показатель достиг на 28 сутки. В 6 группе активность свободных радикалов снизилась незначительно по отношению к группе 1 (в плазме крови – в 2,46 раза; в ротовой жидкости – в 1,92 раза) и по отношению к группе 5 (в плазме крови – в 1,32 раза; в ротовой жидкости – в 1,06 раза). В 7 группе при применении после интоксикации витамина А в качестве антиоксиданта показатель свободных радикалов снизился до контрольных значений только в ротовой жидкости. После применения экстракта расторопши в качестве антиоксиданта показатель снижался, но контрольных значений не достиг ни в одном из образцов.
Обсуждение. Поступление в организм пестицидных препаратов оказывает токсическое воздействие посредством образования активных форм кислорода. Подавление образования свободных радикалов происходит за счет выработки антиоксидантных ферментов, одним из которых является глутатионпероксидаза. Нами показано, что введение фунгицидного препарата тирам на протяжении 28-и суток приводит к значительному увеличению содержания ROS, повышению активности GPХ, GSR (р<0,05).
В плазме крови и ротовой жидкости животных во время моделирования субхронической интоксикации ТМДТ отмечалось снижение соотношения GSH/GSSG. Использование витамина А и экстракта расторопши в течение 28 суток после проведения экспериментальной субхронической интоксикации, привело к восстановлению показателей активности исследуемых ферментов. При коррекции витамином А значения GSH, GSSG и соотношение GSH/ GSSG было полностью восстановлено до контрольных значений, а использование экстракта расторопши привело показатели к значениям максимально приближенным к контрольным.
Рядом исследователей показано, что снижение количества GSH в клетках являлось результатом действия тирама. Однако до конца не было изучено влияние тирама на ферментативное звено антиоксидантной системы и не показано, как изменяется соотношение восстановленного глутатиона к окисленному после проведения интоксикации тирамом, а также после применения антиоксидантной терапии.
Детоксикация АФК происходит с помощью ферментативной системы (через глутатионпероксидазу). Чрезмерное образование GSSG опасно для клеток организма, так как избыток окисленного глутатиона приводит к истощению общего GSH, что мы наблюдали на 28 сутки интоксикации тирама. Удаление GSSG связано с увеличением активности глутатионредуктазы (GSR), которая превращает GSH из GSSG в НАДФН зависимой реакции [12]. В нашей работе отмечено, что уровень GSSG и активность GSR одновременно увеличиваются после применения тирама по сравнению с контрольными значениями. Похожие результаты были получены и при применении тирама в дозе 150 мкг [9]. Несмотря на повышенные уровни GSSG, а также активность GSR, соотношение GSH/GSSG при интоксикации было значительно ниже, чем в контрольной группе, что говорит о истощении активности антиоксидантного барьера.
Во время проведения интоксикации в плазме крови отмечается постепенное снижение активность GРХ, что вероятно нарушает процесс перехода H2O2 в H2O. Накопление H2O2, влечет за собой высокое производство ОН радикалов, что в свою очередь подтверждается увеличением значения ROS в течение всего периода интоксикации. Блюм и Фридович (1985) обнаружили, что активность GPХ может быть инактивирована в условиях окислительного стресса супероксид-анионом и токсичными лигандами, такими как малоновый диальдегид, которые могут частично подавляют активность глутатионпероксидазы [11].
Ротовая полость является первой линией защиты от действия ксенобиотиков при их поступлении в организм [19]. При увеличении производства активных форм кислорода (АФК) и снижении каталитической активности антиоксидантных ферментов может происходить окислительное повреждение клеточных компонентов, как в слюнных железах, так и в пародонте [20, 21]. Окислительный стресс играет основную роль в патогенезе дисфункции слюнных желез, ксеростомии, пародонтита, предраковых состояний и рака полости рта [22, 23]. Поэтому ротовая жидкость может рассматриваться как своеобразный индикатор прооксидантно-антиоксидантного баланса как в ротовой полости, так и в организме в целом. В нашем исследовании показано, что окислительный стресс в ротовой полости вызывает более значимые изменения в системе антиоксидантной защиты, чем в плазме крови: отмечается более высокая концентрация GSH, GSSG и ROS, а при проведении фармакологической коррекции растительные антиоксиданты в ротовой жидкости в большей степени проявляют антиокислительные свойства.
Заключение. В настоящем исследовании, нами установлено, что переход к стандартному рациону после субхронической интоксикации позволяет незначительно восстановить контрольные значения всех исследуемых показателей. Это является следствием включения компенсаторных механизмов организма, направленных на борьбу с негативными последствиями окислительного стресса. Использование витамина А, а также экстракта расторопши привело к значительному восстановлению системы АОЗ до уровня контрольных значений. Значительные изменения в нашем исследовании были отмечены при применении витамина А, что подтверждает его высокие антиоксидантные свойства. Полученные результаты могут быть использованы при проведении антиоксидантной терапии для купирования процессов окислительного стресса.
Информация о финансировании
Работа выполнена за счет средств Курского государственного медицинского университета.




















Список литературы