Влияние нейропептидов семейства меланокортинов на уровень апоптотических и нейротрофических факторов в условиях «социального» стресса
Aннотация
Актуальность: В настоящее время особый интерес представляют научные работы, отражающие результаты изучения патологического влияния стрессогенных факторов, в том числе и «социального» стресса, на различные системы организма. Доказано, что длительное воздействие стресса способствует формированию различных видов расстройств, что в конечном итоге, приводит к развитию нарушений молекулярно-клеточных механизмов запрограммированной гибели клеток. В связи с чем, в настоящее время пристальное внимание уделяется оценке роли апоптотических и нейротрофических факторов в реализации стрессовой реакции. Цель исследования:Изучить влияние меланокортиновых нейропептидных соединений на уровень апоптотических (каспаза-3, каспаза-8, TNF-α) и нейротрофических (BDNF, NGF) факторов в сыворотке крови белых крыс в условиях «социального» стресса. Материалы и методы:Экспериментальные исследования проводили на 70 нелинейных белых крысах-самцах 6-месячного возраста. В процессе моделирования «социального» стресса все крысы были разделены по типу поведения на «агрессоров» и «жертв». В исследовании формировались экспериментальные группы (n = 10): контрольные животные; животные, в течение 20 дней подвергавшиеся воздействию стресса; группы крыс, получавших внутрибрюшинно в дозе 100 мкг/кг/сут, начиная с 1-го дня воздействия стресс-фактора, курсом 20 дней нейропептидные соединения семейства меланокортинов АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro. Влияние соединений на уровень апоптотических и нейротрофических факторов оценивали путем определения уровня каспазы-3, каспазы-8, фактора некроза опухоли, фактора роста нервов и нейротрофического фактора мозга в сыворотке крови белых крыс методом иммуноферментного анализа. Результаты:По результатам проведенного исследования было установлено, что в условиях «социального» стресса наблюдалось усиление апоптотических процессов, сопровождающихся увеличением уровня каспазы-3, каспазы-8, TNF-α в сыворотке крови белых крыс и снижением концентрации BDNF и NGF. Введение меланокортиновых нейропептидов на фоне стресса способствовало восстановлению уровня исследуемых показателей, что, вероятнее всего, связано с наличием у меланокортинов антиапоптотического и нейропротекторного действия за счет ингибирования каспаза-зависимого каскада реакций апоптоза, а также индукции синтеза нейротрофических факторов, обладающих антиапоптотической активностью. Заключение:Таким образом, введение меланокортиновых нейропептидных соединений АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro в условиях стрессогенного воздействия способствует восстановлению уровня каспаз и фактора некроза опухоли, а также нейротрофических факторов, в результате чего наблюдается антиапоптотический эффект за счет ингибирования каспаза-зависимого каскада реакций
Ключевые слова: меланокортины, нейропептиды, «социальный» стресс, апоптоз, каспазы, фактор некроза опухоли, фактор роста нервов, нейротрофический фактор мозга, TNF-α, BDNF, NGF
Введение. В настоящее время пристальное внимание уделяется научным исследованиям, отражающим влияние различных стрессовых факторов на организм человека [1, 2]. Установлено, что длительное стрессовое воздействие приводит к формированию неврологических, иммунных, эндокринных, метаболических и других видов расстройств, а также развитию нарушений молекулярно-клеточных механизмов апоптоза, в том числе нейроцитов [3, 4]. В связи с чем в настоящее время пристальное внимание уделяется оценке роли апоптотических и нейротрофических факторов в реализации стрессовой реакции.
Наиболее информативными показателями в оценке апоптотических процессов являются фактор некроза опухоли, инициаторные и эффекторные каспазы [5, 6]. Результаты многочисленных исследований показали, что фактор некроза опухоли способствует увеличению секреции воспалительных медиаторов, что относит данный цитокин к одному из самых значимых активаторов апоптоза [7, 8]. Установлено, что уровень TNF-α повышен у пациентов с психоневрологическими и нейродегенеративными заболеваниями, а также травматическими повреждениями головного мозга. Установлено, что в результате воздействия стрессогенных факторов наблюдается формирование комплекса TNF-α с рецепторами Fas с последующей активацией сигнальных молекул, который активирует инициирующую каспазу-8 и эффекторную каспазу-3, в результате чего развивается необратимое повреждению нейронов [9, 10, 11]. Установленный процесс инициации характерен также для развития апоптоза в лимфоидных и эндотелиальных клетках, что, в свою очередь, способствует развитию иммунной дисфункции, а также патологии различных систем организма [12, 13, 14].
При рассмотрении нейротрофиновой гипотезы развития различных патологических нарушений, в том числе апоптоза, таким нейротрофическим факторам, как фактор роста нервов и нейротрофический фактор мозга, обладающим выраженной нейроспецифичностью, отводится важное значение в проявлении нейропротекторного действия за счет реализации их способности к индукции синтеза антиапоптотических белков и ингибированию проапоптотических, оказывая влияние тем самым на выживаемость и дифференцировку отдельных популяций нейронов [15, 16]. Доказано, что апоптоз напрямую зависит от баланса NGF и BDNF, которые активируя рецепторы тирозинкиназ, оказывают нейропротекторное действие. Установлено, что фактор роста нервов привлекает внимание ученых в качестве перспективного средства лечения различных психоневрологических заболеваний, таких как болезнь Альцгеймера и депрессия [17, 18]. Доказана способность фактора роста нервов к индукции высвобождения иммуноактивных нейропептидов и нейротрансмиттеров, а также к влиянию на врожденные и адаптивные иммунные реакции. Доказано также, что уровень сывороточного BDNF имеет отрицательную корреляционную связь со степенью выраженности тревожных расстройств и даже в ряде случаев определяет развитие нейродегенеративных процессов [19, 20].
Таким образом, апоптотические и нейротрофические факторы играют важную роль в реализации адаптационных механизмов к стрессовым воздействиям различного генеза и определяет перспективность рассмотрения его в качестве мишени для стресспротекторов.
В настоящее время особый интерес вызывают нейропептидные соединения, на основе которых синтезируется большое количество высокоэффективных и безопасных лекарственных препаратов, обладающих разносторонней фармакологической активностью, в том числе и стресспротекторной [21]. На сегодняшний день в ряду пептидных соединений в отдельную группу выделены регуляторные пептиды - меланокортины [22, 23], представителем которых является зарегистрированный препарат Семакс, синтезированный учеными Института молекулярной генетики Национального исследовательского центра «Курчатовский институт». В медицинской практике Семакс применяется с целью улучшения мнестических функций. Доказано, что наряду с нейротропной активностью, данный препарат оказывает иммунотропное, антиоксиданьное, противогипоксическое и др. виды действия [24]. Описанные свойства актуализируют необходимость детального изучения фармакологического действия нейропептидов семейства меланокортинов.
Цель исследования. Изучить влияние меланокортиновых нейропептидных соединений на уровень апоптотических (каспаза-3, каспаза-8, TNF-α) и нейротрофических (BDNF, NGF) факторов в сыворотке крови белых крыс в условиях «социального» стресса.
«Социальный» стресс моделировали путем обеспечения условий проживании крыс при наличии сенсорного контакта и отсутствии физического с последующим формированием агрессивного и субмиссивного типа поведения [26, 27, 28] при размещении животных попарно в клетках, разделенных прозрачной перегородкой. С целью наблюдения за межсамцовыми конфронтациями ежедневно на 10 мин снимали перегородку, по результатам чего были сформированы группы крыс «агрессоров» и «жертв». Агрессивность крыс оценивалась по наличию вертикальных и боковых стоек и атаки, а субмиссивность – по наличию неподвижности, обнюхивания, аутогруминга, вертикальных «защитных» стоек.
В исследовании формировались экспериментальные группы (n = 10): контрольные животные; животные, в течение 20 дней подвергавшиеся воздействию стресса; группы крыс, получавших внутрибрюшинно в дозе 100 мкг/кг/сут, начиная с 1-го дня воздействия стресс-фактора, курсом 20 дней меланокортиновые соединения АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro
Выбор дозы нейропептидных соединений основан на предварительном изучении выраженности психомодулирующего эффекта. Исследования проводили при введении исследуемых соединений в дозах 25, 50, 100 и 200 мкг/кг/сут. Было установлено, что наиболее активными дозами явились 100 и 200 мкг/кг/сут. В связи с чем, в качестве экспериментальной дозы в дальнейшем была выбрана наименьшая – 100 мкг/кг/сут.
Влияние нейропептидов на уровень каспазы-3, каспазы-8, TNF-α, BDNF, NGF в сыворотке крови белых крыс оценивали методом иммуноферментного анализа с использованием иммунологического анализатора «Multiscan FC» и применением высокочувствительных наборов ELISA Kit for Caspase-8 (США); ELISA Kit for Caspase-3 (США); ELISA Kit for Tumor Necrosis Factor Alpha (TNF-α) (США), ELISA Kit for Brain Derived Neurotrophic Factor (BDNF) (США); ELISA Kit for Nerve Growth Factor (NGF) (США).
Нейропептидные соединения для исследования предоставлены Институтом молекулярной генетики Национального исследовательского центра «Курчатовский институт».
Статистическая обработка результатов. Статистическую обработку полученных результатов проводили с помощью пакета Exсel и программного обеспечения BIOSTAT, с учетом критерия Манна-Уитни. Статистически значимыми различия считали при p≤0,05.
Результаты и их обсуждение. Результаты, отражающие влияние меланокортинов на уровень каспаз-3 в сыворотке крови белых крыс в условиях «социального» стресса, представлены рисунке 1.
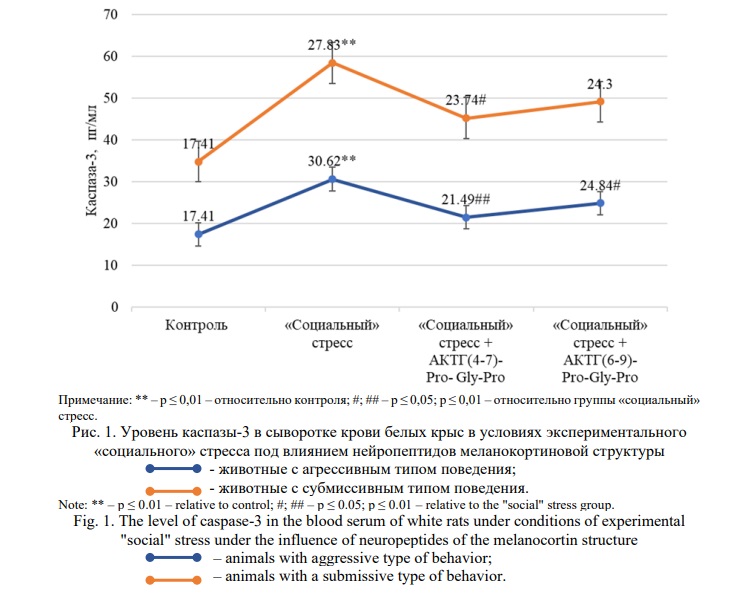
При формировании «социального» стресс у животных с агрессивным типом поведения уровень каспазы-3 увеличился практически на 76% (p≤0,01) по отношению к контролю. При введении меланокортиновых соединений было отмечено снижение уровня исследуемого показателя: при АКТГ(4-7)-Pro-Gly-Pro (Семакс) – на 30% (p≤0,01) и АКТГ(6-9)-Pro-Gly-Pro – на 20% (p≤0,05) в сравнении с группой стресс.
В группе стрессированных животных с субмиссивным типом поведения уровень каспазы-3 увеличился на 60 % (p ≤ 0,01) по отношению к контрольной группе животных. При введении АКТГ(4-7)-Pro-Gly-Pro (Семакс) отмечалось снижение уровня показателя более чем на 15% (p≤0,05), АКТГ(6-9)-Pro-Gly-Pro – на 12% (p≥0,05) по сравнению с группой «социального» стресса.
Результаты, отражающие влияние меланокортинов на уровень каспаз-8 в сыворотке крови белых крыс в условиях «социального» стресса, представлены рисунке 2.

Формирование «социального» стресса привело к увеличению уровня каспазы-8 в 2,6 раза (p≤0,01) в сравнении с контрольными крысами. Введение меланокортиновых соединений АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro способствовало снижению данного показателя в 1,5 раза (p≤0,01), в 1,2 (p≤0,01) соответственно по отношению к группе стрессированных животных.
Уровень каспазы-8 в группе стрессированных животных с субмиссивным типом поведения увеличился в 2,4 раза (p≤0,01) по отношению к интактным животным. Введение меланокортиновых нейропептидных соединений АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro способствовало снижению уровня изучаемого показателя на 24% (p≤0,05); на 19% (p≤0,01) соответственно по сравнению с группой «социального» стресса.
На рисунке 3 представлены результаты, отражающие влияние нейропептидов меланокортиновой структуры на уровень TNF-α в сыворотке крови белых крыс в условиях «социального» стресса.
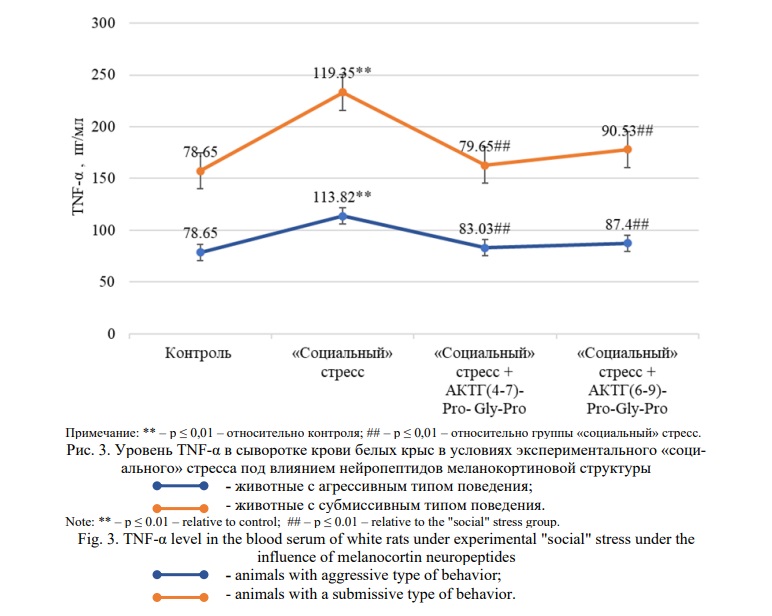
Формирование «социального» стресса у животных с агрессивным типом поведения привело к увеличению уровня фактора некроза опухоли на 45% (p≤0,01) в сравнении с контрольной группой животных. На фоне введения меланокортиновых нейропептидов АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro было отмечено снижение данного показателя на 27% (p≤0,01) и 23% (p≤0,01) соответственно по отношению к стрессированным животным.
В группе крыс с субмиссивным типом поведения при формировании стресса уровень TNF-α увеличился на 52% (p≤0,01) в сравнении с контролем. Соединения АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro вызвали снижение данного показателя на 33% (p≤0,01) и 24% (p≤0,01) по отношению к группе «социального» стресса.
На рисунке 4 показаны результаты, отражающие влияние меланокортинов на уровень NGF в сыворотке крови белых крыс в условиях «социального» стресса.
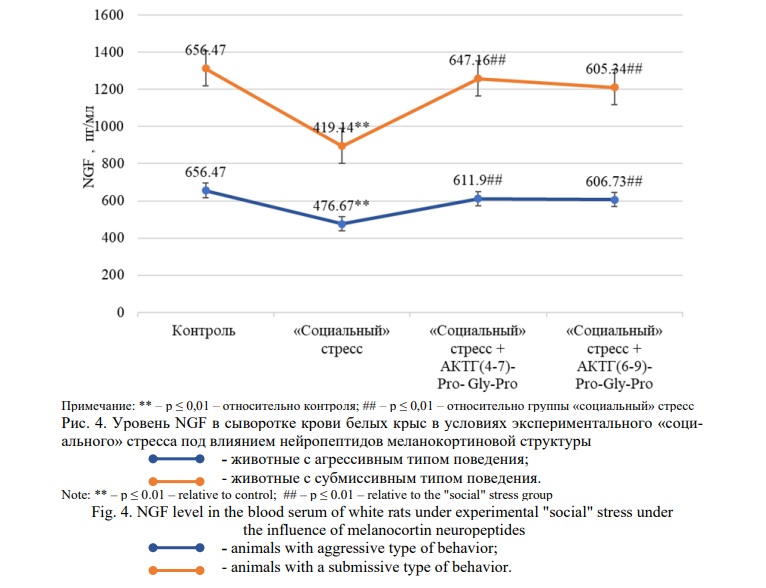
В группе животных с «социальным» стрессом и агрессивным типом поведения наблюдалось снижение уровня NGF на 28% (p≤0,01) в сравнении с интактными животными. При введении меланокортинов АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro было отмечено повышение уровня исследуемого фактора на 28% (p≤0,01) и 27% (p≤0,01) соответственно в сравнении с группой «социального» стресса.
Формирование «социального» стресса в группе животных с субмиссивным типом поведения привело к снижению уровня NGF на 36% (p≤0,01) в сравнении с контрольной группой. На фоне введения меланокортинов АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro было отмечено повышение уровня фактора роста нервов на 55% (p≤0,01) и 44% (p≤0,01) соответственно по сравнению с группой «социальный» стресс.
На рисунке 5 представлены результаты, отражающие влияние меланокортинов на уровень нейротрофического фактора BDNF в сыворотке крови белых крыс в условиях «социального» стресса.
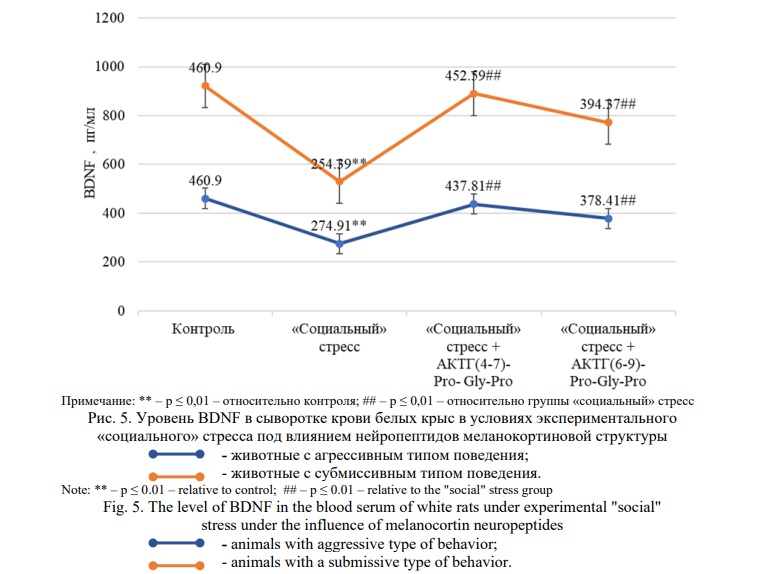
В группе стрессированных животных с агрессивным типом поведения было отмечено снижение уровня нейротрофического фактора головного мозга на 40% (p≤0,01) в сравнении с контрольной группой. Введение соединений АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro способствовали увеличению уровня мозгового нейротрофического фактора по отношению к стрессированной группе животных на 60% (p≤0,01) и 38% (p≤0,01) соответственно.
В группе стрессированных крыс с субмиссивным типом поведения было отмечено снижение уровня BDNF на 45% (p≤0,01) в сравнении с контрольными животными. При введении меланокортиновых соединений также отмечались изменения уровня исследуемого нейротрофического фактора в виде его статистически значимого повышения (p≤0,01): на фоне АКТГ(4-7)-Pro-Gly-Pro (Семакс) – на 78% и АКТГ(6-9)-Pro-Gly-Pro – 55% по отношению к группе животных, подверженных воздействию «социального» стресса.
В результате проведения данного исследования было установлено, что «социальный» стресс сопровождается снижением уровня BDNF и NGF, что связано с изменением нейропластичности с последующим угнетением нейрогенеза. В ряде экспериментальных работ доказано, что BDNF обладает выраженными нейропротекторными свойствами, способствуя угнетению клеточного апоптоза, препятствуя, в свою очередь, гибели нейронов и стимулируя рост холинергических нервных волокон [20]. В эксперименте установлено, что в условиях «социального» стресса наряду со снижение уровней нейротрофических факторов наблюдается повышение уровней каспазы-3 и каспазы-8, а также TNF-α сыворотки крови белых крыс, что свидетельствует об усиление апоптотических процессов [13, 14]. Существенная роль нейротрофических факторов в индукции или торможении апоптоза доказана и в других экспериментальных работах. Установлено, что NGF тормозит апоптоз при ряде нейродегенеративных заболеваниях [20]. Кроме того, доказано, что фактор роста нервов и нейротрофический фактор головного мозга реализуют свое действие через генетические механизмы индукции апоптотических процессов [22].
Снижение экспрессии нейротрофических факторов в результате стрессогенных воздействий различной природы и восстановление его уровня продолжительным введением средств коррекции привели к созданию нейротрофической гипотезы развития стресс-индуцированной депрессии, согласно которой изменение уровня нейротрофических факторов является ключевым механизмом формирования и разработки подходов к лечению подобных нарушений [17]. Установленная в данном исследовании корригирующая активность меланокортиновых нейропептидов в отношении уровня нейротрофических факторов при «социальном» стрессе свидетельствует о проявлении АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro выраженных антистрессорных и нейропротекторных эффектов, что сопровождается восстановлением уровней фактора роста нервов и нейротрофического фактора головного мозга [28].
Наряду с этим, установлено, что введение нейропептидных соединений АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro на фоне «социального» стресса способствует снижению уровня апоптотических показателей – капсазы-3, каспазы-8 и фактора некроза опухоли, что опосредовано, возможным, ингибированием каспаза-зависимого каскада реакций разрушения клеточных структур путем, гидролиза ядерной ламины, расщепления адгезивных белков и разрушения цитоскелета [29, 30]. Данный путь, наряду с каспазами, реализуется с участием рецепторов клеточной гибели, к которым относятся фактор некроза опухолей. Установлено, что нейропептидные соединения в условиях «социального» стресса вызывают выраженное ингибирование процессов свободнорадикального окисления и снижают концентрацию провоспалительных цитокинов таких как IL–1β, IL–6 и TNF-α [22, 23]. На основании полученных результатов можно сделать вывод о наличие у меланокортинов антиапоптотического действия за счет влияния на уровень каспаз, концентрацию провоспалительных цитокинов и ингибирование процессов перекисного окисления липидов [23].
Заключение. Таким образом, проведенное исследование позволило установить наличие у меланокортиновых нейропептидов АКТГ(4-7)-Pro-Gly-Pro (Семакс) и АКТГ(6-9)-Pro-Gly-Pro антиапоптотической активности за счет ингибирования каспаза-зависимого каскада реакций апоптоза, а также выраженного стресс-протекторного действия за счет восстановления уровня нейротрофических факторов мозга, что актуализирует дальнейшее детальное изучение каспаза-зависимого и опосредованного нейротрофическими факторами механизма антистрессорного эффекта меланокортинов.
Информация о финансировании
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, грант РФФИ № 19-04-00461.





















Список литературы
Benham G, Charak R. Stress and sleep remain significant predictors of health after controlling for negative affect. Stress and Health. 2019;35(1):59-68. DOI: https://doi.org/10.1002/smi.2840
Cohen S, Gianaros APJ, Manuck SB. Stage Model of Stress and Disease. Perspectives on Psychological Science. 2016;11(4):56-63. DOI: https://doi.org/10.1177/1745691616646305
Magariños AM, Schaafsma SM, Pfaff DW. Impacts of stress on reproductive and social behaviors. Frontiers in Neuroendocrinology. 2018;49:86-90. DOI: https://doi.org/10.1016/j.yfrne.2018.01.002
O'Connor DB, Thayer JF, Vedhara K. Stress and Health: A Review of Psychobiological Processes. Annual Review of Psychology. 2021;72:663-688. DOI: https://doi.org/10.1146/annurev-psych-062520-122331
Майборода АА. Апоптоз: гены и белки. Сибирский медицинский журнал. 2013;3:130-135.
Obeng E. Apoptosis (programmed cell death) and its signals - A review. Brazilian Journal of Biology. 2021;81(4):1133-1143. DOI: https://doi.org/10.1590/1519-6984.228437
Дятлова АС, Дудков АВ, Линькова НС, и др. Молекулярные маркеры каспаза-зависимого и митохондриального апоптоза: роль в развитии патологии и в процессах клеточного старения. Успехи современной биологии. 2018;138(2):126-137. DOI: https://doi.org/10.7868/S0042132418020023
D'Arcy MS. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 2019;43(6):582-592. DOI: https://doi.org/10.1002/cbin.11137
Jacotot É. Caspase inhibition: From cellular biology and thanatology to potential clinical agents. Médecine sciences (Paris). 2020;36(12):1143-1154. DOI: https://doi.org/10.1051/medsci/2020222
Munoz-Pinedo CA, Lopez-Rivas A. А role for caspase-8 and TRAIL-R2/DR5 in ER-stress-induced apoptosis. Cell Death and Differentiation. 2018;25:226. DOI: https://doi.org/10.1038/cdd.2017.155
Furusawa Y, Iizumi T, Fujiwara Y, et al. Inhibition of checkpoint kinase 1 abrogates G2/M checkpoint activation and T. promotes apoptosis under heat stress. Apoptosis. 2012;17:102-112. DOI: https://doi.org/10.1007/s10495-011-0660-7
Kumar S. Caspase function in programmed cell death. Cell Death and Differentiation. 2007;14:32-43. DOI: https://doi.org/10.1038/sj.cdd.4402060
D’Sa-Eipper C, Roth KA. Caspase regulation of neuronal progenitor cell apoptosis. Developmental Neuroscience. 2000;22(1-2):116-124. DOI: https://doi.org/10.1159/000017433
Xu X, Lai Y, Hua ZC. Apoptosis and apoptotic body: disease message and therapeutic target potentials. Bioscience Reports. 2019;39(1):BSR20180992. DOI: https://doi.org/10.1042/BSR20180992
Кузник БИ, Давыдов СО, Ланда ИВ. Фактор роста нервов (NGF) и его роль в условиях нормы и патологии. Успехи физиологических наук. 2019;50(4):64-80. DOI: https://doi.org/10.1134/S0301179819040052
Santucci D, Racca A, Alleva E. When Nerve Growth Factor Met Behavior. Recent Advances in NGF and Related Molecules. 2021;1331:205-214. DOI: https://doi.org/10.1007/978-3-030-74046-7_13
Крыжановская СЮ, Запара МА, Глазачев ОС. Нейротрофины и адаптация к средовым стимулам: возможности расширения «терапевтического потенциала» (краткий обзор). Вестник международной академии наук (русская секция). 2020;1:36-43.
Левчук ЛА, Вялова НМ, Михалицкая ЕВ, и др. Роль BDNF в патогенезе неврологических и психических расстройств. Современные проблемы науки и образования. 2018;6:58.
Острова ИВ, Голубева НВ, Кузовлев АН, и др. Прогностическая значимость и терапевтический потенциал мозгового нейротрофического фактора BDNF при повреждении головного мозга (обзор). Общая реаниматология. 2019;15(1):70-86. DOI: https://doi.org/10.15360/1813-9779-2019-1-70-86
Duman RS, Deyama S, Fogaça MV. Role of BDNF in the pathophysiology and treatment of depression: Activity‐dependent effects distinguish rapid‐acting antidepressants. European Journal of Neuroscience. 2021;53(1):126-139. DOI: https://doi.org/10.1111/ejn.14630
Carr R, Frings S. Neuropeptides in sensory signal processing. Cell and Tissue Research. 2019;375(1):217-225. DOI: https://doi.org/10.1007/s00441-018-2946-3
Kanunnikova NP. Neuroprotective properties of neuropeptides. Journal of the Grodno State Medical University. 2017;15(5):492-498. DOI: http://dx.doi.org/10.25298/2221-8785-2017-15-5-492-498
Samotrueva MA, Yasenyavskaya AL, Murtalieva VK, et al. Experimental Substantiation of Application of Semax as a Modulator of Immune Reaction on the Model of "Social" Stress. Bulletin of Experimental Biology and Medicine. 2019;166(6):754-758. DOI: https://doi.org/10.1007/s10517-019-04434-y
Vyunova TV, Andreeva LA, Shevchenko KV, et al. An integrated approach to study the molecular aspects of regulatory peptides biological mechanism. Journal of Labelled Compounds and Radiopharmaceuticals. 2019;62(12):812-822. DOI: https://doi.org/10.1002/jlcr.3785
Директива 2010/63/EU Европейского парламента и Совета европейского союза о защите животных, использующихся для научных целей. [Электронный ресурс] [дата обращения 11.10.2021]. URL: https://ruslasa.ru/wp-content/uploads/2017/06/Directive_201063_rus.pdf
Avgustinovich DF, Kovalenko IL, Kudryavtseva NN. A model of anxious depression: persistence of behavioral pathology. Neuroscience and Behavioral Physiology. 2005;35(9):917-924. DOI: https://doi.org/10.1007/s11055-005-0146-6
Koolhaas JM, De Boer SF, Buwalda B, et al. Social stress models in rodents: Towards enhanced validity. Neurobiology of Stress. 2017;6:104-112. DOI: https://doi.org/10.1016/j.ynstr.2016.09.003
Ясенявская АЛ, Самотруева МА, Мясоедов НФ, и др. Влияние семакса на уровень интерлейкина-1β в условиях "социального" стресса. Медицинский академический журнал. 2019;9(1S):192-194. DOI: https://doi.org/10.17816/MAJ191S1192-194
Fricker LD. Carboxypeptidase E and the Identification of Novel Neuropeptides as Potential Therapeutic Targets. Advances in Pharmacology. 2018;82:85-102. DOI: https://doi.org/10.1016/bs.apha.2017.09.001
Thiele TE. Neuropeptides and Addiction: An Introduction. International Review of Neurobiology. 2017;136:1-3. DOI: https://doi.org/10.1016/bs.irn.2017.07.001