Аллельный полиморфизм генов, вовлеченных в продукцию IL-1β, и предрасположенность людей к развитию артериальной гипертензии
Aннотация
Актуальность: Уровень IL-1β в плазме крови определяется не только провоспалительными стимулами, но и аллельным полиморфизмом генов IL1B и NLRP3. Сведения об ассоциации аллельного полиморфизма этих генов с риском развития артериальной гипертензии (АГ) малочисленны и противоречивы. Цель исследования:Оценить риск развития АГ у носителей аллельных вариантов по полиморфным маркерам rs1143634 (c.3953С>T), rs16944 (c.-511T>C), rs1143627 (с.-31С>T) гена IL1B и rs35829419 (с.2113С>A) гена NLRP3, а также изучить возможные механизмы включения этих аллельных вариантов в этиологию и патогенез АГ. Материалы и методы:Для генотипирования по rs1143634, rs16944, rs1143627 (ПЦР-ПДРФ анализ) использовали 182 образца ДНК здоровых людей и 180 образцов ДНК пациентов с АГ (I-II стадии); по rs35829419 гена NLRP3 (аллель-специфическая ПЦР с TaqMan зондами) − 215 образцов ДНК здоровых индивидов и 180 пациентов с АГ. Для оценки экспрессии генов методом ПЦР в режиме реального времени использована тотРНК, полученная из лейкоцитов периферической крови 45 здоровых людей и 50 пациентов с АГ (27 человек, принимающих метопролол или бисопролол, и 23 человека без гипотензивной терапии). Содержание провоспалительных белков в плазме крови 40 здоровых индивидов измеряли методом ИФА. Результаты:Обнаружено, что у носителей генотипа ТТ по c.3953С>T маркеру гена IL1B в 3 раза повышен риск АГ (ОШ=3,239; 95%ДИ: 1,858-5,649). У здоровых индивидов с этим генотипом содержание IL-1β в плазме крови и экспрессия гена ICAM1 в ЛПК выше, чем у гетерозигот или гомозигот по аллелю С (р=0,029 и р=0,004, соответственно). У лиц с генотипом ТТ по с.-31С>T маркеру гена IL1B риск АГ ниже, чем у носителей альтернативных генотипов (ОШ=0,645; 95%ДИ: 0,481-0,866). Экспрессия гена IL1B и содержание вчСРБ были ниже у здоровых людей с генотипом ТТ по rs1143627 (p=0,022, р=0,040, соответственно). Различий в распределении частот аллелей и генотипов по маркерам c.-511T>C гена IL1B и с.2113С>A гена NLRP3 в исследуемых группах не выявлено. Заключение:Полиморфные маркеры rs1143634 (c.3953С>T) и rs1143627 (с.-31С>T) гена IL1B, вероятно, вовлечены в предрасположенность жителей Карелии к развитию АГ
Введение. Повышенная продукция воспалительных цитокинов, таких как IL-1β и IL-6, является одним из патогенетических факторов развития артериальной гипертензии (АГ), ишемической болезни сердца [1]. IL-1β относится к цитокинам «раннего ответа». Он высвобождается из иммунных клеток (моноциты и макрофаги, дендритные клетки, нейтрофилы, B-лимфоциты и естественные киллеры) и некоторых неиммунных клеток (кератиноциты) на очень ранних стадиях иммунного ответа и способен стимулировать продукцию других цитокинов, таким образом, инициируя и поддерживая хроническое воспаление в кровеносных сосудах и почках [2]. В ответ на внутренние (факторы, высвобождаемые поврежденными клетками) и внешние (например, инфекционные агенты) стимулы незрелая форма белка быстро накапливается в клетках за счет активации паттерн-распознающих рецепторов (PRR), в частности, Toll-подобных рецепторов (TLR), на поверхности указанных клеток, и усиления транскрипционной активности гена IL1B. Инициация сигналинга приводит к олигомеризации компонентов инфламмасомы NLRP3 и активации каспазы-1, расщепляющей про-IL-1β [3]. Таким образом, продукция этого цитокина регулируется провоспалительными стимулами. Вопрос о том, влияет ли на уровень IL-1β аллельный полиморфизм генов, контролирующих его синтез, пока остается открытым. В некоторых исследованиях выявлены различия в содержании IL-1β у носителей аллельных вариантов по полиморфным маркерам гена IL1B [4-9]. Ген NLRP3 (или ген криопирина) кодирует один из компонентов инфламмасомы NLRP3 (pyrin domain-containing protein 3) – Nod-подобный рецептор семейства NALP. В разных частях этого гена обнаружены мутации, влияющие на его транскрипционную активность и эффективность сборки инфламмасомного комплекса. Полиморфный вариант rs35829419 представляет собой замену цитозина на аденин в 3-м экзоне, которая приводит к замене в позиции 705 аминокислотной последовательности белка глицина на лизин (p.Gln705Lys). Показана связь rs35829419 (с.2113С>A) гена NLRP3 c усилением продукции IL-1β и экспрессии генов IL1B и TNF [10].
Вероятно, носительство аллельных вариантов генов IL1B и NLRP3, ассоциированных с изменением содержания в плазме этого цитокина, может обуславливать повышенный риск развития неинфекционных заболеваний, сопровождающихся воспалением, в том числе патологий сердечно-сосудистой системы. Cведения об ассоциации аллельного полиморфизма гена IL1B с высоким риском АГ немногочисленны и противоречивы. Выявлена связь носительства аллельных вариантов по полиморфному маркеру rs16944 (c.-511T>С) с предрасположенностью к АГ среди лиц татарской национальности, проживающих в России [11], у жителей Мордовии [12], среди китайских мужчин провинции Аньхой [13]. Показан повышенный риск развития гипертонии у носителей аллеля C по rs1143627 (с.-31С>T) у японцев [14], среди пациентов с болезнью коронарных сосудов в польской популяции [15]. В то же время, различия в частотах аллелей и генотипов по указанному маркеру в группах нормотензивных и гипертензивных коренных европейских жителей не выявлены [16]. По данным Conen и соавт. [17] полиморфный маркер rs1143634 гена IL1B не связан с повышением уровня давления крови и риском формирования АГ у белокожих американских женщин. Тогда как, согласно результатам исследования Шамониной и соавт., носительство аллельных вариантов по указанному маркеру ассоциировано с риском данного заболевания [12]. Мы не обнаружили работ по влиянию rs35829419 гена NLRP3 на предрасположенность людей к АГ.
Цель исследования. Оценить риск развития артериальной гипертензии у носителей различных аллельных вариантов по полиморфным маркерам rs1143634 (c.3953С>T), rs16944 (c.-511T>C), rs1143627 (с.-31С>T) и rs35829419 (с.2113С>A), а также изучить возможные механизмы включения аллельного полиморфизма генов IL1B и NLRP3 в этиологию и патогенез данного заболевания.
Материалы и методы исследования. В исследование включены условно здоровые люди и пациенты с диагнозом артериальная гипертензия (I-II стадии), жители Карелии, в основном, города Петрозаводска. Для генотипирования по rs1143634, rs16944, rs1143627 использовали образцы ДНК 182 здоровых людей и 180 пациентов с АГ (средний возраст − 44±3,85 и 50,4±4,82, соответственно). Для генотипирования по rs35829419 гена NLRP3 использовали образцы ДНК 215 здоровых индивидов и 180 пациентов с АГ (средний возраст − 45±4,85 и 50,4±4,82, соответственно). Диагноз АГ ставили амбулаторно с учетом рекомендаций европейского общества кардиологов по артериальной гипертензии (ESC, 2018) [18]. Уровень САД и ДАД (однократное измерение) у больных АГ: 136,19±1,57 а.д. и 82,17±1,18 а.д., соответственно. Креатинин – 86,79±4,67 мкмоль/л, индекс массы тела – 26,53±0,60 кг/м2. Общие критерии исключения для исследования: наличие хронических иммунновоспалительных заболеваний, в том числе сахарного диабета второго типа, злоупотребление алкоголем, курение табака, перенесенные в последние два месяца инфекционные заболевания, индекс массы тела ≥ 28 кг/м2. Условно здоровые доноры были подобраны при прохождении диспансеризации. От всех обследованных получено информированное согласие на проведение исследований.
Использовали периферическую кровь, взятую натощак. Из одной пробы крови выделяли ДНК, получали фракцию лейкоцитов и плазму. ДНК выделяли на микроколонках DiaGene (ДиаЭм, Россия) согласно инструкции к набору. Качество и количество ДНК определяли на спектрофотометре SmartSpecPlus (Bio-Rad, США). Для исследования выбраны полиморфные маркеры генов IL1B и NLRP3, связанные с изменением экспрессии гена IL1B и/или содержанием IL-1β [4-10, 19, 20]. Замена цитозина на тимин в позиции -31 промотора (rs1143627) гена IL1B приводит к усилению сродства транскрипционных факторов C/EBPβ и PU.1 и способствует повышению продукции цитокина [19]. Rs16544 также картирован в промоторной области гена IL1B и связан с изменением его транскрипционной активности [20]. Полиморфный маркер c.3953С>T (rs1143634) представляет собой замену цитозина на тимин в 5 экзоне гена IL1B, влияет на формирование сплайсосомных форм белка. Rs35829419 (с.2113С>A), часто обозначаемый в литературе как Q703K, картирован в экзоне 3, который кодирует олигомеризационный домен. Согласно данным Verma и соавторов, наличие аллеля А связано с усилением функций инфламмасомы и провоспалительным фенотипом [10]. Генотипирование по локусам гена IL1B осуществляли методом ПЦР-ПДРФ анализа [21]. Полимеразную цепную реакцию проводили в термоциклере MaxyGene (AxyGene, США) c использованием реактива Screen-Mix HS (Евроген, Россия). Продукты амплификации ДНК обрабатывали соответствующими эндонуклеазами рестрикции (1 о.е.) (СибЭнзим, Россия) в течение 16 часов [21]. Продукты рестрикции анализировали после электрофоретического разделения в 6% ПААГ, окрашивания бромистым этидием и визуализации в УФ источнике. Характеристика аллелей: rs1143634 аллель C: 84 п.о., 150 п.о., аллель Т: 234 п.о.; rs16944 аллель С: 191 п.о., 114 п.о., аллель Т: 305 п.о.; rs1143627 аллель С: 134 п.о., 114 п.о., аллель Т: 248 п.о.
Определение аллелей и генотипов по rs35829419 гена NLRP3 проводили методом аллель-специфической ПЦР в режиме реального времени с TaqMan зондами на приборе LightCycler (Roshe, Германия) с использованием реактива qPCRmix-HS (Евроген, Россия). Праймеры и зонды конструировали, используя программу Beacon Designer5. Последовательность праймеров и зондов: прямой 5'-GGAGGAAGAGGAGGAG-3': обратный 5’-GCATGAGAGGAGCTTG-3’; зонд на аллель дикого типа 5’-FAM-AGGACACACTGCACCATATC-BHQ1-3’; зонд на мутантный аллель 5’-ROX-AGGACACACTTCACCATATC-BHQ2-3’. Температура отжига праймеров и зондов – 60°C. Аллельная дискриминация производилась при помощи программного обеспечения LightCycler 96SW 1.1.
Для анализа уровня экспрессии генов были отобраны образцы тотальной РНК (тотРНК), выделенной из лейкоцитов периферической крови (ЛПК) с использованием реагента PureZole (Bio-Rad, США) условно здоровых доноров (45 человек, возраст 45,0±4,3 лет) и пациентов с АГ, не принимающих (27 человек, возраст 42,0±5,2 года) и принимающих кардиоселективные блокаторы β-адренорецепторов более года (метопролол (25 мг/сут) или бисопролол (5-10 мг/сут)) (23 человека, возраст 50,0±3.80 лет). Чтобы исключить влияние провоспалительных стимулов, уровень транскриптов генов VCAM1 и ICAM1 исследовали в ЛПК здоровых людей. Качество выделенной тотРНК определяли после электрофоретического разделения в 1% агарозном геле. Количество тотРНК оценивали на спектрофотометре SmartSpecPlus (Bio-Rad, США). ТотРНК обрабатывали ДНКазой (1 о.е.). Первую цепь кДНК синтезировали, используя набор для обратной транскрипции "MMLV RT kit" (Евроген, Россия). Качество и количество кДНК оценивали на спектрофотометре SmartSpecPlus (Bio-Rad, США). Уровень транскриптов генов изучали методом ПЦР в режиме реального времени на приборе LightCycler (Roshe, Германия) используя набор qPCRmix-HS SYBR (Евроген, Россия). Последовательность праймеров и условия ПЦР-РВ даны в таблице 1. В качестве референсных генов использовали гены 18S rRNA и GAPDH. Эффективность ПЦР (не менее 98%) оценивали по стандартным кривым. Специфичность продуктов проверяли по кривым плавления. Каждую ПЦР повторяли не менее 2-х раз. Количество транскриптов оценивали по ΔCt.

Содержание интерлейкина 1 бета (IL-1β), фактора некроза опухоли альфа (TNFα), интерлейкина 6 (IL-6), растворимой формы молекулы адгезии сосудистого эндотелия (sVCAM), металлопротеиназы 9 (MMP9), высокочувствительного С-реактивного белка (вчСРБ, hs-CRP), в плазме крови 40 условно здоровых доноров (18 мужчин и 22 женщины, возраст 38±3,01 и 41,53±2,35, соответственно) определяли методом иммуноферментного анализа, используя наборы Human IL-1β ELISA Kit (Invitrogen, США), Human TNF alpha ELISA Kit (Invitrogen, США), Human IL-6 (Invitrogen, США), Human sVCAM-1 ELISA Kit (Invitrogen, США), Human MMP-9 ELISA Kit (Invitrogen, США), hs-CRP ELISA Kit (Biomerica, Германия) согласно протоколам производителя. Измерения проводили в двукратной аналитической повторности.
Статистическая обработка данных выполнена в пакете программ Statgraphics Centurion XVI (version 16.1.11) и GenAlex 6.502. При сравнении частот встречаемости аллелей и генотипов в группах условно здоровых людей и пациентов с АГ применяли критерий χ2. Определяли значения наблюдаемой (Ho) и ожидаемой (Не) гетерозиготности, соотвествие равновесию Харди-Вайнберга, отношение шансов (ОШ) с 95% доверительным интервалом (ДИ) и уровнем значимости, равным 0,05. Согласно тесту Шапиро-Уилка, биохимические показатели распределены ненормально. Значимость различий средних величин оценивали с помощью U-критерия Вилкоксона-Манна-Уитни. Данные представлены в виде медианы (Me), 25% и 75% процентиля (Q1; Q3). Проведен дисперсионный анализ с использованием Н-критерия Краскела-Уоллиса. Возраст индивидов, включенных в исследование, представлен в виде средних значений и ошибки среднего (М±m). Различия считали значимыми при р<0,05.
Результаты и их обсуждение. В исследуемых группах проводился тест на соответствие распределения равновесию Харди-Вайнберга. Выявлено отклонение частот генотипов от равновесия Харди-Вайнберга в контрольной группе по rs1143634, rs16944 и в группе пациентов с АГ по rs1143627 и rs35829419 (табл. 2). Это может быть обусловлено отбором против гетерозигот и гомозигот по минорным аллелям. Обнаружены различия в распределении частот аллелей и генотипов по rs1143634 в группе здоровых людей и пациентов с АГ (табл. 2). Частота TT генотипа среди гипертоников значительно выше, чем в группе лиц с нормальным давлением крови (χ2=9,42; р=0,003). У носителей аллеля T по данному полиморфному маркеру риск развития АГ повышен в 2 раза (ОШ=2,054; 95%ДИ 1,525-2,766), а у носителей генотипа TT в 3 раза (ОШ=3,239; 95%ДИ: 1,858-5,649). Различий в частотах аллелей и генотипов по полиморфному маркеру rs16944 гена IL1B в двух группах сравнения не выявлено (табл. 2).
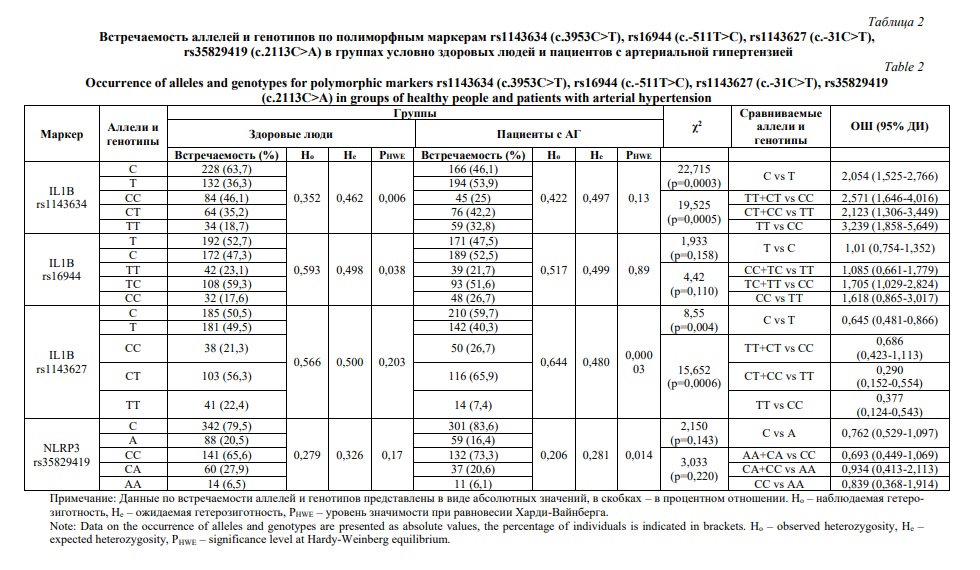
Обнаружены различия в распределении частот аллелей и генотипов по rs1143627 в группе здоровых людей и пациентов с АГ (табл. 2). Частота генотипа ТТ в группе здоровых индивидов выше, чем в группе пациентов с АГ (χ2=15,280; р<0,0006). У лиц с генотипом ТТ риск развития АГ снижен (ОШ=0,645; 95%ДИ: 0,481-0,866). Различий в распределении частот аллелей и генотипов по rs35829419 гена NLRP3 в группах исследования не выявлено (табл. 2). Содержание транскриптов генов IL1B и NLRP3 в ЛПК здоровых индивидов было значительно меньше, чем у лиц с АГ без гипотензивной терапии (рис. 1А и 1Б). У гипертоников, принимающих кардиоселективные блокаторы β-адренорецепторов, уровень экспрессии гена IL1B был ниже, чем у пациентов без гипотензивной терапии (p=0,00013) (рис. 1А).
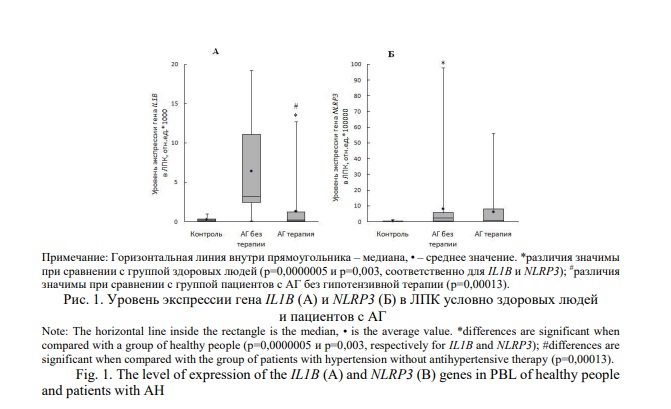
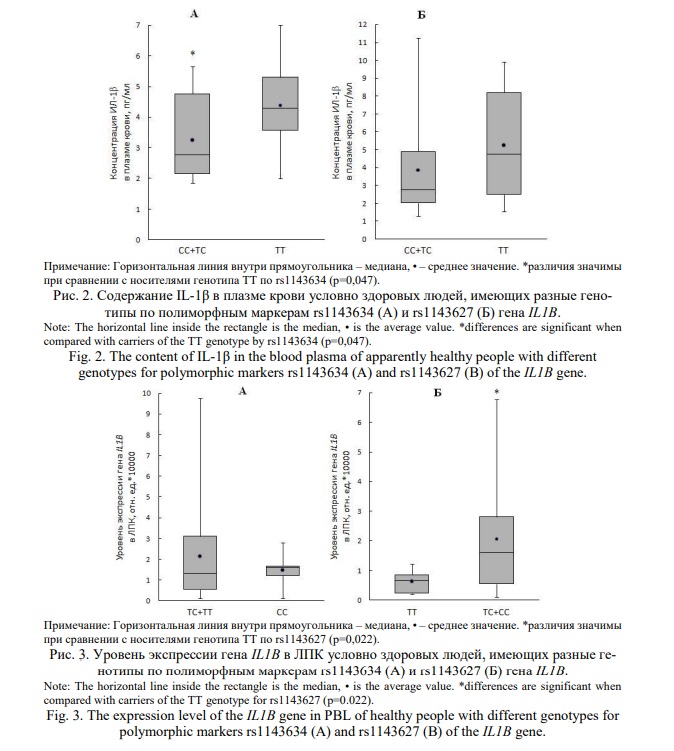
Чтобы исключить влияние провоспалительных стимулов, сравнительную оценку содержания мРНК гена IL1B и уровня IL-1β проводили в ЛПК и плазме крови здоровых людей. Содержание IL-1β у носителей генотипа ТТ по rs1143634 выше (р=0,047), чем у лиц с генотипами TC и СС (рис. 2 А). Выявлено влияние генотипа по указанному полиморфному маркеру на содержание IL-1β (Н=4,02; р=0,045). Различий в содержании данного цитокина в плазме крови носителей аллеля С и TТ генотипа по rs1143627 не выявлено (р=0,200) (рис. 2 Б). Уровень мРНК гена IL1B у здоровых лиц с разными аллельными вариантами по rs1143634 был практически одинаковым (р=0,740) (рис. 3А). Выявлены различия этого показателя в зависимости от носительства генотипов по rs1143627 (рис. 3Б). Количество транскриптов указанного гена оказалось ниже у лиц с генотипом ТТ по сравнению с носителями генотипов ТС и СС (р=0,022).
Содержание IL-1β положительно коррелировало с уровнем IL-6 (R=0,52; p=0,009), TNFα (R=0,42; p=0,04). Cвязь между уровнем IL-1β и sVCAM-1, MMP9, hs-CRP не выявлена (р=0,34; p=0,65; p=0,07, соответственно). Обнаружены различия в содержании hs-CRP в группе здоровых индивидов, имеющих в генотипе аллель С или Т по rs1143627 (табл. 3). У носителей ТТ генотипа уровень hs-CRP в плазме крови ниже, чем у гетерозигот или гомозигот по аллелю С. Различий в содержании других провоспалительных белков у носителей аллельных вариаций по rs1143634 и rs1143627 не выявлено (табл. 3).

Содержание IL-1β положительно коррелировало с транскрипционной активностью гена VCAM1 в лейкоцитах периферической крови здоровых людей (R=0,46; p=0,012), но не коррелировало с уровнем транскриптов гена ICAM1 (R=0,08; p=0,600). Исследована связь носительства изучаемых аллельных вариантов гена IL1B с транскрипционной активностью генов VCAM1 и ICAM1 в ЛПК здоровых индивидов. Уровень транскриптов гена VCAM1 не отличался у лиц, имеющих разные аллельные варианты по rs1143634 и rs1143627 (рис. 4).
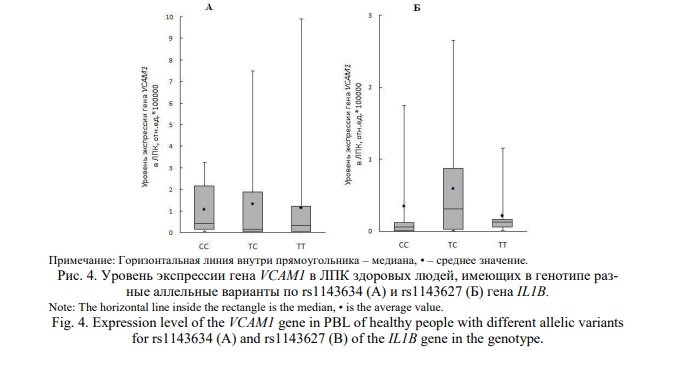
Обнаружены различия в уровне транскриптов гена ICAM1 в ЛПК гомозигот по аллелю Т и носителей аллеля С (гетерозигот и гомозигот по аллелю С) полиморфного маркера rs1143634 (рис. 5 А) (р=0,029 и р=0,004, соответственно). У лиц, имеющих аллель Т, носительство которого ассоциировано с повышенным риском АГ, экспрессия гена ICAM1 выше, чем у индивидов с генотипом СС

Таким образом, в ходе исследования впервые выявлена ассоциация полиморфных маркеров c.3953С>T (rs1143634) и с.-31С>T (rs1143627) гена IL1B с развитием артериальной гипертензии у жителей Карелии. Носительство аллеля Т по rs1143634 связано с повышением риска формирования артериальной гипертензии, тогда как наличие генотипа ТТ по rs1143627, напротив, обуславливает более низкую вероятность развития данного заболевания. Известно, что АГ сопровождается активацией клеток врожденного и адаптивного иммунитета, повышением содержания в плазме крови провоспалительных белков [1, 24]. Уровень сывороточного ИЛ-1β в периферической крови больных АГ значительно выше по сравнению со здоровыми людьми, а количество транскриптов генов NLRP3 и IL1B в их Т-лимфоцитах больше, чем у нормотоников [25]. Аналогичные данные получены в нашем исследовании. В ЛПК пациентов с АГ уровень экспрессии генов IL1B и NLRP3 значительно выше, чем у здоровых индивидов, а применение препаратов, нормализующих артериальное давление, способствует снижению уровня их транскриптов.
Усиление выработки IL-1β в условиях воспаления в основном происходит за счет активации транскрипции гена IL1B и инфламмасомы NLRP3 [3]. Олигомеризация компонентов инфламмасомы после инициации сигнала от Toll-подобных рецепторов приводит к активации каспазы 1, расщепляющей предшественники IL-1β и IL-18 с образованием их биологически активных форм. Как одни из регуляторов иммунного ответа и воспалительных реакций в организме, эти цитокины вовлекаются в патогенез сердечно-сосудистых заболеваний, в том числе и артериальной гипертензии [26]. Повышенная продукция IL-1β влияет на гладкомышечные клетки (ГМК) и эндотелиальные клетки сосудов. У крыс со спонтанной гипертензией (HSR) содержание белков, составляющих инфламмасомный комплекс NLRP3, активность каспазы 1 и уровень IL-1β в средней оболочке артериальных сосудов существенно выше, чем у крыс Вистар [27]. Усиление активности инфламмасомы, по-видимому, связано с фенотипической трансформацией и пролиферативной способностью ГМК, поскольку ингибирование транскрипции гена NLRP3 способствует снижению интенсивности воспалительных процессов, пролиферации ГМК и предотвращает ремоделирование сосудов у HSR [27]. IL-1β участвует в формировании эндотелиальной дисфункции, в том числе и за счет регуляции экспрессии молекул адгезии на поверхности клеток эндотелия и трансэндотелиальной миграции лейкоцитов [28]. Моноциты, попадая в интиму сосудов, в свою очередь, индуцируют секрецию воспалительных молекул, таких как хемокины и белки острой фазы (IL-6, IL-8, MCP-1), эндотелиальными и гладкомышечными клетками, усиливая воспалительные реакции. Хроническое воспаление стенок сосудов рассматривается в настоящее время как основной патогенетический механизм атеросклероза [29].
Плазменный уровень IL-1β регулируется не только провоспалительными стимулами, но и зависит от наличия в генотипе аллельных вариантов генов IL1B и NLRP3 [4-10]. Изменения в продукции этого цитокина, обусловленные носительством аллельных вариантов указанных генов, вероятно, могут быть причиной повышения или снижения риска развития АГ. Полиморфный маркер rs1143634 представляет собой однонуклеотидную замену (цитозин меняется на тимин) в экзоне 5 в положении 3954 гена IL1B. Аллель T по с.3954C>T маркеру встречается реже, чем аллель C, и, по некоторым данным, ассоциирован с повышенным уровнем сывороточного IL-1β [8, 9]. Тем не менее, согласно Mendonça и соавт., содержание этого цитокина в слюне здоровых людей не зависело от генотипа по указанному полиморфному маркеру [30]. Как показано в нашем исследовании, уровень этого цитокина у здоровых индивидов выше у носителей генотипа ТТ по rs1143634, который, согласно нашим данным, ассоциирован с высоким риском развития АГ.
Полиморфный маркер rs1143627 также может быть связан с вариабельностью плазменного уровня IL-1β. По некоторым данным носительство СС генотипа обуславливает повышенный уровень этого цитокина в плазме крови [5, 7], что, вероятно, может стать фактором предрасположенности людей к формированию стабильно высокого давления крови. Выявлена ассоциация rs1143627 с высоким риском преэклампсии у женщин провинции Хань [7]. У женщин с генотипом СС почти в 2 раза выше риск формирования высокого давления крови в период беременности. В нашем исследовании обнаружено снижение риска развития АГ у носителей аллеля Т по указанному маркеру, что позволяет обозначить его как протективный аллель. Полиморфный вариант rs1143627 представляет собой замену цитозина на тимин в положении -31 промотора гена IL1B на антисенс цепи и связан с изменением его экспрессии и продукции IL-1β [5, 7]. В представленном нами исследовании не выявлены различия в содержании этого цитокина в плазме крови здоровых доноров, имеющих в генотипе аллель С или Т по rs1143627. Однако показано снижение уровня транскриптов гена IL1B у здоровых индивидов с генотипом ТТ по сравнению с гетерозиготами и гомозиготами по аллелю С. Мы не выявили связи между носительством аллельных вариантов rs16944 (c.-511T>С) гена IL1B, rs35829419 (с.2113С>A) гена NLRP3 и риском развития АГ, хотя, согласно имеющимся сведениям, указанные аллельные варианты могут влиять на содержание IL-1β в плазме крови у больных людей, т.е. в условиях воспаления [6, 10].
По данным литературы, уровень IL-1β в плазме крови связан с содержанием провоспалительных цитокинов и белковых факторов эндотелиальной дисфункции [31]. При воспалении эндотелиальные клетки сосудов также могут продуцировать IL-1β, который, в свою очередь, инициирует активацию вторичных медиаторов воспаления, таких как IL-6 и С-реактивный белок, и усиливает секрецию молекул адгезии и хемокинов, индуцируя мощный провоспалительный ответ и прогрессирование эндотелиальной дисфункции [32]. Согласно результатам нашего исследования, содержание IL-1β коррелировало с плазменными уровнями IL-6 и TNFα, и с транскрипционной активностью гена VCAM1. Повышенный уровень IL-1β, обусловленный носительством аллельных вариантов гена IL1B, вероятно, может влиять на содержание провоспалительных белков. Так, нами выявлена связь rs1143627 с содержанием вчCРБ у здоровых людей. У лиц с генотипом ТТ, который выступает как протективный в отношении АГ, содержание вчCРБ ниже, чем у носителей альтернативных генотипов (СС и СТ). В условиях повышенной продукции провоспалительных факторов происходит усиление трансэндотелиальной миграции лейкоцитов в интиму сосудов, которое обеспечивается за счет адгезии этих клеток на поверхности эндотелия [33]. В этом процессе существенную роль играет индукция экспрессии мРНК генов молекулы межклеточной адгезии-1 (ICAM1) и молекулы адгезии сосудистого эндотелия (VCAM1) в эндотелиальных клетках провоспалительными цитокинами [34]. Как показано в нашем исследовании, наличие в генотипе аллеля Т по rs1143634 связано с более высоким уровнем транскрипционной активности гена ICAM1. Вероятно, аллельный полиморфизм гена IL1B может влиять на экспрессию молекул межклеточной адгезии на поверхности эндотелиальных клеток через модуляцию его уровня в плазме крови.
Заключение. Полиморфные маркеры rs1143634 (c.+3953С>T) и rs1143627 (с.-31С>T) гена IL1B, вероятно, вовлечены в предрасположенность жителей Карелии к развитию артериальной гипертензии. Повышенный риск развития АГ у носителей ТТ генотипа по rs1143634 связан с увеличением уровня IL-1β в плазме крови и экспрессии гена молекулы межклеточной адгезии-1 (ICAM1) в лейкоцитах периферической крови. Протективный эффект генотипа ТТ по rs1143627 в отношении АГ, вероятно, обусловлен снижением транскрипционной активности гена IL1B и влиянием на содержание вчСРБ.
Информация о финансировании
Исследования проведены в рамках выполнения НИР (тема FMEN-2022-0009 № г.р. 122031100064-4) на оборудовании Центра коллективного пользования Федерального исследовательского центра Карельский научный центр Российской академии наук.





















Список литературы