Особенности разнообразия кишечной микробиоты у пациентов пожилого возраста с метаболическими нарушениями (обзор литературы)
Aннотация
Актуальность: В настоящее время во всем мире увеличивается доля пациентов пожилого возраста (на территории Российской Федерации отмечается более 20% пациентов возраста старше 60 лет), большая часть которых страдает хроническими неинфекционными заболеваниями, в том числе и метаболическими нарушениями (сахарный диабет 2 типа, ожирение, дислипидемии). Методы лабораторной диагностики (глюкозо-толерантный тест, определение уровня глюкозы, гликированного гемоглобина, общего холестерина, липопротеидов низкой, высокой плотности, коэффициент атерогенности), широко используемые специалистами различных областей, способны своевременно поставить диагноз. Существует множество теорий, объясняющих развитие патологического процесса при метаболических нарушениях. При атеросклеротическом поражении сосудов большую роль может играть эндотелиальная дисфункция, окислительный стресс. Помимо этого, одним из новых механизмов развития патологического воспаления может являться формирование микробиоты кишечника с преобладанием кластера бактерий, вырабатывающих активные метаболиты (коротко-цепочные жирные кислоты (КЦЖК)) в избыточном количестве, которые являются субстратом для глюконеогенеза и липогенеза, что способствует изменению метаболизма глюкозы и снижению чувствительности тканей к инсулину. Также известно влияние КЦЖК на регуляцию синтеза инкретинов (ГПП-1, ДПП-4), ингибирование которых осуществляют современные сахароснижающие препараты. Изучение родо-видового биоразнообразия может быть новым диагностическим признаком, влияющим на своевременную коррекцию лечебных мероприятий. Цель исследования:Оценить биоразнообразие кишечной микробиоты у пациентов пожилого возраста с метаболическими нарушениями по данным литературных источников. Материалы и методы:Проведен обзор и анализ источников литературы в базах данных Scopus, Web of Science, Pubmed за последние 5 лет. Результаты:Данные о влиянии жизнедеятельности кишечной микробиоты подтверждают ее воздействие на развитие метаболических нарушений у пожилых пациентов, в том числе, определяют новые возможные механизмы развития сахарного диабета 2 типа. В связи с нарушением метаболизма жирных кислот в адипоцитах и гепатоцитах, происходит изменение глюконеогенеза. Основной причиной метаболических нарушений является активная выработка КЦЖК. В следствие этого происходит модуляция экспрессии кишечных каннабиноидов, регулирующих проницаемость слизистой оболочки, что приводит к нарушению секреции инкретинов. Заключение:Полученные результаты свидетельствуют о необходимости углубленного изучения микробиоты кишечника у гериатрических пациентов с данной патологией, что может способствовать определению новых подходов в диагностике и лечении
Ключевые слова: кишечная микробиота, метаболические нарушения, гериатрические пациенты, сахарный диабет, ожирение, дислипидемия
Введение. Увеличение числа гериатрических пациентов объективно приводит к повышению количества лиц, испытывающих трудности с решением не только социальных, но и медицинских проблем. Коморбидная патология среди пациентов пожилого возраста занимает лидирующие позиции в структуре общей заболеваемости. В среднем, у гериатрического пациента в анамнезе обнаруживается до 5 различных хронических заболеваний неинфекционного генеза, что способствует снижению адаптационных возможностей организма и увеличению случаев инвалидности и преждевременной смерти [1, 2]. Метаболические нарушения оказывают серьезное влияние на течение основного заболевания, что ухудшает качество жизни пациентов. Своевременная диагностика нарушения толерантности к глюкозе, сахарного диабета 2 типа, дислипидемии у лиц пожилого возраста затруднена ввиду отсутствия яркой клинической симптоматики на фоне других хронических заболеваний. Поэтому актуально проводить ранний скрининг на наличие данной патологии (определение глюкозы, гликированного гемоглобина, проведение глюкозо-толерантного теста, показатели липидного обмена).
Одним из новых механизмов развития может быть изменение качественного и количественного состава микробиоты кишечника. Определение специфических метаболитов микроорганизмов, может говорить о новых патогенетических механизмах развития и прогрессирования метаболических нарушений. Коррекция родового состава микробиоты способна привести к предотвращению развития патологического состояния, характерного для возникновения нарушения сахарного диабета 2 типа [3]. Кишечная микробиота у пожилых людей характеризуется снижением бактерий, которые относятся к роду Bacteroides, Bifidobacteria, при этом увеличивается число бактерий, относящихся к роду Firmicutes, а также к «патогенному кластеру» [4, 5, 6]. Уменьшение числа родового биоразнообразия среди Bacteroides, Prevotella, Faecalibacterium, наряду с увеличением бактерий семейства Enterobacteriaceae можт быть ассоциирована со снижением качества жизни у людей пожилого возраста. Факторами, способствующими подобным изменениям микробиоты кишечника у гериатрических пациентов, являются прием лекарственных средств, изменения гормонального статуса, режима и характера питания, хронические заболевания неинфекционного генеза, наличие коморбидной патологии [7].
Кроме того, изменение состава микрофлоры полости рта, происходящие в пожилом возрасте, также способны оказывать прямое влияние на состояние микробиоты желудочно – кишечного тракта (ЖКТ). Исследования, в которых была показана связь между изменениями состава кишечной микробиоты и сахарным диабетом 2 типа, дают возможность предположить, что метаболические маркеры заболевания могут иметь отношение к определению взаимосвязей. Последнее метагеномное исследование также привело к разработке математической модели для идентификации метагеномных маркеров метаболизма Снижение количества некоторых бутиратпродуцирующих бактерий (например, Roseburia, Faecalibacterium рrausnitzii) и повышение количества условнопатогенных бактерий (Clostridium clostridioforme) могут быть потенциально характерным признаком при сниженной толерантности к углеводам и развитию сахарного диабета. Эта гипотеза поддерживается выявлением липополисахаридов грамотрицательных бактерий в крови пациентов с метаболическим синдромом и сахарным диабетом 2 типа. Кроме того, бактериальная ДНК, в основном принадлежащая к типу Proteobacteria, была обнаружена в крови пациентов еще до дебюта сахарного диабета. Некоторые роды бактерий, производящие активные метаболиты, тесно связаны с развитием нарушения толерантности к глюкозе, что способствует стремительному развитию сахарного диабета 2 типа у лиц пожилого возраста. Помимо этого, некоторые бактерии активно влияют на повышенную выработку глутамата. Это может указывать на возможные пути коррекции разнообразия кишечной микробиоты как предиктора развития органической патологии у лиц пожилого возраста [8, 9].
Цель исследования. Оценка биоразнообразия микробиоты кишечника у пациентов пожилого возраста с метаболическими нарушениями по данным литературных источников.
Материалы и методы исследования. Проведен обзор и анализ литературных источников в базах данных Scopus, Web of Science, Pubmed за последние 5 лет.
Результаты и их обсуждение. На основании данных метагеномных исследований, охватывающих несколько континентов, можно подтвердить существование трех энтеротипов в микробиоме кишечника, различающихся по видовому и функциональному составу. Каждый из этих трех энтеротипов может быть идентифицирован по преобладанию одного из трех бактериальных родов: Bacteroides (энтеротип – 1), Prevotella (энтеротип – 2) и Ruminococcus (энтеротип – 3). В энтеротипе 1 доминируют бактерии рода Bacteroides, где они составляют 80% экосистемы, что означает отсутствие разнообразия среди других представителей. Другие желчные резистентные роды, присутствующие в этом кластере, включают Parabacteroides, Paraprevotella и Odoribacter, получающих энергию преимущественно за счет ферментации углеводов и белков. Эти микроорганизмы обладают мощным сахаролитическим потенциалом – их геном обогащен генами галактозидаз, гексозаминидаз и протеаз, а также генами ферментов гликолиза и пентозофосфатного пути окисления глюкозы. Данный энтеротип ассоциирован с длительным употреблением животных белков, аминокислот и насыщенных жиров. Энтеротип – 2 обогащен видами, относящимся к роду Prevotella, который способен переваривать жесткие пищевые волокна, как ксилан и гемицеллюлоза [10].
У пациентов с метаболическими нарушениями, в том числе и при сахарном диабете 2 типа снижено биоразноообразие кишечной флоры, что может указывать на недостаточную степень компенсации и развитие осложнений заболевания. Влияние кишечной микробиоты способно изменить представление о развитии сахарного диабета 2 типа, что предусматривает новые подходы не только в диагностике, но и в лечении основного заболевания у лиц пожилого возраста.
Одним из основных представителей нормофлоры микробиоты является бактерия Akkermansia (Akkermansia Muciniphila), которая живет в слизистом слое кишечника и обеспечивает неповрежденный барьер энтероцитов [11, 12, 13]. Наличие данной бактерии является показателем здорового метаболизма и связано с улучшением гомеостаза глюкозы, липидного обмена. Исследования, которые показывают низкий уровень Akkermansia у пожилых пациентов, могут быть связаны с физиологическими особенностями организма, а также развитием метаболических нарушений (сахарный диабет 2 типа, ожирение) в связи с недостаточной выработкой слизи и большей проницаемости для других микроорганизмов. Ведущим признаком воспаления является массивная выработка таких метаболитов, как ацетат, пропионат, бутират, запускающих процесс системного воспаления. Бутират способен напрямую активировать экспрессию генов, задействованных в глюконеогенезе в клетках кишечника путем цАМФ-зависимого механизма. Пропионат активирует процесс глюконеогенеза в кишечнике путем взаимодействия с FFAR рецепторами 3 типа, которые расположены в клетках нервной системы [14, 15, 16]. Также выявлено, что отсутствие действия пропионата и бутирата на FFAR рецепторы 3 типа, снижают аппетит, стимулируя выработку инкретинов, останавливают увеличение массы тела и развитие ожирения. На фоне отсутствия экспрессии FFAR3 и FFAR2 может отмечаться стойкий эффект повышения уровня инсулина в крови, что способно напрямую регулировать углеводный обмен. Помимо этого, данный механизм способен влиять на метаболизм желчных кислот, что влечет за собой активное поглощение энергии и нарушение энергетического обмена [17, 18, 19]. Сигнальные молекулы, взаимодействуя с различными внутриклеточными и трансмембранными рецепторами способны снизить экспрессию гена проглюкагона и синтез глюкагоноподобного пептида 1 (ГПП-1). Данный процесс происходит путем активации L-клеток кишечника и прямого влияния на гомеостаз глюкозы, чувствительность тканей к инсулину (Рис. 1) [20, 21, 22]. Таким образом, нарушение гомеостаза глюкозы способно изменяться за счет усиления действия глюкагоноподобного пептида 1 (GLP-1), и улучшение чувствительности к нему имеют терапевтический потенциал при лечении сахарного диабета 2 типа.
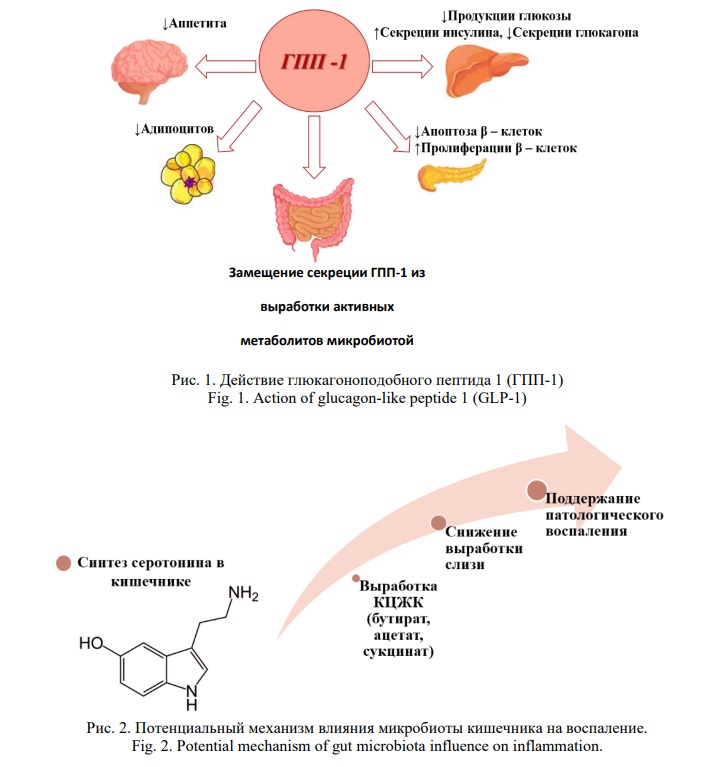
Кишечные анаэробные бактерии изменяют выработку синтеза серотонина в кишечнике, продуцируют коротко-цепочные жирные кислоты (КЦЖК), включая ацетат, пропионат и бутират, в качестве основных конечных продуктов путем ферментации неперевариваемых полисахаридов (Рис. 2) [23, 24, 25]. Данные метаболиты вносят примерно 200 ккал / день в энергетический баланс пожилого человека и способствуют липогенезу и накоплению в адипоцитах, что приводит к сбору энергии. Кроме того, более высокие концентрации также могут быть связаны с кардио-метаболическими факторами риска. Состав кишечной микробиоты модулирует биодоступность холина из рациона и накопление проатерогенного метаболита триметиламин-N-оксида (ТМАО), который усугубляет атеросклеротический процесс за счет стимулирования прямого транспорта и ингибирования обратного транспорта холестерина. Кроме того, ТМАО усугубляет нарушенную толерантность к глюкозе, препятствует передаче сигналов печеночного инсулина и способствует воспалению жировой ткани.
Что касается кишечной микробиоты, то некоторые семейства бактерий из типов Firmicutes и Proteobacteria, выделенных из комменсальных бактерий в кишечнике человека, были идентифицированы как потребители холина и карнитина и, следовательно, потенциальные продуценты триметиламин (ТМА). Пути синтеза ТМА в кишечнике были описаны с помощью специфического фермента глицил-радикала (GRE), включая холин-ТМА-лиазу GRE (cutC) и его активатор GRE-активазу (cutD), которая использует холин в качестве субстрата, а также, двухкомпонентная оксигеназа / редуктаза типа Риске (cntA / B), которая использует карнитин и его производное γBB в качестве субстрата [26, 27, 28]. Недавнее исследование показало, что ингибирование лиаз ТМА - ферментов, экспрессируемых микробами кишечника, которые превращают холин в ТМА способно снизить атеросклеротическое поражение. TMAO-опосредованный атеросклероз, скорее всего, происходит несколькими путями. TMAO усиливает прямой транспорт холестерина в макрофагах за счет активации рецептора CD-36 (кластер дифференцировки 36) и акцептора рецептора A. Также известно, что ТМАО изменяет метаболизм холестерина и желчных кислот в кишечнике, нарушая тем самым основной путь, необходимый для выведения холестерина из организма [29, 30].
Увеличение представителей рода Dorea, может говорить об увеличении кишечной проницаемости за счет усиленного метаболизма сиаловых кислот и разложения муцина. Также может отмечаться увеличение значения рода Blautia, который напрямую воздействует на рецепторы, связанные с G – белком (41, 43 типов). Данный род участвует в метаболизме желчных кислот, что способно влиять на углеводный обмен [31]. Высокое значение рода Prevotella, некоторые виды которой могут использовать в качестве источников топлива и клетчатку, и белок достаточно часто встречается у лиц пожилого возраста. В зависимости от диеты и образа жизни, данная бактерия выделяет или полезные, или вредные метаболиты. В сочетании с минимально обработанной пищей с высоким содержанием клетчатки, Prevotella производит полезные КЦЖК, которые могут помочь в поддержании равновесия [32, 33]. Диеты в западном стиле, которые наиболее часто используются пожилыми пациентами, с низким содержанием клетчатки, побуждает Prevotella переключаться на другой источник питания и использовать белок вместо клетчатки. Это приводит к образованию соединений, известных как аминокислоты с разветвленной цепью (BCAA), которые связаны с метаболическими нарушениями, что увеличивает вероятность развития метаболических заболеваний, в том числе сахарного диабета 2 типа. Это своеобразный биомаркер для раннего выявления инсулинорезистентности и последующего диабетического риска у лиц пожилого возраста [34]. Практическую значимость может иметь и определение Eggerthella lenta. Это обитатель кишечной микробиоты, который может использовать простую сахарную глюкозу, белок и некоторые стероиды для получения энергии, а также производить короткоцепочечный ацетат жирной кислоты, уремические токсины и имидазолпропионат, который может способствовать развитию атеросклеротического процесса, сахарного диабета 2 типа. Увеличение рода Tyzzerella, которое наблюдалось у лиц старше 60 лет, может говорить о возникновении риска заболеваний сердечно-сосудистой системы. В некоторых исследованиях повышенный уровень бактерии наблюдался при наличии атеросклеротических повреждениях, что служит пусковым фактором развития сердечно-сосудистых заболеваний. Также повышенное значение отмечалось у лиц, страдающих избыточной массой тела, сахарным диабетом 2 типа [35, 36, 37].
Уменьшение основных представителей бутиратпродуцирующих микроорганизмов рода Roseburia также наблюдалось у пациентов с метаболическими нарушениями. Бутират является основным источником энергии для клеток, выстилающих кишечник, обладает противовоспалительными свойствами и имеет важное значение для здоровья кишечника. Представители данного рода регулируют иммунную систему и помогают уменьшить воспаление. Низкие значения у пожилых пациентов были ассоциированы с метаболическими нарушениями либо с приемом лекарственных препаратов [38]. Alloprevotella является одним из нормальных кишечных микробов человеческого организма и широко встречается в ротовой полости и пищеварительном тракте, сохраняя приэтом стабильность. Относительная численность Alloprevotella явно снижается в условиях болезни.
Род Parasutterella как один из основных компонентов кишечной флоры, часто упоминаемых таксономических единиц кишечных бетапротеобактерий, который может влиять на физиологию хозяина, изменяя ключевые метаболиты. Сукцинат, один из КЦЖК, продуцируемых Parasutterella, может способствовать колонизации анаэробными бактериями, поддерживать гомеостаз кишечной микробиоты, стимулировать глюконеогенез и нормализовать уровень глюкозы. Parasutterella как продуцент производных пурина, таких как инозин, гипоксантин и ксантин, которые играют роль в регуляции иммунитета хозяина и поддержании стабильности слизистой оболочки кишечника, что очень важно для гериатрического пациента. Представители рода Subdoligranulum являются строго анаэробным, не образующим спор, производящим бутират, грамотрицательными микроорганизмами. Серия исследований на людях показала, что увеличение колоний было связано с улучшением метаболического здоровья. Этот род бактерий положительно коррелировал с бактериальным разнообразием микробиоты, а также с уровнями холестерина и ЛПНП и с показателями чувствительности клеток к инсулину [39]. Phascolarctobacterium – это грамотрицательная, не образующая спор и строго анаэробная бактерия, впервые выделенная от здорового человека-донора и охарактеризованная как бактерия, утилизирующая сукцинат и в значительной степени продуцирующая ацетат/пропионат. Отмечается повышение у лиц с нарушением толерантности к глюкозе. Группа Eubacterium ruminantium представляет собой разновидность грамположительных строго анаэробных бактерий, типичных для нормальной микрофлоры кишечника человека, составляющих значительную часть всех микроорганизмов, населяющих желудочно-кишечный тракт. Некоторые виды могут превращать холестерин в 5β-копростанол и участвовать в деконъюгации желчных кислот. Многие эубактерии метаболизируют углеводы и пептоны с накоплением маслянистой, уксусной, муравьиной и других органических кислот, используемых энтероцитами в метаболических процессах. Большинство видов данного рода являются сахаролитическими, то есть способны ферментировать углеводы с накоплением смеси КЦЖК. Отдельные штаммы сахаролитических эубактерий также могут синтезировать витамины, в частности кобаламин, аминокислоты (аланин, валин, изолейцин), расщеплять целлюлозу, участвовать в метаболизме стероидных гормонов. Увеличение показателей данного рода может указывать на развитие метаболических нарушений. Группа Christensenellaceae R-7 отвечает за развитие абдоминального ожирения у людей, причем большее влияние наблюдается у пожилых пациентов. Было установлено, что обилие этого рода бактерий отмечается у пациентов с избыточной массой тела [40]. Род Parabacteroides также признан основной частью кишечной флоры и выполняет важные физиологические функции у хозяина. Вид Parabacteroides distasonis является наиболее изученным штаммом Parabacteroides в кишечнике человека, при этом большинство исследований показывают, что данный представитель относительно низок у пациентов с ожирением, нарушением толерантности к глюкозе. Parabacteroides distasonis обладает способностью трансформировать желчные кислоты, продуцировать янтарную кислоту и способствовать увеличению желчных кислот, тем самым регулируя метаболизм хозяина. Другие виды Parabacteroides, выделенные из кишечника, такие как Parabacteroides goldsteinii, имеют аналогичные эффекты [41]. Наряду с этим может отмечаться высокое значение Megasphaera, которая является анаэробной бактерией и входит в состав нормальной микрофлоры кишечника. Данная бактерия способна к утилизации лактата и производству полезного бутирата. Megasphaera может снижать токсичность лактата при избыточном его производстве. Лактат вырабатывается микробами, колонизирующими кишечник человека, как конечный продукт углеводного брожения. В нормальных условиях лактат обнаруживается редко, поскольку он быстро превращается другими бактериями в полезные КЦЖК. Накопление лактата может быть серьезным, вызывая нейротоксичность. Накопление лактата в толстом кишечнике снижает pH просвета, разрыхляет ткань кишечника и может вызывать диарею. Секвенировав рибосомные РНК-гены кишечных микробов, исследователи определили обилие определенных групп бактерий, принадлежащих к роду Megasphaera у пациентов с преддиабетом. Было показано, что эти бактерии модулируют активность других бактерий и повышают уровень пищевых сахаров в толстой кишке.
Терапевтически значимым может быть и снижением рода Ruminococcus. Это бактерия энтеротипа, которая проникает в кишечник, обладает способностью ферментировать сложные углеводы, такие как целлюлоза, пектин и крахмал, а также производит ацетат и пропионат. Род Ruminococcus неоднороден и включает как полезные, так и вредные виды. Например, известно, что Ruminococcus bromii оказывает благотворное влияние на здоровье, тогда как другие виды Ruminococcus обладают провоспалительным действием. Данный вид считается краеугольным камнем микробиома кишечника за его способность разрушать устойчивый крахмал. Он может производить короткоцепочечный ацетат жирных кислот, который другие бактерии, такие как Agathobacter rectalis используют для производства КЦЖК, таких как бутират. Исследования показывают, что роль R. bromii в качестве основного разрушителя крахмала помогает стимулировать рост видов бактерий, продуцирующих бутират. Наряду с этим, имеются убедительные доказательства, подтверждающие связь между Erysipelotrichaceae и метаболизмом липидов хозяина, что требует дополнительного изучения метаболических профилей этих организмов и их влияния на хозяина. Сообщалось о частичной потере биосинтеза жирных кислот в геномах некоторых представителей Erysipelotrichaceae. Кроме того, обнаружение того, что специфические таксоны внутри Erysipelotrichaceae могут коррелировать с хроническим воспалением, в то время как другие являются высокоиммуногенными штаммами, добавляет вес к важности правильной характеристики этого бактериального семейства и может, в конечном итоге, предоставить микробные мишени для борьбы с метаболическими нарушениями. Тем не менее, стоит отметить, что современные данные, связывающие это бактериальное семейство с заболеванием, являются коррелятивными, и необходимы исследования, посвященные прямому влиянию изменений в численности Erysipelotrichaceae на хозяина.
Увеличение кластера сульфатредуцирующих бактерий (Bilophila, Desulfovibrio) может говорить о высоком содержании ЛПНП, общего холестерина, глюкозы. Данные бактерии обладают способностью осуществлять восстановление сульфата с образованием сероводорода (H2S). Bilophila, Desulfovibrio обладают способностью связываться с муцином слизистого барьера толстой кишки человека, используя его в качестве субстрата для производства сероводорода. Сероводород является цитотоксичным соединением, а некоторые штаммы синтезируют магнетит, который, вероятно, может вызывать олигомеризацию и агрегацию белка α-синуклеина. Повышенный уровень сероводорода способствует нарушению кишечного барьера, системному воспалению, дисметаболизму желчных кислот и изменению метаболического профиля. Кроме того, чрезмерный рост данных бактерий может вызвать дисфункцию барьера слизистой оболочки толстой кишки, влияя на метаболизм бутирата - основного энергетического вещества для эпителия толстой кишки. Чрезмерный рост H2S-продуцирующих бактерий представляет очевидную угрозу этой барьерной функции, поскольку сульфиды нарушают окисление бутирата [42].
Помимо этого, наиболее часто встречается увеличение представителей патогенной флоры, что может быть связано с ослабленным иммунитетом хозяина старшей возрастной группы. Возможно нахождение Campylobacter в организме в качестве носителя без проявления клинической симптоматики. При неблагоприятных условиях вызывает клиническую картину острой кишечной инфекции, осложнениями которой может быть воспаление парных суставов – лодыжек, коленей, запястья, мелких суставов рук и синдром Гийена-Барре. Наиболее распространенный возбудитель гастроэнтеритов среди представителей рода – Campylobacter jejuni. Еще один вид Campylobacter ureolyticus – новый важный желудочно-кишечный патоген. Заболеваемость может быть связана с пациентами с иммунными нарушениями, причем случаи заболевания выявляются у пациентов с ослабленным иммунитетом и сахарным диабетом 2 типа. Увеличение рода Megamonas, который может использовать несколько моносахаридов, таких как арабиноза, глюкоза и ксилоза. Конечными продуктами метаболизма являются пропионовая и уксусная кислоты, а также небольшие количества молочной и янтарной кислот. В некоторых исследованиях была ассоциация с изменениями в жировом и углеводном обменах пациентов. При этом синтез желчных кислот повышался при усугублении тяжести основного заболевания и наблюдался у лиц, страдающих ожирением. Желчные кислоты имеют решающее значение для эмульгирования липидов и поддержания гомеостаза глюкозы в печени, и они оказывают сильное противомикробное действие благодаря своим детергентным свойствам, которые, вероятно, изменяют среду кишечной микробиоты, подавляя рост восприимчивых бактерий. Несмотря на то, что толерантность к желчным кислотам проявляется штаммоспецифическим свойством, грамотрицательные бактерии, как правило, более устойчивы к противомикробным эффектам желчных кислот, чем грамположительные бактерии. Данная бактерия регулирует содержание жира в печени и состав видов липидов, а также уменьшает воспаление жировой ткани у мышей с высоким содержанием жира [43]. Обнаружение Klebsiella в желудочно-кишечном тракте пожилого человека, в общем случае, не требует лечения. Она является нормальным представителем микробиоты кишечника, когда определяется в пределах нормы. Способна вызвать клинические проявления болезни только при большом количестве. При нарушении функционирования органов ЖКТ или в результате внешних воздействий, а также антибиотикотерапии побочным действием которой является подавление основных представителей нормальной микрофлоры, тормозящих чрезмерный рост патогена, возможно значительное увеличение количества Klebsiella в организме и развитие инфекции.
В повышенном количестве может приводить к развитию колита, а также может быть маркером хронического панкреатита, часто встречающегося у пациентов с измененным углеводным обменом, других метаболических нарушений. Часто ее изобилие связано с заболеваниями в популяции пациентов с артериальной гипертензией. Выявление Enterobacter в повышенном значении может говорить о развитии метаболических нарушений. В небольшом количестве бактерия встречается в ротовой полости и кишечнике здоровых людей. Повышение представленности и попадание Enterobacter в другие органы может вызывать воспалительный процесс, во многом, за счет производства мощных эндотоксинов. Это потенциальная причина развития воспаления органов ЖКТ и мочевыводящих путей, особенно у лиц пожилого возраста. Некоторые виды бактерии участвуют в развитии метаболического синдрома. Недавние исследования показали, что вид Enterobacter cloacae B-29 в кишечнике может способствовать развитию ожирения у пациента. Enterobacter cloacae – наоборот, индуцирует развитие ожирения и резистентность к инсулину, но при этом может являться пусковым фактором при обострении хронических заболеваний. Enterobacter участвует в изменении липометаболизма, включая лептин-резистентный фенотип, повышенную экспрессию ацетил-Коа-карбоксилазы 1 типа, синтетазы жирных кислот и ген-рецептора, активируемого пролифератором пероксисом в печени. Различные виды Enterobacter, по своей природе, устойчивы к большинству антибактериальных препаратов: ампициллину, амоксициллину, амоксициллин-клавуланату, цефалоспоринам первого поколения и цефокситину, благодаря продукции конститутивной бета-лактамазы, что усугубляет лечебные мероприятия у пожилых пациентов в отношении бактериальных инфекций. Это позволяет им выживать и разрастаться в кишечнике людей, получавших данные группы антибактериальных препаратов [44]. Enterobacter также могут быть cвязаны с риском развития сердечно-сосудистых заболеваний. Наряду с Enterobacter, бактерии рода Citrobacter – грамотрицательные типичные обитатели микрофлоры кишечника. обладают устойчивостью к ампициллину.
Citrobacter, как и Enterobacter, также связаны с ТМАО производством, что может являться основным фактором риска возникновения сердечно-сосудистых заболеваний и прогрессирования атеросклеротического процесса. В пределах рода Citrobacter существует 12 признанных видов, три из которых являются патогенными бактериями человека. Оказалось, что пожилые люди были наиболее подвержены риску инфицирования данной бактерии [45].
Заключение. Полученные сведения о влиянии жизнедеятельности микробиоты и метаболитов подтверждают их воздействие на процесс нарушения углеводного и липидного обменов, а также свидетельствуют о необходимости углубленного изучения биоразнообразия кишечной флоры у пациентов гериатрического профиля с коморбидной патологией. Данные особенности способны выявить новые механизмы возникновения сахарного диабета, дислипидемий, что может привести к усовершенствованию способов диагностического поиска заболеваний, коррекции проводимого лечения, предотвращению развития осложненных форм, улучшению качества жизни пациентов гериатрического профиля.
Информация о финансировании
Работа выполнена при поддержке Министерства науки и высшего образования Российской Федерации (в рамках национального проекта «Наука» (проект FZGW-2020-0001), уникальный номер реестра государственных заданий 075001X39782002).





















Список литературы