Ретроэлементы как мишени таргетной терапии опухолей (обзор)
Aннотация
Актуальность: В большинстве злокачественных опухолей определяется патологическая активация ретротранспозонов, которые вызывают геномную нестабильность вследствие воздействия на супрессоры опухолей и онкогены. Это отражается на профилях экспрессии определенных длинных некодирующих РНК и микроРНК в тканях специфических опухолей, поскольку ретроэлементы являются ключевыми источниками возникновения некодирующих РНК. Так как ретроэлементы служат драйверами инициации и прогрессирования канцерогенеза, перспективно применение препаратов, направленных на регуляцию их экспрессии. Цель исследования: Определить имеющиеся методы таргетного воздействия на ретроэлементы в противоопухолевой терапии, оценить пути их дальнейшего совершенствования для эффективного воздействия на злокачественные новообразования. Материалы и методы: Использованы базы данных Scopus, WoS, PubMed для анализа роли ретроэлементов в развитии опухолей, методов воздействия на них при лечении новообразований. Результаты: Эффективными в сайленсинге ретротранспозонов оказались ингибиторы обратной транскриптазы. Воздействия на модификаторы гистонов может приводить к ослаблению противоопухолевого иммунного ответа, поэтому для данного подхода необходимы РНК-гиды, направляющие формирование гетерохроматина в области расположения строго специфических ретроэлементов. Перспективным направлением является метод вирусной мимикрии, направленный на активацию интерферонового и Т-клеточного ответа на искусственным путем активированные эндогенные ретровирусы. Для этого используют ингибиторы метилтрансфераз гистонов, ДНК метилтрансфераз, деацетилаз гистонов. Наиболее эффективна их комбинация, особенно в сочетании с блокаторами контрольной точки PD-1. Расположение ретроэлементов в интронах генов стало основой для разработки сплайсосомной таргетной терапии, также инициирующей противоопухолевый иммунный ответ на двуцепочечные РНК транскрипты. Сделано предположение о возможности применения антисмысловых олигонуклеотидов, нацеленных на ретроэлементы, в противоопухолевой терапии. Такой подход применяется для лечения возрастной дегенерации желтого пятна, мышечной дистрофии Фукуямы, бокового амиотрофического склероза. В противоопухолевой терапии применяют антисмысловые олигонуклеотиды, направленные на микроРНК, протоонкогены и онкосупрессоры, тесно взаимосвязанные с ретроэлементами, которые могут стать перспективными мишенями для данных молекул. Заключение: В терапии опухолей возможно использование двух диаметрально противоположных стратегий воздействия на ретроэлементы: ингибирование и активация. Наиболее перспективный путь – комбинация данных способов со специфическим сайленсингом ретротранспозонов с помощью гидов (комплементарных РНК) и стимуляцией экспрессии не участвующих в канцерогенезе, но активирующих иммунный ответ элементов.
Ключевые слова: вирусная мимикрия, длинные некодирующие РНК, злокачественные новообразования, канцерогенез, микроРНК, мобильные генетические элементы, таргетная терапия, транспозоны
Введение. Мобильные генетические элементы представляют собой участки ДНК, способные к мобилизации в другие локусы. По способу перемещения их подразделяют на ДНК-транспозоны (вырезание и вставка), составляющие около 3% всех последовательностей ядерной ДНК, и ретроэлементы (РЭ), которые образуют копии за счет обратной транскрипции собственных РНК и вставкой кДНК в другой локус генома. К ретроэлементам относятся содержащие длинные концевые повторы (LTR) эндогенные ретровирусы человека (HERV), которые занимают 8% генома, и не содержащие LTR РЭ (non-LTR РЭ). К последним относятся автономные LINE и неавтономные SINE элементы (35% генома) [1]. Из них LINE-1 занимают 17% генома человека и характеризуются патологической активностью в злокачественных новообразованиях (ЗНО), включая рак простаты [2], толстой кишки [3], являясь инициатором опухолевого процесса [2].
РЭ являются ключевыми эволюционными источниками длинных некодирующих РНК (днРНК), о чем свидетельствует обнаружение фрагментов РЭ в 83% всех известных днРНК [4]. Более того, HERV [5] и LINE-1 [6] могут служить непосредственно в качестве генов днРНК при процессинге их транскриптов. В эволюции РЭ и ДНК-транспозоны стали источниками специфических микроРНК, участвующих в патогенезе различных ЗНО [7]. Теми же свойствами обладают днРНК. Так, произошедшая от HERV днРНК TROJAN вовлечена в механизмы прогрессирования тройного негативного рака молочной железы (ТНРМЖ) [8]. От HERV в эволюции возникли и другие днРНК, участвующие в канцерогенезе: днРНК HCP5 [9], днРНК PRLH1 [10] и lncMER52A [11] в клетках гепатоцеллюлярной карциномы. Процессинг днРНК может приводить к образованию специфических микроРНК, участвующих в канцерогенезе: при раке молочной железы экспрессируется днРНК LOC554202, которая процессируется в miR-31 [12] и днРНК H19 в miR-675 [13], из днРНК MIR497HG образуется pri-miR-497, предшественник miR-195 и miR-497 (которая связывается с рибосомами и образует онкосупрессорный пептид miPEP497) [14]. Таким образом, в ходе преобразований РЭ в геноме человека образуются эпигенетические молекулы и пептиды, участвующие в канцерогенезе (Рис. 1).

О важной роли РЭ в инициировании и прогрессировании ЗНО свидетельствуют результаты проведенных мета-анализов о достоверной активации Alu элементов [15] и LINE-1 [16] в тканях различных опухолей. Крупномасштабные исследования образцов ЗНО показали инсерции РЭ в геномах 35% [17] – 87% (для отдельных типов рака) из них, с активацией протоонкогенов под влиянием интегрированных промоторов HERV и LINE-1 [18]. Степень активации РЭ влияет также на выживаемость пациентов с ЗНО, что говорит о значимости РЭ в механизмах прогрессирования опухолей [19]. Поскольку большинство днРНК [4] и многие микроРНК, участвующие в канцерогенезе [7] произошли от РЭ и, соответственно, содержат в своем составе комплементарные РЭ последовательности, данные некодирующие РНК можно использовать для таргетной терапии, направленной на изменение активности строго определенных РЭ, участвующих в патогенезе ЗНО. В качестве основы для такой стратегии необходимо рассмотреть имеющиеся в настоящее время методы воздействия на РЭ в лечении ЗНО, усовершенствование которых может стать новым этапом развития онкологии совместно с эпигенетикой.
Ингибирование ретроэлементов в противоопухолевой терапии
Поскольку ЗНО характеризуются патологической активацией РЭ, которые вызывают геномную нестабильность, способствуя канцерогенезу, подавление экспрессии РЭ могло бы стать основой для противоопухолевой терапии. В качестве мишеней для воздействия могут служить деметилазы гистонов (ДМГ), характеризующиеся гиперэкспрессией в ЗНО, что ведет к потере гетерохроматина и активации РЭ. В различных типах опухолей определяются повышенные уровни представителей подсемейств ДМГ KDM5A/B/C/D семейства JARID1, которое деметилируют H3K4me2 и H3K4me3. В связи с этим для лечения ЗНО предлагаются селективные ингибиторы деметилаз, такие как CPI-455 и 1,7-нафтиридины, эффективные в отношении устойчивых к химиотерапии ЗНО [20]. ДМГ KDM1A (LSD1) подавляет экспрессию HERV и гены, содержащие LTR в своих промоторах, за счет деметилирования H3K9 и усиления ацетилирования H3K27 и метилирования H3K4 [21]. Однако в экспериментах на выделенных от пациентов клетках рака молочной железы была выявлена ассоциация повышенной экспрессии KDM1A с ослабленным иммунным ответом и скудным проникновением в ткань опухоли CD8+ Т-клеток и низким уровнем экспрессии лиганда программированной клеточной смерти (PD-L1) [22].
Воздействовать на вызванную активированными РЭ геномную нестабильность возможно с помощью специфических метилтрансфераз гистонов, например SETDB1 (ESET, KMT1E), которая действует на H3K9me3 (эпигенетическая метка замалчивания РЭ) независимым от ДМТ способом за счет взаимодействия с KRAB белком цинковых пальцев [23]. Было выявлено также, что, помимо подавления РЭ, SETDB1 препятствует функции транскрипционных факторов CDX2, ELF3, HNF4G, PPARG, VDR. Поэтому истощение SETDB1 в эксперименте способствовало переходу стволовых клеток колоректального рака в постмитотическое состояние с восстановлением нормальной морфологии и глобального профиля экспрессии генов дифференцированных клеток [24]. Более того, истощение SETDB1 вызывает активацию РЭ, индуцируя экспрессию генов вирусного ответа, вызывая гибель клеток острого миелобластного лейкоза под влиянием SETDB1 [25]. Полученные данные свидетельствуют о том, что подавление РЭ при ингибировании ДМГ в терапии ЗНО, помимо устранения геномной нестабильности (антиканцерогенный эффект), снижает иммунный ответ против опухоли, что нужно учитывать в разработке подходов терапии. Наиболее перспективно в данном отношении выявление активации специфических РЭ, являющихся индуктором канцерогенеза, воздействуя на них таргетной терапией с использованием микроРНК, комплементарных РЭ, в связи с происхождением от них в эволюции [7]. МикроРНК и днРНК могут быть использованы также как гиды для таргетного воздействия на строго определенные РЭ, активность которых вовлечена в канцерогенез. В качестве гидов можно использовать также антисмысловые олигонуклеотиды (АСО) (Рис. 2).

Хотя для ингибирования РЭ с использованием в качестве объектов модификаторы гистонов необходимо использование гидов, воздействие на ферменты самих РЭ более перспективно. В клинических исследованиях при колоректальном раке использование нуклеозидных ингибиторов обратной транскриптазы (НИОТ), показало достоверную эффективность. Помимо устранения геномной нестабильности, вызванной ретроэлементами, НИОТ индуцировали повреждение ДНК и интерфероновый ответ против опухоли [3]. Противоопухолевая эффективность НИОТ определена в отношении гормон-резистентного рака простаты [2]. На линии клеток рака молочной железы использование НИОТ абакавира и ставудина показало значительное увеличение количества и скорости гибели клеток, ингибирование их миграционной способности, особенно в комбинации с паклитакселом [26]. Проведенные мета-анализы показали также снижение риска гепатоцеллюлярной карциномы у принимающих НИОТ тенофовир больных хроническим вирусным гепатитом В [27].
Перспективно также использование ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ). К ним относится эфавиренз, который показал свою противоопухолевую активность на клетках рака поджелудочной железы [28]. ННИОТ этравирин, вызывающий деградацию AGR2 (белок эндоплазматической сети, секретируемый опухолевым микроокружением) in vitro подавлял пролиферацию, миграцию и инвазию опухолевых клеток. На моделях мышей комбинация паклитаксела с этравирином более эффективно ингибировала прогрессирование рака яичника [29]. Нужно отметить, что выраженная экспрессия обратной транскриптазы теломеразы ассоциирована с плохим клиническим ответом на ингибиторы иммунных контрольных точек [30], в связи с чем ННИОТ могут быть предложены в комбинированной терапии с данными препаратами.
Лечение опухолей путем активации ретроэлементов
Хотя активация РЭ играет важную роль в инициации и прогрессировании ЗНО [15-19], в иммунотерапии опухолей РЭ применяют для вирусной мимикрии (ВМ) при помощи запуска противовирусного ответа [31]. Впервые эта методика была описана в 2015 году при лечении рака яичника. С помощью ингибитора ДНК-метилтрансферазы (иДМТ) усиливалась иммунная передача сигналов через пути защиты от вирусов – запускается цитозольное восприятие двуцепочечной РНК (дцРНК) HERV, вызывая апоптоз под влиянием интерферона. Отключение таких сенсоров дцРНК как MAVS (митохондриальные антивирусные сигнальные белки) и TLR3 (Толл-подобные рецепторы) вдвое ослабляет, а блокирование интерферона-бета или его рецептора отменяет этот ответ [32]. При вирусной мимикрии HERV действуют также в качестве внутренних адъювантов, распознающихся цитотоксическими CD8+ Т-лимфоцитами, с последующим уничтожением раковых клеток. Наиболее мощный противоопухолевый эффект может быть достигнут при комбинации ВМ и Т-клеточного ответа [33]. Для это перспективно использование ДНК-вакцинации против кодирующих HERV генов, таких как Env, что, помимо интерферонового ответа, вызывает антигенспецифический противоопухолевый ответ CD8+ Т-клеток (Рис. 3). Планируется применение терапевтических вакцин на основе аденовирусного вектора. При этом стимулируется ответ CD8+, CD4+ Т-клеток и В-клеток [34].

Вирусная мимикрия за счет активации HERV была продемонстрирована на клетках колоректального рака при использовании иДМТ 5-аза-2-деоксицитидина (5-AZA) [35]. Для вирусной мимикрии используются также более специфические агенты, воздействующие на EZH2 (Enhancer of zeste homolog 2), субъединицу репрессивного комплекса Polycomb 2, устанавливающего метки метилирования лизина 27 гистона Н3 (Н3K27me). Пример ингибиторов EZH2 – Таземетостат, применяемый для лечения эпителиоидной саркомы, диффузной крупноклеточной В-клеточной лимфомы, фолликулярной лимфомы и мезотелиомы [36]. Планируется использование ингибиторов EZH2 в лечении резистентного к химиотерапии рака молочной железы [37], а также рака простаты за счет потенцирования ответа на блокаду контрольной точки PD-1 [38].
Наибольшего успеха вирусной мимикрии РЭ можно добиться при комбинации ингибирования ДМТ и деацетилазы гистонов (ДАГ). В эксперименте на мышах с моделированным немелкоклеточным раком легкого комбинация ингибирования ДМТ и ДАГ усиливала антигенную презентацию за счет повышенной экспрессии дцРНК, со стимуляцией интерферона-I, одновременно с подавлением сигналинга MYC и стимуляцией хемоаттрактанта Т-лимфоцитов CCL5. В результате подавлялось уклонение опухоли от иммунного ответа, повышалось количество Т-клеток и их инфильтрация (CD8+ лимфоцитами) [39]. Выраженный противоопухолевый эффект за счет стимуляции интерферона-I и Т-клеточного иммунного ответа был получен в эксперименте на мышах с эпителиальным раком яичника при комбинации ДМТ и ДАГ, особенно при сочетании с ингибитором контрольных точек α-PD-1 [40].
Метилтрансферазы гистонов, способствующие триметилированию H3K9me3 с сайленсингом LINE и ERV, предотвращают активацию интерферона. Их ингибирование также может быть использовано в вирусной мимикрии для лечения опухолей. Метилтрансфераза SENDB1, которая рекрутируется с помощью KAP1 или комплекса сайленсинга HUSH (human silencing hub complex) в области расположения РЭ, является мишенью ингибиторов для лечения острого миелобластного лейкоза [41]. Ингибиторы метилтрансферазы гистонов G9a показали свою эффективность в отношении клеток рака яичника [42]. Было показано, что метилтрансфераза гистонов SUV39H1 рекрутируется с помощью FBXO44 в локусы расположения РЭ и может быть использована для вирусной мимикрии в раковых клетках [1].
Роль ретроэлементов в спласосомной таргетной терапии опухолей
Поскольку РЭ занимают большую часть нуклеотидных последовательностей генома человека (69%) [43], помимо формирования генов некодирующих РНК, они распределены в значительном количестве в интронах генов. При этом сами сплайсосомные интроны и компоненты сплайсосомы в эволюции произошли от РЭ [44]. Поэтому интроны являются удобными мишенями в вирусной мимикрии для сплайсосомной таргетной терапии (СТТ) опухолей. Многие факторы сплайсинга являются мишенями микроРНК, которые могут быть использованы для СТГ. Одним из вариантов является активация вирусной мимикрии за счет удержания интронов. При раке почки микроРНК miR-30a-5p и miR-181a-5p подавляют экспрессию SRSF7 (serine/arginine-rich splicing factor 7). В результате нарушается сплайсинг регуляторов апоптоза и супрессоров опухолей, что приводит к канцерогенезу [45]. Индуцированные ретиноевой кислотой miR-10a и miR-10b приводят к репрессии SRSF1 и к терминальной дифференцировке клеток нейробастомы [46].
В эволюции сохраняются множественные инсерции РЭ в интроны, межгенные и регуляторные области, которые активно включаются в качестве мишеней для СТГ. Поэтому в СТГ могут быть использованы в качестве мишеней ERV, расположенные в 3’-нетранслируемых областях специфических генов (с обратной ориентацией), регулируемых такими факторами как STAT1 и EZH2. При двунаправленной транскрипции таких генов происходит активация интерферона-гамма в ответ на образуемые при экспрессии ERV двуцепочечных РНК (Рис. 4). В опухолях индукция таких HERV приводит к экспрессии главного комплекса гистосовместимости класса 1. Однако развивающийся при этом иммунный ответ является патологическим, в связи с чем данное явление может стать перспективным объектом для иммунокоррекции в терапии ЗНО [47]. Эффективность СТГ была продемонстрирована в эксперименте на MYC-позитивных клетках ТНРМЖ с использованием сплайсосомного модулятора SD6 (sudemycin D6) [48]. Для клеток рака простаты характерна высокая чувствительность к ингибитору сплайсосомы E7107, нацеленному на комплекс SF3B [49].

Ретроэлементы и антисмысловые олигонуклеотиды в онкологии
В регуляции активности РЭ могут быть использованы АСО, последовательности РНК длиной 12-25 нуклеотидов, которые ингибируют экспрессию генов путем связывания с клеточными мРНК, а также микроРНК и днРНК [50]. Поскольку РЭ являются ключевыми эволюционными источниками (вследствие этого содержат идентичные последовательности) генов днРНК [4] и микроРНК [7], использование таких АСО может оказывать воздействие на РЭ. Мишенями АСО, помимо некодирующих РНК, являются компоненты сплайсинга, трансляции РНК, деградации мРНК, высвобождения секвестрированного белка [50].
В современной научной литературе не представлены данные о применении АСО, нацеленных на РЭ в онкологии. Однако имеется информация в отношении других заболеваний, таких как синдром Ангельмана. На нейронах, полученных от пациентов с синдромом Ангельмана были использованы АСО для гена UBE3A, который регулирует экспрессию гена PEG10, произошедшего от РЭ (ген GAG) [51]. Показана возможность применения АСО против Alu при возрастной дегенерации желтого пятна [52], против SVA (SINE-VNTR-Alu) РЭ при мышечной дистрофии Фукуямы [53], против HERV HML-2, участвующего в патогенезе бокового амиотрофического склероза [54].
АСО, такие как кастирсен, успешно применяются в онкологии уже больше двух десятилетий, особенно в комбинации с другими противоопухолевыми препаратами [55]. Мишенями для АСО являются различные молекулы, вовлеченные в канцерогенез, такие как 11 экзон гена NF2 при нейрофиброматозе 2-го типа [56], FLT3-ITD (fms-подобная тирозинкиназа 3) и микроРНК miR-125b при остром миелобластном лейкозе [57], микроРНК miR-17 (для µ-17-ON), miR-21 (для µ-21-ON) и miR-155 (для µ-155-ON) при лимфосаркоме [58], рецептора инсулиноподобного фактора роста 1 (IGF1R) для CT102 [59], Smad7 и Stat3 для Smad7-AS [60], мРНК рибонуклеотидредуктазы для GTI2040 [61], Stat3 при гепатоцеллюлярной карциноме для Stat3-AS [62], Toll-подобного рецептора 9 (TLR9) для ODN, трансформирующего фактора роста-β2 (TGF-β2) для TIO3 при раке легкого [63], TGF-β2 для TASO при ТНРМЖ [64]. Следует отметить, что перечисленные мишени относятся к онкосупрессорам и онкогенам, взаимосвязь которых с ретроэлементами имеет ключевое значение в канцерогенезе [65]. Поэтому перспективным подходом может стать использование АСО, нацеленных на патологически активированные в опухолях РЭ. Возможен комбинированный подход, в котором ингибируются специфические РЭ, являющихся драйверами опухолевого процесса и активируются определенные РЭ, наиболее подходящие для вирусной мимикрии (Рис. 5).
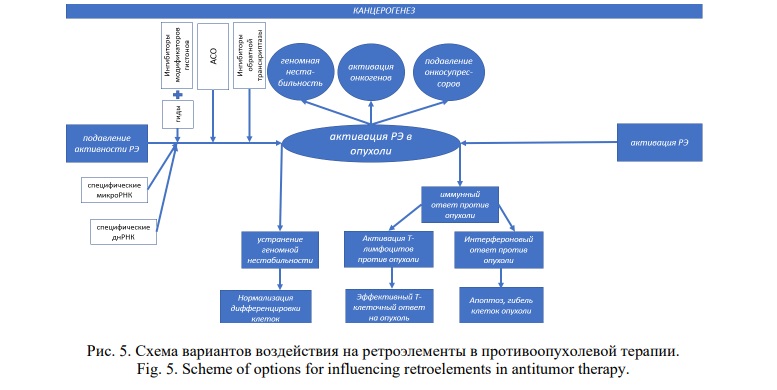
Заключение. Патологическая активация ретроэлементов играет важную роль в инициации и поддержании опухолевого процесса в связи с развитием геномной нестабильности, активацией онкогенов и подавлением онкосупрессоров. Однако подавление РЭ путем неспецифического воздействия на ацетилазы и метилтрансферазы гистонов не применяется, поскольку устраняет противоопухолевый иммунный ответ. Напротив, неспецифическая активация РЭ в опухолях оказалась эффективной за счет вирусной мимикрии против дцРНК с запуском Т-клеточной и интерфероновой реакций. Для этого используются ингибиторы метилтрансферазы и деацитилазы гистонов и ДМТ, наиболее эффективно – в комбинации с ингибиторами контрольной точки. Расположение РЭ в интронах генов стало основой для сплайсосомной таргетной терапии опухолей. Эффективными противоопухолевыми молекулами являются АСО, нацеленные на различные молекулярные мишени, в качестве которых многообещающими могли бы стать РЭ. Однако подобных исследований пока не проводилось, что является предметом дальнейших работ. Имеются данные о применении АСО против ретроэлементов при возрастной дегенерации желтого пятна, мышечной дистрофии Фукуямы и боковом амиотрофическом склерозе. Эффективным методом противоопухолевой терапии оказалось предотвращение инсерций РЭ с помощью НИОТ и ННИОТ. Наиболее перспективно использование нкРНК, оказывающих таргетное воздействие на строго определенные РЭ, участвующие в развитии злокачественных новообразований.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы