Применение метода Менделевской рандомизации для оценки причинно-следственных связей в офтальмологии (обзор)
Aннотация
Актуальность: Менделевская рандомизация (МР) широко применяется в генетической эпидемиологии и позволяет использовать результаты полногеномных исследований ассоциаций (genome-wide association studies; GWAS) для оценки причинно-следственных связей между различными факторами риска и клиническими признаками или заболеваниями, в том числе в офтальмологии. Цель исследования:Оценить текущие возможности применения МР в офтальмологических исследованиях. Материалы и методы:Проведен поиск научных статей в системах Scopus, Medline и Web of Science по состоянию на август 2022 с помощью протокола PRISMA «Предпочтительные параметры отчетности для систематических обзоров и мета-анализа». Была извлечена следующая информация: исследуемый(е) фактор(ы) риска и заболевания (состояния), дизайн Менделевского рандомизированного исследования, проведенный(е) анализ(ы) чувствительности, если таковой имелся, использованный(е) генетический инструмент(ы), а также была ли подтверждена в результате исследования причинно-следственная связь между фактором риска и исходом. Результаты:В текущий обзор были включены 37 публикаций, в которых было проверено 211 ассоциаций фактора риска с офтальмологическим заболеванием (признаком). Исследования были опубликованы в рецензируемых журналах по август 2022 года; 25 из них (67,5%) опубликованы в 2020 г. или позже. Методом МР установлена причинно-значимая роль липидов сыворотки крови, С-реактивного белка, свободного тироксина, курения и приема алкоголя в развитии возрастной макулярной дегенерации. Для глаукомы была показана значимость диабета 2 типа, глюкозы сыворотки крови, наличия аномалий рефракции, повышенного внутриглазного давления. МР анализ выявил влияние повышенного внутриглазного давления, уровня образования, массы тела при рождении на развитие аномалий рефракции. Роль диабета 2 типа, артериальной гипертензии и курения в развитии катаракты была определена с помощью метода МР. Заключение:Результаты 97 МР исследований в офтальмологии выявили значимую роль ряда факторов риска в развитии глазных заболеваний, что послужит ориентиром для проведения клинических испытаний и разработки лекарственных препаратов.
Ключевые слова: Менделевская рандомизация, полиморфизм, полногеномные исследования ассоциаций, заболевания глаз
Введение. Офтальмологические заболевания являются важной проблемой для общественного здравоохранения. Рост распространенности угрожающих зрению нарушений, таких как некоррегированные аномалии рефракции и катаракта, является одной из основных причин слепоты и нарушений зрения во всем мире [1, 2], что подчеркивает их социальную значимость. В настоящее время отмечается рост распространенности офтальмологической патологии, связанный с повсеместным старением населения, причем в возрастной группе старше 40 лет прогнозируется троекратное увеличение числа людей, страдающих заболеваниями глаз [3] в каждые последующие 10 лет жизни. Поэтому выявление причинно-значимых факторов риска офтальмологических заболеваний имеет важное значение в своевременной диагностике и лечении заболеваний глаз. Тем не менее, стандартные наблюдательные исследования имеют ограниченные возможности для оценки причинно-следственной связи между воздействием (фактором риска) и исходом (клиническим состоянием), поскольку смещение оценки и обратная причинно-следственная связь могут привести к систематической ошибке, что отражено в высказывании: «ассоциация не подразумевает причинно-следственную связь» [4, 5]. Рандомизированные контролируемые испытания (РКИ) считаются золотым стандартом метода установления причинно-следственных связей в эпидемиологии [6, 7]. Однако и у РКИ имеются определенные недостатки: они занимают много времени, требуют значительных ресурсов и могут быть нарушать этические нормы – например, представим себе РКИ, в котором изучается роль школьного образования на развитие миопии. В этом случае исследователи должны случайным образом распределить детей в две группы: одних обучать, а вторую оставить без учебной нагрузки, что является невыполнимым заданием.
Менделевская рандомизация (МР) – это статистический метод в эпидемиологии, при котором генетические варианты (SNP), связанные с определенным воздействием (фактором риска), например, курением, используются в качестве инструментальных переменных для оценки причинно-следственного воздействия данного воздействия на интересующий исход, такой как конкретное заболевание глаз [8]. МР является эффективным способом контроля наличия обратной причинно-следственной связи и позволяет снизить риск систематической ошибки из-за смешения оценки [9].
Катан в 1986 г. [10] представил концепцию использования генетических вариантов в качестве инструментальных переменных. В своей новаторской работе он предложил использовать полиморфизмы гена аполипопротеина Е (АРОЕ) для определения причинно-следственной связи между уровнем холестерина в сыворотке и раком. Он предположил, что пациенты, наследующие аллель «снижающую уровень холестерина», не будут систематически отличаться от людей, не наследующих такой аллель, следуя закону Менделя о случайном распределении аллелей при зачатии. Тем не менее, люди, унаследовавшие аллель, снижающую уровень холестерина, будут иметь риск рака чуть ниже среднего, при условии, что более высокий уровень холестерина вызывает повышенный риск рака. Gray и Wheatley [11] были первыми авторами, использовавшими термин «Менделевская рандомизация», который был позднее популяризирован Davey Smith и Ebrahim [12].
Чтобы быть валидной (допустимой) инструментальной переменной, генетический вариант должен соответствовать трем критериям: (1) быть значимо связанным с воздействием (фактором риска) (βGX на Рис. 1); (2) быть не связанным с факторами, искажающими ассоциацию «воздействие-результат» (βGU = 0 на Рис. 1); (3) быть связанным с результатом только через воздействие (βGY = 0 на Рис. 1). Поскольку результаты многочисленных полногеномных исследований ассоциаций (genome-wide association study; GWAS) общедоступны [13], обычно несложно найти генетические варианты, соответствующие первому критерию; исследователи обычно выбирают полиморфизмы, связанные с фактором риска с уровнем значимости p<5 E-08. Невозможно проверить соответствие второму и третьему критерию; поэтому был разработан ряд анализов чувствительности, чтобы обеспечить достоверную оценку причинно-следственного ассоциации, даже если некоторые из генетических вариантов не являются валидным инструментальными переменными [14, 15, 16]. Среди основных статистических методов, применимых в анализах чувствительности следует отметить регрессию Эггера (MR-Egger), и метод взвешенной медианы (weighted median).

Менделевская рандомизация проводится на одной или двух выборках. В первом случае, степень корреляции SNP с фактором риска и исходом оценивается на одной выборке. Данный тип исследования требует доступа к генетической и фенотипической информации у каждого из участников этой выборки. Во втором случае одна выборка используется для оценки ассоциации генетических вариантов с фактором риска, а другая для оценки ассоциации с исходом. Двухвыборочный анализ МР позволяет использовать сводные статистические данные как индивидуальных GWAS, так и их мета-анализов, включающие коэффициенты регрессии и стандартные ошибки для генетических вариантов. Важным преимуществом этого метода является то, что они проводятся на больших выборках, позволяя увеличить статистическую мощность исследования, также результаты зачастую находятся в свободном доступе [17].
Интерпретация результатов МР-исследования требует учета множества факторов, в том числе выбора дизайна МР-исследования, валидности инструментальных переменных и достаточности мощности статистического теста. На основании выполнения вышеперечисленных условий интерпретация результатов МР-исследования должна по-прежнему основываться на принципах доказательной медицины [18], в том числе с применением метода триангуляции, когда оцениваются данные, полученные различными методами из разных источников [19].
Несмотря на растущий интерес эпидемиологического исследовательского сообщества к применению метода МР, ранее сообщалось, что количество МР-исследований офтальмологических заболеваний ограничено [20]. Мы провели систематический обзор литературы по применению метода Менделевской рандомизации в офтальмологической эпидемиологии.
Цель исследования. Оценить текущие возможности применения МР в офтальмологических исследованиях.
Материалы и методы исследования. Авторы следовали контрольному списку предпочтительных элементов для систематического обзора и метаанализа (PRISMA)» [21] при проведении данного обзора.
Был проведен поиск статей для выявления исследований с использованием менделевского подхода рандомизации для оценки причинно-следственной связи различных факторов риска с признаками, связанными с глазами. Поиск проводился в базах данных Medline, Web of Science и Scopus с момента создания до марта 2022 года исследований МРТ, изучающих связь генетически предсказанных факторов риска с риском развития офтальмологического заболевания, используя следующий алгоритм: «Mendelian Randomization OR Mendelian Randomisation OR genetic instrumental variable OR genetic instrument) AND (glaucoma OR POAG OR NTG OR intraocular* OR IOP OR AMD OR macular* OR strabismus OR myopia OR refractive error OR hyperopia OR astigmatism)». Была извлечена следующая информация: исследуемый(е) фактор(ы) риска и заболевания (состояния), дизайн Менделевского рандомизированного исследования, проведенный(е) анализ(ы) чувствительности, если таковой имелся, использованный(е) генетический инструмент(ы), а также была ли подтверждена в результате исследования причинно-следственная связь между фактором риска и исходом.
Поскольку некорректный выбор инструментов может привести к систематической ошибке в оценки эффекта, мы проверяли критерии выбора инструментов (сила связи SNP-экспозиция) в каждом исследовани, была ли представлена информация о доле дисперсии фактора риска, объясненной инструментами. В случае проведения анализа чувствительности оценивалась согласованность результатов с точки зрения величины и направления эффекта.
Необходимо отметить, что в отечественной научной литературе отсутствуют публикации по данной тематике (по состоянию на август 2022 года)
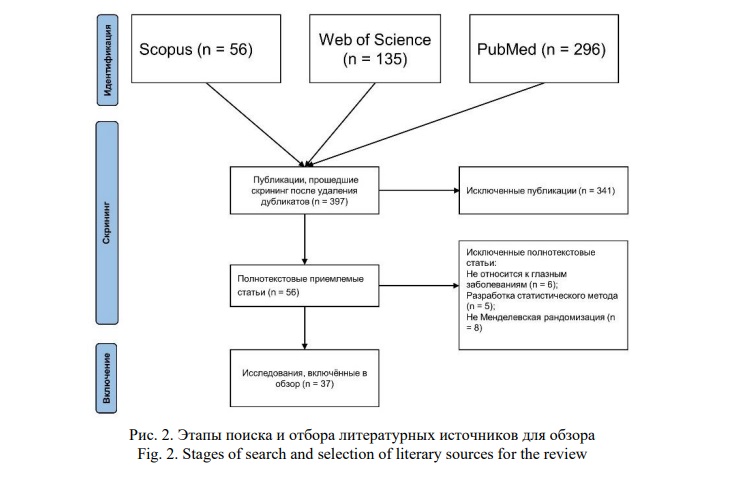
Результаты и их обсуждение. В ходе первоначального поиска было найдено 487 публикаций; 56 из них были оценены в полнотекстовом формате, при этом 19 были исключены, в результате чего 37 исследований были включены в текущий обзор (Рис 2). В этих 37 исследованиях было проверено 211 ассоциаций фактора риска с офтальмологическим заболеванием (признаком).
Исследования были опубликованы в рецензируемых журналах по август 2022 года; 25 из них (67,5%) опубликованы в 2020 г. или позже (Рис 3).

Исследуемые популяции
Регрессионные коэффициенты, количественно определяющие генетическую ассоциацию инструмента с фактором риска в основном были получены из полногеномных исследований ассоциаций (GWAS), проведенных среди участников европейского происхождения (187 анализов, 88,6%), тогда как доля GWAS на смешанной выборке была значительно меньше: 16 анализов, 7,6%, и всего 5 анализов было проведено на азиатской популяции, что составило 2,4%. Для 3 (1,4%) анализов не было приведено данных о выборке. Схожая картина наблюдалась и для популяций, в которых оценивалась ассоциация инструмента с заболеванием. Доля европейской выборке составила 185 анализов, 87,6%, азиатской выборке 14 анализов (6,6%), смешанных групп (европейцы и азиаты; 9 анализов, 4,3%); и для 3 (1,4%) анализов исходная популяция не сообщалась.
Размер выборки полногеномного исследования ассоциации, проведенного для фактора риска был указан в 26 (70,3%) публикациях для 164 анализов (77,8%). Размер выборки GWAS варьировался от 1966 до 1407282 человек, с медианным значением 188578 участников. Что касается GWAS для исходов, то размер выборки варьировался от 1966 для задней субкапсулярной катаракты до 536253 для старческой катаракты; медианное количество участников составило 70018 человек. В четырех (10,8%) публикациях не сообщалось о размере выборки GWAS для исходов в 9 проведенных МР анализах (4,3%).
Наиболее часто изучаемым фактором риска было влияние липидов сыворотки, которое было исследовано в 60 анализах (28,4%), за которыми следовали фенотипы, связанные с диабетом 2 типа (25 анализа, 11,8%). Что касается исхода, представляющего интерес, в большинстве исследований рассматривалось влияние воздействия на возрастную макулярную дегенерацию (ВМД; 93 анализа, 44,1%) и на глаукому и ее эндофенотипы [22] (50 анализов, 23,7%).
Выбор инструмента
Все генетические инструменты были выбраны на основе значимости их ассоциации с фенотипом воздействия; наиболее часто сообщаемый порог значимости был P<5 ‧10-8 (166 анализов, 78,8%). В одном исследовании (0,5%) использовались различные пороговые значения p в диапазоне от p<0,5 до p<10-7, а в 39 (18,5%) анализах порог значимости не сообщался. Доля дисперсии фактора риска (ДД), объясненная генетическими инструментами, является параметром, необходимым для расчета статистической мощности в менделевском анализе рандомизации (33); это значение было указано в 106 (50,2%) анализах. Самое низкое значение ДД было показано для уровня витамина D в сыворотке (0,1%), а максимальное значение ДД было сообщено для липопротеина A (16%); с медианным значением в 7%. При известных значениях ДД можно рассчитать статистическую мощность МР исследования, она была представлена в 66 анализах (31,2%). Исследователи использовали от 1 до 526 SNP в качестве инструментальных переменных, медианное значение составило 58 полиморфизмов. В 11 (5,2%) анализах применялся комбинированный полигенный индекс риска (Polygenic risk score или allele score), который рассчитывается как сумма аллелей, ассоциированных с фенотипом, а в качестве взвешивающего коэффициента используется оценка эффекта данного аллеля, полученная при проведении GWAS [23].
МР анализ и методы анализа чувствительности
МР на одной выборке проводился для проверки 24 ассоциаций (11,4%) в 8 исследованиях (21,5%); двухвыборочный дизайн МР применялся в 29 (78,3%), тестировавших 187 ассоциации (88,5%). В 187 анализах, в которых использовался дизайн МР с двумя выборками, для основным методом определения причинно-значимого влияния фактора риска на исход в 174 анализах (80,2%) был мета анализ оценок эффекта генетических вариантов с использованием метода взвешенных значений обратной дисперсии, тогда как в 12 анализах (5,5%) основным методом была регрессия Эггера. Анализы чувствительности были выполнены 182 (86,2%) раза. Из этих 182 анализов чувствительности подавляющее большинство (178 из 182) представляли собой МР-исследования на двух выборках. Метод МР Эггера был наиболее часто выполняемым анализом чувствительности (169 анализа, 80,1% всех анализов), за которым следовал метод взвешенной медианы (126 анализов, 59,7% всех анализов). Соответствие результатов анализов чувствительности с результатами основных статистических методов отмечалось в 150 из 182 МР.
Факторы риска и исходы
В 97 (45,9%) из 211 случаев МР подтвердила гипотезу о том, что фактор риска оказал причинно-значимое влияние на исход. Среди этих 97 значимых ассоциаций содержание липидов различных фракций в сыворотке было наиболее часто тестируемым воздействием (28 ассоциаций, 28,8%), тогда как возрастная макулярная дегенерация (48 ассоциаций, 49,5%) была наиболее часто тестируемым исходом.
Возрастная макулярная дегенерация (ВМД)
В восьми из 38 рассмотренных публикаций изучалось влияние различных факторов на риск развития ВМД [24-31]. В семи работах авторам удалось установить причинно-следственную связь (Табл. 1), значимые факторы риска представлены на рисунке 4.




ВМД является одним из наиболее изученных с генетической точки зрения заболеваний с момента проведения первого GWAS в 2005 году [32]. Полиморфизмы ряда генов (APOE, LIPC, CETP) ассоциированы как с ВМД, так и c показателями липидного профиля человека [33], поэтому неслучаен интерес исследователей к изучению роли липидов в развитии данного офтальмологического заболевания.
В трех публикациях оценивалась причинно-значимая роль липидов плазмы в патогенезе ВМД и было обнаружено, что генетически детерминированный уровень липопротеинов высокой плотности (ЛПВП) увеличивает риск ВМД (всех подтипов заболевания) как у европейцев, так и у азиатов. В своей работе Burgess и соавторы [24] использовали 86 SNP, значимо ассоциированных с ЛПВП в качестве инструментальных переменных. Кроме того, авторы изучили эффект полиморфизмов генов HMGRC и NCP1L1, кодирующих мишени липид-снижающих лекарственных препаратов на риск развития ВМД, проведя симуляцию клинического исследования, изучающего влияние этих препаратов на данное заболевание. Авторы пришли к выводу, что гетерогенность в результатах МР анализов может быть обусловлена тем, что полиморфизмы, ассоциированные с уровнем липидов, связаны с различными биологическими механизмами, каждый из которых по-своему вовлечен в патогенез ВМД. Например, МР анализ установил эффект полиморфизма гена CETP rs5880 на уровне ОШ = 2,10, что значительно выше оценки эффекта всех инструментальных переменных (ОШ = 1,22), а полиморфизмы гена LIPC были ассоциированы со сниженным риском ВМД. Такая разнонаправленность эффекта предположительно вызвана несоответствием между ассоциацией полиморфизмов (генов LIPC, CETP) с уровнем липидов крови и накоплением липидов в сетчатке глаза, являющимся важным фактором риска ВМД.
Fan и соавторы [25] пришли к схожим выводам, используя 96 SNP в качестве инструментов для МР анализа на европейской выборке и 81 SNP для изучения эффекта ЛПВП на ВМД в азиатской выборке. Выявленная разница между полученной оценкой эффекта в разных популяциях (ОШ = 1,21 для европейской и ОШ = 1,51 для азиатской выборки, соответственно, все р<0,05) может быть объяснена гетерогенной структурой выборок с преобладанием в каждой из них разных форм заболевания.
В работе Han и соавторов [26] изучалась роль восьми фракций липидов в развитии различных форм ВМД. Для этого исследователи провели ряд GWAS липидов крови на выборке Британского Биобанка (n = 382786 до 419185 человек) и использовали полученные сводные статистические данные для дальнейшего анализа. Всего было отобрано от 207 до 488 SNP ассоциированных с определенным фактором риска на полногеномном уровне значимости. Результаты МР анализа для ЛПВП (ОШ = 1,18-1,34 для разных форм ВМД) были сопоставимы с данными более ранних публикаций. Также были получены доказательства причинно-следственной связи между уровнем липопротеинов низкой плотности (ЛПНП) и риском ВМД; авторы пришли к выводу, что ЛПНП снижает риск для промежуточной стадии ВМД и географической атрофии (ОШ = 0,77 и 0,70, соответственно). Однако два предыдущих исследования [24, 25] не обнаружили доказательств причинно-следственной связи, аналогичное расхождение в результатах наблюдалось для триглицеридов (ТГ): Han и соавторы сообщили, что более высокие уровни ТГ снижали риск ВМД (ОШ = 0,74-0,84, p <0,05 для различных форм ВМД).
В исследовании, проведённом Kuan и соавт. [28], изучалось влияние широкого спектра потенциальных факторов риска, включая курение, употребление алкоголя, гипертонию (артериальное давление) и индекса массы тела на риск развития прогрессирующей ВМД. Авторы использовали данные крупномасштабных полногеномных исследований ассоциации факторов риска (от 462690 до 1323091 человек) и отобрали значительное число генетических инструментов: 336 SNP для оценки эффекта начала курения, 289 SNP – для индекса массы тела. Результаты свидетельствовали о значимой связи начала курения с ВМД, причем более сильный эффект был показан для неоваскулярной ВМД (ОШ = 1,26, 95% ДИ 1,03-1, 49, р = 0,02) по сравнению с географической атрофией (ОШ = 1,24, 95% ДИ 1,11-1,43, р<0,001). Также наблюдалась причинно-следственная связь между прекращением курения и снижением риска ВМД (ОШ = 0,66, 95% ДИ 0,50-0,87, р = 0,003), что еще раз подтверждает значимую роль курения в патогенезе ВМД. С помощью 85 SNP, ассоциированных с приемом алкогольных напитков было доказано влияние потребления алкоголя на риск развития ВМД (ОШ = 1,57, 95% 1,03-2,40, р = 0,04)
В одной публикации исследовалась взаимосвязь С-реактивного белка (СРБ), маркера воспаления, и ВМД [27]. В работах, опубликованных ранее, не было выявлена ассоциация полиморфизмов гена CRP, колирующего С-реактивный белок с ВМД, однако дисперсия СРБ, объяснённая этими полиморфизмами слишком мала и требовалось наличие более сильного инструмента для проведения МР анализа. Использовав 526 SNP, которые объясняли 13% дисперсии СРБ в качестве генетических инструментов, Han и соавторы обнаружили значимую связь СРБ с повышенным риском развития различных форм ВМД (ОШ от 1,15 до 1,52, p<0,05). В другом исследовании [29] изучалось влияние жирных кислот сыворотки крови на ВМД. Авторский коллектив Wang применил следующий подход к выбору генетических инструментов: для основного анализа исследователи выбрали три полиморфизма, rs10740118 гена JMJD1C, rs174547 гена FADS1 и rs16966952 гена NTAN1 руководствуясь результатами ранее проведенных исследований. Для анализа чувствительности использовались все полиморфизмы, независимо ассоциированные с жирными кислотами на полногеномном уровне значимости (10 SNP для линолевой кислоты и 16 для арахидоновой кислоты). Wang и соавторы обнаружили доказательства защитного действия линолевой кислоты, снижающего риск ВМД (ОШ = 0,97, 95% ДИ 0,945-0,990, р = 0,005). Однако, для арахидоновой кислоты повышение ее уровня в сыворотке крови было связан с ростом риска развития ВМД (ОШ = 1,034, 95% ДИ 1,012-1,056, р = 0,02). Тем не менее, авторы отметили небольшой размер выборки GWAS (n = 8631) для факторов риска как ограничение данного исследования.
В одной публикации была проверена взаимосвязь между аномалией рефракции и ВМД [30]. Wood и Guggenheim выявили наличие причинно-следственной связи, однако авторы пришли к выводу, что влияние аномалии рефракции было незначительным по сравнению с другими известными факторами риска. В исследовании, проведенном Li и соавторами в 2022 году [31], 24 генетических варианта были использованы в качестве инструментальных переменных, чтобы установить роль свободного тироксина в развитии ВМД. Авторы использовали итоговую статистику крупномасштабного GWAS гормонов щитовидной железы проведенного на выборке из 49269 участников и показали увеличение риска ВМД в зависимости от повышения уровня свободного тироксина (ОШ = 1,19, 95% ДИ 1,06-1,33, р = 0,005).
Глаукома
Внутриглазное давление и/или глаукома изучались как исходы в 15 исследованиях, в восьми из них была установлена причинно-следственная связь между фактором риска и исходом (Табл. 2, Рис. 5.).



Исследование Shen и соавторов [34] подтвердило гипотезу о том, что сахарный диабет 2 типа (СД2) является фактором риска первичной открытоугольной глаукомы (ПОУГ). Кроме того, эти авторы провели дополнительный МР анализ, предназначенный для изучения влияния определенных механизмов, участвующих в развитии СД2: а именно ожирения, функции В-клеток, регуляции инсулина и других метаболических процессов. Это было достигнуто за счет использования полигенных оценок риска (Polygenic risk score; PRS) для конкретных биологических механизмов в качестве инструментальных переменных. Результаты МР анализа, в котором использовалась комбинированная в PRS оценка эффекта 39 SNP показали, что у лиц с СД2 повышен риск развития ПОУГ (ОШ = 2,53, 95% ДИ 1,06-6,11, р = 0,04); с доказательством того, что нарушение регуляции В-клеток причинно-значимо связано с глаукомой (ОШ = 4,09, 95% ДИ 1,33-12,53, р = 0,01). Для последнего анализа использовалось 20 SNP, объединенных в PRS. Значение повышенного уровня глюкозы крови в развитии офтальмогипертензии было также показано в исследовании, проведенном Tan и соавторами [35]. Авторы исследовали влияние 11 компонентов метаболического синдрома на ПОУГ и эндофенотипы глаукомы используя итоговую статистику GWAS для каждого из исследуемых признаков. 22 однонуклеотидных полиморфизма, ассоциированных с уровнями глюкозы крови были отобраны в качества инструментальных переменных для МР анализа, который установил наличие причинно-следственной связи между данным фактором риска и повышением внутриглазного давления (β = 0,80 (95% ДИ 0,38-1,22, р = 2,12‧10-4 в стандартных отклонениях показателей ВГД).
Коллектив авторов под руководством Lin [36] подтвердил гипотезу о наличии связи между признаками, связанными с ожирением (индекс массы тела и окружность талии) и риском развития ПОУГ. В своей работе, авторы использовали 31 и 33 SNP, ассоциированных с вышеуказанными факторами риска с уровнем значимости р <5 ‧10-8. Полученные результаты свидетельствуют о более высоких рисках развития глаукомы у лиц с повышенным индексом массы тела (ОШ = 1,91, 95% ДИ 1,23-2,98, р = 0,004). Bao и соавторы исследовали роль жирных кислот в развитии глаукомы [37]. Однако авторы сообщили, что результаты их работы были неубедительны, скорее всего, из-за ограниченного количества инструментов, доступных для каждой из протестированных жирных кислот, и относительно небольшого размера выборки GWAS для факторов риска. Два исследования [38, 39] изучали связь между свойствами роговицы и глаукомой. Simcoe и соавторы не обнаружили значимого влияния центральной толщины роговицы, корнеального гистерезиса или фактора резистентности роговицы на риск повышения ВГД. В своем исследовании Currant и соавторы [40] не нашли доказательств, подтверждающих причинное влияние толщины слоя нервных волокон сетчатки или толщины внутреннего плексиформного слоя на риск развития ПОУГ, но выявили 36 новых локусов, ассоциированных с морфологией сетчатки. Интересным было то, что один из найденных вариантов, rs1254276 гена SIX6 был ранее определен в GWAS глаукомы. Кроме того, пять из этих 36 SNP были ранее выявлены как ассоциированные с внутриглазным давлением. Авторы также сообщили о значимом влиянии внутриглазного давления (ВГД) на ПОУГ (β = 0,55, р = 2,80 ‧10-85).
Исследование, проведенное Simcoe и соавторами [41]. оценивало влияние ВГД и аномалий рефракции на риск развития синдрома пигментной дисперсии и риск ПГ. Авторы предоставили доказательства роли близорукости (β = -0.35, р = 8,86‧10-7) и ВГД (β = 0,42, р = 4,05‧10-6 в патогенезе пигментной глаукомы. В оригинальной статье результаты были представлены в виде регрессионных коэффициентов, что соответствовало ОШ = 1,42 для миопии и 1,52 для повышения ВГД.
Два исследования МР оценивали риск липидов плазмы [42, 43] при ПОУГ. Исследование, проведенное Xu и соавторами [43] не обнаружило доказательств влияния ЛПНП, ЛПВП или триглицеридов на глаукому. Эти исследователи использовали в общей сложности 185 SNP, связанных с уровнями липидов в плазме, в качестве инструментальных переменных в МР анализе на двух выборках. Данные о генетической ассоциации с факторами риска были получены из большого GWAS у лиц европейского происхождения. Другой подход использовали Nusinovici и соавторы, проведя исследование в два этапа. На первом этапе авторы проверили связь липидов крови с ПОУГ у 8503 участников Сингапурского исследования эпидемиологии глазных заболеваний (SEED) путем применения регрессионного анализа с последующим байесовским сетевым моделированием. Пять генетических вариантов генов ABCA1, FADS2, APOA5, ALDH1A2/LIPC, CETP, связанные с холестерином ЛПВП-3 - признаком, выявленным на первом этапе, впоследствии использовались в качестве инструментов на втором этапе, на котором изучалось влияние связанных с липидами метаболитов на ПОУГ с использованием МР анализа. Результаты второго этапа свидетельствовали о потенциальной значимой роли холестерина ЛПВП-3 в развитии ПОУГ (ОШ = 0,91 (95% ДИ 0,84-0,99, р = 0,02). Авторы сделали предположение о значимой роли полиморфизмов гена ABCA1, которые экспрессируются в ганглиозных клетках сетчатки и могут принимать участие в физиологических процессах, протекающих в структурах глаза.
В работе Hysi и соавторов исследовалось влияние метаболита витамина С на ВГД [44]. Исследователи использовали в качестве инструментов 13 SNР, ассоциированных с метаболитом витамина С на уровне значимости р <10-6 и провели МР анализ на двух выборках: Британском Биобанке и когорте Epic-Norfolk [45] и показали наличие причинно-следственной связи (β = -0,67 р = 2,04‧10-10 на выборке Британского Биобанка и β = -2,89, р = 2,50‧10-5 на выборке EPIC-Norfolk. Авторы пришли к выводу о наличии генетических факторов, повышающих уровень метаболита витамина С и одновременно с этим, снижающих ВГД.
Роль абструктивного апноэ сна [46] и потребления кофеина [47] в развитии глаукомы также были проверены с помощью МР. Однако эти исследования не выявили значимой роли этих двух потенциальных факторов риска в развитии заболевания.
Влияние аномалий рефракции на риск развития глаукомы оценивалось в исследовании, проведенном Choquet и соавторами в 2022 году [48]. Исследователям удалось установить общие генетические механизмы развития миопии и глаукомы (коэффициент корреляции rg = -0,24, р = 3,90 ‧10-5). Используя 168 SNP, ассоциированных с аномалиями рефракции в МР анализе, авторы выявили наличие ассоциации между этими заболеваниями (ОШ = 0,91, р = 0,02).
Роль повышенного артериального давления в развитии офтальмогипертензии была исследована в работе Plotnikov и соавторов [49]. В данном исследовании не было выявлено влияния изменения систолического, диастолического и пульсового давления на риск развития глаукомы.
Аномалии рефракции
В шести публикациях рассматривались вопросы, связанные с аномалиями рефракции или близорукостью [50-55] и в пяти из них было показано наличие причинно-следственной связи между факторами риска (Рис. 6) и исходом (Табл. 3).



В своем исследовании Patasova и соавторы [52] применили МР на двух выборках чтобы определить, было ли использование лекарств значимо связано с развитием аномалий рефракции а также чтобы выявить наличие связи между рефракцией в молодом возрасте и наличием хронических заболеваниях на поздних этапах жизни Авторы указали, что прием пероральных противодиабетических препаратов играет роль в развитии аномалий рефракции (β = -0.028, p<0.001), хотя диабет 2 типа сам по себе не был определен факторам риска. Patasova и соавторы подтвердили гипотезу о влиянии ВГД на риск развития аномалий рефракции (β = -0,04, р<0,01), что согласуется с данными ранее проведенной Менделевской рандомизации [50].
В одной публикации оценивалось влияние массы тела при рождении на аномалии рефракции [53]. Используя комбинированный полигенный индекс массы тела при рождении, Plotnikov и соавторы обнаружили доказательства причинно-следственной связи (β = 0,28, p = 0,02), для анализа использовались данные, полученные на взрослой выборке Британского биобанка [53]. 73 SNP объединенные в полигенный индекс объясняли 1,2% дисперсии массы тела при рождении.
В исследованиях, опубликованных в 2016 и 2018 годах [51, 55], была рассмотрена гипотеза о том, что образовательный процесс связан с развитием близорукости. Оба исследования представили доказательства влияния повышения уровня образования на риск развития миопии. Для проведения МР анализа коллектив под руководством Cuelar-Partida создали серию полигенных индексов риска, используя различные уровни значимости ассоциации полиморфизмов с уровнем образования в качестве пороговой величины. Для каждого из этих индексов оценивалась его ассоциация с уровнем образования c помощью линейной регрессии. Модель, включавшая полигенный индекс, составленный из верхнего дециля (17749 SNP) всех полиморфизмов исходя из степени их ассоциации с образованием, показала наибольшую предсказательную ценность. Результаты МР анализа показали, что каждые два дополнительных года образования приводят к ухудшению рефракции на 0,92 Диоптрии. Mountjoy и соавторы [51] применили другой подход к выбору генетических инструментов и использовали 69 SNP, ассоциированных с уровнем образования на полногеномном уровне. Объединенные в полигенный индекс риска, эти полиморфизмы объясняли 4,32% дисперсии фенотипа интереса, полученная оценка эффекта образования на рефракцию (β = -0.27, p = 4‧10-8 на каждый дополнительный год образования) была ниже, чем в предыдущем исследовании, что может быть объяснено увеличением размера выборок GWAS как для фактора риска, так и для исхода.
Результаты МР исследования, изучающего роль уровня витамина D сыворотки крови в развитии миопии, показали, что эта связь не была причинно-следственной. Авторы предположили, что дополнительное время, проведённое на открытом воздухе, может быть причиной как повышенного уровня витамина D сыворотки, так и менее близорукой аномалии рефракции [54].
Катаракта
В трех публикациях оценивалось влияние различных факторов на риск развития катаракты [56-60] и наличие значимого эффекта было показано в двух из них (Табл. 4, Рис. 7).


В двух из этих исследований оценивалась причинно-следственная связь между диабетом 2 типа и катарактой, в обоих анализах проводилась МР на двух выборках. Zhang и соавторами [56] использовали сводную статистику GWAS, проведённого в азиатской популяции как для диабета, так и для катаракты показали наличие значимой ассоциации (ОШ = 1,12 (95% ДИ 1,10-1,45, р = 5,60е-41). В своей работе авторы установили наличие генетической корреляции между заболеваниями (rg = 0.58, р = 5.60 × 10–6) и выявили два гена-кандидата (MIR4453HG и KCNK17), которые могут определять наличие причинно-значимой связи между диабетом и катарактой.
Yuan и соавторы [57] анализировали данные, полученные на европейской выборке. Оба исследования показали значение диабета в развитии катаракты. В своем исследовании Yuan и соавторы использовали 497 SNP как генетический инструмент для диабета 2 типа. Оценка ассоциации полиморфизмов с катарактой была получена из сводной статистики двух GWAS, проведенных на выборке Британского биобанка и консорциума FinnGen [59]. Авторы провели МР анализ на каждой из выборок, и мета анализ полученных результатов показал повышенный риск развития катаракты у лиц, страдающих диабетом (ОШ = 1,06, 95% ДИ 1,03-1,09, р<0,001). Также оценивалось, связаны ли индекс массы тела (ИМТ), систолическое артериальное давление (САД), потребление кофе, алкоголя и начало курения с повышенным риском старческой катаракты. Выявлены значимая ассоциация ИМТ (ОШ = 1,19, 95% ДИ 1,09-1,29, р <0,001), САД (ОШ, 95% ДИ 1,04-1,23, р = 0,004) и курения (ОШ = 1,19, 95% ДИ 1,10-1,29, р<0,001) с повышенным риском развития старческой катаракты. Влияние избыточной массы тела на развитие катаракты также была проверено в исследовании, проведенном Tan и соавторами [58]. Результаты данного исследования не подтвердили наличие подтверждающих причинно-следственной связи между ожирением и катарактой. Стоит отметить, что в Tan и соавторы проводили свое исследование на относительно небольшой выборке из 1949 человек и использовали только один полиморфизм для оценки эффекта ожирения на катаракту.
Другие исходы
В трех публикациях были представлены результаты МР анализов оценивающих эффект факторов риска на морфологию сетчатки [60, 61, 62] (Табл. 8).

МР исследование, проведенное на выборке, состоящей из лиц разных национальностей, изучало влияние артериального давления на калибр сосудов сетчатки [62]. Авторы пришли к выводу, что генетически детерминированное артериальное давление незначительно влияет на калибр артериол сетчатки (β = -4,5, р = 0,01). В МР исследовании участников Британского биобанка Han и соавторы [60] оценивали, связаны ли близорукость или ВГД с риском отслойки сетчатки, использовав 224 и 99 SNP, соответственно. Были получены доказательства, подтверждающие причинно-следственную связь обоих факторов риска (ОШ = 0,72, 95% ДИ 0,69-0,76, р = 3,8е-44 для аномалий рефракции; ОШ = 1,08, 95% ДИ 1,03-1,14, р = 0,001) для внутриглазного давления. Наконец, в другом исследовании, проведенном на выборке Британского биобанка, сообщалось о значительном уменьшении толщины центральной области слоя наружного сегмента фоторецепторов у лиц с генетической предрасположенностью к ВМД (β = -0,34, р = 0,008) для наружного сегмента фоторецепторов [61]. Было показано значение полиморфизмов генов CFH и NPLOC4-TSPAN10, ассоциированных с ВМД на толщину сетчатки.
Заключение. В целом, результаты 79 из 211 проанализированных в данном обзоре МР в офтальмологии предоставили доказательства причинно-следственной связи между факторами риска и исходами. Результаты этих исследований будут ориентиром для проведения клинических испытаний и разработки лекарственных препаратов, а также послужат теоретической основой для принятия клинических решений и решений в области общественного здравоохранения.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы