Особенности ассоциаций SHBG-связанных генов с раком молочной железы у женщин в зависимости от наличия наследственной отягощенности и мутаций в генах BRCA1/CHEK2
Aннотация
Актуальность: Одним из наиболее распространенных заболеваний женского населения является рак молочной железы (РМЖ), которое является гормон-зависимой патологией и имеет значимый наследственный компонент. Гены-кандидаты, определяющие концентрации белка, транспортирующего половые гормоны (SHBG) в организме, могут являться перспективными генетическими факторами риска развития РМЖ. Цель исследования:Оценить особенности ассоциаций SHBG-связанных генов с РМЖ у женщин в зависимости от наличия/отсутствия наследственной отягощенности и мутаций в генах BRCA1/CHEK2. Материалы и методы:Выборка больных РМЖ (n=358) в зависимости от наличия/отсутствия у них отягощенного семейного анамнеза (n=68 и n=290 соответственно), а так же в зависимости от наличия/отсутствия у них мутаций в генах BRCA1/CHEK2 (n=26 и n=332 соответственно), была разделена на соответствующие подгруппы для проведения сравнительного генетического анализа с контрольной группой (n=1140). В работе рассмотрены девять полиморфизмов SHBG-значимых генов - PRMT6 (rs17496332), GCKR (rs780093), PPP1R21 (rs10454142), BAIAP2L1 (rs3779195), ZBTB10 (rs440837), JMJD1C (rs7910927), SLCO1B1 (rs4149056), NR2F2 (rs8023580), SHBG (rs12150660). Ассоциации изучались с помощью логистической регрессии. Результаты:Установлены существенные различия в вовлеченности в предрасположенность к РМЖ SNP SHBG-связанных генов в зависимости от наличия/отсутствия у больных отягощенного семейного анамнеза и мутаций в генах BRCA1/CHEK2. Полиморфизм rs10454142 PPP1R21 ассоциирован с РМЖ у женщин, не имеющих отягощенного семейного анамнеза по РМЖ (аллель риска – С; аддитивная модель OR=1,32 95%CI=1,03-1,70 p=0,027 pperm=0,027), и у женщин у которых отсутствовали мутации в генах BRCA1/CHEK2 (аллель риска – С; аддитивная модель OR=1,34 95%CI=1,05-1,70 p=0,017 pperm=0,017; рецессивная модель OR=1,74 95%CI=1,05-2,86 p=0,030 pperm=0,034). При этом среди женщин, у которых есть отягощенная по РМЖ наследственность или мутации в генах BRCA1/CHEK2, полиморфные варианты SHBG-связанных генов не оказывают самостоятельного влияния на риск развития заболевания. Заключение:Полиморфизм rs10454142 PPP1R21 является фактором риска возникновения РМЖ у женщин без отягощенной наследственности и у женщин, не имеющих мутаций в генах BRCA1/CHEK2
Введение. Рак молочной железы (РМЖ) продолжает оставаться одно из значимых медико-социальных проблем как в мире, так и в Российской Федерации в связи с высокой распространенностью заболевания среди женщин и его неуклонным ростом за последние десятилетия, существенным влиянием на показатели смертности [1, 2, 3]. Показатель заболеваемости РМЖ у женского населения РФ («грубые» показатели на 100 тыс. населения) вырос с 74,87 (2011г) до 89,25 (2021г), при этом прирост составил 18,98% при среднегодовом темпе прироста 1,72% [3]. В 2021 г наибольший удельный вес РМЖ в структуре онкопатологии (более 30%) зарегистрирован у женщин в возрасте 35-49 лет (45-49 лет – 33,58%, 40-44 лет – 33,58% и 35-39 лет – 30,08%) и при этом максимальное количество болеющих РМЖ встречается в возрастных группах 60-64 (10793 человек, показатель заболеваемости 181,45 на 100 тыс.) и 65-69 (10758 человек, показатель заболеваемости 181,45 на 100 тыс.) лет [3]. В 2021 г в структуре смертности женского населения от злокачественных новообразований РМЖ занимает 1-ое ранговое место и его доля составляет 15,8% и при этом лидирующие позиции в структуре смертности женщин от онкопатологии РМЖ занимает практически во всех возрастных группах: 30-39 (19,8%), 40-49 (21,8%), 50-59 (19,9%), 60-69 (16,4%), 70 лет и старше (13,7%); риск умереть от рака молочной железы у женщин в 2021 г. составил 1,4% [3].
Многовекторные и разнонаправленные исследования в области РМЖ находятся в области повышенного «внимания» как отдельных исследовательских коллективов, так и Всемирной организации здравоохранения (ВОЗ) [4]. Цель Глобальной инициативы ВОЗ по борьбе с раком молочной железы заключается в ежегодном сокращении смертности от этого заболевания в мире на 2,5%, что позволит предотвратить 2,5 миллиона случаев смерти от рака молочной железы во всем мире в период с 2020 по 2040 гг. Сокращение смертности от рака молочной железы в мире на 2,5% в год позволит предотвратить 25% случаев смерти от этого вида рака к 2030 г. и 40% случаев – к 2040 г. среди женщин в возрасте до 70 лет. Тремя основными компонентами, необходимыми для достижения этих целей являются: меры по укреплению здоровья; своевременная диагностика; комплексное лечение рака молочной железы [4]. С целью более раненого выявления РМЖ в мире активно развиваются программы скрининга заболевания: согласно данных международного проекта CanScreen5 за 2022г среди 84 стран-участников данной программы скрининг на РМЖ осуществлялся в 57 странах, но при этом эффективность реализации программы, по мнению ее координаторов, является еще недостаточной [5]. Одним из подходов повышения эффективности скрининга РМЖ и его своевременной диагностики, является выделение среди женщин групп высокого риска развития заболевания и уже в этих группах обеспечение 100% охвата мероприятиями, направленными на раннее выявление заболевания и своевременное его лечение на ранних стадиях. С этой целью необходим поиск новых биологических (генетических) маркеров, позволяющих эффективно формировать среди женщин групп повышенного риска развития заболевания. Одними из таких перспективных генетических маркеров могут статью однонукледотидные полиморфизмы генов, детерминирующих концентрацию SHBG организме [6] в связи с тем, что данный белок является «эффективным регулятором» уровня активных половых гормонов (тестостерон/эстрогены) роль которых в патофизиологии РМЖ на сегодняшнем этапе развития науки очевидна и доказана в многочисленных научных исследованиях [7-10].
Цель исследования. Изучение роли высокопенетрантных мутаций в генах BRCA1 и CHEK2 в характере ассоциаций полиморфизма генов матриксных металлопротеиназ с раком молочной железы.
Материалы и методы исследования. Настоящее исследование выполнено на выборке из 358 больных РМЖ и 1140 индивидуумов контроля. Выборка больных РМЖ (n=358) в зависимости от наличия/отсутствия у них отягощенного семейного анамнеза (n=68 и n=290 соответственно), а также в зависимости от наличия/отсутствия у них мутаций в генах BRCA1/CHEK2 (n=26 и n=332 соответственно), была разделена на соответствующие подгруппы для проведения сравнительного генетического анализа с контрольной группой. Детальная характеристика мутаций, выявленных в изучаемой выборке больных РМЖ (n=26) представлена в ранее опубликованной работе Павловой Н.В. и др. [11] Группа больных была сформирована специалистами-онкологами Белгородского областного онкологического диспансера (2010-2016 гг.) с учетом обязательной верификации диагноза заболевания гистологическим методом (у всех больных проведено морфологическое исследование образцов опухоли). Детальная характеристика группы больных представлена в работах Pavlova N.V. et al. [12, 13]. В контрольную группу были включены женщины, не имеющие РМЖ (использовались клинико-анамнестические материалы, полученные при проф. осмотрах в Белгородской областной клинической больнице). Все обследуемые были русскими и проживали в Центральном Черноземье РФ (критерии включения) [14]. Работа выполнялась при контроле со стороны этического комитета БелГУ и обязательным условием являлось получение согласия в письменной форме от всех участников исследования.
В работе рассмотрены девять полиморфизмов SHBG-значимых генов - PRMT6 (rs17496332), GCKR (rs780093), PPP1R21 (rs10454142), BAIAP2L1 (rs3779195), ZBTB10 (rs440837), JMJD1C (rs7910927), SLCO1B1 (rs4149056), NR2F2 (rs8023580), SHBG (rs12150660), которые согласно результатам, ранее выполненного Coviello A.D. et al. GWAS были ассоциированы с концентрацией SHBG в организме среди европейского населения [6]. Для генотипирования использовались образцы ДНК из биобанка кафедры медико-биологических дисциплин, амплификаторы CFX96-Bio-Rad, и реагенты, разработанные «Тест-Ген» (методика генотипирования представлена ранее [15]).
Ассоциации изучались с помощью логистической регрессии на основе расчета показателей OR и 95%CI (отношение шансов и его доверительный интервал) [16] для 4 моделей (аллельная;аддитивная;доминантная;рецессивная) в программе gPLINK; учитывался возраст в качестве ковариаты и проводилось пермутационное тестирование. Финальное значение pperm<0,05 было принято в качестве статистически значимого [17]. Для РМЖ-ассоциированного локуса (rs10454142 PPP1R21) оценена его связь с экспрессией (eQTL) и сплайсингом (sQTL) генов (были использованы данные GTExportal [18]).
Результаты и их обсуждение. Результаты проведенного исследования представлены в таблицах 1 и 2 (для групп пациенток в зависимости от наличия/отсутствия у них отягощенного семейного анамнеза) и таблицах 3 и 4 (для групп пациенток в зависимости от наличия/отсутствия у них мутаций в генах BRCA1/CHEK2). Анализ полученных данных показывает, что, во-первых, распределение всех рассматриваемых SNP SHBG-связанных генов во всех четырех изученных подгруппах в полной мере согласуется с законом Харди-Вайнберга – фактические показатели р были на уровне ≥0,187 среди пациенток с РМЖ с наследственной отягощенностью, ≥0,126 у больных без отягощенного семейного анамнеза, ≥0,134 у пациенток с мутациями в генах BRCA1/CHEK2 и ≥0,063 у больных без мутаций в генах BRCA1/CHEK2.
Во-вторых, для двух анализируемых подгрупп женщин в зависимости от наличия/отсутствия у них отягощенного семейного анамнеза достоверные ассоциации были выявлены только для женщин, не имеющих отягощенной наследственности по РМЖ (таблица 2), тогда как среди женщин с отягощенным семейным анамнезом по РМЖ SNP SHBG-связанных генов не были связаны с риском развития заболевания (таблицы 1 и 2). Согласно полученных данных полиморфизм rs10454142 PPP1R21 ассоциирован с РМЖ согласно аддитивной модели (ССvsTСvsTT; OR=1,32;95%CI=1,03-1,70;p=0,027;pperm=0,027), при этом редкий аллельный вариант этого полиморфизма – аллель С, является генетическим фактором риска развития заболевания у женщин без отягощенной наследственности (таблица 2).
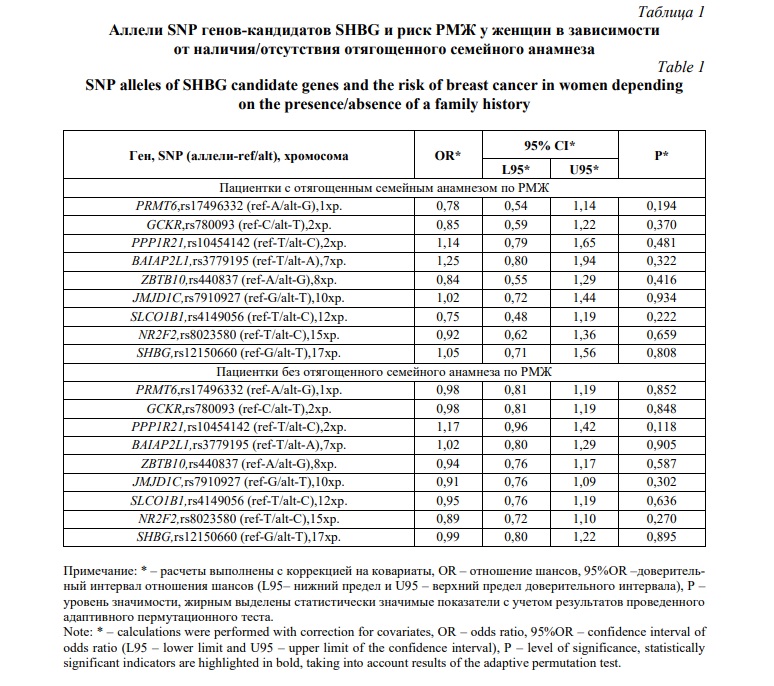
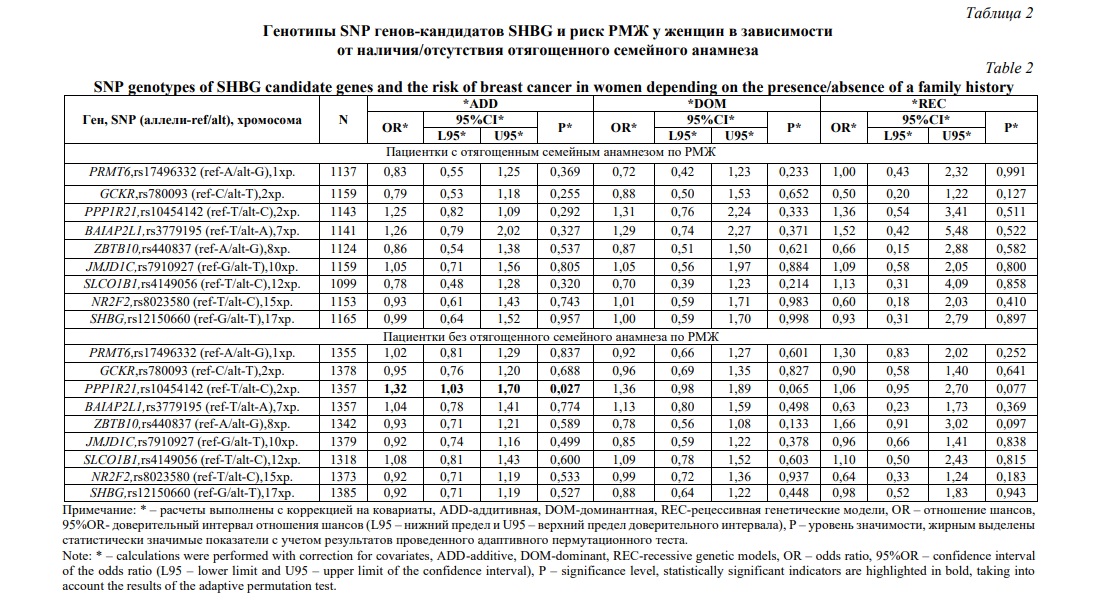
В-третьих, выявлены различия в вовлеченности в формирование РМЖ у женщин в зависимости от наличия/отсутствия у них мутаций в генах BRCA1/CHEK2 – значимые ассоциации регистрировались в группе женщин, не имеющих мутаций в генах BRCA1/CHEK2 (таблица 4) и отсутствовали среди женщин, у которых были диагнозцированы различные мутации генах BRCA1/CHEK2 (таблицы 3 и 4). Полиморфный вариант rs10454142 PPP1R21 был связан повышенным риском РМЖ согласно аддитивной (ССvsTСvsTT; OR=1,34;95%CI=1,05-1,70; p=0,017; pperm=0,017) и рецессивной (ССvsTС+TT; OR=1,74;95%CI=1,05-2,86; p=0,030; pperm=0,034) моделям (таблица 4).
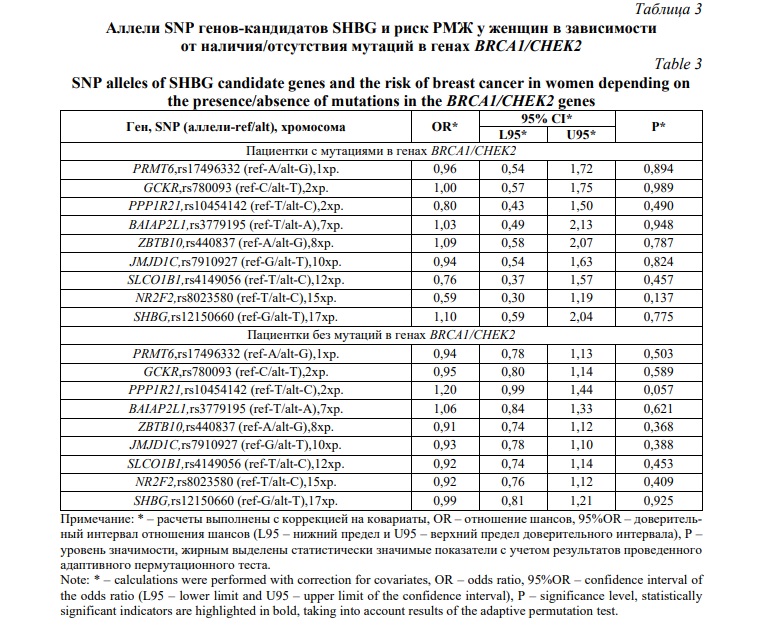
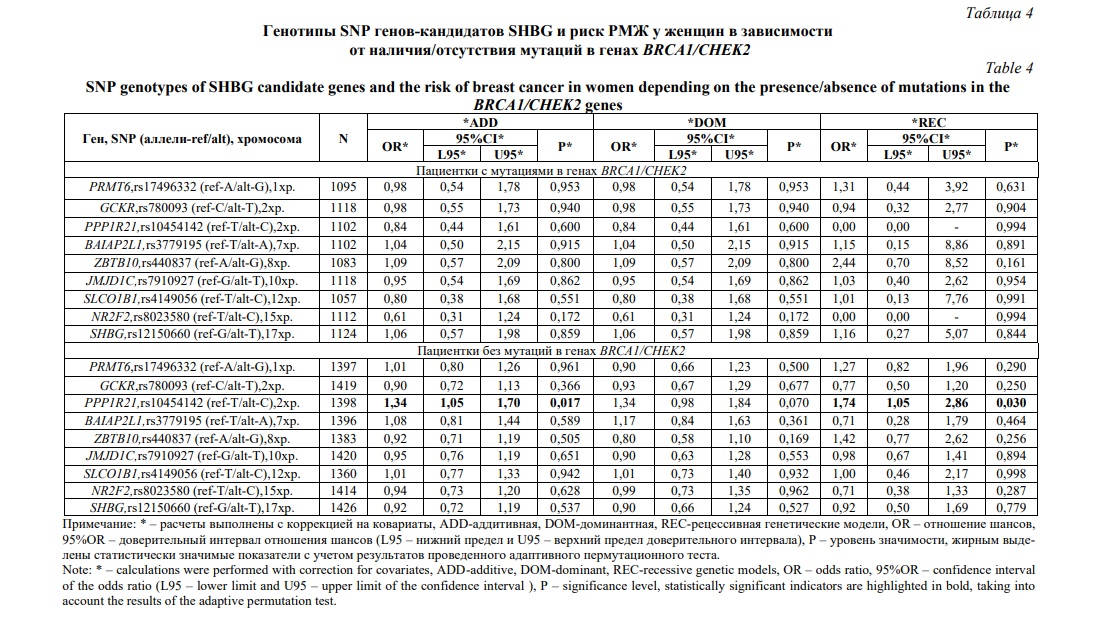
Итак, выполненный в данной работе генетико-статистический анализ, показал существенные различия в вовлеченности в предрасположенность к РМЖ SNP SHBG-связанных генов в зависимости от наличия/отсутствия у больных отягощенного семейного анамнеза и мутаций в генах BRCA1/CHEK2. Полиморфизм SHBG-связанных генов и в частности rs10454142 PPP1R21, являлся значимым фактором риска возникновения заболевания как у женщин, не имеющих отягощенного семейного анамнеза по РМЖ (для минорного аллеля С OR=1,32), так и у женщин у которых отсутствовали мутации в генах BRCA1/CHEK2 (для минорного аллеля С OR=1,34-1,74). При этом среди женщин, у которых есть отягощенная по РМЖ наследственность или мутации в генах BRCA1/CHEK2, полиморфные варианты SHBG-связанных генов не оказывают самостоятельного влияния на риск развития заболевания.
Полученные нами insilico результаты позволяют заключить, что SNP rs10454142 PPP1R21 в целом в организме является eQTL и sQTL значимым для 9 (FOXN2,GTF2A1L,LHCGR,MSH6,PPP1R21,RP11-460M2.1, STON1-GTF2A1L, FSHR,STON,) и 4 (GTF2A1L,PPP1R21,STON1,STON1-GTF2A1L) генов соответственно (материалы базы данных GTE portal), при чем эти функциональные эффекты rs10454142 PPP1R21 проявляет в том числе и в культуре клеток фибробластов, имеющих важное патогенетическое значение при заболевании [19]. Аллельный вариант С rs10454142, определяющий повышенный риск развития РМЖ у женщин, не имеющих отягощенного семейного анамнеза по РМЖ (OR=1,32) и у женщин у которых отсутствовали мутации в генах BRCA1/CHEK2 ( OR=1,34-1,74), ассоциирован с низкой транскрипционной активностью 3 генов - GTF2A1L (NES=-0,42;р=3,5e-13),FOXN2 (NES=-0,11;р=0,000048),MSH6 (NES=-0,06;р=0,00013), и высокой экспрессией гена PPP1R21 (NES=0,25;р=2,4e-12), а так же, наоборот, низким уровнем sQTL гена PPP1R21 (IntronID:48505596:48505718:clu_38732;NES=-0,43;р=2,6e-10) в культуре клеток фибробластов (Рис. 1, 2).
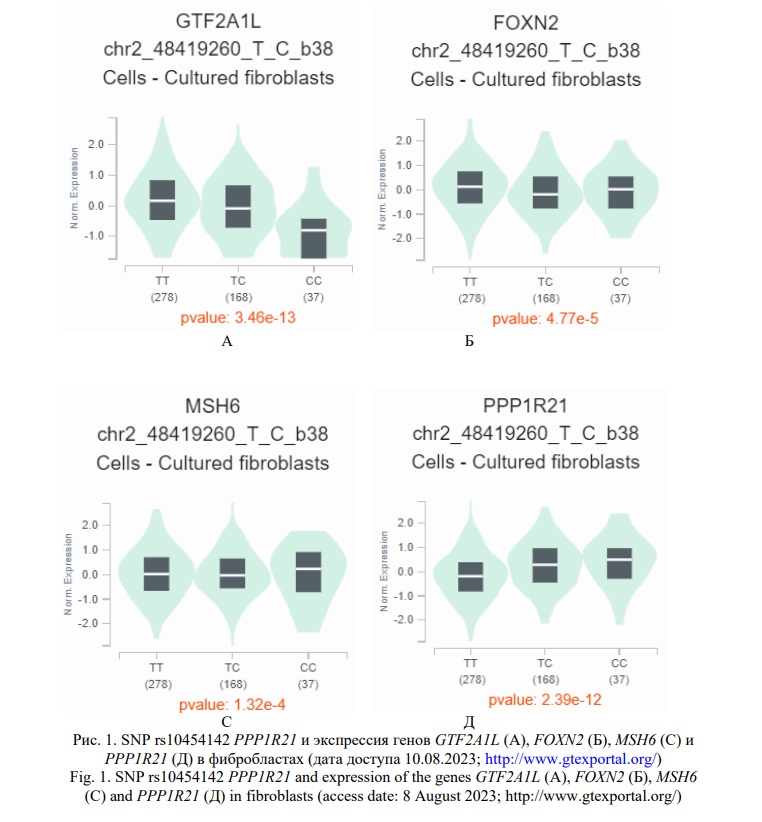
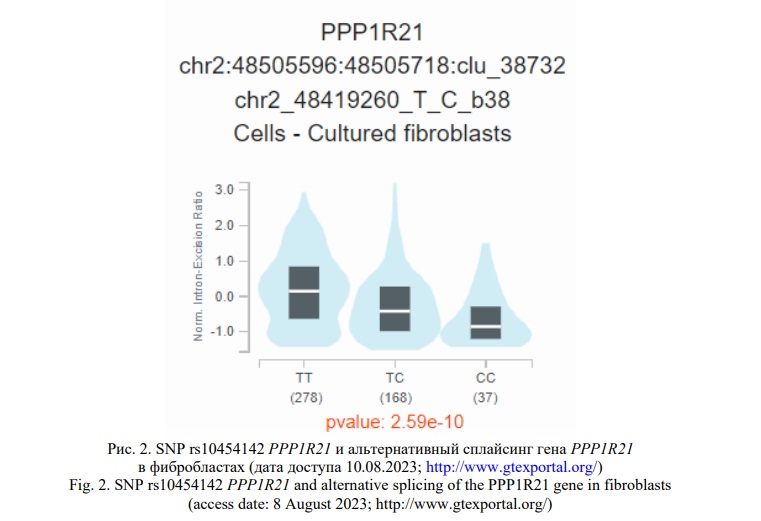
Материалы, представленные в базе GTE portal, показывают влияние rs10454142 PPP1R21 на экспрессию генов как в висцеральной, так и в подкожной жировой ткани. Рисковый для РМЖ аллельный вариант С rs10454142 ассоциирован с пониженной транскрипцией 3-х генов – GTF2A1L (NES=-0,46; р=1,6e-11), RP11-460M2.1 (NES=-0,39; р=1,8e-8), STON1-GTF2A1L (NES=-0,37; р=7,2e-8) в висцеральной жировой ткани и 2-х генов – GTF2A1L (NES=-0,55; р=2,1e-22), STON1-GTF2A1L (NES=-0,36; р=1,7e-9) в подкожной жировой ткани. Так же этот генетический вариант связан с уровнем сплайсинга 4-х генов (GTF2A1L, STON1, PPP1R21, STON1-GTF2A1L) в висцеральной и 3-х генов (GTF2A1L, STON1, PPP1R21) в подкожной жировой ткани. Причем, аллель С маркирует пониженный уровень сплайсинга гена PPP1R21 как в висцеральной (IntronID:48505857:48507269:clu_47092;NES=-0,37;р=1,3e-10) так и в подкожной (IntronID:48505857:48507269:clu_48393;NES=-0,41;р=8,7e-12) жировой ткани и повышенные величины альтернативного сплайсинга генов GTF2A1L (IntronID:48591855:48595228:clu_47096;NES=0,49;р=1,1e-10), STON1 (IntronID:48591855:48595228:clu_47096;NES=0,49;р=1,1e-10), STON1-GTF2A1L (IntronID:48769074:48776280:clu_47101;NES=0,32;р=0,0000025) в висцеральной жировой ткани и генов GTF2A1L (IntronID:48591855:48595228:clu_48397;NES=0,50;р=5,5e-14), STON1 (IntronID:48591855:48595228:clu_48397;NES=0,50;р=5,5e-14) в подкожной жировой ткани.
Ген PPP1R21 (расположен в 2p16.3;в регионе данного гена находится РМЖ-ассоциированный rs10454142, который, согласно нашим insilico данным, влияет на экспрессию и сплайсинг данного гена) кодирует белок – регуляторную субъединицу 1 протеинфосфатазы 21, который относится к группе широко представленных в организме и достаточно многочисленных фосфопротеинфосфатаз 1 (PhosphoProtein Phosphatase 1 - PPP1) (к настоящему времени идентифицировано более 200 PPP1) [20]. PPP1s могут выступать в качестве целевых субъединиц, субстратов, регуляторов активности в процессах обратимого фосфорилирования различных белков (этап дефосфорилирования), участвующих во внутриклеточных механизмах передачи сигналов в различных сигнальных путях, «задействованных» в регуляции клеточного роста, клеточного цикла, апоптоза и других cancer-значимых клеточных реакциях [20]. Наряду с этим, предполагается важная роль PPP1R21 в процессах функционирования эндосом (лизосом) и, в том числе, в сортировке и созревании эндосом, что имеет первостепенное значение в обеспечении эффективной работы внутриклеточной эндосомально-аутофагически-лизосомальной системы [20].
В многочисленных ранее проведенных клинико-экспериментальных исследованиях показана связь PPP1R21 (PPP1R21) с развитием различных опухолей и в том числе таких как колоректальная карцинома,рак ротовой полости, карцинома щитовидной железы, рак легких, опухоль тонкой кишки, рак желудка [21, 22, 23 и др.]. Обращает на себя внимание наличие подтверждений вовлеченности PPP1R21 в онкогенез (колоректальный рак) в полногеномных исследованиях [21].
В ряде работ продемонстрирована корреляция PPP1R21 и с формированием РМЖ [24, 25]. Согласно материалам Cebrià-Costa J.P. et al., экспрессия гена PPP1R21 повышается в клеточных линиях с «выключенным» геном LOXL2 при TNBC форме РМЖ [24]. Наоборот, в работе Horvath A., et al. продемонстрирована очень низкая плотность «экспрессируемых» SNP в регионе chr2:48000000-48999999, содержащем гены PPP1R21, MSH6, FBX011, FOXN2, STON1, GTF2A1L, LHCGR у пациентов со всеми тремя проанализированными подтипами РМЖ (TNBC, non-TNBC, HER2 позитивный) [25]. Имеются данные о связи повышенной экспрессии еще одного представителя фосфопротеинфосфатаз 1 – PPP1R14C, с повышенным риском развития и плохим прогнозом (метастазирование) при TNBC варианте РМЖ [26].
Следует отметить, что полиморфизмы, локализованные в регионе генов PPP1R21/FOXN2/PPP1R21-DT, ассоциированы на полно-геномном уровне достоверности (p≤5*10-8) с такими РМЖ-значимыми признаками как концентрация циркулирующего SHBG (rs200883214 [27], rs4497915 [28], rs11690748 [27, 29]), антропометрические показатели (рост (rs4953579, rs7566996 [30], rs76154567 [31]), окружность талии (rs72820455 [32]), содержание жира в организме (rs4497915 [28])), показатели липидного профиля (триглицериды, липопротеиды высокой и низкой плотности (rs4497915 [28]), липопротеиды высокой плотности (rs12713007 [33])). Имеются GWAS данные о связи SNP этого региона генома с уровнем печеночных ферментов в сыворотке крови (аланинаминотрансфераза и аспартатаминотрансфераза (rs4497915 [28]), аланинаминотрансфераза (rs10208627 [31], rs4290706 [34]), гамма-глутамилтранспептидаза (rs13429377 [31]), гамма-глутамилтрансфераза (rs62137009 [34]) щелочная фосфатаза (rs6749773 [31, 34])). При этом важно подчеркнуть, что печень является основным местом образования SHBG организме [35] и состояние печени, оцениваемое по уровню печеночных ферментов, будет напрямую коррелировать с продукцией ею SHBG.
Ген STON1 кодирует белок стонин 1, являющийся важным компонентом эндоцитарного аппарата и принимающий за счет этого участие в молекулярных механизмах эндоцитоза белков клеточной поверхности [https://www.genecards.org/cgi-bin/carddisp.pl?gene=STON1]. Считается, что стонин 1, участвуя в процессах локальной адгезии на поверхности клеток и являясь специфическим адаптером онкогенного протеогликана нейрон-глиального антигена 2 (служит ко-рецептором интегринов и рецептора фактора роста тромбоцитов), может модулировать подвижность опухолевых клеток и способствовать тем самым росту опухоли [36, 37]. Экспериментально доказано, что при отсутствии стонина 1 нейрон-глиальный антиген 2 накапливается на поверхности клеток, что приводит к «активизации» миграции клеток, и, наоборот, присутствие стонина 1 улучшает интернализацию нейрон-глиального антигена 2 (за счет стонин 1-опосредованного эндоцитоза этого онкогенного протеогликана), что нарушает «работу» системы локальной адгезии и приводит к снижению уровня клеточной сигнализации этой системы и уменьшению подвижности клеток (в т.ч. опухолевых) [36].
Результаты многочисленных эпидемиологических и биоинформатических исследований убедительно показывают связь гена STON1 (его экспрессии) с РМЖ (на модели РМЖ-специфических клеточных линиях (MCF-7)) [25, 38, 39], а так же с другими различными онкологическими заболеваниями: аденокарцинома протоков поджелудочной железы, рак легких, колоректальный рак, папиллярная почечно-клеточная карцинома, карцинома толстой кишки (метастазы в печень), базально-клеточный рак кожи, светлоклеточная карцинома почки, карцинома мочевого пузыря, глиома [37, 40, 41, 42, 43 и др.], и в том числе в полно-геномных исследованиях (рак легких [40]).
В нашей работе выявлены значительные регуляторные эффекты SHBG-значимых РМЖ-ассоциированных локусов в фибробластах по отношению к 18 генам (eQTL (17 генов): ATRAID, AC074117.10, BAIAP2L1, BRI3, FOXN2, GPN1, MRPL35P2, JMJD1C-AS1, RP11-307C18.1, NRBF2, NRBP1, JMJD1C, GTF2A1L, MSH6, PPP1R21, PRMT6, SLC5A6; sQTL (2 гена): FNDC4, PPP1R21). Материалы, представленные в литературе, свидетельствуют о важной роли фибробластов в опухолевом процессе и в том числе при РМЖ [19]. Фибробласты в норме располагаются в строме большинства органов и при формировании опухоли (развитии воспаления и фиброза в опухолях) они «активируются» (начинают продуцировать различные компоненты внеклеточного матрикса, матриксные металлопротеиназы, приводящие к деградации внеклеточного матрикса и др.) и при этом трансформируются в опухоль-ассоциированные фибробласты, являющиеся основой опухолевой стромы (обеспечивают регуляторную, питательную, «каркасную» функции для опухоли), которая непрерывно взаимодействует с опухолевыми клетками, способствуя развитию друг друга и приводя в конечном счете к прогрессированию опухоли [19]. Опухоль-ассоциированные фибробласты, обусловливая развитие “десмопластической реакции” (образуется большое количество коллагенов I,III,IV,V типов, фибринолитического белка, ламинина, гиалуроновой кислоты, секретируются различные протеазы, матриксные металлопротеиназы, что приводит к выраженному ремоделированию внеклеточного матрикса и др.), определяют формирование каркасной структуры опухоли (происходит упрочнение тканей и фиброз стромальных клеток), которая лежит в основе уклонения опухоли от иммунитета (предотвращает проникновение иммунных клеток) и обеспечивает «оптимальную» среду для взаимодействия между опухолевыми клетками и цитокинами, усиливая миграцию, инвазию раковых клеток, способствуя тем самым прогрессированию опухоли и в том числе при РМЖ [19]. Итак, установленные нами существенные функциональные эффекты SHBG-значимых РМЖ-ассоциированных локусов в фибробластах по отношению к 18 генам могут быть медико-биологической основой вовлеченности фибробластов в патогенез РМЖ за счет регуляторных эффектов локусов, контролирующих образование SHBG в организме. Следует отметить, что в ранее проведенном исследовании РМЖ, выполненном на этой же выборке больных/контроля, показаны значимые ассоциации ряда функционально значимых полиморфных локусов гена матриксной металлопротеиназы 9 (rs17576, rs2250889) в формировании заболевания [12].
Литературные материалы, указывают на то, что регион генома в области rs10454142 PPP1R21 (гены STON1, STON1-GTF2A1L, GTF2A1L и др.) является потенциально связанным с метаболизмом адипоцитов [44-47]. В нашем исследовании показано важное eQTL и sQTL rs10454142 PPP1R21 в жировой ткани (GTF2A1L, STON1, PPP1R21, STON1-GTF2A1L, RP11-460M2.1). Cao C.H. et al. проведя глубокий комплексный генетический функциональный анализ (3D взаимодействия генома на основе технологии захвата конформации хромосом с высокой проходимостью (Hi-C),eQTL,RNA-Seq,DNase-Seq,ChIP-Seq,sing-cell секвенирование) доказали связь STON1-коэкспрессируемых генов (PPP1R21, LHCGR, FOXN2, STON1-GTF2A1L, GTF2A1L и др.) с метаболическими процессами в адипоцитах (Р=0,0001), что было подтверждено в жировой ткани (Р<0,0001) и яичниках (Р=0,0035) мышей, питавшихся жирами [44]. Так же авторы выявили выраженные разнонаправленные пол-специфические корреляции между экспрессией STON1 и ИМТ в мужских и женских адипоцитах: в мужских адипоцитах ИМТ положительно коррелировал с экспрессией STON1, в женских адипоцитах, наоборот, эти корреляции были отрицательными [44]. Особенности экспрессии циркулирующей РНК STON1-GTF2A1L в эпикардиальной жировой ткани у индивидуумов с/без сердечной недостаточности показаны в работе He S. et al. [45]. Экспериментальные и биоинформатические исследования продемонстрировали, что регион генома в области генов STON1-GTF2A1L, GTF2A1L является таргетным в процессах фруктозо-зависимого изменения метиллирования генов в адипоцитах и связан за счет этого с трансформацией морфологически дифференцирующихся адипоцитов в более зрелые и метаболически устойчивые [46]. Различия в дифференциальной экспрессии гена GTF2A1L (гипоэкспрессия) при сравнении метаболически «нездоровых» пациентов, страдающих ожирением, и здоровых индивидуумов с ожирением, обнаружены Prashanth G. et al. [47].
Результаты достаточно большого числа GWAS свидетельствуют об ассоциациях SNP, расположенных в регионах генов STON1-GTF2A1L, GTF2A1L, STON1 с такими РМЖ-значимыми ИМТ-связанными признаками рост, вес, oкружность талии, cоотношение талии к бедрам, объем ягодично-бедренной жировой ткани, индекс формы тела, ИМТ, размер тела взрослых [30, 31, 48 и др.]. Так же представляется важным, что данный регион генома является GWAS-ассоциированным с такими РМЖ-, адипоцит-, гормон-, ИМТ-значимыми признаками как возраст менопаузы женщин, липидный профиль (триглицериды, ЛПВП, ЛПНП) [31, 33, 49, 50 и др.], а также с адипоцит-, гормон-, ИМТ-значимым заболеванием, характеризующимся гиперандрогенным статусом, как поликистоз яичников [51]. Cao C.H. et al. в эксперименте с мышами, послужившими моделью для поликистоза яичников, выявили связь такого фактора транскрипции как рецепторы андрогенов с уровнем экспрессии гена STON1 в яичниках экспериментальных животных [44]. Авторы показали, что у пациенток с поликистозом яичников высокая экспрессия STON1 может быть ответственна за гиперандрогенный фенотип, связанный с выраженными метаболическими нарушениями [44]. Различия в уровнях экспрессии (гиперэкспрессия) и метиллирования (гипометиллирование) гена STON1-GTF2A1L у больных поликистозом яичников продемонстрированы и в работе Jones M.R. et al. [52]. Полиморфизмы, локализованные в регионах генов STON1-GTF2A1L, GTF2A1L, STON1, согласно результатов GWAS, ассоциированы также с уровнем тестостерона [27, 29].
Заключение. В результате проведенного исследования установлены существенные различия в вовлеченности в предрасположенность к РМЖ SNP SHBG-связанных генов в зависимости от наличия/отсутствия у больных отягощенного семейного анамнеза и мутаций в генах BRCA1/CHEK2. Полиморфизм rs10454142 PPP1R21 являлся значимым фактором риска возникновения заболевания у женщин, не имеющих отягощенного семейного анамнеза по РМЖ (для минорного аллеля С OR=1,32), и у женщин у которых отсутствовали мутации в генах BRCA1/CHEK2 (для минорного аллеля С OR=1,34-1,74). При этом среди женщин, у которых есть отягощенная по РМЖ наследственность или мутации в генах BRCA1/CHEK2, полиморфные варианты SHBG-связанных генов не оказывают самостоятельного влияния на риск развития заболевания.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы