Эффект полиморфизма гена интерлейкина-10 в формировании глубоких нарушений микробиоценоза влагалища при бактериальном вагинозе
Aннотация
Актуальность: Бактериальный вагиноз является распространенной вагинальной инфекцией, вызывающей значительную гинекологическую и акушерскую заболеваемость. Несмотря на современные методы и схемы лечения терапия БВ остается сложной задачей в связи с высокими показателями рецидивов, которые составляют до 60% в течение года после лечения. Данная проблема, отчасти, может быть решена оценкой индивидуальных генетических особенностей организма, связанных с наличием аллельных вариантов генов иммунной системы, определяющих конституциональную возможность к высокому или низкому уровню синтеза соответствующих иммунокомпетентных молекул (цитокинов, образ-распознающих рецепторов и др.). Цель исследования:Определить значение полиморфизма -1082 G/A (rs1800896) гена IL-10 в формировании различных молекулярно-биологических профилей микробиоценоза влагалища при бактериальном вагинозе. Материалы и методы:Были обследованы 195 женщин репродуктивного возраста, 100 из которых составили больные с бактериальным вагинозом и 95 – условно-здоровых женщин с нормоценозом влагалища. Состояние микробиоценоза влагалища оценивали микроскопическим и молекулярно-биологическим методами. Генотипирование полиморфизма -1082 G/A (rs1800896) гена IL-10 осуществляли с помощью полимеразной цепной реакции и детекции продуктов амплификации на электрофорезном геле. Результаты:Генотип G/G чаще встречался у женщин с превалированием облигатно-анаэробных микроорганизмов в микробиоценозе (21,2%, р=0,046), генотип G/A – у женщин с выраженным смешанным дисбиозом (61,3%, р=0,023). У женщин с преобладанием в составе микробиоценоза факультативных анаэробов Gardnerella vaginalis и Atopobium vaginaе существенной разницы по распределению генотипов не выявлено (р>0,05). Заключение:Носительство аллельных вариантов -1082G (rs1800896) гена IL-10 ассоциировано с более глубокими нарушениями микробиоценоза влагалища, что предполагает их использование в качестве маркеров, повышающих эффективность диагностики рецидивирующих форм бактериального вагиноза
Ключевые слова: бактериальный вагиноз, полиморфизм -1082 G/A (rs1800896) гена IL-10, микробиоценоз влагалища, противовоспалительные цитокины
Введение. Бактериальный вагиноз (БВ) является наиболее распространенным полимикробным инфекционным заболеванием влагалища, диагностируемым у 20-30% женщин репродуктивного возраста [1], с распространенностью 50-60% в некоторых группах населения с высоким сексуальным поведением [2]. К развитию БВ приводит сокращение популяции кислотообразующих Lactobacillus spp., вследствие которого происходит повышение pH влагалищной жидкости с сопутствующим избыточным ростом нескольких строго или факультативно анаэробных бактерий, представителей нормальной микрофлоры влагалища [3]. Таким образом, БВ является полимикробным заболеванием, при котором один патоген не способен индуцировать заболевание [4].
БВ ассоциирован с целым рядом акушерско-гинекологической патологии. Инфекции, передающие половым путем (хламидиоз, герпес, гонорея, ВИЧ, ВПЧ и т.п.) значительно чаще возникают на фоне дисбиоза влагалища [3, 5, 6]. С БВ связывают бесплодие, неудачные попытки ЭКО, воспалительные и пролиферативные заболевания органов малого таза [7]. В акушерской практике наличие БВ приводит к невынашиванию, преждевременным родам, хорионамниониту, рождению детей с внутриутробным инфицированием [8, 9]. Терапия БВ является сложной проблемой, поскольку применимые методы лечения в большинстве случаев дают кратковременный эффект [10, 11]. В связи с этим вопросы успешного долгосрочного лечения и профилактики рецидивов БВ приобретают особую актуальность.
Хотя примерно половина случаев БВ протекает клинически бессимптомно, у женщин с БВ наблюдается увеличение местных провоспалительных реакций [12]. В этой сети цитокины представляют собой молекулы межвидовой связи, которые могут координировать взаимодействия вагинальных сообществ, включая рост патогенных микроорганизмов [13]. Интерлейкин-10, известный как плейотропный цитокин, обладает сильным иммунодепрессивным и противовоспалительным действием. Первоначально считалось, что IL-10 продуцируется Т-хелперами 2 типа (Тh2-клетками); в настоящее время известно, что IL-10 продуцируется различными иммунными клетками лимфоидного и миелоидного происхождения, которые функционируют как в адаптивном, так и врожденном иммунитете [14]. IL-10 может ингибировать процесс антигенпрезентации путем подавления экспрессии молекул HLA на поверхности клетки и подавления экспрессии множества провоспалительных цитокинов, таких как TNFα, IL-1, IL-6 и IL-8, ингибируя Т-клетки [15].
Ряд исследователей полагают, что развитию БВ способствует снижение иммунологической реактивности организма в ответ на дисбаланс состава микрофлоры [16]. Концентрация факторов иммунной защиты в биологических жидкостях зависит от уровня экспрессии соответствующего гена, которая в свою очередь может быть различным в зависимости от замен нуклеотидных последовательностей нити ДНК у разных индивидуумов. Однонуклеотидные полиморфизмы считаются одной из наиболее частых причин геномной изменчивости у людей. Полиморфизмы гена IL-10 могут быть связаны с различными уровнями транскрипции генов, поскольку некоторые аллели могут продуцировать низкое или высокое количество IL-10 [17]. Способность секретировать различные уровни цитокинов у разных индивидуумов может определять дифференцированный иммунный ответ на инфекцию и на его исход.
В последние годы активно изучается связь полиморфизмов генов цитокинов, TLR и других иммунных факторов в развитие инфекционно-воспалительных заболеваний гениталий, в том числе бактериального вагиноза [18, 19], что может расширить представление о потенциальном генетическом влиянии организма на состав влагалищной микрофлоры и объяснять различные варианты течения заболевания.
Цель исследования. Определить значение полиморфизма rs1800896 (A-1082G) гена IL-10 в формировании различных молекулярно-биологических профилей микробиоценоза влагалища при бактериальном вагинозе.
Материал и методы исследования. В исследование включены 195 женщин репродуктивного возраста узбекской национальности. В основную группу включены 100 женщин с бактериальным вагинозом. Контрольную группу составили 95 условно-здоровых женщин, с нормоценозом влагалища и без каких-либо заболеваний. В зависимости от молекулярно-биологического профиля микробиоценоза влагалища женщин основной группы сформированы подгруппы: 1-группа – пациентки с выраженным анаэробным дисбиозом (с преобладанием в составе микробиоценоза факультативных анаэробов Gardnerella vaginalis и Atopobium vaginaе; n=36), 2-группа – с выраженным анаэробным дисбиозом (с преобладанием в микробиоценозе облигатных анаэробов; n=33) и 3-группа – с выраженным аэробно-анаэробным дисбиозом (n=31). Исследование проведено после получения письменного согласия на участие у субъектов исследования.
Во время клинического обследования оценивали общее состояние, соматический и гинекологический статус женщин. Проводили осмотр шейки матки и влагалища с помощью гинекологических зеркал, во время которого определяли наличие критериев Амселя. Обильные, жидкие выделения, рН влагалищного отделяемого более 4,5, положительный аминный тест (оцениваемый как специфический «рыбный запах» при смешивании вагинальных выделений с гидрооксидом калия) и выявление «ключевых клеток» (десквамированных эпителиальных клеток с адгезировавшимся на них грамвариабельной микрофлорой) в мазках в совокупности составляют тест Амселя. Наличие трех признаков из четырех показывает, что больная страдает бактериальным вагинозом. Состояние микробиоценоза влагалища оценивали путем проведения микроскопического исследования вагинального отделяемого по Граму и молекулярно-биологическим методом ПЦР-РВ с помощью комплекта реагентов Фемофлор-16. Концентрацию цитокина IL-10 в смывах из влагалища определяли методом твердофазного иммуноферментного анализа.
Исследование полиморфизма -1082 G/A (rs1800896) гена IL-10 проводили методом ПЦР-РВ с детекцией продуктов амплификации на электрофорезном геле. Оценку соответствия распределений генотипов ожидаемым значениям при равновесии Харди-Вайнберга и сравнение распределений частот генотипов в группах проводили с использованием критерия χ2 с поправкой Йейтса. Различия при p<0,05 считались статистически значимыми.
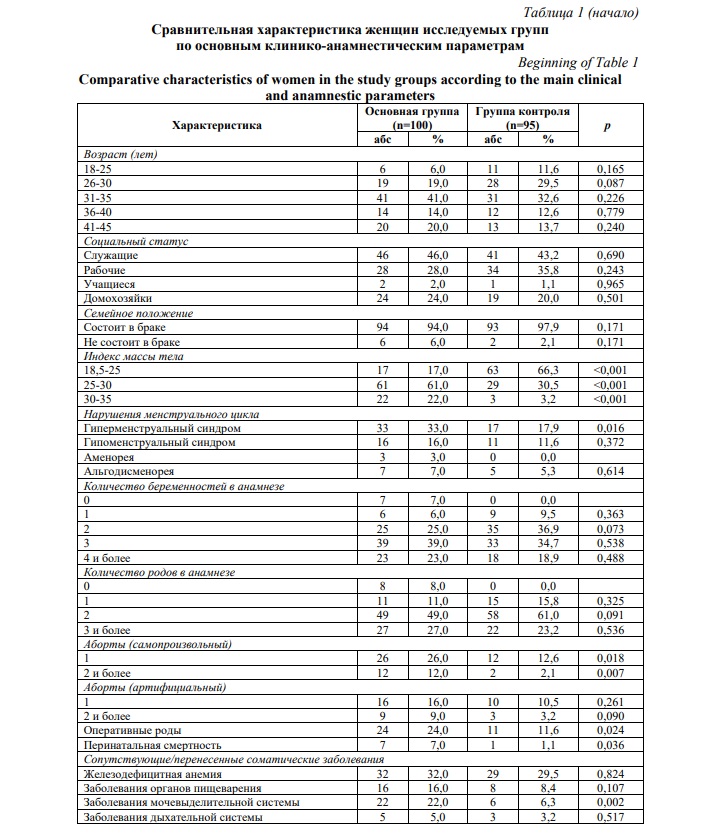
Результаты и их обсуждение. Средний возраст пациенток составил 34,7±0,71 лет, в контрольной группе 33,7±0,93 лет (р>0,05) (Табл. 1). Интеллектуальным трудом занимались 46,0% и 43,2% женщин основной и контрольной групп, рабочими являлись 28,0% и 35,8%, безработными (домохозяйками) – 24,0% и 20,0%, студентами – 2,0% и 1,1% женщин с БВ и контрольной группы соответственно (р>0,05). Группы исследования по основным клинико-анамнестическим параметрам, учитывающих социальный статус, соматические и репродуктивные данные, акушерский и гинекологический анамнез, применяемых методов контрацепции практически не отличались. Но вместе с тем следует указать, что частота высокого ИМТ, нарушения менструальной функции в виде гиперменструального синдрома, самопроизвольного аборта, оперативного родоразрешения, случаев перинатальной смертности, заболеваний мочевыделительной системы, инфекционно-воспалительных заболеваний влагалища в анамнезе была значительно выше в основной группе по сравнению с группой контроля (р<0,05).
Жалобы на патологические обильные, жидкие выделения серо-белого цвета с неприятным запахом отмечали 94% больных бактериальным вагинозом. рН влагалищных выделений составил 6,1±0,12 в основной группе, 4,0±0,31 в контрольной группе (р<0,001). Положительный аминный тест выявлен в 82,3% случаев, только в основной группе.
При микроскопии влагалищных мазков выявлены ряд характерных для БВ микроскопических признаков: угасание лейкоцитарной реакции (единичное число лейкоцитов) в 72,7% мазках, большое число эпителиальных клеток (более 10-15 клеток в поле зрения) в 75,5% мазках, наличие «ключевых клеток» (эпителиальных клеток с адгезированными на них грамвариабельной микрофлорой) в 90,0% мазках, массивное число микроорганизмов, относящихся преимущественно к морфотипам анаэробных бактерий в 60,0% мазках.
Микробиоценоз влагалища женщин основной группы в большинстве случаев оценен как выраженный анаэробный дисбиоз (69,0%). 31,0% образцов соответствовали профилю выраженный аэробно-анаэробный дисбиоз. Согласно кластерной дифференцировке БВ, предложенной Назаровой В.В и др. (2017) [20], образцы выраженного анаэробного дисбиоза нами были профилированы как образцы с доминированием в составе условно-патогенной микрофлоры факультативных анаэробов Gardnerella vaginalis и Atopobium vaginaе (36,0%), и образцы с превалированием групп облигатно-анаэробных микроорганизмов Sneathia/Leptotrichia/Fusobacteriumspp., Megasphaera/Veillonella/Dialisterspp. и Lachnobacterium/Clostridium spp. (33,0%). Образцы влагалищных мазков женщин контрольной группы соответствовали абсолютному (28,4%) и условному нормоценозу (71,6%).
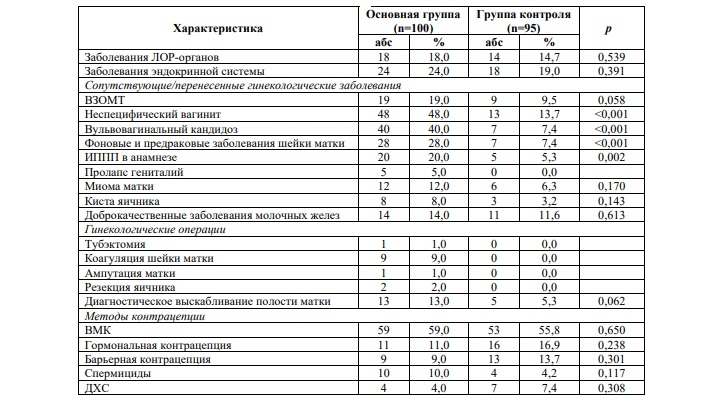
Как абсолютное (3,92±0,22 lg ГЭ/мл), так и относительное содержание (4,34±1,26%) лактофлоры у женщин с БВ было очень низким (р<0,001). Выявлено достоверно высокое содержание Gardnerella vaginalis (р<0,001), Eubacteriumspp. (р<0,005), Sneathia/Leptotrichia/Fusobacteriumspp. и Megasphaera/Veillonella/Dialisterspp. (р<0,001), Lachnobacterium/Clostridiumspp. (р=0,013), Mobiluncus/Corynebacteriumspp. (р=0,004), Pеptostreptococcusspp. и Atopobiumvaginae (р<0,001) у женщин с БВ. Из комменсальных микроорганизмов только Mycoplasmahominis достоверно превышала контрольные показатели (р=0,007).
Нами проведен сравнительный анализ частоты выявления в диагностически значимых количествах условно-патогенной микрофлоры влагалища в подгруппах женщин. Как видно по таблице 2 в 1-й и 2-й группе более часто выявлялась в диагностически значимых количествах Gardnerellavaginalis/Prevotellabivia/Porphyromonas. Во 2-й и 3-й группе преобладающими микроорганизмами становилась группа облигатных анаэробов. Вместе с тем, в 3-й группе отмечалось достоверное увеличение частоты встречаемости в значимых количествах групп аэробных микроорганизмов (р<0,05).
Таким образом, для 2-й и 3-й групп является характерным повышение частоты выявления облигатных анаэробов в диагностически значимых количествах. Следует отметить, что преобладание облигатных анаэробов над другими группами бактерий, а в случае смешанного дисбиоза и групп аэробных микроорганизмов является признаком глубоких нарушений состава микрофлоры влагалища.
Как известно, иммунный ответ на патогены включает быструю активацию провоспалительных цитокинов, которые служат для инициации защиты макроорганизма от микробной инвазии. Согласно концептуальной модели патогенеза БВ, предложенной Muzny CA. et al. [4], Gardnerella vaginalis и Prevotella bivia считаются ранними колонизаторами, которые не вызывает сильного воспалительного ответа со стороны вагинальных эпителиальных клеток. Эти первые колонизаторы могут уклоняться от иммунной системы, создавая биопленку. Далее происходит усиление адгезии вторичных колонизаторов, включая Atopobium vaginae, Sneathia spp. и других потенциально связанных с БВ бактерий к зрелой полимикробной биопленке. Вторичные колонизаторы являются более мощными стимуляторами иммунного ответа хозяина.
Усиление провоспалительного звена цитокинов в ответ на рост условно-патогенной микрофлоры является естественной иммунной реакцией, направленной на сохранение равновесия между разными представителями микрофлоры влагалища. Параллельно с этим активизируются и противовоспалительные механизмы, которые служат для сдерживания производства провоспалительных молекул для ограничения повреждения тканей и поддержания или восстановления тканевого гомеостаза. Учитывая зависимость концентрации IL-10 в биологических жидкостях при воспалительном ответе от полиморфизма соответствующего гена, нами было исследована частота распределения полиморфных вариантов гена IL-10 среди женщин с БВ. Наиболее изученными в настоящее время считаются три вида полиморфизма этого гена: -819 C/T (rs1800871), -592 C/A (rs1800872) и -1082 G/A (rs1800896). Несколькими исследованиями была показана важная роль полиморфизма -1082 G/A (rs1800896) при инфекционных заболеваниях, однако связь с клинико-микробиологическим характером БВ не изучалась.
На первом этапе исследования мы проанализировали частоту встречаемости аллелей и генотипов изучаемого полиморфизма, а также соответствие наблюдаемых частот генотипов, рассчитанным по уравнению Харди–Вайнберга для популяций, что позволяет судить об адекватном выборе субъектов и формировании групп сравнения для проведения генетических исследований. Далее проводили анализ распределения аллелей и генотипов полиморфизма гена в исследуемых группах. Анализ полученных данных показал низкую гетерогенность наблюдаемых и ожидаемых значений генотипов -1082 G/A (rs1800896) гена IL-10 в основной и контрольной группах. В группе больных эмпирическое количество Hobs-гетерозигот по данному локусу соответствовало теоретическому Hexp (0,46/0,46), а в контрольной группе было ниже ожидаемого количества гетерозигот (0,38/0,39). Отклонение наблюдаемой гетерозиготы по сравнению с ожидаемой гетерозиготой составило: D=+0,01 и D=-0,02 соответственно. Полученные нами данные свидетельствуют о незначительном дефиците гетерозигот полиморфизма -1082 G/A (rs1800896) гена IL-10 в узбекской популяции.
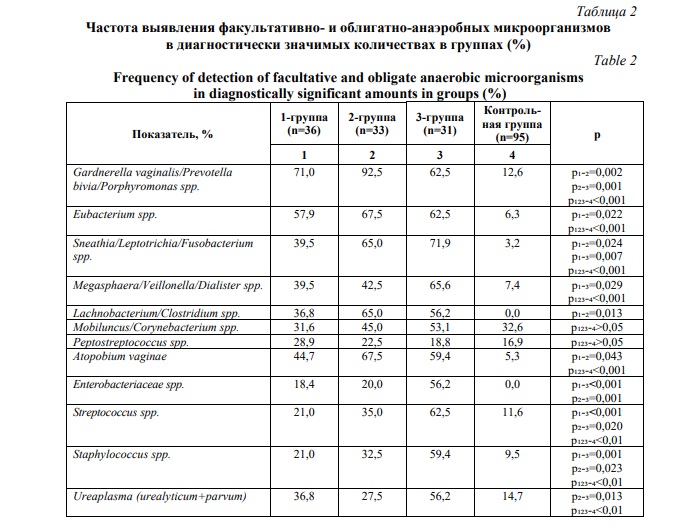
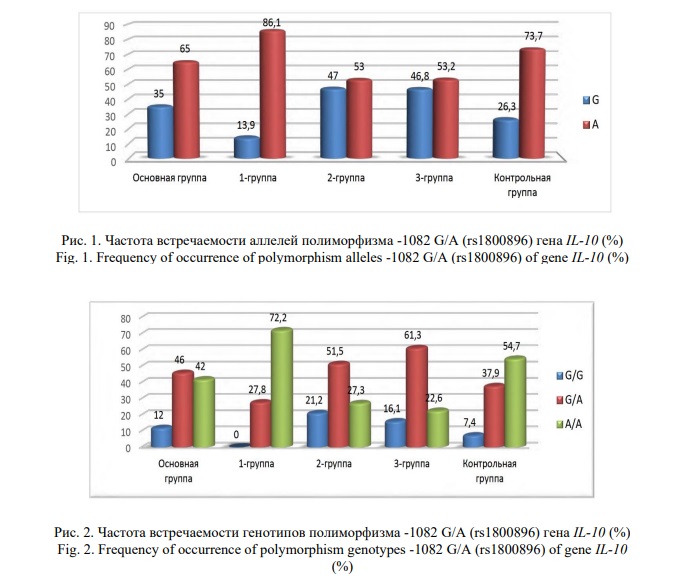
Выявлено повышение частоты встречаемости дикого аллеля G в группе женщин с бактериальным вагинозом по сравнению с контрольной группой, что особенно заметно на примере 2-й и 3-й групп (Рис. 1). Исследуемые группы также отличались по генотипическим вариациям, гетерогенность которых была выражена во 2-й и 3-й группах (Рис. 2).
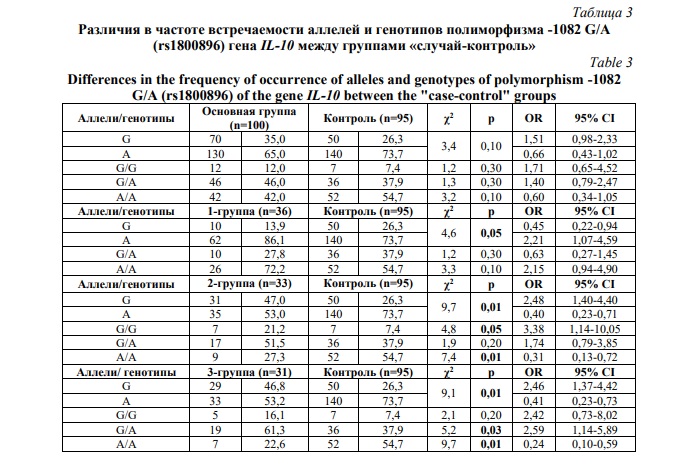
Статистический анализ не выявил различий в распределении аллелей и генотипов -1082 G/A (rs1800896) гена IL-10 между основной и контрольной выборкой (Табл. 3). Анализ распределения аллелей и генотипов изучаемого полиморфизма в исследуемых подгруппах «случай-контроль» обнаружил следующие особенности. Аллель А достоверно чаще встречался в 1-й группе (86,1% против 73,7% контроля), аллель G – во 2-й (47,0%) и 3-й (46,8%) группах по сравнению с контролем (26,3%) (р<0,05). Распределение генотипа G/G приняло достоверно высокие значения во 2-й группе (21,2%) относительно контрольной (7,4%) при χ2=4,8; р=0,05; ОR=3,4; 95% CI: 1,14-10,05. Генотип А/А достоверно в 2 раза меньше определялся во 2-й группе (27,3% против 54,7% в контрольной) при χ2=7,4; р=0,01; ОR=0,3; 95% CI: 0,13-0,72. Шансы на выявление гетерозиготного генотипа G/А достоверно повышались в 3-й группе (61,3% против 37,9% в контрольной) (χ2=5,2; р=0,03; ОR=2,6; 95% CI: 1,14-5,89. Частота генотипа А/А в этой группе также оказалось ниже чем в группе контроля (22,6% против 54,7%; χ2=9,7; р=0,01; ОR=0,2; 95% CI: 0,10-0,59).
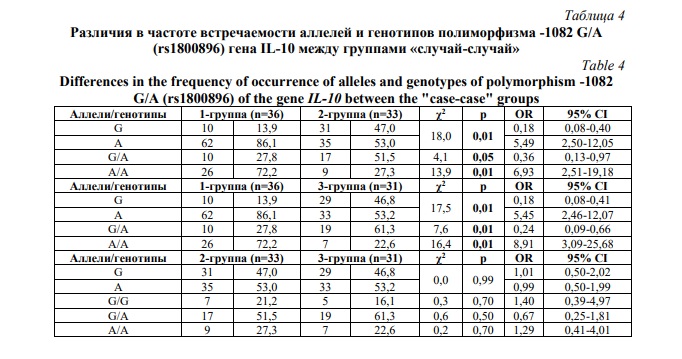
Статистический анализ обнаружил достоверно высокие отличия по содержанию аллелей: аллель А достоверно чаще определялся в 1-й группе, а полиморфный аллель G – во 2-й и 3-й группах (р<0,01) (Табл. 4). Частота гетерозиготного генотипа G/А в 1-й группе (27,8%) оказалось значительно ниже относительно показателей 2-й (51,5%) и 3-й (61,3%) групп (р<0,05). Шансы на выявление гомозиготы А/А были высокими (72,2%) в 1-й группе по сравнению со 2-й (27,3%) и 3-й (22,65) группами (χ2=13,9; р=0,01; ОR=6,9; 95% CI: 2,51-19,18 и χ2=16,4; р=0,01; ОR=8,9; 95% CI: 3,09-25,68 соответственно). Как видно, частая встречаемость генотипа А/А в 1-й группе указывает на возможную протективную роль данного генотипа в отношении развития глубоких нарушений микробиоценоза влагалища.
Таким образом, полученные нами данные позволяют считать, что более глубокие нарушения микробиоценоза влагалища с доминированием в нем представителей облигатно-анаэробных бактерий, а также повышением условной доли как аэробных, так и анаэробных микроорганизмов (смешанный дисбиоз) могут быть ассоциированы с носительством полиморфного аллеля G и его вариантов G/G и G/А полиморфизма -1082 G/A (rs1800896) гена IL-10.
Полиморфизм -1082 G/A (rs1800896) гена IL-10 характеризуется заменой аденина (A) на гуанин (G) в промоторной области гена. Аллель -1082A гена IL-10 считается низкопродуктивным, тогда как аллель G связывают с высокой концентрацией IL-10 в биологических жидкостях [17]. Наибольшее содержание IL-10 в вагинальном отделяемом нами выявлено у носителей мутантного аллеля -1082G IL10 (rs1800896), как в гомозиготном, так и гетерозиготном варианте (р<0,05), т.е. отмечалась определенная взаимосвязь между местной концентрацией IL-10 и полиморфизмом гена IL10 (Табл. 5).

На наш взгляд гиперпродукция IL-10, индуцированная вариантами G/G и G/А полиморфизма -1082 G/A (rs1800896) гена IL-10 оказывает иммунодепрессивное влияние на развивающийся провоспалительный ответ, приводит к ограничению иммунного ответа макроорганизма и дает ход персистированию инфекции с нарастанием массы биопленок. Следует отметить, что бактерии в биопленке являются труднодоступными воздействию иммунной системы макроорганизмами приобретают резистентность к антимикробным препаратам [21].
Во многих исследованиях была выявлена ассоциация полиморфизма гена IL-10 с рядом заболеваний, связанных с нарушением иммунитета, таких как бронхиальная астма, туберкулез, острый и хронический гепатит [22], некротический энтероколит [23], цервикальный рак [24] и т.д. Было установлено, что носительство высокопродуктивного аллеля G (A-1082G) гена IL-10 является фактором риска развития и поддержания аллергического воспаления гениталий [25], неспецифических вульвовагинитов [26]. Очевидно, что IL-10 играет решающую роль в предотвращении воспалительных и аутоиммунных заболеваний. Нарушение экспрессии или передачи сигналов IL-10 может усиливать клиренс патогенов во время острой инфекции, но также усиливать воспалительную реакцию, что приводит к усугублению иммунопатологии и повреждению тканей [22]. И наоборот, некоторые патогены могут использовать иммунодепрессивную способность IL-10 для ограничения иммунного ответа макроорганизма, что приводит к персистирующей инфекции.
При полимикробном синдроме, такой как бактериальный вагиноз особенно важен баланс между Тh1-(провоспалительным) и Тh2-(противовоспалительным) ответом на инфекцию, что может определять ход инфекционного процесса в сторону разрешения или персистенции. Поэтому изучение наиболее важных полиморфизмов цитокинов, участвующих в воспалительном ответе, может служит раскрытию патогенетических механизмов формирования глубоких нарушений микрофлоры влагалища.
Заключение. Генотипы G/G и G/А полиморфизма -1082 G/A (rs1800896) гена IL-10 ассоциированы с глубокими дисбиотическими нарушениями микрофлоры влагалища, что предполагает их использование в качестве прогностических маркеров рецидивирующего течения бактериального вагиноза.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы