Полиморфные локусы генов матриксных металлопротеиназ ассоциированы с развитием ишемической болезни сердца с сопутствующим метаболическим синдромом
Aннотация
Актуальность: Метаболический синдром (МС) и его компоненты являются причиной развития и прогрессирования заболеваний сердечно-сосудистого континуума. На сегодняшний день связь ишемической болезни сердца и МС остается неоднозначной. Показана центральная роль матриксных металлопротеиназ в обмене белков соединительной ткани, ремоделирования клеточного матрикса, репарации тканей и других сложных биохимических процессах организма, что подразумевает вовлеченность их в патогенез заболеваний сердечно-сосудистого континуума. Цель исследования:Поиск ассоциаций полиморфных вариантов генов матриксных металлопротеиназ с развитием стабильной ишемической болезни сердца с сопутствующим метаболическим синдромом. Материалы и методы:В исследование включены пациенты со стабильной ишемической болезнью сердца (n=170), имеющие висцеральный тип ожирения в сочетании с двумя или более патологическими состояниями: повышенный уровень глюкозы в крови, повышенный уровень холестерина в крови, гипертония. Контрольная – условно-здоровые добровольцы (n=182). Генотипирование 5 сайтов 4 генов (MMP1 (rs514921), MMP3 (rs6796620, rs626750), MMP9 (rs17576), TIMP2 (rs2277698)) проведено методом ПЦР в режиме реального времени. Концентрацию ММП в сыворотке крови измеряли методом ИФА. Анализ межгенных взаимодействий был проведен при помощи программы MDR v.3.0.2. Результаты:Частота гетерозиготного генотипа С/Т полиморфизма rs626750 MMP3 выше в группе контроля (37,90 %), чем в группе пациентов (23,20%), что говорит о его протективном эффекте в отношении развития ИБС с сопутствующим метаболическим синдромом (ОШ=0,47, 95%ДИ 0,29-0,75). Продемонстрировано увеличение риска развития ИБС с сопутствующим метаболическим синдромом в 2,6 раза при носительстве генотипа A/G rs2277698 TIMP2 по кодоминантной модели наследования. Ассоциаций с концентрацией MMP, а также их ингибиторов, в сыворотке крови и генотипами полиморфных вариантов MMP1 (rs514921), MMP3 (rs626750), MMP9 (rs17576), TIMP2 (rs2277698) не получено. Получена четырехлокусная модель межгенных взаимодействий (MMP9 (rs17576) – MMP3 (rs626750) – MMP1 (rs514921) – TIMP2 (rs2277698)), обладающая высокой чувствительностью и специфичностью, а также рисковым эффектом в отношении развития данного патологического состояния. Заключение:Исследование позволило выявить ассоциации полиморфных вариантов генов MMP и их ингибиторов с развитием ИБС с сопутствующим метаболическим синдромом
Введение. Заболевания сердечно-сосудистой системы и их осложнения на протяжении многих лет сохраняют свои лидирующие позиции в структуре смертности лиц трудоспособного возраста, являясь одной из главных проблем здравоохранения. Метаболический синдром (МС) и его компоненты могут быть взаимосвязаны с возникновением и прогрессированием заболеваний сердечно-сосудистого континуума [1]. Показано, что риск развития ишемической болезни сердца (ИБС) у мужчин и женщин с МС составил в 2,54 и 1,54 раз, соответственно. Однако, связь ИБС и МС остается неоднозначной, особенно в области генетической составляющей [2].
Ранее установлена центральная роль матриксных металлопротеиназ (MMP) в обмене белков соединительной ткани, ремоделирования клеточного матрикса, репарации тканей и других сложных биохимических процессах организма, что подразумевает вовлеченность их в патогенез заболеваний сердечно-сосудистого континуума. Сложные механизмы регулирования при патологических процессах, возникающих на клеточном уровне при атеросклеротическом поражении сосудов на фоне, обусловленным метаболическим синдромом, дает предпосылки исследований в этом направлении при коморбидных состояниях.
Известно, что MMP – семейство цинкзависимых эндопептидаз, ответственных за ремоделирование тканей и деградацию белков внеклеточного матрикса (ВКМ) [3]. На сегодняшний день, семейство MMP насчитывает 28 членов, 23 из которых синтезируются в тканях человека, а экспрессия 14 обнаруживается в венах и артериях [4]. Экспрессия MMP обнаруживается на различных типах клеток, так MMP-1 известная как интерстициальная коллагеназа в основном обнаруживается на лейкоцитах, фибробластах, а также эндотелиальных клетках, MMP-3 (стромелизин) – на сердечных фибробластах и макрофагах [3], MMP-9 секретируется достаточно большим количество клеток, среди которых кардиомиоциты, эндотелиальные клетки, нейтрофилы, макрофаги и фибробласты [5]. Практически все MMP ингибируется тканевыми, биологическими, а также синтетическиими ингибиторами. Наиболее изученными являются тканевые ингибиторы металлопротеиназ (TIMP), которые препятствуют деградации матрикса. Всего представлено 4 вида TIMP, однако TIMP-1 и TIMP-2 наиболее представлены в исследованиях. Показано, что TIMP -1 ингибирует MMP-1, MMP-3, MMP-7, MMP-9, а TIMP-2 – MMP-2 [6]. Отмечена вовлеченность MMP в патогенез заболеваний сердечно-сосудистого континуума [7]. Так, показано, что концентрация MMP-9 имела положительную корреляционную связь с прогрессированием атеросклеротического поражения коронарных артерий [8]. Кроме того, выявлены более высокие концентрации MMP-1,-3,-9 у пациентов с острым инфарктом миокарда с подъемом сегмента ST по сравнению с контрольной группой на протяжении всего госпитального периода [9]. Вместе с тем, важным компонентом в изучении роли MMP в развитии неблагоприятных сердечно-сосудистых событий в подгруппах риска, является оценка вариабельности структуры генов, кодирующих данные белки. Исходя из описанной проблемы была сформулирована цель исследования, которая заключалась в поиске ассоциаций полиморфных вариантов генов матриксных металлопротеиназ с развитием стабильной ишемической болезни сердца с сопутствующим метаболическим синдромом.
Материалы и методы исследования. Исследование выполнено на базе ФГБНУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний», г. Кемерово и является ретроспективным, одноцентровым. Все участники исследования проходили лечение в кардиологическом и кардиохирургическом отделениях НИИ КПССЗ.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practive) и принципами Хельсинской Декларации. Получено одобрение Локального этического комитета на протокол исследования (протокол №13 от 05.08.2016 г.). Все обследуемые дали добровольное письменное согласие на участие в исследовании, в том числе и на молекулярно-генетическое тестирование. В рамках исследования сформировано две группы: основная – пациенты со стабильной ишемической болезнью сердца с сопутствующим МС (128 мужчин и 42 женщины) и контрольная – условно-здоровые добровольцы (110 мужчин и 72 женщины), средний возраст которых составил 59,85 (33-75) и 53,59 (30-75), соответственно. Критерии включения в основную группу: возраст моложе 75 лет, наличие стабильной стенокардии в анамнезе, подписанное информированное согласие на участие в исследовании, наличие висцерального типа ожирения в сочетании с двумя или более патологическими состояниями: повышенный уровень глюкозы в крови, повышенный уровень холестерина в крови, гипертония; не включались пациенты, имеющие тяжелую сопутствующую патологию, и не подписавшие информированное согласие на участие. Диагноз ИБС установлен квалифицированными врачами-кардиологами НИИ КПССЗ на основании комплексного клинического и инструментального обследования пациентов, а также согласно Национальным рекомендациям Всероссийского научного общества кардиологов по диагностике и лечению стабильной стенокардии [10]. Для оценки функционального класса стенокардии применяли Канадскую классификацию, для характеристики хронической сердечной недостаточности использовали классификацию Нью-Йоркской ассоциации кардиологов (NYHA) [11]. Все участники исследования принадлежали к русскому этносу и проживали на территории Западной Сибири (Кемеровская область, РФ) не менее, чем в двух поколениях. В группу контроля включались участники без какой-либо сердечно-сосудистой патологии. Критерии исключения из исследования: тяжелая сопутствующая патология (онкологические, ревматические заболевания и др.), участники, не подписавшие информированное согласие на участие в исследовании.
Для выделения геномной ДНК стандартным методом фенол-хлороформной экстракции, использовали периферическую кровь, собранную из локтевой вены в пробирку, которая содержала K3EDTA. Критериями для отбора полиморфных вариантов послужили: локализация в генах, кодирующих MMP, а также их ингибиторов, распространенность минорного аллеля полиморфного сайта в популяции по данным HapMap более 5%, наличие функциональных эффектов (связь эпигенетическими характеристиками и транскрипцией генов), согласно базе данных HaploReg v4.2 [12], а также связь с экспрессией генов. Для отбора SNP использовались базы данных dbSNP, SNPinfo и SNPnexus.
На основании данных научных публикаций, для нашего исследования отобрано 5 сайтов 4 генов (MMP1 (rs514921), MMP3 (rs6796620, rs626750), MMP9 (rs17576), TIMP2 (rs2277698)) (Табл. 1).

Генотипирование проводили методом аллель – специфической ПЦР с флуоресцентно-мечеными зондами (TaqMan), которые были синтезированы компанией ДНК-синтез (Москва, Россия), на приборе CFX96 Touch (1855195, Bio-Rad, США) с использованием мастер-микса БиоМастер HS-qPCR Lo-ROX (2×) (кат.номер MHR021-2040, Биолабмикс).
Для контроля качества персонал, проводящий исследование, не был поставлен в известность о принадлежности каждого образца конкретному индивидууму, использовались контрольные образцы с известными генотипами и 10 % случайно выбранных образцов генотипировано повторно.
Концентрацию MMP-1 (кат. DY901B, R&D Systems, USA), MMP-3 (кат. DMP300, R&D Systems, USA), MMP-9 (кат. DMP900, R&D Systems, USA), TIMP-1 (кат. DTM100, R&D Systems, USA), TIMP-2 (кат. DTM200 R&D Systems, USA) определяли посредством иммуноферментного анализа согласно протоколу производителя на спектрофотометре Multiskan Sky (Thermo Scientific).
Статистический анализ данных проводили в программах GraphPad Prism 8 (GraphPad Software) и SNPstats (https://www.snpstats.net/) [13]. Нормальность распределения выборки оценивали критерием Шапиро-Уилка. Описание количественных признаков представлено в виде среднеарифметического значения и минимума, и максимума к нему. При анализе независимых количественных признаков между двумя группами использовали критерий Манна-Уитни. Сравнение между тремя группами проводили при помощи критерия Краскела-Уолиса, поправку на множественные сравнения выполняли с использованием метода FDR. Различия в распределении аллельных вариантов в исследуемых группах осуществляли по критерию χ2. Ассоциации генотипов с риском развития заболевания проводили путем вычисления отношения шансов (ОШ) и доверительного интервала к нему (95%ДИ). Анализ межгенных взаимодействий был проведен при помощи программы MDR v.3.0.2 [14]. Регуляторный потенциал полиморфных локусов оценивали с помощью онлайн сервиса HaploReg (v.4.1) (http://archive.broadinstitute.org / mammals / haploreg
/ haploreg.php). Результаты считали статистически значимыми при p<0,05.
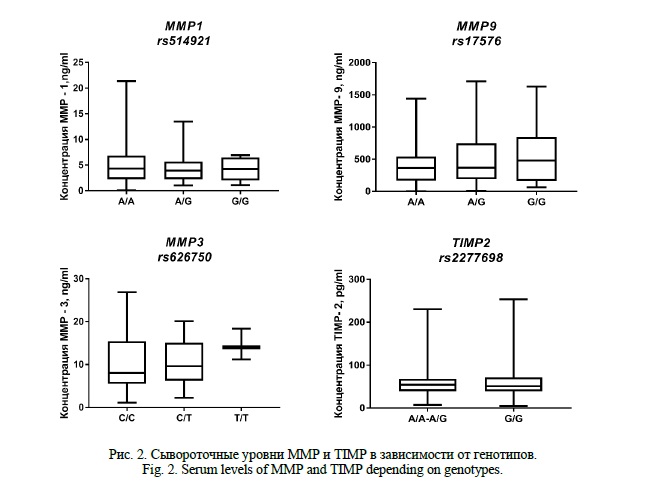
Результаты. Тест на равновесие Харди-Вайнберга показал, что 4 (rs626750, rs514921, rs2277698, rs17576) полиморфных варианта из 5 соответствуют равновесному распределению, для локуса rs6796620 гена MMP3 отмечено отклонение от ожидаемого распределения, обусловленное уменьшением наблюдаемой гетерозиготности по сравнению с ожидаемой частотой, в связи с чем данный локус был исключен из анализа ассоциаций (Табл. 2).
При сравнительном анализе выбранных полиморфных вариантов в группе пациентов с ИБС и контрольной группой, установлено, что с ИБС с сопутствующим метаболическим синдромом ассоциированы MMP3 (rs626750) и TIMP2 (rs2277698). Выявлено, что частота гетерозиготного генотипа С/Т полиморфизма rs626750 MMP3 была выше в группе контроля (37,90 %), чем в группе пациентов (23,20%), что говорит о его протективном эффекте в отношении развития ИБС с сопутствующим метаболическим синдромом (ОШ=0,47, 95%ДИ 0,29-0,75). Кроме того, продемонстрировано увеличение риска развития ИБС с сопутствующим метаболическим синдромом в 2,6 раза при носительстве генотипа A/G rs2277698 TIMP2 по кодоминантной модели наследования (Табл. 2).
Согласно данным, полученным из базы HaploReg (v4.1), аллельные варианты rs626750 MMP3 и rs2277698 TIMP2, для которых показаны ассоциации с изучаемым фенотипом, располагаются в регионах ДНК, связывающихся с гистонами, маркирующими энхансеры (модифицированный гистон H3K4me1) (в мезенхимальных клетках, клетках жировой ткани, предшественниках фибробластов, клетках головного мозга).
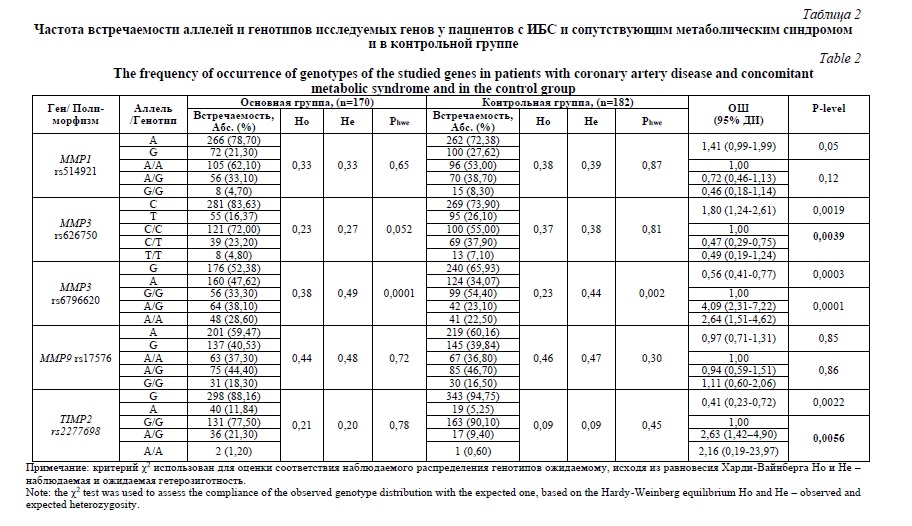
Неотъемлемой частью ассоциативных исследований является изучение взаимодействий между генами с целью установления комбинаций полиморфных вариантов, имеющих наибольшую патогенетическую значимость. Так, с использованием программы MDR выявлена одна наиболее значимая модель взаимодействия, обладающая высокой точность, чувствительностью и специфичностью (Табл. 3). В рамках построенной четырехлокусной модели межгенных взаимодействий выявлены следующие комбинации генотипов, которые ассоциированы с изучаемым фенотипом и обладают рисковым эффектом в отношении развития данного патологического состояния: A/A (rs514921) – A/G (rs17576) – A/G (rs2277698) – C/C (rs626750) (ОШ=3,48, 95%ДИ 2,17-5,57) и A/A (rs514921) – A/G (rs17576) – G/G (rs2277698) – C/T (rs626750) (ОШ=3,26, 95%ДИ 2,10-5,07).

Кроме того, данная программа позволяет построить граф (Рис. 1), который иллюстрирует характер и силу межгенных взаимодействий между изучаемым фенотипом и полиморфными вариантами генов. Показано, что характер взаимодействий между ИБС с сопутствующим метаболическим синдромом и локусами генов MMP умеренно антагонистический или аддитивный, при этом больший вклад в развитие патологии вносят полиморфные локусы rs626750 (2,42% энтропии) и rs2277698 (2,16% энтропии).
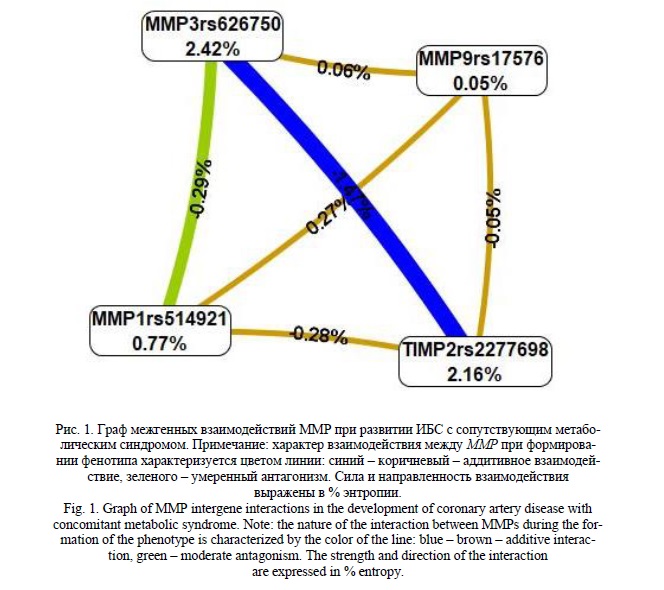
Предполагается, что концентрации циркулирующих молекул могут зависеть от генотипов полиморфных вариантов генов. Для подтверждения данной гипотезы мы провели оценку зависимости сывороточных уровней MMP-1, MMP-3, MMP-9 и TIMP -2 от генотипов выбранных полиморфных вариантов. Однако в данном случае ассоциаций с концентрацией MMP, а также их ингибиторов, в сыворотке крови и генотипами полиморфных вариантов MMP1 (rs514921), MMP3 (rs626750), MMP9 (rs17576), TIMP2 (rs2277698) не получено (Рис. 2).
Обсуждение. В результате проведенного нами исследования установлены ассоциации полиморфных вариантов rs626750 (MMP3) и rs2277698 (TIMP2) c развитием ишемической болезни сердца с сопутствующим метаболическим синдромом, однако, не было выявлено зависимости сывороточных уровней MMP от генотипов.
Развитие заболеваний сердечно-сосудистого континуума сложный и многогранный процесс, в котором задействованы различные патофизиологические механизмы. Так, одним из направлений исследований является изучение вклада различных видов матриксных металлопротеиназ в патогенез данных заболеваний. Экспрессия MMP обнаруживается в низких концентрациях в плазме взрослого человека [15], однако, при развитии какого-либо патологического процесса их уровень смещается в сторону увеличения [6], что дает возможность использования данных маркеров в клинической практике.
MMP1 – ген, кодирующий белок интерстициальной коллагеназы, которая способствует расщеплению коллагена I, II и III типов, и располагающийся на 11 хромосоме (chr11:102798499). Установлено, что MMP-1 экспрессируется фибробластами, хондритами, макрофагами, эндотелиальными клетками и остеобластами [3], что обуславливает ее вовлеченность в процесс разрыва бляшки, развитие острого коронарного синдрома, а также инфаркта миокарда. На сегодняшний день, для полиморфного варианта rs514921 гена MMP1 не получено статистически значимых ассоциаций с предрасположенностью к развитию ИБС, но установлена взаимосвязь с развитием аневризмы грудного отдела аорты [16, 17]. В нашем исследовании сравнительный анализ не показал взаимосвязи данного полиморфного варианта с развитием ИБС с сопутствующим метаболическим синдромом, а также не выявили статистической значимости данного полиморфизма с сывороточными уровнями циркулирующей MMP -1.
MMP3 – входит в кластер генов MMP и располагается на 11 хромосоме (11q22.3.) и кодирует фермент, который расщепляет фибронектин, ламинин, а также коллагены III, IV, IX и X типов [18]. Более того, показано, что MMP3 способна активировать другие MMP, такие как MMP-1 и является важным регулятором процессов ремоделирования [19]. Кроме того, неоднократно отмечено, что увеличение экспрессии MMP-3 может быть одной из причин разрыва атеросклеротической бляшки, что приводит к закупорке коронарных артерий [20]. По данным литературы, полиморфизм MMP3 влияет на концентрацию циркулирующего MMP-3, а также приводит к прогрессированию атеросклероза и накоплению коллагена во внеклеточном матриксе [21]. Для изучаемого нами аллельного варианта rs626750 в базе данных GWAS показана ассоциация аллеля G с развитием хронической обструктивной болезни легких [22, 23]. Наряду с этим, также Гончаровой и соавторами установлено, что полиморфизмы rs626750 (MMP3 / MMP12) и ассоциированы с ИБС и ИМ, что также согласуется с полученными нами данными [24].
Ген MMP9 располагается на хромосоме 20q12.2–13.1 и содержит 13 экзонов и 12 интронов. Полиморфный вариант rs17576 располагается в 6 экзоне, мутация приводит к замене агргенина на глутамин, что может приводить к изменению активности фермента [4]. Стоит отметить, что MMP9 является наиболее изученной молекулой из всего семейства MMP в контексте заболеваний сердечно-сосудистого континуума. Доступные литературные источники сообщают о достаточном количестве проведенных исследований, посвященных изучению взаимосвязи полиморфных вариантов гена MMP9 и предрасположенности к развитию ИБС, однако, все они носят противоречивый характер [25, 26]. Так, показано увеличение концентрации MMP -9 в сыворотке пациентов с ИБС по сравнению с здоровыми добровольцами, кроме того, продемонстрированы более высокие уровни MMP-9 и MMP-3 у пациентов с многососудистым поражением [27]. С одной стороны, ряд исследований демонстрируют, что аллельный вариант rs17576 ассоциирован с развитием неблагоприятных сердечно-сосудистых событий [15, 28]. Однако, часть имеющихся исследований, свидетельствуют об отсутствии ассоциаций данного полиморфизма с предрасположенностью к развитию ИБС [29]. В проведенном нами исследовании мы не получили каких-либо ассоциативных связей между генотипами полиморфного варианта rs17576 и формированием подверженности к развитию ИБС.
Известно, что TIMP-2 является естественным эндогенным ингибитором MMP-2, в вязи с чем многие физиологические и патофизиологические процессы напрямую зависят от их баланса [30]. Однонуклеотидные замены в гене TIMP2, котрый расположен на хромосоме 17q25, могут приводить к повышению или снижению активности TIMP-2 и впоследствии нарушая баланс между их активностью [31]. Кроме того, показано, что TIMP-2 способен вызывать остановку клеточного цикла [32]. На сегодняшний день данные о вкладе TIMP-2 в развитие патологии сердечно-сосудистой системы в большинстве случаев являются экспериментальными и сосредоточены в большей мере на патофизиологии атеросклероза. В исследовании на экспериментальных животных (мыши TIMP2 (-/-)) продемонстрировано снижение экспрессии MMP2 и увеличение антиангиогенных факторов, что в последствии привело к аномальному ремоделированию желудочков и тяжелой сердечной недостаточности [33]. Нами выявлено, что при носительстве генотипа A/G rs2277698 TIMP2 увеличивается риск развития ИБС с сопутствующим метаболическим синдромом в 2,6 раза. Для полиморфизма rs2277698 показаны ассоциации с раком молочной железы [31] и риском развития ИБС и ИМ [24].
Настоящее исследование имеет некоторые ограничения. Так, в представленной работе изучена вариабельность всего 5 полиморфных вариантов 4 генов матриксных металлопротеиназ, а также не рассматривались иные фактора риска связанные с развитием данного патологического состояния. Все вышесказанное свидетельствует о необходимости проведения дальнейших исследований.
Заключение. Таким образом, проведённое исследование позволило выявить ассоциации полиморфных вариантов генов MMP и их ингибиторов (rs626750 MMP3 и rs2277698 TIMP2) с развитием ИБС с сопутствующим метаболическим синдромом. Выявлена четырехлокусная модель взаимодействий генов MMP9, MMP3, MMP1, TIMP2, ассоциированная с изучаемым фенотипом.
Информация о финансировании
Исследование выполнено в рамках комплексной программы фундаментальных научных исследований СО РАН в рамках фундаментальной темы НИИ КПССЗ № 0419-2022-0002.





















Список литературы