Применение психотропных препаратов при онкологических заболеваниях (обзор)
Aннотация
Актуальность: По меньшей мере 25-30% пациентов с онкологическими заболеваниями страдают психическими расстройствами, в связи с чем психотропные препараты уже достаточно давно и успешно используются в онкологии. Психофармакологические препараты также применяются в качестве основного или вспомогательного средства для лечения симптомов, связанных с самим онкологическим заболеванием и с побочными эффектами терапии (нарушения сна, потеря аппетита, боль, тошнота, усталость и др.). Использование психотропных препаратов дает возможность точечно воздействовать на симптомы, которые негативно влияют на качество жизни пациентов. Вместе с тем, при назначении психотропных препаратов существуют проблемы лекарственных взаимодействий и побочных эффектов. Цель исследования:Целью исследования являлся анализ применения психофармакотерапии в онкологической практике для лечения коморбидных психических расстройств и симптомов, связанных с онкологическими заболеваниями. Также был проведен анализ побочных эффектов и лекарственных взаимодействий психофармакологических и онкологических препаратов. Материалы и методы:Произведен поиск в базах данных eLibrary, PubMed и Google Scholar, по ключевым словам «психоонкология», «психофармакотерапия» («psychooncology», «psychopharmacotherapy»). Из полученных результатов были выбраны ревью, метаанализы и рекомендации по терапии, которые наиболее полно отражают актуальные научные данные по данной теме. Результаты:Результаты исследования показали, что у онкологических пациентов наиболее часто встречаются различные типы тревожных расстройств и депрессивные реакции, которые успешно корректируются психофармакологическим вмешательством. Кроме того, назначение антидепрессантов и антипсихотиков может быть успешным в корректировке части симптомов, связанных как с самим течением онкологического процесса, так и с побочными эффектами основного лечения (анорексия, боль, тошнота и т.д.). Однако необходимо тщательно оценивать риски лекарственных взаимодействий при назначении любых психотропных препаратов. Например, назначение сильных ингибиторов цитохрома CYP2D6 может привести к снижению концентрации активного метаболита тамоксифена, а сочетание антидепрессантов и трамадола может повысить риск серотонинового синдрома. Заключение:Применение психотропных препаратов при терапии онкологических заболеваний может существенно улучшить качество жизни пациентов. При этом необходимо тщательно учитывать возможные побочные эффекты и лекарственные взаимодействия
Ключевые слова: психоонкология, психофармакотерапия, симптомы, связанные с онкологическими заболеваниями, паллиативная помощь, качество жизни, онкология
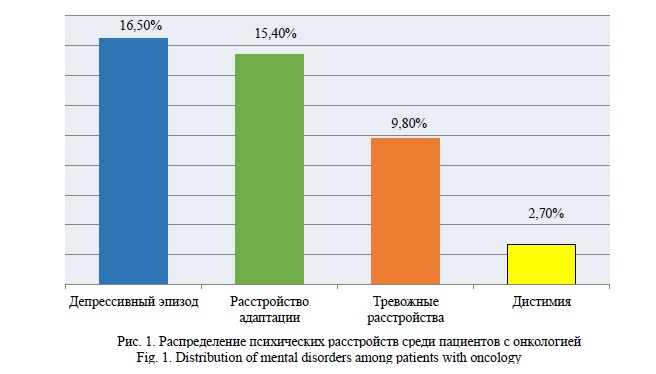
Введение. Комплексное лечение онкологических заболеваний должно включать не только специализированную противоопухолевую терапию, но и психофармакотерапию в случае наличия показаний. По меньшей мере, 25-30% пациентов с онкологическими заболеваниями соответствуют критериям психического расстройства. Наиболее распространенными психическими расстройствами являются депрессия, расстройства адаптации, тревога, нарушения сна и делирий (Рис. 1) [1, 2]. По результатам мета-анализа, треть онкологических пациентов как на этапе диагностики, так и в отделении неотложной помощи при госпитализации, страдали психическими расстройствами и нуждались в специализированном психофармакологическом лечении [3, 4]. Другое крупное когортное исследование, в котором приняли участие 7298 пациентов с онкологическими заболеваниями, показало, что примерно 15,6% пациентов соответствовали критериям психического расстройства (тревога, депрессия и/или чрезмерное употребление алкоголя) в сравнении с 1,4% здоровых добровольцев в контрольной группе. Психотропные препараты были назначены в течение 6 месяцев после впервые диагностированного онкологического заболевания 14,6% пациентам [5]. В 2020 г. были опубликованы результаты популяционного когортного исследования пациентов, которым впервые был выставлен диагноз онкологического заболевания. Из 142 270 пациентов 46% имели симптомы депрессии согласно Эдмонтонской системе оценки симптомов. Было выявлено, что такие факторы, как молодой возраст, более высокое бремя сопутствующих заболеваний, получение системной терапии в рамках лечения, а также рак ротоглотки и дыхательных путей способствуют более частому возникновению депрессивной симптоматики [6]. Назначение психотропных препаратов может начинаться вскоре после постановки диагноза, предположительно, по причине страха в отношении исходов болезни, однако в большинстве случаев оно имеет тенденцию к увеличению ближе к терминальной стадии заболевания. В одном ретроспективном исследовании "случай – контроль", включавшем в общей сложности 113 887 онкологических пациентов, были получены данные, что использование психотропных препаратов (антипсихотиков, антидепрессантов и бензодиазепинов) было значительно выше в последние 3 месяца жизни по сравнению с первыми 3 месяцами после постановки диагноза. Частое назначение антидепрессантов может отражать более высокий уровень психологического стресса на терминальной стадии онкологического заболевания, в то время как увеличение применения антипсихотиков на терминальных стадиях, вероятно, связано с развитием органического поражения головного мозга [7].
В связи с широкой распространенностью психических расстройств у данной группы пациентов психотропные препараты уже долгое время успешно используются в онкологии как для комплексного лечения психических расстройств, так и для вспомогательного лечения симптомов, связанных непосредственно с онкологическими заболеваниями (например, боль, приливы, усталость). Относительно безопасный профиль и минимальный риск серьезных побочных эффектов еще больше способствуют широкому использованию данных препаратов. Популяционное исследование, проведенное в США, показало, что более половины пожилых пациентов с раком мочевого пузыря получали психотропные препараты в течение 2 лет после постановки диагноза. Чаще всего назначались стимуляторы/модуляторы ГАМК, а также селективные ингибиторы обратного захвата серотонина [8]. В другом исследовании, проведенном японскими учеными, было показано, что наиболее часто применялись психотропные препараты при раке легкого, реже – при раке предстательной железы: 62,6% и 35,1% соответственно [9].
В связи с высокой значимостью данной проблемы, изучение и систематизация литературных данных, касающихся применения психотропных средств в онкологии, представляется актуальным.
Цель исследования. Обобщение современных знаний об использовании психотропных препаратов в онкологии (антидепрессантов, антипсихотиков, анксиолитиков и гипнотиков) с целью лечения коморбидных психических расстройств и устранения симптомов, связанных с онкологическими заболеваниями.
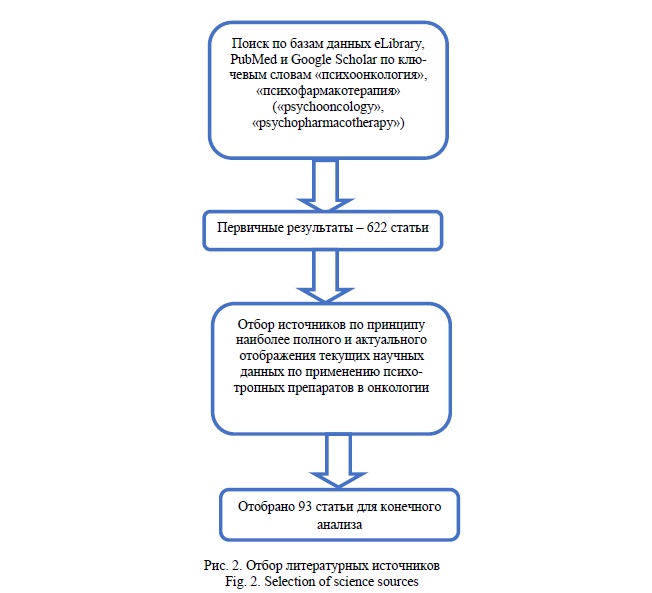
Материалы и методы исследования. Для решения поставленных задач был проведен поиск по базам данных eLibrary, PubMed и Google Scholar по ключевым словам «психоонкология», «психофармакотерапия» («psychooncology», «psychopharmacotherapy»). Результатом первичного поиска стали 622 статьи, из которых были отобраны 93 публикации, наиболее полно, по мнению авторов, отражающих актуальные научные данные, касающиеся рассматриваемой темы (Рис. 2).
Результатыиихобсуждение
Антидепрессанты. За последние несколько десятилетий, главным образом в результате появления новых классов антидепрессантов с лучшей переносимостью и меньшим количеством побочных эффектов, использование этой группы препаратов у онкологических пациентов стало более распространено. Во-первых, было показано, что антидепрессанты эффективны в лечении депрессии, тревожных и обусловленных стрессом расстройств у онкологических пациентов [10, 11]. Во-вторых, антидепрессанты также используются в качестве вспомогательного средства для лечения симптомов, не связанных с онкологическими заболеваниями, таких как приливы, невропатическая боль, тошнота, рвота, усталость и другие [12]. Эффективность антидепрессантов при онкологических заболеваниях была установлена во многих рандомизированных контролируемых исследованиях [13-16]. Из всех классов антидепрессантов наиболее часто в клинической практике используются селективные ингибиторы обратного захвата серотонина (СИОЗС) из-за относительно простого режима дозирования и оптимального соотношения потенциальной пользы и риска возникновения побочных эффектов. Также было установлено, что СИОЗС обладают противовоспалительными свойствами в отношении микроглии, основных клеток центральной нервной системы, которые регулируют и реагируют на воспалительные факторы [17]. Поскольку воспалительные механизмы вовлечены в биологию и физиологию онкологических заболеваний, СИОЗС являются рациональным вариантом лечения депрессии в таких клинических ситуациях. СИОЗС могут улучшать иммунитет онкологических пациентов и обладают противоопухолевыми свойствами, включая апоптотические свойства in vitro в клетках гепатоцеллюлярной карциномы [18].
Применение антидепрессантов в лечении коморбидных психических расстройств. Депрессия является одним из наиболее распространенных расстройств у онкологических пациентов. Исследования подтвердили увеличение частоты назначения антидепрессантов онкологическим пациентам с целью устранения симптомов депрессии [7, 11]. По данным систематического обзора и мета-анализа, было установлено, что антидепрессанты, независимо от их класса (например, СИОЗС или трициклические антидепрессанты), более эффективны, чем плацебо, при лечении депрессивных симптомов [19]. Тем не менее, антидепрессанты, как правило, следует назначать только при тяжелых проявлениях депрессии, при легких формах оптимальной является психотерапевтическая поддержка [20]. Стресс, расстройства, обусловленные стрессом, и расстройства адаптации также широко распространены у онкологических пациентов [1, 21]. Исследования показали, что примерно 12–25% онкологических пациентов страдают посттравматическим стрессовым расстройством (ПТСР), в то время как 20% пациентов страдают расстройствами адаптации [22, 23]. По данным литературы, антидепрессанты, особенно СИОЗС, являются первой линией терапии как для лечения ПТСР, так и для расстройств адаптации, однако конкретных данных в отношении онкологических пациентов представлено не было [24]. При тревожных расстройствах (например, фобиях, тяжелой и стойкой тревоге ожидания, социальной тревоге), СИОЗС, СИОЗСиН и миртазапин являются препаратами выбора у онкологических пациентов [25, 26]. Нарушение циркадных ритмов у онкологических пациентов может быть проявлением депрессии, тревожных расстройств, а также осложнением химиотерапии [27]. В данном случае помимо классических снотворных средств, могут быть назначены антидепрессанты с седативным эффектом (например, миртазапин и тразодон).
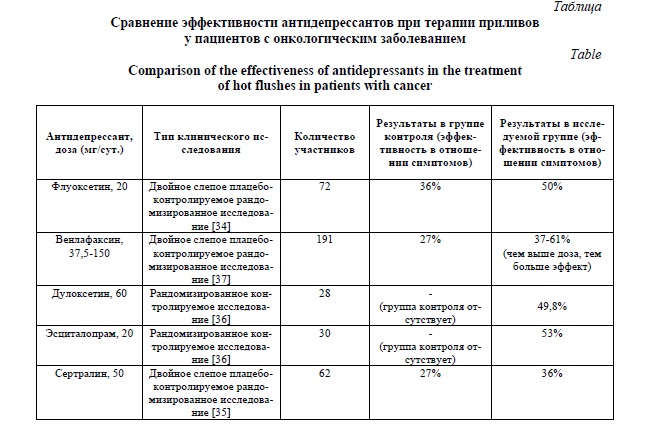
Применение антидепрессантов в отношении симптомов, связанных с онкологическими заболеваниями. Клиническая практика, подкрепленная научными данными, показала, что антидепрессанты можно использовать для улучшения симптомов, связанных с онкологическими заболеваниями, таких как потеря аппетита, анорексия, нарушения сна, боль, приливы, которые заметно влияют на качество жизни. В первую очередь антидепрессанты используются в качестве аугментации при терапии боли у онкологических пациентов [28, 29, 30]. Трициклические антидепрессанты и СИОЗСиН (в первую очередь дулоксетин) эффективны при лечении невропатической боли у онкологических пациентов, получающих химиотерапию [31, 32]. Некоторые химиотерапевтические препараты могут вызывать приливы жара, которые негативно сказываются на качестве жизни пациентов. Было показано, что антидепрессанты, особенно СИОЗС и СИОЗСиН, эффективны для лечения приливов [33]. Наибольшую эффективность среди них показали флуоксетин [34], сертралин [35], эсциталопрам дулоксетин [36] и венлафаксин [37] (Табл. 1). Однако при использовании этих препаратов требуется осторожность из-за потенциального ингибирующего действия на фермент системы цитохромов CYP2D6 [34, 36]. Антигистаминергические свойства миртазапина могут быть направлены на борьбу с тошнотой, анорексией/кахексией и тяжелой потерей веса [38]. Исследование II фазы подтвердило его благотворное влияние на аппетит, нарушения сна, беспокойство, боль, а также качество жизни и депрессию у онкологических пациентов [39].
Ограничения применения, побочные эффекты и лекарственные взаимодействия антидепрессантов в онкологической практике. Другие важные вопросы, связанные с применением антидепрессантов при онкологических заболеваниях, включают побочные эффекты и лекарственные взаимодействия [40, 41]. Препараты, обычно назначаемые онкологическим пациентам, такие как трамадол, прокарбазин и линезолид, повышают риск развития серотонинового синдрома при добавлении серотонинергических антидепрессантов. Данные лекарственные средства также могут усиливать тошноту и симптомы со стороны ЖКТ, а также повышать риск кровотечения у пациентов с тромбоцитопенией или принимающих антикоагулянты. Возможно развитие гипонатриемии, синдрома отмены и снижение судорожного порога. Флуоксетин по причине длительного периода полувыведения и сильного ингибирующего действия на цитохром CYP2D6 следует применять с осторожностью у онкологических пациентов, которые получают химиотерапию, во избежание возможных лекарственных взаимодействий с противоопухолевыми агентами, которые метаболизируются через систему CYP2D6. Аналогичным образом, пароксетин обладает выраженным ингибирующим эффектом на CYP2D6, а также антихолинергическими эффектами, которые требуют особого внимания со стороны лечащего врача. Сертралин, циталопрам и эсциталопрам имеют наименьшее количество лекарственных взаимодействий и являются препаратами выбора в данных условиях. Тамоксифен – селективный модулятор рецепторов эстрогена, используемый для профилактики рецидивов у пациенток с гормонорецепторным раком молочной железы. Фермент цитохром 2D6 (CYP2D6) является основным ферментом, превращающим тамоксифен в его активный метаболит эндоксифен. Генетические вариации в CYP2D6 влияют на превращение тамоксифена в его активную форму; около 7% женщин имеют нефункциональные аллели CYP2D6 и более низкий уровень эндоксифена. Три антидепрессанта – пароксетин, флуоксетин и дулоксетин – являются сильными ингибиторами CYP2D6; они могут вмешиваться в метаболизм тамоксифена [42]. Ретроспективное исследование показало более высокий риск смерти от рака молочной железы среди тех, кто принимал комбинированное лечение тамоксифеном и пароксетином, что изменило практику назначения антидепрессантов многими врачами. Последующие крупные исследования, изучавшие влияние различных фенотипов метаболизма CYP2D6, не выявили никакой связи с контролем заболевания и рецидивами [43, 44]. Позиция актуальных клинических рекомендаций заключается в том, чтобы избегать сильных ингибиторов CYP2D6 (пароксетин), отдавая предпочтение препаратам с отсутствием или слабым ингибированием данного цитохрома (эсциталопрам, венлафаксин), но лечащий врач должен быть внимателен к дальнейшим исследованиям по этому вопросу по мере их появления [45]. При этом ревью 2022 года не выявило разницы в исходах терапии у пациентов, принимающих и не принимающих антидепрессанты (включая пароксетин) совместно с тамоксифеном [46]. Следует отметить, что в российской инструкции в разделе лекарственное взаимодействие указана вся группа СИОЗС как потенциально способная снизить уровень активного метаболита тамоксифена, в связи с чем подобные назначения следует проводить с большой осторожностью и тщательно документировать.
Антипсихотики. Антипсихотики также являются препаратами, которые уже долгое время используются в онкологической практике. Они применяются для лечения таких психических расстройств, как расстройства настроения, депрессия, тревога; психотических расстройств (делирий и/или психотические симптомы, вызванные приемом некоторых лекарственных препаратов), а также побочных эффектов химиотерапии. Во многих случаях побочные эффекты отдельных антипсихотиков используются для контроля целевых симптомов, как в случае с тошнотой, рвотой или снижением аппетита.
Применение антипсихотиков в лечении коморбидных психических расстройств. При острой тревоге у онкологических пациентов антипсихотики могут быть предпочтительнее бензодиазепинов, поскольку последние повышают риск изменения психического статуса и угнетения дыхания. По аналогичным причинам низкие дозы седативных атипичных антипсихотиков (кветиапина, оланзапина) предпочтительнее гипнотиков для лечения бессонницы [47, 48, 49]. У детей с онкологическими заболеваниями рисперидон и оланзапин показатели свою эффективность и хорошую переносимость в отношении раздражительности и симптомов депрессии [50].
Применение антипсихотиков в отношении симптомов, связанных с онкологическими заболеваниями. Применение галоперидола, левомепромазина и дроперидола для контроля тошноты и рвоты не рекомендовано у онкологических пациентов ввиду недостаточного количества данных об эффективности [51, 52, 53]. В то же время, атипичный антипсихотик оланзапин показал эффективность в лечении тошноты и рвоты, вызванных химиотерапией [54]. Оланзапин в дозе 10 мг значительно уменьшал выраженность тошноты, рвоты и снижал частоту использования купирующей терапии по сравнению с плацебо у онкологических пациентов, проходящих химиотерапию и испытывающих сильные рвотные позывы [55]. В детской онкологии оланзапин при его применении в средней дозе 0,1 мг/кг снижал частоту возникновения рвоты, ассоциированной с химиотерапией. Средний возраст пациентов в выборке составлял 13 лет [56]. Таким образом, применение оланзапина в составе комбинированной терапии для контроля тошноты и рвоты оправдано как у детей, так и у взрослых пациентов с онкологическими заболеваниями. Исследования показывают, что оланзапин снижал потерю веса у онкологических пациентов более чем на 10% и увеличивал потребление пищи [57, 58, 59]. Данное свойство может быть полезным при лечении анорексии, вызванной онкологическим заболеванием.
Более 90% онкологических пациентов в последние дни жизни переживают предсмертный делирий [60, 61]. При этом у 70% развивается беспокойство, возбуждение или агрессивное поведение [62]. Антипсихотики уже на протяжении долгого времени используются в качестве препаратов первой линии для лечения делирия и связанного с ним возбуждения [63, 64]. Среди типичных антипсихотиков галоперидол является одним из наиболее часто используемых препаратов [65]. В опросе, проведенном среди 135 врачей, оказывающих паллиативную помощь в девяти странах, галоперидол считался одним из четырех основных препаратов, которые должны быть доступны во всех учреждениях, оказывающих помощь пациентам с онкологическим заболеваниями в терминальном состоянии [66]. Более того, комбинация лоразепама и галоперидола показала лучшие результаты по сравнению с монотерапией галоперидолом в рамках их применения для контроля ажитации и субъективной оценки комфорта пациентов [63, 67]. Не только галоперидол, но и хлорпромазин является предпочтительным вариантом для лечения предсмертного делирия. Он блокирует α1-адренорецепторы, что может эффективно уменьшить возбуждение [68]. Однако применение галоперидола не рекомендуется при гипоактивном делирии на поздних стадиях в связи с отсутствием эффективности или ухудшением симптоматики, что возможно связано с полиорганной недостаточностью [69]. Также не стоит забывать о высоком риске развития злокачественного нейролептического синдрома, чаще возникающего при назначении галоперидола и других антипсихотиков-антагонистов D2-рецепторов [70]. Недавний систематический обзор показал, что оланзапин и кветиапин являются адекватными альтернативами галоперидолу, особенно у пациентов с выраженными экстрапирамидными симптомами, нуждающихся в седации или имеющих указания на непереносимость галоперидола в анамнезе [71]. Рисперидон также используется при лечении делирия, обладая эффективностью сравнимой с галоперидолом и оланзапином [72, 73].
Ограничения применения, побочные эффекты и лекарственные взаимодействия. Онкологические пациенты подвержены бóльшему риску побочных эффектов в связи с ухудшением общего состояния здоровья. Например, гиповолемия может повысить риск ортостатической гипотензии, приводящей к обморокам и падениям. Внутримышечный способ введения антипсихотиков ассоциирован с риском возникновения гематом у онкологических пациентов с тромбоцитопенией. Проблема нейролептической гиперпролактинемии у пациентов с раком молочной железы, вызывает все большую озабоченность. У пациентов с шизофренией прижизненная распространенность рака молочной железы встречается на 25% чаще, чем в общей популяции [74, 75]. Большинство внутрипротоковых опухолей сверхэкспрессируют рецептор пролактина, и пролактин может способствовать прогрессированию опухоли независимо от статуса рецептора. В недавнем исследовании, проведенном в Финляндии, было показано, что длительное применение антипсихотиков, повышающих уровень пролактина (рисперидон и галоперидол), было связано с повышением риска развития рака молочной железы [76]. Из антипсихотиков, наиболее часто используемых в онкологической практике, рисперидон и галоперидол чаще всего вызывают гиперпролактинемию, тогда как арипипразол, зипрасидон и кветиапин вызывают минимальное повышение пролактина [77]. Акатизия может развиваться наряду с другими экстрапирамидными симптомами, особенно при сочетании антипсихотиков с антиэметиками. Несмотря на то, что экстрапирамидные симптомы чаще ассоциируются с приемом типичных антипсихотиков, они также могут возникать во время лечения такими атипичными антипсихотиками, как рисперидон и оланзапин, особенно при их применении в высоких дозах [78]. Регулярный мониторинг интервала QT также очень важен, особенно у онкологических пациентов с электролитными нарушениями и принимающих препараты, удлиняющие интервал QT, поскольку его удлинение может предрасполагать к развитию угрожающих жизни желудочковых аритмий [79]. Данный побочный эффект наиболее выражен при лечении тиоридазином, сертиндолом, зипрасидоном, галоперидолом, рисперидоном и оланзапином, хотя всем пациентам, получающим антипсихотические препараты, рекомендуется регулярно проверять интервал QT [80]. Мета-анализ применения антипсихотиков при терапии шизофрении показал, что препаратами, способствующими пролонгированию QT в меньшей степени, являются арипипразол, луразидон, палиперидон и азенапин [81]. Другие серьезные побочные эффекты, включая инсульт и венозную тромбоэмболию, были описаны в связи с применением атипичных антипсихотиков в популяции пожилых пациентов [82]. Дополнительные опасения при назначении антипсихотиков включают риск метаболического синдрома при длительном применении (т. е. инсулинорезистентность, дислипидемия, ожирение), гипонатриемию, снижение судорожного порога в контексте параллельного применения стероидов, лекарственные взаимодействия, повышение уровня печеночных трансаминаз и антихолинергическую токсичность (например, запор, сухость во рту, задержка мочи). При назначении антипсихотиков пациентам с делирием есть риск падений и возникновения аспирационных пневмоний [83]. Назначая антипсихотики, следует начинать с минимальных доз с последующим титрованием для более благоприятного исхода [84].
Применение анксиолитиков и гипнотиков в лечении коморбидных психических расстройств у пациентов с онкологическими заболеваниями. Метаанализ 70 исследований показал, что в учреждениях онкологической помощи распространенность расстройства адаптации и тревожных расстройств среди пациентов составляет 19,4% и 10,3% соответственно [1]. Несмотря на то, что серотонинергические антидепрессанты остаются основной группой, применяемой в лечении генерализованной тревоги и профилактики панических атак у онкологических пациентов, лечение также часто включает бензодиазепины короткого и длительного действия. Бензодиазепины часто являются препаратом выбора при острых симптомах тревоги и паники. Такие препараты короткого действия как алпразолам, лоразепам и оксазепам, могут быть полезны при проведении коротких процедур (фобия инъекций, закрытое МРТ) или приступах паники [76]. Клоназепам и диазепам действуют дольше, поэтому могут быть полезными для лечения симптоматической тревоги и бессонницы. Золпидем, зопиклон и залеплон, также известные как “Z-drugs”, являются небензодиазепиновыми препаратами, используемыми для лечения инсомнии у онкологических пациентов. Данная группа препаратов обладает минимальным анксиолитическим эффектом и меньшим риском развития толерантности и нежелательных реакций [85, 86]. Антигистаминный препарат гидроксизин может также назначаться по мере необходимости при симптомах тревоги [24]. Основное преимущество небензодиазепиновых препаратов заключается в том, что они, как правило, не вызывают зависимости. В последнее время увеличивается число публикаций, описывающих исследования препарата лемборексанта, являющегося двойным антагонистом рецептора орексина. Ранее лемборексант показал хорошую эффективность и переносимость у пациентов с инсомнией с затруднениями при засыпании и частыми пробуждениями [87]. В небольшом пилотном исследовании оценивалось применение лемборексанта при нарушениях сна у онкологических пациентов, в том числе с делирием, результаты были аналогичны. Несмотря на ограничения исследования (небольшая выборка, ретроспективная оценка), результаты обнадеживающие и говорят о том, что в будущем применение препарата будет более широким [88].
Применение анксиолитиков и гипнотиков в отношении симптомов, связанных с онкологическими заболеваниями. Бензодиазепины часто используют для лечения психомоторного возбуждения и судорог. При рефрактерности симптомов они используются для паллиативной седативной терапии. Идеальным бензодиазепином для использования в паллиативной помощи является мидазолам по причине скорости наступления эффекта, короткой продолжительности действия и отсутствия выраженного синдрома отмены. Он рассматривается как один из четырех незаменимых препаратов для пациентов в терминальной стадии [89-92]. В комбинации с противорвотными средствами и поведенческими техниками, бензодиазепины также могут быть эффективны при тошноте, связанной с химиотерапией [93]. Аквагенный зуд (интенсивное ощущение царапания после контакта с водой), возникающий при BCR-ABL1-негативных миелопролиферативных новообразованиях, резко снижает качество жизни пациентов с онкологией. Анксиолитик с антигистаминным и антихолинергическим действием гидроскизин может быть эффективен у пациентов с данной патологией [94].
Ограничения применения, побочные эффекты и лекарственные взаимодействия. Наиболее распространенные побочные эффекты бензодиазепинов включают седацию, головокружение, падения, угнетение дыхания, нарушение координации и спутанность сознания [76, 93]. У онкологических пациентов бензодиазепины противопоказаны при угнетении дыхания или брадикардии. Некоторые побочные эффекты бензодиазепинов, а именно седация, головокружение и нарушение координации движений, могут способствовать чувству усталости и слабости. В некоторых случаях применение бензодиазепинов может усугублять дезориентацию и нарушение памяти или даже вызывать парадоксальные эффекты (возбуждение, расторможенность) у пациентов с поражением центральной нервной системы [93]. Следует помнить, что длительное применение бензодиазепинов может способствовать развитию толерантности и потере эффективности. Как и большинство психотропных препаратов, бензодиазепины метаболизируются ферментной системой CYP450, что может привести к развитию лекарственных взаимодействий. При комбинировании бензодиазепинов с препаратами, угнетающими центральную нервную систему (например, с опиоидами), важно учитывать их синергические эффекты. Существует потенциальный риск угнетения дыхания в результате комбинированного применения опиоидов и бензодиазепинов. Также существует связь между риском передозировки опиоидов и приемом бензодиазепинов [94, 95]. Не было приведено никаких доказательств прямой связи риска передозировки опиоидов со снотворными препаратами «Z-drugs», однако на основании их сходных фармакологических свойств с бензодиазепинами, можно предположить возможный риск передозировки при совместном использовании с опиоидами [95].
Заключение. Психические расстройства, включая тревогу и депрессию, часто наблюдаются у пациентов с онкологическими заболеваниями. Психофармакотерапия также может эффективно скорректировать симптомы, связанные с основным состоянием и процессом его лечения. Несмотря на возможные побочные эффекты и взаимодействия с другими лекарствами, применение психотропных препаратов оправдано в многих случаях. Правильно подобранные и назначенные психотропные препараты могут значительно улучшить качество жизни и результаты лечения онкологических пациентов.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы