Связь полиморфизма rs11546155 гена GGT7 с риском развития ишемического инсульта
Aннотация
Актуальность: Учитывая значимую роль окислительного стресса в патогенезе ишемического инсульта (ИИ) целесообразным является изучение молекулярно-генетических механизмов регуляции редокс-гомеостаза и метаболизма глутатиона. Цель исследования:Изучить ассоциации полиморфного варианта rs11546155 гена гамма-глутамилтрансферазы 7 (GGT7) c риском развития ИИ. Материалы и методы:Образцы ДНК 600 больных ИИ и 688 лиц контрольной группы использовались для генотипирования SNP rs11546155 методом ПЦР в режиме реального времени с дискриминацией аллелей с помощью TaqMan-зондов. Результаты:Установлено, что генотипы G/A и A/A ассоциированы с повышенным риском развития ИИ в группе женщин (OR=1,54, 95%CI 1,02–2,32, Pperm=0,04), тогда как у мужчин ассоциаций генотипов rs11546155 гена GGT7 не наблюдалось. У пациентов с гиподинамией полиморфизм rs11546155 был ассоциирован с повышенным риском развития ИИ (OR=1,59, 95%CI 1,01–2,00, Pperm=0,04), в то время как у лиц с достаточной физической активностью данный SNP не был связан с развитием болезни. Кроме того, у лиц носителей аллеля rs11546155G, которые не злоупотребляли алкоголем, наблюдается пониженный риск развития ИИ (OR=0,58, 95%CI 0,38–0,88, Pperm=0,01), тогда как у лиц, злоупотребляющих алкоголем, данный аллель терял свой защитный эффект в отношении риска болезни. Функциональное аннотирование SNP показало, что связанный с ИИ аллель rs11546155A ассоциирован со снижением экспрессии гена GGT7, а также генов, вовлеченных в аутофагию и протеасомную деградацию белков. Заключение:В настоящем исследовании впервые установлена связь полиморфизма rs11546155 с риском развития ИИ. Дальнейшие исследования необходимы для выяснения природы, как пол-специфической ассоциации SNP, так и генно-средовых взаимодействий
Ключевые слова: ишемический инсульт, окислительный стресс, глутатион, ДНК-полиморфизм, гамма-глутамилтрансфераза (GGT7)
Введение. Смертность от цереброваскулярных патологий, связанных с нарушениями кровотока в головном мозге, составляет 20% и занимает второе место в общем уровне летальности в РФ [1, 2]. Согласно докладу ВОЗ, в мире каждый год выявляют более 15 миллионов случаев инсульта и большая часть пациентов умирает в течение первого года, а среди выживших около 80% остаются инвалидами [3]. Ишемический инсульт (ИИ) – самая распространенная форма инсульта, представляет собой состояние организма, при котором происходит нарушение циркуляции крови в мозге, что приводит к гипоксии, некрозу органа и последующему неврологическому дефициту [4]. Хорошо известно, что основными причинами ИИ являются атеросклероз, тромбоз или эмболия церебральных сосудов.
С генетических позиций ишемический инсульт представляет собой мультифакториальноe полигенное заболевание, в развитие которого вовлечены генетические и средовые факторы [5]. Так, согласно результатам близнецовых исследований, значение конкордатности по наличию ИИ у монозиготных близнецов превышает таковой показатель на 65% у дизиготных близнецов, что указывает на мультифакториальную природу болезни [6]. Семейные исследования также продемонстрировали значимость генетических факторов для развития ИИ – если один из родителей перенес ишемический инсульт, то риск возникновения болезни у потомства повышается вдвое и семейная отягощенность ИИ более отчетливо проявляется среди молодых пациентов [6]. Многочисленные молекулярно-генетические исследования последних лет позволили установить различные классы генов, полиморфные варианты которых ассоциированы с предрасположенностью к ишемическому инсульту. В частности, выделены следующие группы кандидатных генов ИИ: регуляции липидного обмена, гемостаза и фибринолиза, ренин-ангиотензин-альдостероновой системы, метаболизма оксида азота, гомоцистеина и металлопротеиназ [6, 7]. Также установлены полиморфные варианты генов, ассоциированные с течением и исходами ИИ, в том числе генов, определяющих сосудистую реактивность, устойчивость головного мозга к ишемии и гипоксическому повреждению [5]. Показано, что некоторые моногенные заболевания могут объяснить порядка 7% генетических причин ишемического инсульта [8]. По результатам крупного полногеномного ассоциативного исследования (GWAS), выполненного в Великобритании на выборке более 3,5 тысяч пациентов с ИИ и около 6 тысяч контроля, установлено, что наследуемость ишемического инсульта в целом составляет около 38%, тогда как наследуемость инсульта с поражением крупных мозговых сосудов составляет 40%, инсульта кардиоэмболического типа – 33%,а инсульта с поражением мелких сосудов – 16% [6].
Окислительный стресс (ОС) является одним из ключевых патологических процессов, обнаруживающихся на всех этапах развития цереброваскулярной патологии и возникающих в результате избыточного образования свободных радикалов на фоне дефицита антиоксидантной защиты [9, 10]. Патологическое действие окислительного стресса включает активацию экспрессии провоспалительных генов, которые индуцируют иммунные клетки и способствуют выделению в эндотелии цитокинов и факторов клеточной адгезии, что зачастую является причиной воспаления сосудистой стенки. В связи со значимостью окислительного стресса для патогенеза ишемического инсульта целесообразным является изучение молекулярно-генетических механизмов регуляции редокс-гомеостаза и особенно метаболизма глутатиона [11]. В этом контексте особый интерес привлекают гены ферментов метаболизма глутатиона, которые потенциально могут влиять на его синтез и, тем самым, быть вовлеченными в регуляцию редокс-гомеостаза клеток, в том числе артерий и клеток головного мозга [7]. Известно, что поступление аминокислот-предшественников для внутриклеточного синтеза глутатиона (цистеина, глицина и глутаминовой кислоты) регулируется под влиянием мембран-ассоциированных ферментов, одним из которых является гамма-глутамилтрансфераза, которая расщепляет внеклеточный восстановленный глутатион на глутамат и дипептид цистеинил-глицин, которые после аминопептидазной реакции транспортируются в клетку для de novo синтеза глутатиона [12]. До настоящего времени исследований, целью которых является изучение связи полиморфизма генов ферментов катаболизма глутатиона, а именно гамма-глутамилтрансфераз, с риском развития ишемического инсульта не проводилось, ни в России, ни за рубежом.
Цель исследования. Изучить ассоциацию функционально значимого полиморфного варианта rs11546155 гена гамма-глутамилтрансферазы 7 (gamma-glutamyltransferase 7, GGT7) c риском развития ишемического инсульта.
Материалы и методы исследования. В настоящее исследование было вовлечено 600 пациентов (330 мужчин и 270 женщин), находившихся на лечении в неврологическом отделения регионального сосудистого центра Курской областной многопрофильной клинической больницы. Диагноз ИИ верифицировался опытными врачами-неврологами на основе клинической картины болезни с использованием данных инструментального обследования (компьютерная томография и ядерно-магнитная резонансная томография головного мозга). Средний возраст пациентов составил 61,09±9,77 лет. Контрольная группа для исследования была сформирована из образцов ДНК биобанка научно-исследовательского института генетической и молекулярной эпидемиологии КГМУ и включала 688 относительно людей без какой-либо хронической соматической патологии (366 мужчин и 322 женщины, средний возраст 60,84 ± 7,45 лет). Протокол исследования (№ 6 от 14.05.2018) был одобрен региональным этическим комитетом ФГБОУ ВО КГМУ Минздрава России. От всех участников исследования было получено добровольное информированное согласие на участие в данном научном исследовании. Среди пациентов проводилось анкетирование с использованием валидированного опросника [13] для выявления различных факторов, которые могут быть связаны с развитием ишемического инсульта (образ жизни, питание, психоэмоциональный стресс, вредные привычки и пр.). У пациентов с ИИ производился забор цельной венозной крови для выделения геномной ДНК стандартным двухэтапным методом фенольно-хлороформной экстракции и преципитации этанолом. Для исследования был выбран функционально значимый однонуклеотидный полиморфизм (SNP) rs11546155 гена GGT7, ассоциированный с экспрессией данного гена в артериях и плазме крови (данные портала GTEx, https://www.gtexportal.org/home/) и частотой минорного аллеля A более 10% в европейских популяциях (данные геномного браузера Ensembl, https://www.ensembl.org/index.html). Генотипирование полиморфизма rs11546155 гена GGT7 проводилось методом ПЦР в режиме реального времени с дискриминацией аллелей с помощью TaqMan-зондов в лаборатории геномных исследований НИИ генетической и молекулярной эпидемиологии КГМУ.
Статистическая обработка данных, включая анализ ассоциаций SNP с риском развития ИИ, была проведена с использованием программы PLINK 1.9. Оценка распределения частот генотипов на соответствие равновесию Харди-Вайнберга (РХВ) и межгрупповые сравнения частот аллелей и генотипов осуществлялась точным тестом Фишера. Анализ ассоциацией аллелей и генотипов с риском развития ИИ проводился путем расчета отношения шансов (OR) и 95% доверительных интервалов (95% CI). Анализировались следующие генетические модели взаимосвязи SNP с фенотипом: аллельная, аддитивная, доминантная и рецессивная. Для оценки уровня значимости ассоциаций аллелей и генотипов с ИИ использовался адаптивный пермутационный тест, позволяющий рассчитывать эмпирический уровень значимости (Pperm). Наилучшая генетическая модель ассоциации SNP c ИИ соответствовала наименьшему значению Pperm.
Результаты и их обсуждение. Частоты генотипов полиморфного варианта rs11546155 соответствовали их ожидаемым значениям при равновесии Харди-Вайнберга (р>0,05). Результаты по анализу ассоциации полиморфного варианта rs11546155 гена GGT7 с риском развития ишемического инсульта в общих (объединенных мужчин и женщин) группах и в группах, стратифицированных по полу, представлены в таблице 1. Как видно из таблицы 1, статистически значимых ассоциаций полиморфизма rs11546155 с риском развития ишемического инсульта в общих (не стратифицированных по полу) группах пациентов не обнаружено. В то же самое время, генотипы G/A и A/A были ассоциированы с повышенным риском развития ИИ в группе женщин (OR=1,54, 95%CI 1,02–2,32, Pperm= 0,04), тогда как у мужчин ассоциаций генотипов rs11546155 гена GGT7 не наблюдалось.
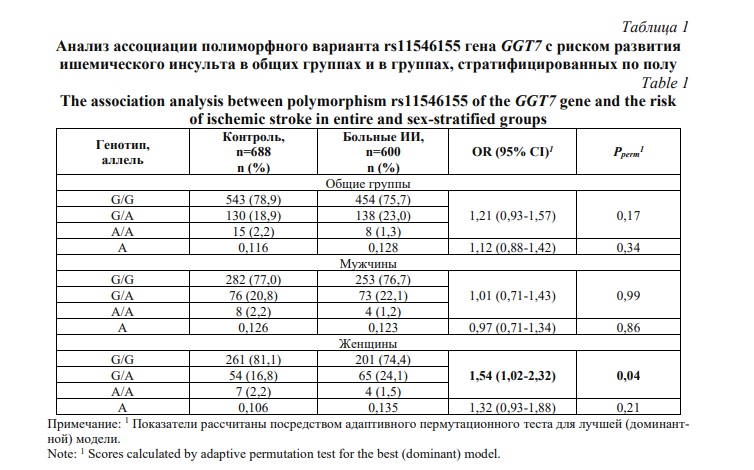
В связи с тем, что ишемический инсульт представляет собой типичное мультифакторное заболевание, на развитие которого оказывают как генетические, так и средовые факторы, при анализе влияния генетических маркеров на риск развития болезни необходимо учитывать разнообразные средовые факторы [14]. С использованием анкетных данных пациентов были проанализированы следующие средовые факторы ИИ: курение, злоупотребление алкоголем, гиподинамия, психоэмоциональный стресс и низкий уровень употребления свежих овощей и фруктов. В таблице 2 представлены результаты совместного влияния полиморфного варианта rs11546155 гена GGT7 и средовых факторов на риск развития ишемического инсульта. Согласно данным, представленным в таблице 2, у пациентов с низкой физической активностью (гиподинамией) полиморфизм rs11546155 был ассоциирован с повышенным риском развития ишемического инсульта (OR=1,59, 95%CI 1,01–2,00, Pperm=0,04), в то время как у лиц с достаточной физической активностью данный однонуклеотидный полиморфизм не был связан с развитием болезни.
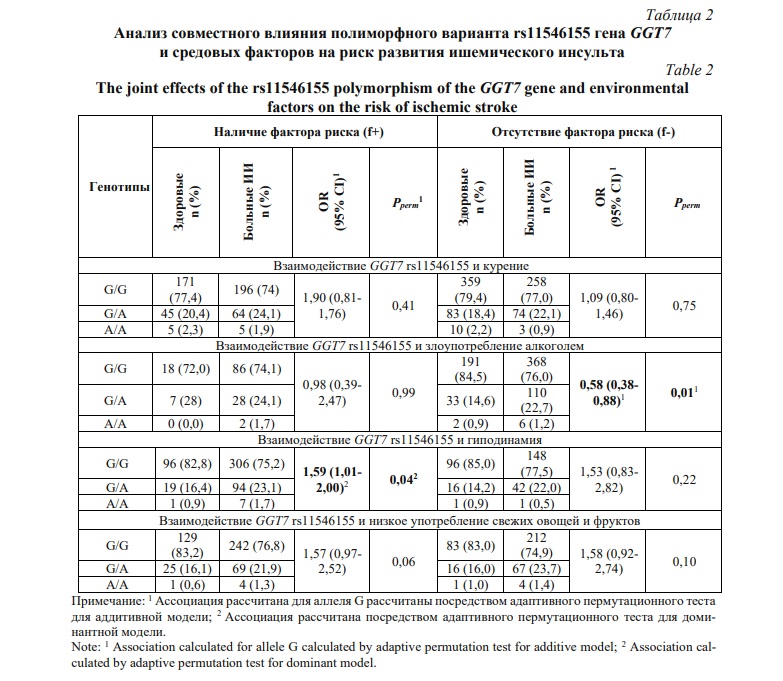
Также установлено, что у носителей генотипов с аллелем G, не злоупотребляющих алкоголем, наблюдался пониженный риск развития ИИ (OR=0,58, 95%CI 0,38–0,88, Pperm=0,01). Однако у лиц, злоупотребляющих алкоголем, данный аллель терял свой защитный эффект в отношении развития ишемического инсульта (ассоциации SNP не наблюдалось). Совместного влияния полиморфизма rs11546155 гена GGT7 с курением и дефицитом в пищевом рационе свежих овощей и фруктов на риск развития ишемического инсульта не установлено.
Для интерпретации выявленных гено-фенотипических ассоциаций нами было проведено функциональное аннотирование полиморфного варианта rs11546155 гена GGT7 с использованием геномно-транскриптомных данных портала GTEx (Табл. 3). При этом анализировались данные экспрессии гена GGT7 в артериях, мозге и плазме крови, которые могут иметь патогенетическое значение для развития ишемического инсульта.
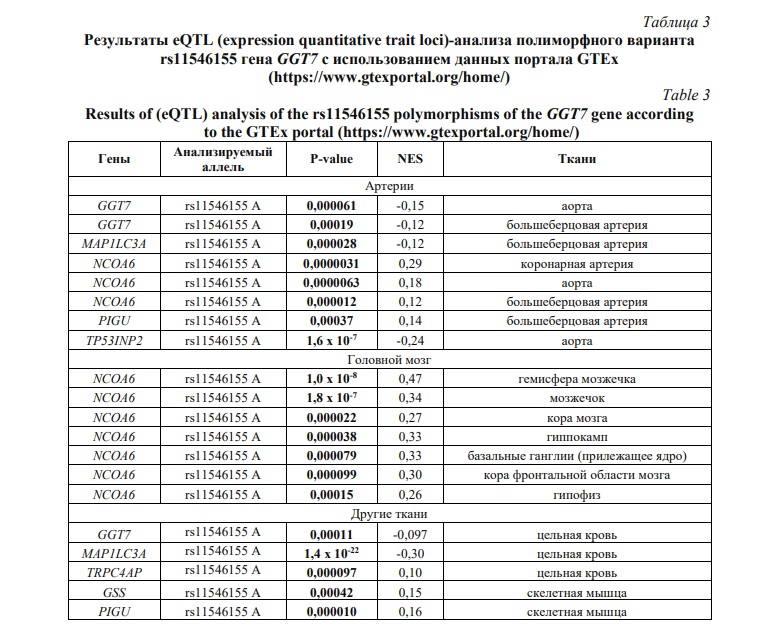
Оказалось, что вариантный аллель ассоциирован с экспрессией, как гена GGT7, так и других генов, расположенных в хромосомном сегменте 20q11.22. Как видно из таблицы 3, аллель rs11546155A ассоциирован с пониженной экспрессией гена GGT7 в аорте, большеберцовой артерии и цельной крови, пониженной экспрессией гена MAP1LC3A – белка, ассоциированного с микротрубочками (microtubule associated protein 1 light chain 3 alpha,) в большеберцовой артерии и цельной крови, а так же гена опухолевого белка p53, индуцируемым ядерным белком 2 (tumor protein p53 inducible nuclear protein 2, TP53INP2) в аорте. Аллель rs11546155 A так же ассоциировался с повышенной экспрессией гена коактиватора ядерных рецепторов 6 (nuclear receptor coactivator 6, NCOA6) в аорте, большеберцовой и коронарной артериях, а также в различных отделах головного мозга. Кроме того, аллель rs11546155A был ассоциирован с повышенной экспрессией гена белка класса U биосинтеза фосфатидилинозитол-гликанового якоря (phosphatidylinositol glycan anchor biosynthesis class U, PIGU) в большеберцовой артерии и скелетной мышце. Повышенный уровень мРНК гена TRPC4AP – белка, ассоциированного с 4м членом подсемейства катионных каналов С переходного рецепторного потенциала (transient receptor potential cation channel subfamily C member 4 associated protein) и глутатионсинтетазы (glutathione synthetase, GSS) в крови были также ассоциированы с аллелем rs11546155 A.
Таким образом, учитывая транскриптомные данные, представленные в таблице 3, можно полагать, что носительство ассоциированного с повышенным риском развития ИИ у женщин аллеля rs11546155A связано со снижением экспресии генов GGT7,MAP1LC3A и TP53INP2 в артериях и данные изменения могут отражать существование у лиц, предрасположенных к ишемическому инсульту, нарушений метаболизма глутатиона и процессов аутофагии - важнейших биологических процессов, которые связаны с развитием атеросклероза. По всей видимости, связь изученного полиморфизма с риском развития ишемического инсульта отражает ко-регуляцию экспрессии данных генов в артериях и взаимосвязь процессов аутофагии и метаболизма глутатиона, которые, как известно, могут иметь патогенетическое значение для формирования ишемического инсульта [11, 15].
Учитывая главную биологическую функцию GGT7, а именно его вовлеченность во внеклеточный катаболизм восстановленного глутатиона (GSH) и его конъюгатов [12], дефицит данного фермента в мембранах клеток сосудистой стенки может быть причиной недостаточного поступления в клетку аминокислот-предшественников для синтеза GSH – глутамата и дипептида цистеинил-глицина. Известно, что GSH транспортируется из печени (главный орган, который производит глутатиона в организме) через кровоток в органы и периферические ткани, включая эндотелиальные клетки сосудов. Носительство аллеля rs11546155A может быть сопряжено с дефицитом внутриклеточного глутатиона и высоким риском формирования окислительного стресса, который, как известно, имеет непосредственное отношение к развитию атеросклероза.
Представляют также интерес обнаруженные корреляции аллеля rs11546155A с экспрессией генов, вовлеченных в аутофагию (Табл. 3). Как было отмечено выше, продукты генов MAP1LC3A и TP53INP2 вовлечены в регуляцию аутофагии – непрерывного процесса, при котором поврежденные белки органелл и клеточный материал разрушаются внутри аутофагосом [14]. Аутофагия – внутриклеточный процесс деградации цитоплазматических молекул и органелл в аутофагосомах, осуществляющий регуляцию баланса между уровнем распада и синтеза клеточных компонентов. При умеренной активации аутофагия защищает клетку от стрессовых воздействий, однако при чрезмерной активации она может действовать в синергизме с апоптозом, способствуя гибели клетки [9]. MAP1LC3A отвечает за продукцию белка клеточной системы аутофагии [16], необходимой для поддержания клеточного гомеостаза, что также имеет значение для нормального функционирования нейронов [17]. Ген TP53INP2 кодирует белок, который способствует аутофагии и необходим для правильного формирования и функционирования аутофагосом. Кроме того, кодируемый белок может усиливать транскрипцию рДНК, помогая в сборке комплекса предварительной инициации POLR1/РНК-полимеразы I [18]. Пониженный уровень экспрессии данного гена в артериях у носителей, ассоциированного с ишемическим инсультом аллеля rs11546155А, также может отражать низкую активность процессов аутофагии. Можно предположить, что пониженный уровень экспрессии данного гена в артериях, цельной крови у носителей аллеля rs11546155А, ассоциированного с повышенным риском ишемического инсульта, может косвенно отражать сниженную активность процессов аутофагии в артериях у данных пациентов. Известно, что аутофагия патогенетически связана с атеросклеротическим процессом и тесно коррелирует с отложением липидов, инфильтрацией, пролиферацией и воспалительными изменениями, а также разрывом атеросклеротической бляшки [11, 19], что является причиной острых нарушений артериальной проходимости.
Еще одним геном, экспрессия которого в головном мозге положительно коррелировала с носительством аллеля rs11546155А, был NCOA6. Белок, кодируемый данным геном, является коактиватором транскрипции, который может взаимодействовать с ядерными рецепторами гормонов для усиления их функций по активации транскрипции, в том числе и сигнального каскада NF-κB, контролирующего экспрессию генов иммунного ответа, апоптоза и клеточного цикла. С носительством аллеля rs11546155А также были связана экспрессия и других генов. Так, PIGU представляет собой ген, кодирующий белок, который является пятой субъединицей трансамидазного комплекса GPI, который играет важную роль в развитии и функционировании нейронов [17, 20]. TRPC4AP участвует в убиквитинировании белков и их протеасомной деградации [21]. Наконец GSS – ген, кодирующий фермент глутатионсинтазу – катализирует второй этап биосинтеза глутатиона, а именно реакции АТФ-зависимого превращения гамма-L-глутамил-L-цистеина в восстановленный глутатион. Установлено, что полиморфные варианты гена глутатионсинтазы могут представлять собой значимые факторы риска развития ишемического инсульта [11], что свидетельствует о значимой роли нарушений метаболизма глутатиона и редокс-гомеостаза, способствующих формированию окислительного стресса – ключевого звена патогенеза данного заболевания.
Заключение. В результате исследования была впервые установлена ассоциация полиморфного варианта rs11546155 гена GGT7 с риском развития ишемического инсульта. Связь данного полиморфного варианта rs11546155 с ИИ наблюдалась в выборке женщин, а также лиц с пониженной физической активностью. Кроме того, установлено, что аллель rs11546155-G GGT7 обладает протективным эффектом в отношении ишемического инсульта у лиц, не злоупотребляющих алкоголем. Анализ данных функционального аннотирования исследованного полиморфизма гена GGT7 с использованием геномно-транскриптомных данных портала GTEx позволил обнаружить, что носительство аллеля повышенного риска ИИ ассоциировано с экспрессией генов, отражающих изменения внутриклеточного метаболизма глутатиона, аутофагии и протеасомной деградации белков – патологических изменений, обнаруживающихся при атеросклерозе и ишемическом инсульте. Пол-специфический характер ассоциации полиморфизма rs11546155 с ИИ, а также потенциальное модифицирующее влияние средовых факторов, таких как, злоупотребление алкоголем и гиподинамия, требуют проведения дальнейших генетико-эпидемиологических исследований на выборках большего объемах для расшифровки механизмов, лежащих в основе выявленных генно-средовых взаимодействий.
Информация о финансировании
Работа выполнена при финансовой поддержке Курского государственного медицинского университета.
Благодарности
выражаем благодарность за возможность проведения научной работы руководству Курского государственного медицинского университета в лице ректора, профессора В.А. Лазаренко, научно-исследовательскому институту генетической и молекулярной эпидемиологии Курского государственного медицинского университета, в частности директору НИИ ГМЭ, профессору А.В. Полоникову





















Список литературы