Влияние регуляторного пептида тафтцин-pro-gly-pro на показатели вариабельности ритма сердца крыс в условиях различной физической активности
Aннотация
Актуальность: Исследовано кардиотропное действие синтетического пептида с анксиолитическим действием тафтцина-Pro-Gly-Pro (тафтцин-ПГП) в условиях стресса. Ранее влияние данного пептида на состояние сердечно-сосудистой системы, играющей важную роль в адаптивных реакциях организма, не было изучено. Цель исследования:Изучить влияние регуляторного пептида тафтцин-Pro-Gly-Pro на показатели вариабельности ритма сердца (ВРС) крыс в условиях различной физической активности. Материалы и методы:Исследование выполнено на 48 крысах Вистар. Показатели ВРС регистрировали при помощи комплекса «Физиобелт 2.5.1» (Нейроботикс, Россия) и анализировали по статистическим, геометрическим и спектральным показателям. Тафтцин-ПГП вводили внутрибрюшинно в дозах 80, 250 и 750 мкг/кг однократно в объеме 1 мкг/кг. Исследование выполнено в 4 этапа: 1 – после адаптации к устройству (до введения пептида), 2 – через 15 минут после введения пептида, 3 – после физической нагрузки (2-минутный бег на тредмиле), 4 – после 15-минутного отдыха. Результаты:В дозе 80 мкг/кг тафтцин-ПГП оказывал выраженный адаптогенный эффект в виде поддержания исходного уровня функционирования регуляторных механизмов как при физической нагрузке, так и в период восстановления. В дозе 250 мкг/кг тафтцин-ПГП приводил к дезорганизации вегетативной регуляции на уровне автономного и центрального контуров регуляции сердечного ритма. Введение пептида в дозе 750 мкг/кг стабилизировало механизмы регуляции сердечного ритма при повышенной физической активности, однако вызывало дисбаланс регуляции сердечного ритма в период восстановления. Заключение:Внутрибрюшинное введение тафтцина-ПГП крысам Вистар оказывало дозозависимое действие на регуляцию сердечного ритма на всех этапах эксперимента: в покое (через 15 мин после введения), после физической нагрузки и в период восстановления
Введение. Регуляторные пептиды являются эндогенными соединениями с полифункциональной биологической активностью, которые в организме формируют единый континуум [1]. Данные их свойства обуславливают их важную роль в поддержании гомеостаза при различных состояниях, в том числе в условиях стресса [2].
К числу регуляторных пептидов в полной мере можно отнести тафтцин (Thr-Lys-Pro-Arg) и его защищенный с С-конца глипролином Pro-Gly-Pro (ПГП) аналог тафтцин-ПГП, который является действующим веществом лекарственного препарата Селанк® (АО ПЕПТОГЕН Инновационный научно-производственный центр, Россия). Тафтцин-ПГП оказывает анксиолитическое действие, улучшает когнитивные процессы у лабораторных животных, повышает адаптационные возможности при физической нагрузке [3-6]. Показано, что тафтцин-ПГП обладает иммуномодулирующим, антикоагулянтным, антиульцерогенным и гепатопротекторным действием в условиях стресса [7, 8, 9]. Таким образом, тафтцин-ПГП оказывает комплексное стресс-лимитирующее действие.
Морфофункциональные изменения в миокарде при стрессорном воздействии обуславливают актуальность изучения кардиопротективных эффектов регуляторных пептидов [10]. В частности, пептид АКТГ4-7-ПГП («Семакс») обладает кардиопротективным действием за счет устранения гиперактивации симпатического отдела вегетативной нервной системы в условиях острой ишемии миокарда и ишемии-реперфузии [11]. При этом исследования эффектов тафтцина-ПГП на состояние сердечно-сосудистой системы ранее не проводились.
Одним из информативных методов исследования нейрогуморальной регуляции является изучение вариабельности ритма сердца (ВРС) [12]. Оценка ВРС позволяет оценить состояние центральных и периферических отделов симпатической и парасимпатической нервной системы, а также их изменения в различных условиях и состояниях. C учетом выраженного нейротропного действия тафтцина-ПГП, представляется актуальным изучение его влияния на состояние вегетативной регуляции у лабораторных животных с использованием оценки ВРС, в том числе для поиска информативных критериев оценки адаптивных реакций организма.
Цель исследования. Изучить влияние регуляторного пептида тафтцин-ПГП на показатели вариабельности ритма сердца крыс в условиях различной физической активности.
Материалы и методы исследования. Исследуемые животные: 48 крыс Вистар (24 самца и 24 самки) массой 250-300 г в возрасте 5-6 месяцев. Крысы были получены из SPF-вивария Института цитологии и генетики СО РАН. Условия содержания: пластиковые клетки, температура воздуха 22±2°С, световой режим 12 часов – свет, 12 часов – темнота, свободный доступ к гранулированному корму и воде. В каждой клетке было по 4-5 однополых особей. Работа с животными выполнялась в соответствии с Приказом Минздрава РФ от 01.04.2016 г. № 199н «Об утверждении правил надлежащей лабораторной практики», Национальным стандартом РФ ГОСТ Р-53434-2009 «Принципы надлежащей лабораторной практики». Научное исследование было одобрено Региональным этическим комитетом при Курском государственном медицинском университете протокол № 1 от 17.02.2022 г.
Показатели вариабельности ритма сердца регистрировали при помощи программно-аппаратного комплекса «Физиобелт 2.5.1» (Нейроботикс, Россия) в условиях свободного перемещения крысы. Для адаптации животного к условиям эксперимента до его начала крысам проводили пробные записи длительностью 5 минут 3 раза в неделю. Анализ вариабельности ритма сердца проводили с использованием статистических, геометрических, и спектральных показателей [12]. Статистические показатели: ЧСС, RRNN, SDNN, RMSSD, рNN3, рNN5, рNN10, CV. Геометрические показатели: Мо, АМо, ВР, ИВР, ПАПР. Спектральные показатели: ТР, HF (мс2), LF (мс2), VLF (мс2), HF (%), LF (%), VLF (%), LF/HF, IC [13, 14].
В работе использовали тафтцин-ПГП, синтезированный в Институте молекулярной генетики НИЦ «Курчатовский институт», который хранили в виде порошка при -20°C. Пептид растворяли в физиологическом растворе и вводили внутрибрюшинно в дозах 80, 250 и 750 мкг/кг [15, 16] однократно в объеме 1 мл/кг массы тела животного. Использованные дозы пептида выбраны с учетом литературных данных об установленных эффективных дозах препарата. Животным контрольной группы вводили физиологический раствор в эквивалентном объеме. Каждая группа включала 12 животных (6 самцов и 6 самок).
Эксперименты выполняли в дневное время с 10 до 14 часов. Первая запись (запись 1) кардиосигнала начиналась после 15 минутной адаптации крысы к устройству Физиобелт в условиях чистой пустой пластиковой клетки аналогичной той, в которой исходно содержались животные. Следующим этапом исследования было внутрибрюшинное введение животному тафтцина-ПГП или физиологического раствора с последующей записью кардиосигнала через 15 минут после инъекции (запись 2). Далее крыса выполняла физическую нагрузку: двухминутный бег на тредмиле (Treadmill LE8710, Panlab, Испания) со скоростью 15 м/мин при угле наклона беговой дорожки 15°. Непосредственно после завершения бега проводили регистрацию кардиосигнала животного (запись 3). По окончании записи 3 животное возвращали в его клетку для восстановления и через 15 минут выполняли четвертую запись кардиосигнала (запись 4).
Статистическую обработку результатов проводили с использованием Statistica 13 (TIBCO Software Inc., США) и R v.4.1.0 в интегрированной среде разработки RStudio Desktop v. 1.4.1717 (RStudio, PBC; США). Полученные данные представлены в виде среднего значения и стандартного отклонения (M±SD). Достоверность различий определяли с помощью критерия Краскела-Уоллиса с апостериорным тестом Данна (для непарных выборок) (функция функция dunn.test) из пакета dunn.test) и критерием Фридмана с апостериорными сравнениями с апостериорным тестом Коновера (для парных выборок) (функция posthoc.friedman.conover.test) из пакета PMCMR). Различия считали статистически достоверными при p <0,05.
Результаты и их обсуждение. Анализ исходных значений изучаемых показателей ВРС позволил установить отсутствие достоверных различий между группами, что подтверждает однородность сформированных групп (Табл.1). Процентное распределение спектральных показателей ВРС во всех группах имело следующую градацию VLF (более 50%) > LF (25-30%) > HF (17-19%), что свидетельствует о преобладании автономной нейрогуморальной регуляции на синусовый ритм. Во время записи животные находились в покое или спокойно передвигались по клетке, что позволяет говорить об отсутствии стрессоров. В работах Е.В. Курьяновой с соавторами было установлено, что у беспородных крыс в состоянии покоя обычно преобладают HF-волны, составляющие большую часть спектра и свидетельствующие о высокой сопряженности сердечного ритма с дыхательными движениями, что обеспечивается парасимпатической регуляцией [17, 18, 19]. Данный факт может объясняться различными выборками экспериментальных животных, методиками записи кардиосигнала и последующего его преобразования, что подтверждает необходимость разработки стандартизированных подходов к изучению ВРС. В ранее опубликованной нами работе представлены результаты оценки ВРС у самок крыс Вистар в условиях различной физической активности, которые свидетельствует, что градация спектральных показателей VLF > LF > HF характерна для состояния покоя подопытных животных [20].
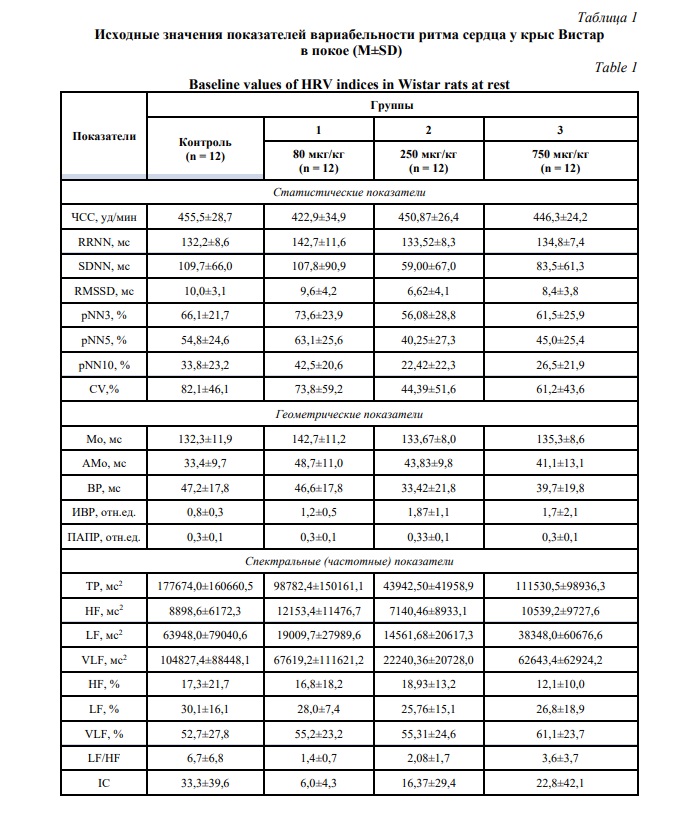
Значения показателей ВРС после введение исследуемым животным пептида тафтцин-ПГП представлены в таблице 2. Полученные результаты позволили установить особенности изменения показателей ВРС после внутрибрюшинной инъекции и достоверные межгрупповые различия.
В группе крыс, получавших дозу пептида 80 мкг/кг, регистрируется ряд достоверных различий с группой контроля, наиболее значимые – в отношении величины АМо и спектральных характеристик HF и VLF (%), LF/HF и IC. Указанные изменения позволяют установить выраженную сбалансированность активности симпатического и парасимпатического отделов вегетативной системы и автономность регуляции сердечного ритма в группе животных после введения пептида по сравнению с группой контроля [18, 19]. Данный факт позволяет предположить наличие адаптивного эффекта тафтцина-ПГП 80 мкг/кг на нейрогуморальные механизмы регуляции сердечного ритма.
Достоверные различия в значениях показателей рNN3, рNN5, рNN10, Амо, ПАПР, LF (%), VLF (%) и IC установлены между группами животных, получавших дозу пептида 80 и 250 мкг/кг. Данный факт свидетельствует в пользу сделанного выше предположения об адаптивном действии пептида в дозе 80 мкг/кг, стабилизирующем функциональное состояние организма. При этом введение пептида в дозе 250 мкг/кг вызывает увеличение активности сегментарных влияний с дисбалансом в механизмах централизации управления сердечным ритмом [17].
Различия между группами животных, получавших тафтцин-ПГП в дозах 80 и 750 мкг/кг, были установлены по ряду следующих показателей: SDNN, RMSSD, рNN3, рNN5, рNN10, ВР, LF. Данный факт свидетельствует, что функциональное состояние животных, получавших пептид в дозе 80 мкг/кг, было оптимальным и проявлялось умеренной активностью симпатического отделе вегетативной нервной системы на фоне катехоламинергической регуляции и доминирования автономного контура на ритм сердца. При этом пептид в дозе 750 мкг/кг вызвал разобщение механизмов центральной и автономной регуляции с дисбалансом симпатического и парасимпатического отделов вегетативной нервной системы [18].
Сравнение величины показателей ВРС группы животных, получавших пептид в дозе 250 мкг/кг, с группой контроля показало достоверное различие лишь в значениях показателя LF (мс2), который отражает активность симпатического отдела вегетативной нервной системы [21]. Однако, отсутствие различий в статистических и геометрических показателях ВРС, также отражающих эффекты симпатической регуляции – SDNN, CV, Мо, ИВР, и одинаковое соотношение относительных спектральных характеристик VLF > LF > HF между указанными группами позволяет считать установленное различие статистической погрешностью.
Анализ показателей АМо, ПАПР, ТР и VLF в группах животных, получавших тафтцин-ПГП в дозах 250 и 750 мкг/кг, позволил установить, что при более высокой дозе наблюдается нарушение централизации управления сердечным ритмом и уменьшается роль гуморальной регуляции на фоне преобладания парасимпатических влияний.
Сравнительный анализ величины показателей ВРС у животных, получавших пептид в дозе 750 мкг/кг, с группой контроля позволил установить достоверные различия по большинству статистических, геометрических и спектральных параметров. Полученные результаты свидетельствуют о повышении активности симпатического отдела вегетативной нервной системы (SDNN, RMSSD) и высоком уровне мобилизации системы кровообращения (АМо) в группе животных, получавших тафтцин-ПГП в дозе 750 мкг/кг. Однако, низкий уровень общей мощности спектра (ТР) и индекса вагосимпатического взаимодействия (LF/HF) свидетельствует о недостаточных адаптационных возможностях и относительном вегетативном балансе между симпатическим и парасимпатическим отделом вегетативной нервной системы. Также при этом обращает внимание нехарактерное для других групп процентное распределение частотных характеристик VLF > HF > LF. Таким образом, после введения пептида в дозе 750 мкг/кг получены достаточно противоречивые данные, которые могут объясняться метаболическим и адаптогенным эффектом регуляторного пептида, усиливающим автономную регуляцию на уровне системы кровообращения без доминирующей роли высших отделов нервной регуляции [20, 22].
Таким образом, однократное введение регуляторного пептида тафтцин-ПГП в дозе 80 мкг/кг оказывало выраженное адаптогенное действие на нейрогуморальные механизмы регуляции ВРС, в дозе 250 мкг/кг не оказывало существенного влияния, а в дозе 750 мкг/кг вызвало разобщение механизмов централизации управления сердечным ритмом и дисбаланс симпатического и парасимпатического отделов вегетативной нервной системы.
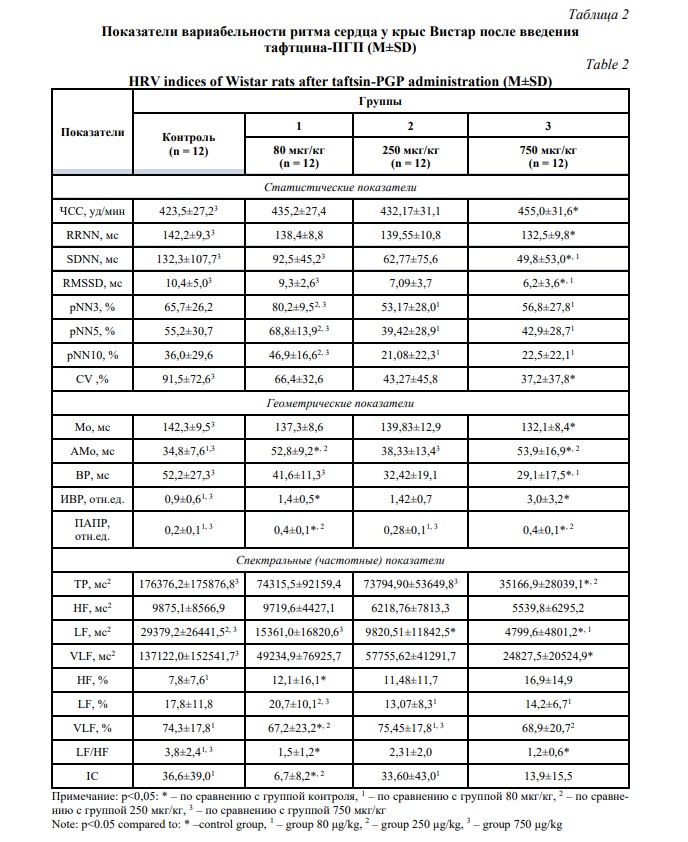
В таблице 3 представлены результаты показателей ВРС, полученные непосредственно после двухминутного бега на тредмиле. Выбранная физическая нагрузка не сопровождалась электростимуляцией.
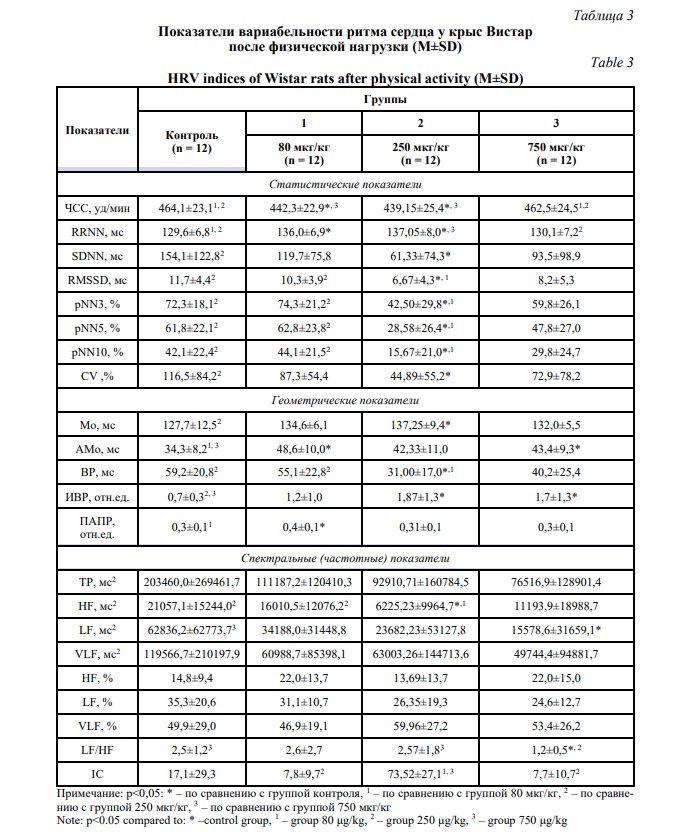
Как видно из таблицы, в контрольной группе наблюдалось повышение общей мощности спектра (ТР) и низкочастотного компонента (LF), коэффициента вариации (CV), свидетельствующее о напряженности регуляторных механизмов и активности симпатического отдела вегетативной нервной системы [17]. У животных, получавших тафтцин-ПГП 80 мкг/кг, в сравнении с контрольной группой установлены достоверные различия по величине показателей ЧСС, RRNN, АМо и ПАПР. Данный факт свидетельствует о сохраняющемся адаптогенном эффекте пептида в виде стабильности величины показателей ВРС на фоне повышенной физической активности.
Также отмечалось различие в величине показателей RMSSD, рNN3, рNN5, рNN10, ВР, HF (мс2) и IC между группами животных с дозировкой пептида тафтцин-ПГП 80 мкг/кг и 250 мкг/кг, что может являться проявлением вегетативного дисбаланса, который увеличивается с увеличением дозы пептида, и различного уровня механизмов централизации управления сердечным ритмом. При этом значимые различия между величинами показателей ВРС при дозах пептида 80 и 750 мкг/кг отсутствовали.
По всем статистическим показателям ВРС, а также Мо, ВР, ИВР и HF (мс2) после введения пептида в дозе 250 мкг/кг установлены значимые различия в сравнении с контрольной группой, которые могут свидетельствовать о повышении влияния вегетативной нервной системы на функцию синусового узла с превалированием парасимпатических эффектов на фоне действия регуляторного пептида. При этом высокое значение IC в группе 250 мкг/кг в сочетании с сохранением исходного соотношения спектральных характеристик VLF > LF > HF может свидетельствовать о вовлечении гипоталамо-гипофизарно-надпочечниковой оси в регуляцию функции синусового узла и мобилизации метаболических резервов организма [19].
Сравнение полученных данных у животных с дозами тафтцина-ПГП 250 и 750 мкг/кг показало достоверные различия между параметрами ЧСС, RRNN, LF/HF и IC. Данный факт свидетельствует о том, что более высокая доза регуляторного пептида на фоне повышенной физической активности позволяет быстро мобилизовать резервы организма посредством централизации управления сердечным ритмом без перенапряжения автономной регуляции.
Введение пептида в дозе 750 мкг/кг также вызывало достоверно значимые в сравнении с контрольной группой различия по показателям АМо, ИВР, LF (мс2), LF/HF. Однако полученные результаты имеют достаточно неоднозначный характер, т.к. геометрические параметры ВРС свидетельствуют о превалировании роли симпатической нервной системы в группе контроля, тогда как частотные показатели отражают повышение активности симпатической нервной системы у получавших пептид крыс [23]. При этом комплексный анализ ВРС после введения пептида свидетельствует о стабильности функционального состояния животных после повышенной физической активности, поддерживаемой балансом вегетативной регуляции и повышением сегментарных влияний на сердечный ритм.
Таким образом, повышенная физическая активность на фоне однократного введения тафтцина-ПГП в дозе 80 мкг/кг не сопровождается значимыми отклонениями в функционировании регуляторных механизмов управления сердечным ритмом, в дозе 250 мкг/кг вызывает дисбаланс вегетативного равновесия с активацией гипоталамо-гипофизарно-надпочечниковой оси и централизацией управления кардиоритмом, в дозе 750 мкг/кг – эффекты, близкие к таковым после введения пептида в дозе 80 мкг/кг.
Значения параметров ВРС исследуемых групп после 15-минутного периода восстановления представлены в таблице 4.
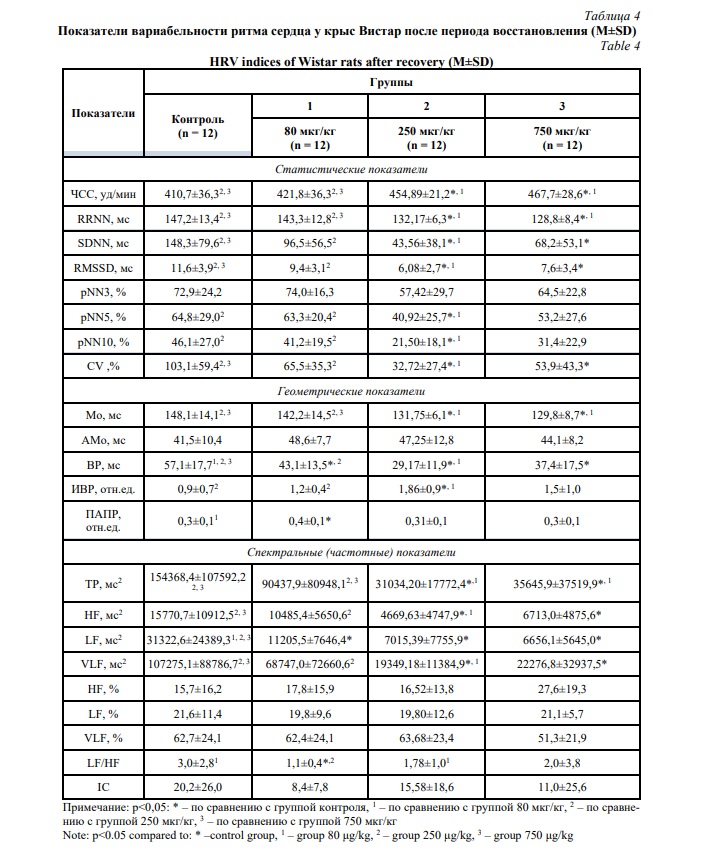
Сравнение показателей ВРС в период восстановления после введения пептида в дозе 80 мкг/кг с контрольными значениями позволил установить различия в уровне активности симпатического отдела вегетативной нервной системы (LF (мс2), LF/HF). Так, на фоне применения пептида наблюдается баланс всех уровней управления сердечным ритмом и функциональное состояние соответствует исходному уровню. Доза пептида 80 мкг/кг обеспечивает стабильность нейрогуморальной регуляции в условиях различной физической активности, что позволяет предположить, повышение устойчивости исследуемых животных к действию стрессоров.
Между группами животных, получавшими пептид в дозах 80 и 250 мкг/кг, значения показателей ВРС имели различия по большинству исследуемых параметров, указывающие на различия в механизмах регуляции сердечного ритма и степени их активности у подопытных животных. Снижение абсолютных значений частотных показателей в группе животных с дозировкой пептида 250 мкг/кг свидетельствует об истощении регуляторных механизмов и нарушении взаимосвязи между активностью сегментарного и надсегментарного контуров регуляции сердечного ритма [14].
Различия между группами животных, получавшими пептид в дозировке 80 и 750 мкг/кг, установлены по величине показателей ЧСС, RRNN, Мо, ТР и свидетельствуют о функционировании организма в условиях баланса регуляторных механизмов при меньшей дозе. Напротив, при высокой дозе пептида система вегетативной регуляции находится в состоянии напряжения.
Комплексный анализ показателей ВРС животных после введения пептида в дозе 250 мкг/кг в сравнении с группой контроля позволил установить различия по большинству исследуемых параметров. Так, в восстановительном периоде у животных, получавших пептид, повышена активность симпатических влияний на синусовый узел (SDNN, RMSSD, Мо), однако выраженное снижение мощности спектральных (ТР, HF (мс2), LF (мс2), VLF (мс2)) характеристик свидетельствует об истощении резервов и снижении активности всех механизмов гипоталамо-гипофизарно-надпочечниковой оси.
При этом различий в показателях ВРС между группами животных, получавшими пептид в дозах 250 и 750 мкг/кг, не установлено.
После введения тафтцина-ПГП в дозе 750 мкг/кг в сравнении с контрольными значениями существенные изменения установлены по следующим параметрам ВРС: ЧСС, RRNN, SDNN, RMSSD, CV, Мо, ВР, ТР, HF (мс2), LF (мс2), VLF (мс2). Данные изменения в восстановительном периоде отражают напряжение симпатического отдела вегетативной нервной системы в сочетании с парасимпатическими влияниями, а также активацию механизмов централизации управления сердечным ритмом посредством высших центров вегетативной регуляции на фоне применения пептида [24].
Таким образом, анализ результатов ВРС после период восстановления в исследуемых группах животных позволил установить, что в группе животных, получавших тафтцин-ПГП в дозе 80 мкг/кг, поддерживается стабильное функциональное состояния и сбалансированность работы регуляторных механизмов организма. У животных, получавших пептид в дозах 250 и 750 мкг/кг, установлены однотипные изменения в виде истощения резервов адаптации, напряжения регуляторных механизмов как центрального, так и автономного контура регуляции сердечного ритма.
В основе установленных в нашей работе эффектов тафтцина-ПГП могут находиться следующие механизмы. Известно, что тафтцин-ПГП ингибирует ферменты, катаболизирующие деградацию эндогенных опиоидов и таким образом увеличивает время их полураспада [25]. Также тафтцин-ПГП изменяет метаболизм катехоламинов и серотонина в структурах лимбической системы и оказывает влияние на активность тирозин- и триптофангидроксилазы [26]. Кроме того, для тафтцина-ПГП отмечена аллостерическая регуляция ГАМК-рецепторов и дофаминовых рецепторов [27]. Данные механизмы лежат в основе его анксиолитического, антидепрессантного, антиастенического и других эффектов [4]. Поэтому можно полагать, что вышеуказанные механизмы могут находиться в основе установленных в работе эффектов пептида.
Также следует отметить, что характер эффектов пептида в различных использованных дозах в данном исследовании является характерным для целого ряда регулярных пептидов и в литературе описывается как U-эффект. В частности, U-образная кривая эффектов была установлена при использовании АКТГ4-7-ПГП и АКТГ6-9-ПГП, когда их выраженность была наибольшей в низких и высоких в дозах, а в средних дозах нивелировались или меняли свою направленность. Предполагается, что в основе данного эффекта может лежать активация разных рецепторов и/или систем внутриклеточной сигнализации, которая зависит от количества введенного лиганда [28, 29]. Поэтому представляется актуальным в дальнейшем проведение исследований по вовлеченности рецепторного аппарата клетки и систем вторичных мессенджеров в реализацию эффектов тафтцина и глипролинов.
Заключение. Регуляторный пептид тафтцин-ПГП при однократном введении в условиях физической активности оказывает выраженное дозозависимое влияние на показатели ВРС крыс. В дозе 80 мкг/кг пептид обладает выраженным адаптогенным эффектом в виде поддержания исходного уровня функционирования регуляторных механизмов как при физической нагрузке, так и в период восстановления. В дозе 250 мкг/кг пептид вызвал дезорганизацию вегетативной регуляции на уровне автономного и центрального контуров сердечного ритма. Введение пептида в дозе 750 мкг/кг стабилизировало механизмы регуляции сердечного ритма при повышенной физической активности, однако вызывало дисбаланс регуляции сердечного ритма в период восстановления. Таким образом, представляется перспективным дальнейшее изучение механизмов действия пептида тафтцин-ПГП в дозе 80 мкг/мл на нейрогуморальную регуляцию и особенности изменения ВРС в условиях стресса.
Информация о финансировании
Финансирование данной работы не проводилось.





















Список литературы