Особенности межлокусных взаимодействий при формировании изолированных и сочетанных осложнений беременности
Aннотация
Актуальность: Осложнения беременности имеют высокую распространенность и важное медико-социальное значение. В их формирование вовлечены генетические факторы. Цель исследования:Изучить особенности межлокусных взаимодействий при формировании изолированных и сочетанных осложнений беременности. Материалы и методы:Выборка для исследования составила 786 беременных из которых 462 женщины были с различными осложнениями беременности (изолированная ПЭ (n=190); 2) изолированная ЗРП (n=196); 3) сочетание ПЭ и ЗРП (n=76)) и 324 женщины с физиологическим течением беременности. Проведено генотипирование 13 полиморфных локусов генов факторов роста и их рецепторов (rs4444903 EGF, rs833061 VEGFA, rs2981582 FGFR2, rs6214 IGF1, rs1800469 TGFβ1), генов рецепторов эстрогенов и прогестерона (rs2234693 ESR1, rs9340799ESR1, rs3798577 ESR1, rs484389 PGR, rs1042838 PGR), генов наследственных тромбофилий (rs1126643 ITGA2, rs5918 ITGB3 и rs5985 F13A1). Взаимодействие полиморфных локусов, ассоциированных с изучаемыми осложнениями беременности, визуализацию и определение характера (синергизм, независимый эффект, антагонизм) и силы (доля вклада в энтропию признака) данных взаимодействий, изучали методами MB-MDR и MDR. Результаты:Риск развития изолированной ЗРП определяется тремя моделями межлокусных взаимодействий 5 полиморфизмов: rs4444903 EGF, rs6214IGF1, rs2234693 ESR1, rs484389 PGR и rs5985 F13A1 с наиболее выраженными эффектами полиморфного локусаrs6214IGF1. Подверженность к изолированной ПЭ определяется межлокусными взаимодействиями пяти локусов: rs4444903 EGF, rs833061 VEGFA, rs2981582 FGFR2, rs2234693 ESR1, rs9340799ESR1 ключевую роль в которых играет двухлокусное взаимодействие rs9340799ESR1хrs2234693 ESR1 (входит в состав всех 3-х моделей). Формирование сочетания ЗРП и ПЭ ассоциировано с двумя моделями межгенных взаимодействий 4 полиморфизмов: rs2234693 ESR1, rs9340799ESR1, rs484389 PGR, rs5918 ITGB3. Три рисковые комбинации генотипов, показали наибольший уровень статистической значимости ассоциаций (р<0,005) с осложнениями беременности: ТТ-rs2234693 ESR1хGA-rs6214 IGF1 – изолированная ЗРП (β = 1,86, р=0,003); AA-rs9340799 ESR1хTT-rs2234693 ESR1 – изолированная ПЭ (β = 2,45, р=0,0009) и сочетание ПЭ и ЗРП (β = 2,38, р=0,002). Заключение:Риск развитияосложнений беременности в значительной степени определяется генетической комбинаторикой трех полиморфных локусов rs2234693 ESR1, rs9340799 ESR1, rs6214 IGF1
Введение. Осложнения беременности (преэклампсия (ПЭ), плацентарная недостаточность (ПН), задержка роста плода (ЗРП)) продолжают оставаться одной из нерешенных научно-практических проблем в мировом акушерстве [1-8]. ПЭ осложняет 2–8% беременностей во всем мире [3, 4]. По данным официальной статистики в настоящее время (2020-2022 гг) в РФ ПЭ регистрируется у 7,6-7,9% беременных и за последние годы встречаемость ПЭ среди беременных РФ несколько возросла с 84,2 на 1000 родов в 2020 г до 85,2 на 1000 родов в 2022 г [9]. В структуре осложнений беременности значимое место занимает задержка роста плода (ЗРП) [7, 8]. Среди всех беременностей встречаемость ЗРП может достигать 8-10% [7, 10].
Анализ современной литературы свидетельствует о том, что ПЭ и ЗРП являются мультифакторными заболеваниями. Роль генетических факторов в формировании как ПЭ [11-16] так и ЗРП [10, 17-20] не вызывают сомнения и является доказанной. Вместе с этим, результаты исследований, направленных на поиск генетических детерминант ПЭ, ЗРП часто не согласуются между собой и нередко противоречивы. Это определят необходимость «дополнительных» исследований по этой теме (поиск генетических факторов риска возникновения ПЭ, ЗРП), особенно с учетом оценки сложных процессов межгенных взаимодействий, влияющих на предрасположенность к ПЭ и ЗРП. Уточнение генетических механизмов формирования ПЭ и ЗРП создаст необходимые предпосылки «генетического обоснования» профилактики ПЭ и ЗРП еще на этапе прегравидарной подготовки. Число фундаментальных научных работ в области молекулярно-генетических исследований осложнений беременности, которые нашли бы практическое применение в современном здравоохранении невелико и необходимы дальнейшие исследования в этой области.
Цель исследования. Изучить особенности межлокусных взаимодействий при формировании изолированных и сочетанных осложнений беременности.
Материалы и методы исследования. Выборка, на которой выполнено настоящее исследование, составила 786 беременных: у 462 женщин были диагносцированы различные осложнения беременности (ПЭ, ЗРП);324 женщины имели физиологическое течение беременности. Критерием включения в группу с осложнениями беременности явилось наличие у женщины клинически подтвержденных ПЭ [16] и/или ЗРП [10]. Исследование проходило под обязательным контролем со стороны этического комитета НИУ БелГУ.
Из общего числа обследованных (786 беременных) были сформированы 4 группы для исследования: 1) изолированная ПЭ (n=190); 2) изолированная ЗРП (n=196); 3) сочетание ПЭ и ЗРП (n=76); 4) контрольная группа (n=324).
Обьектом генетического исследования была ДНК, выделенная из периферической венозной крови. Оценка качества полученной ДНК и определение ее концентрации осуществлялись на спектрофотометре Termo Scientific «NanoDrop 2000c».
В молекулярно-генетическое исследование нами были включены отобранные с учетом определенных критериев полиморфные локусы трех групп генов-кандидатов – факторов роста и их рецепторов, рецепторов эстрогенов и прогестерона, факторов, участвующих в процессах коагуляции крови (факторы наследственных тромбофилий). При отборе полиморфных локусов генов-кандидатов учитывались следующие критерии: а) ассоциации с осложнениями беременности (ПЭ, ЗРП и др.) по данным ранее проведенных генетических ассоциативных исследований; б) значимый регуляторный (эпигенетический) потенциал; в) ассоциации с экспрессией генов; г) частота полиморфного варианта не менее 5%.
Для оценки регуляторного потенциала рассматриваемых в работе полиморфных локусов, их связи с транскрипцией генов, а также распространенности полиморфных вариантов в различных популяциях и в том числе европейских, использовалась он-лайн база данных HaploReg (дата доступа: 15.01.2023 – http://archive.broadinstitute.org/mammals/haploreg/).
Для настоящего исследования (согласно выше обозначенных критериев) были отобраны 13 полиморфных локусов ряда генов, в том числе генов факторов роста и рецепторов факторов роста (rs833061 VEGFA,rs6214 IGF1,rs4444903 EGF,rs2981582 FGFR2,rs1800469 TGFβ1), генов рецепторов эстрогенов и прогестерона (rs2234693 ESR1, rs9340799 ESR1, rs3798577 ESR1, rs484389 PGR, rs1042838 PGR), генов наследственных тромбофилий (rs1126643 ITGA2, rs5918 ITGB3 и rs5985 F13A1). Следует отметить, что все 13 включенных в исследование полиморфных локусов, имеют значимый регуляторный потенциал, в том числе три из них (rs1042838, rs5918 и rs5985) приводят к несинонимичным заменам аминокислот в кодируемых полипептидах (F13A1,PGR,ITGB3), 8 локусов имеют связи с генной экспрессией, 3 локуса (rs2981582,rs5985,rs1800469) по данным полногеномных исследований (GWAS) связаны с такими заболеваниями и признаками как конечная стадия гемокоагуляции, рак молочной железы и др.) и минорные аллели всех рассматриваемых полиморфизмов встречаются с частотой более 10% среди европейского населения.
В работе использовался амплификатор CFX-96-Real-Time System, тест системы/наборы для генотипирования SNP, изготовленные на базе Синтол (Москва) и Тест-Ген (Ульяновск). Исследование проведено на кафедре медико-биологических дисциплин НИУ БелГУ методом дискриминации аллелей по протоколам производителей с контролем качества генотипирования (использовались положительные и отрицательные контрольные образцы) [21].
Все экспериментальные данные (распределение генотипов) оценивались на предмет их соответствия закону Харди-Вайнберга (HWE) [22]. При проведении этого анализа вводили поправку Бонферрони, где учитывали число анализируемых полиморфных локусов (n=13, рbonf=0,05/13=0,0038). Таким образом, статистически значимым считали отклонение наблюдаемого распределения генотипов от теоретически ожидаемого при равновесии HWE при p<0,0038. Так же при проведении популяционно-генетического анализа нами выполнен расчет частот минорных аллелей по рассматриваемым полиморфизмам.
Взаимодействие полиморфных локусов, ассоциированных с изучаемыми осложнениями беременности, визуализацию и определение характера (синергизм/независимый эффект/антагонизм) и силы (вклад в энтропию признака/заболевания) данных взаимодействий, изучали методами MB-MDR и MDR [23]. По результатам проведенного анализа межлокусных взаимодействий (данное исследование выполнялось в программе MB-MDR среды R) отбирались наиболее значимые модели (характеризуются наибольшими значениями статистик Вальда) трех разных уровней - 2, 3 и 4 локусные взаимодействия. В качестве ковариат рассматривались количественные переменные – возраст беременной и индекс массы тела женщины до беременности. При этом проводилась коррекция на множественные сравнения – были выполнены пермутационные перестановки (осуществлялось 1000 пермутаций). Статистически значимыми считались различия на уровне pperm<0,05. Пермутационное тестирование проводилось в программе MB-MDR в среде R.
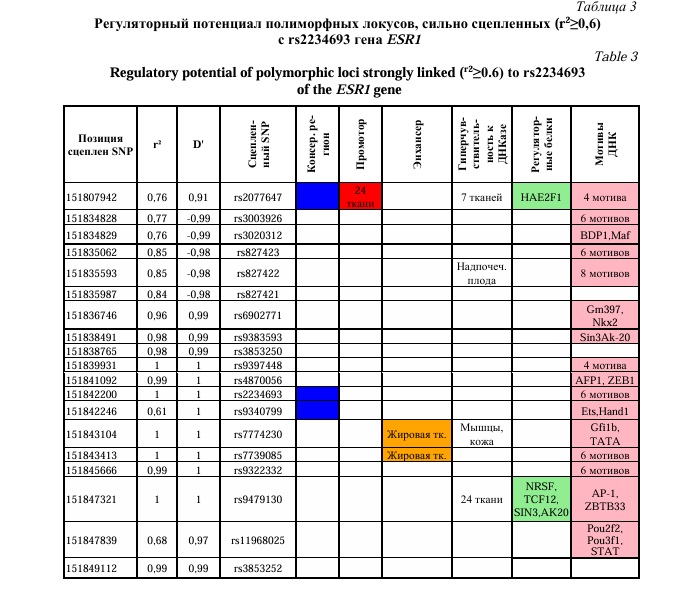
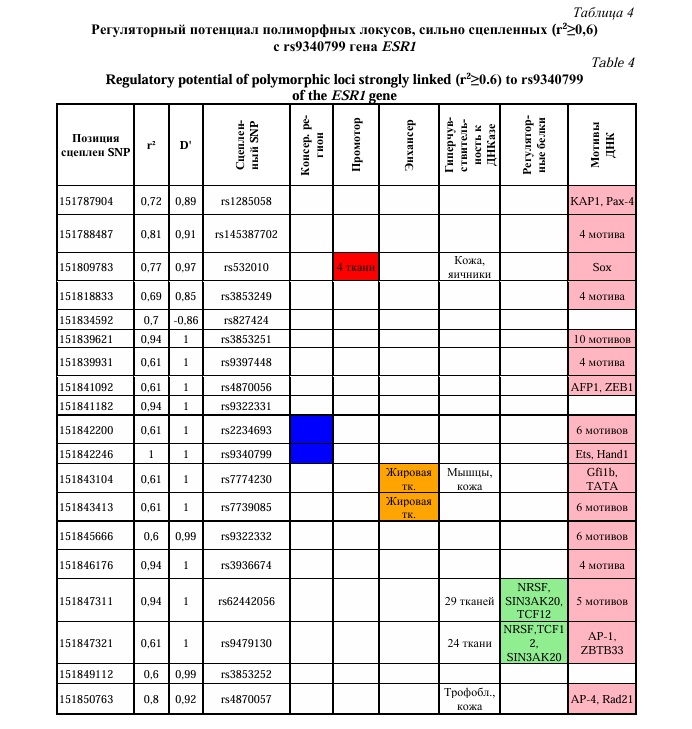
Для полиморфных локусов rs9340799 и rs2234693, показавших наиболее выраженные ассоциации при межлокусных взаимодействиях с осложнениями беременности (изолированная ПЭ, сочетание ПЭ и ЗРП) и SNPs, сильно сцепленных (r2≥0,6) с ними проведен анализ функционального значения. Для этого были использованы мировые онлайн ресурсы (базы данных) по функциональной геномике такие как HaploReg, GTExportal. Определение сильно сцепленных SNPs с изучаемыми нами полиморфными локусами проводилось в программе HaploReg (v4.1). Использовались оценки неравновесия по сцеплению между SNPs по европейской популяции из проекта 1000 Геномов при заданном пороговом значении r2≥0,6.
Результаты и их обсуждение. В начале данного исследования нами проведен популяционно-генетический анализ распределения рассматриваемых молекулярно-генетических маркеров и их соответствие ожидаемым параметрам при выполнении равновесия Харди-Вайнберга (HWE) во всех изучаемых 4 группах беременных с целью оценки качества генетических данных, полученных экспериментально. Соответствие между наблюдаемым и ожидаемым согласно HWE распределением генотипов свидетельствует о «корректности» проведенного экспериментального генетического исследования (полученные генетические данные можно использовать при анализе ассоциаций), тогда как выявленные несоответствия между наблюдаемым и ожидаемым согласно HWE распределением генотипов указывают на необходимость «дополнительных» исследований, которые бы подтвердили «корректность» проведенного экспериментального генетического исследования (проведение повторного генотипирования и др.). Данный «подготовительный этап» анализа первичных генетических данных является обязательным и позволяет избежать получение в результате ассоциативного анализа ложноположительных/ложноотрицательных результатов, что безусловно повышает качество проводимого нами генетико-эпидемиологического исследования.
Результаты проведенного популяционно-генетического анализа показали, что практически для всех рассмотренных нами SNPs во всех изучаемых группах беременных (изолированная ПЭ, изолированная ЗРП, сочетание ПЭ и ЗРП, контрольная группа) полученное нами в результате проведенного молекулярно-генетического исследования эмпирическое распределение генотипов соответствует теоретически ожидаемому при равновесии HWE. Для двух полиморфных локусов в двух группах беременных наблюдалось некоторое отклонение в наблюдаемом распределении генотипов в сравнении с ожидаемым согласно равновесия HWE: среди беременных с изолированной ПЭ по полиморфизму rs5985 гена F13A1 зарегистрировано увеличение доли гомозигот и снижение соответственно доли гетерозиготных индивидуумов (H0=0,332, Hе=0,408 р=0,008), а в группе беременных с изолированной ЗРП по полиморфному локусу rs4444903 гена EGF, наоборот, выявлено повышение удельного веса гетерозиготных индивидуумов и уменьшение доли гомозигот (H0=0,577, Hе=0,500 р=0,044) в сравнении с ожидаемым распределением генотипов согласно равновесия HWE. Следует отметить, что включение в анализ поправки Бонферрони (введена для коррекции на множественные сравнения согласно количеству рассматриваемых полиморфных локусов (n=13, рbonf=0,05/13=0,0038)) отклонения в распределении генотипов по двум вышеуказанным полиморфизмам (rs5985 гена F13A1 и rs4444903 гена EGF) среди беременных с ПЭ и беременных с ЗРП оказались статистически не значимым (p>0,0038) и следовательно, можно заключить, что все рассматриваемые нами полиморфные локусы во всех изучаемых 4 группах беременных прошли тест на соответствие HWE и могут быть использованы на дальнейших этапах нашей работы при изучении ассоциаций.
На следующем этапе работы мы провели анализ взаимодействий полиморфных локусов, с целью установления межгенных взаимодействий, определяющих подверженность к осложнениям беременности (изолированное ЗРП, изолированная ПЭ, сочетание ПЭ и ЗРП), а также определения конкретных комбинаций генотипов, связанных с риском развития различных осложнений беременности. Для этого мы использовали методы MB-MDR и MDR. Полученные результаты приведены в таблицах 1 и 2 и рисунках 1-3.
Согласно полученных нами данных, риск развития изолированной ЗРП определяется тремя моделями межлокусных взаимодействий (0,001≤pperm≥0,018) 5 полиморфизмов: rs4444903 EGF, rs6214 IGF1, rs2234693 ESR1, rs484389 PGR и rs5985 F13A1 (Табл. 1). При этом полиморфный локус rs6214 IGF1 играет ключевую роль в этих моделях – он входит в состав всех 3-х моделей, определяющих риск развития изолированной ЗРП.
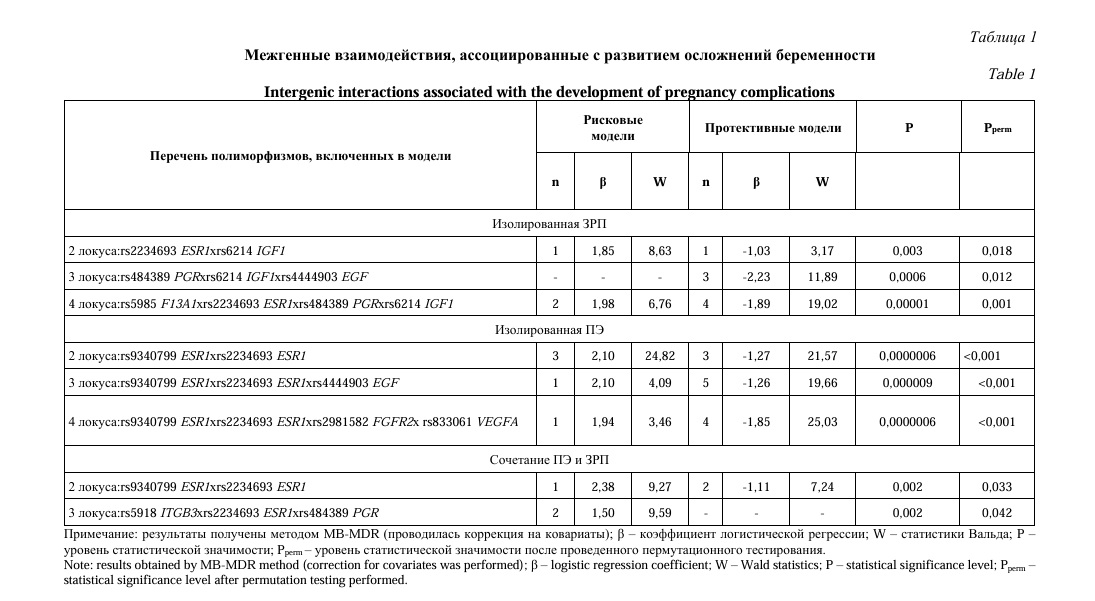
Так же, парное межлокусное взаимодействие rs2234693 ESR1хrs6214 IGF1 является основой 2-х из 3-х моделей, вовлеченных в формирование изолированной ЗРП. Нами установлены (в рамках вышеуказанных моделей) 3 «протективные» комбинации генотипов (показатели β=-1,22 - -2,39) и одна «рисковая» двухлокусная комбинациях – ТТ-rs2234693 ESR1хGA-rs6214 IGF1 (β=1,86), влияющих на формирование изолированной ЗРП (Табл. 2).
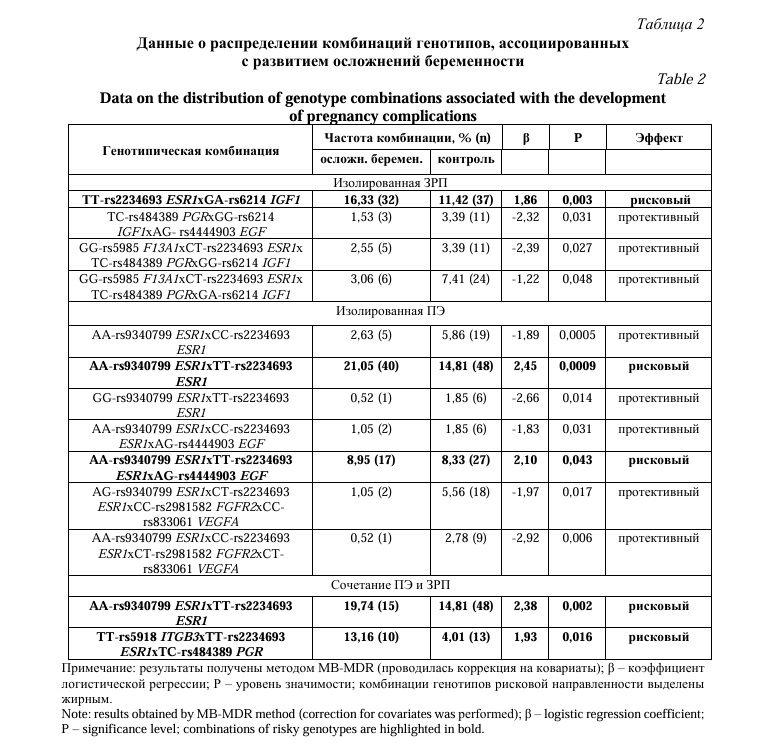
Развитие изолированной ПЭ так же связано с тремя наиболее значимыми моделями межгенных взаимодействий (pperm≤0,001), первостепенное значение в которых (входит в состав всех 3-х моделей) имеет двухлокусное взаимодействие rs9340799 ESR1хrs2234693 ESR1 (Табл. 1). В целом подверженность к изолированной ПЭ определяется межлокусными взаимодействиями пяти локусов: rs4444903 EGF, rs833061 VEGFA, rs2981582 FGFR2, rs2234693 ESR1, rs9340799 ESR1. С развитием изолированной ПЭ ассоциированы 5 комбинаций генотипов протективной направленности (β = -1,83 - 2,92) и две комбинации рисковой направленности – AA-rs9340799 ESR1хTT-rs2234693 ESR1 (β = 2,45) и AA-rs9340799 ESR1хTT-rs2234693 ESR1хAG-rs4444903 EGF (β = 2,10) (Табл. 2).
Формирование сочетания ЗРП и ПЭ ассоциировано с двумя моделями межгенных взаимодействий (0,033≤pperm≥0,042) в которых «задействовано» 4 полиморфизма: rs2234693 ESR1, rs9340799 ESR1, rs484389 PGR, rs5918 ITGB3 (Табл. 1). Две комбинации генотипов, показавших статистически значимые ассоциации с развитием сочетания ЗРП и ПЭ - AA-rs9340799 ESR1хTT-rs2234693 ESR1 и TT-rs5918 ITGB3хTT-rs2234693 ESR1хTC-rs484389 PGR, оказывают рисковое влияние на возникновение данного осложнения беременности (β = 2,38 и β = 1,93 соответственно) (Табл. 2).
Важно подчеркнуть, что комбинация генотипов AA-rs9340799 ESR1хTT-rs2234693 ESR1 в рамках двухлокусного взаимодействия rs9340799 ESR1хrs2234693 ESR1 является рисковой как для формирования изолированной ПЭ (β = 2,45), так и для развития сочетания ПЭ и ЗРП (β = 2,38), что может указывать на универсальное значение этой комбинации генотипов в развитии ПЭ в целом. Около 20-21% женщин с данными осложнениями беременности имеют эту генотипическую комбинацию, тогда как в контрольной группе процент таких женщин не достигает уровня 15%.
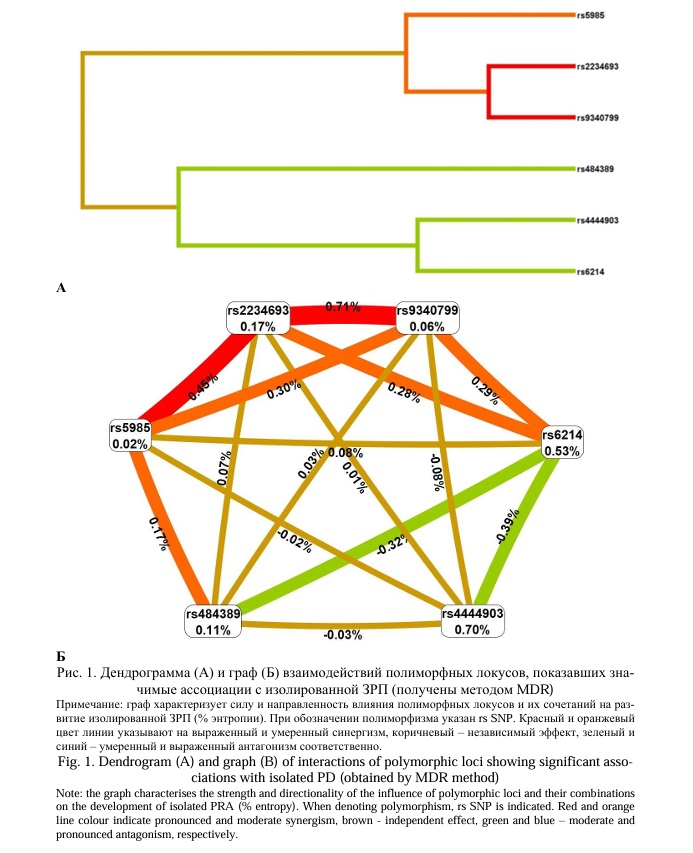
Для изучения силы и направленности межлокусных взаимодействий, определяющих подверженность к изолированным и сочетанным осложнениям беременности мы построили дендрограммы и графы для соответствующих локусов. Итак, в формирование изолированной ЗРП (самостоятельно, в составе гаплотипов (ранее полученные данные [24, 25] и межлокусных взаимодействий (данные настоящего исследования)) согласно полученных нами данных вовлечены 6 локусов – rs4444903 EGF, rs6214 IGF1, rs2234693 ESR1, rs9340799 ESR1, rs484389 PGR и rs5985 F13A1 (дендрограмма и граф взаимодействия этих локусов представлены на рис. 1). Нами обнаружены выраженные эпистатические взаимодействия синергетической направленности (на дендрограмме и графе линии, их соединяющие окрашены в красный цвет) между rs2234693 ESR1 и rs9340799 ESR1 (вклад в энтропию признака – 0,71%), rs2234693 ESR1 и rs5985 F13A1 (вклад в энтропию признака – 0,45%).
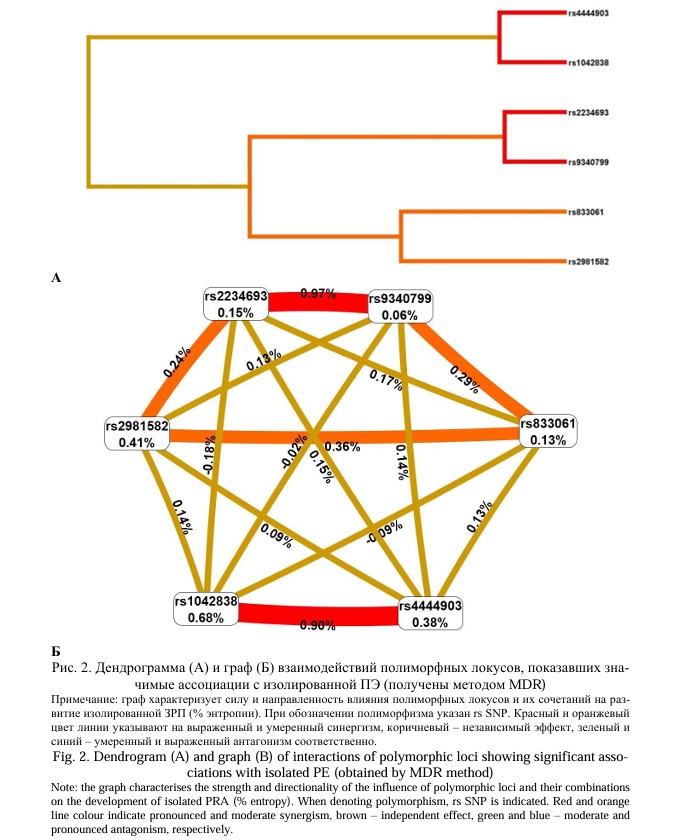
В развитие изолированной ПЭ, как показали результаты нашей работы, вовлечены так же 6 локусов - rs4444903 EGF, rs833061 VEGFA, rs2981582 FGFR2, rs2234693 ESR1, rs9340799 ESR1, rs1042838 PGR (данные настоящего исследования и ранее полученные результаты [26]) (дендрограмма и граф взаимодействия этих локусов представлены на рисунке 2). Наиболее значимые (имеют наибольшие значения показателей энтропии) синергетические взаимодействия (на дендрограмме и графе линии, их соединяющие окрашены в красный цвет) при формировании изолированной ПЭ нами зарегистрированы для двух пар локусов - rs2234693 ESR1 и rs9340799 ESR1 (вклад в энтропию признака – 0,97%), rs1042838 PGR и rs4444903 EGF (вклад в энтропию признака – 0,90%).
Возникновение сочетания ЗРП и ПЭ, согласно материалам данной работы, определяется 5 локусами – rs2234693 ESR1, rs9340799 ESR1, rs3798577 ESR1, rs484389 PGR, rs5918 ITGB3 (материалы настоящего исследования и ранее полученные данные [27]) (дендрограмма и граф взаимодействия этих локусов представлены на рисунке 3). Интересно, что взаимодействия между локусами rs9340799 ESR1 и rs3798577 ESR1 имеют выраженную антагонистическую направленность (на дендрограмме и графе линии, их соединяющие окрашены в синий цвет) и отличаются наибольшим вкладом в энтропию признака (развитие сочетания ЗРП и ПЭ), который составляет -0,73%. Три полиморфизма - rs2234693 ESR1, rs3798577 ESR1, rs484389 PGR, наиболее значимо взаимодействуют между собой в рамках трех парных взаимодействий синергетической направленности (на графе линии, их соединяющие окрашены в красный цвет): rs2234693 ESR1 и rs484389 PGR (показатель энтропии 0,57%), rs2234693 ESR1 и rs3798577 ESR1 (показатель энтропии 0,56%), rs3798577 ESR1 и rs484389 PGR (показатель энтропии 0,53%).
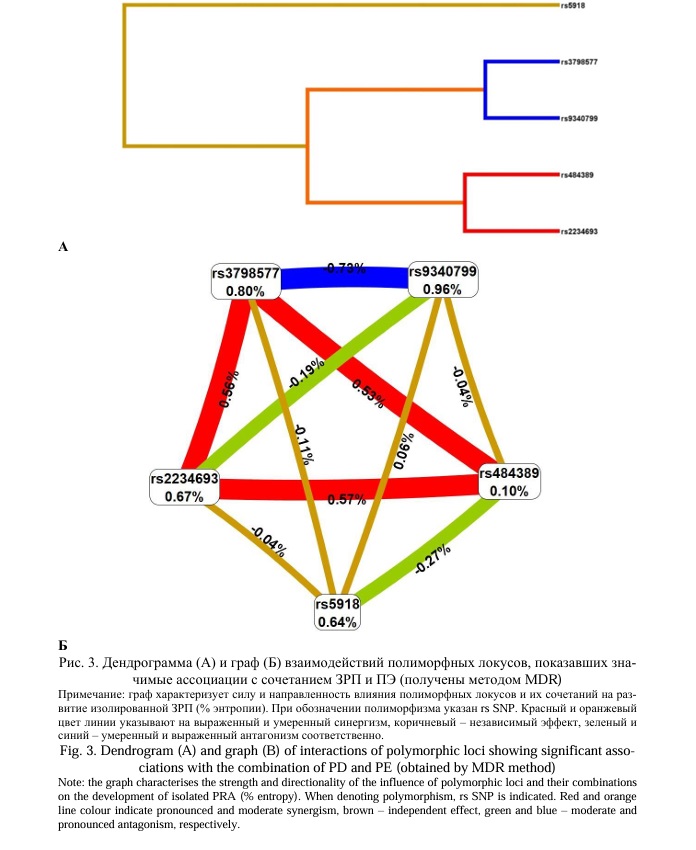
Итак, резюмируя результаты, полученные в данном разделе работы, можно отметить, что в формирование изолированных и сочетанных осложнений беременности вовлечены межлокусные взаимодействия ряда рассматриваемых генов кандидатов. Среди изученных 13 полиморфизмов 5 локусов в составе моделей межгенных взаимодействий определяют подверженность к изолированной ЗРП (rs4444903 EGF, rs6214 IGF1, rs2234693 ESR1, rs484389 PGR и rs5985 F13A1), несколько иные 5 локусов в рамках межгенных взаимодействий вовлечены в формирование изолированной ПЭ (rs4444903 EGF, rs833061 VEGFA, rs2981582 FGFR2, rs2234693 ESR1, rs9340799 ESR1) и межлокусные взаимодействия 4 полиморфизмов ассоциированы с риском развития сочетания ЗРП и ПЭ (rs2234693 ESR1, rs9340799 ESR1, rs484389 PGR, rs5918 ITGB3).
Исходя из вышеприведенных данных можно сделать вывод, что, во-первых, общей генетической детерминантой развития изолированных форм ЗРП и ПЭ (в рамках межгенных взаимодействий) является локус rs4444903 EGF, общей генетической детерминантой для развития изолированной ЗРП и сочетания ЗРП и ПЭ является локус rs484389 PGR, общей генетической детерминантой для возникновения изолированной ПЭ и сочетания ЗРП и ПЭ служит полиморфизм rs9340799 ESR1. Весьма важным является тот факт, что полимофный вариант rs2234693 ESR1 в рамках межгенных взаимодействий является общим генетическим фактором для возникновения всех трех рассматриваемых форм осложнений беременности – изолированной ЗРП, изолированной ПЭ, сочетания ЗРП и ПЭ.
Во-вторых, парное межлокусное взаимодействие rs9340799 ESR1хrs2234693 ESR1 является общим генетическим фактором риска развития как изолированной ПЭ, так и сочетания ЗРП и ПЭ.
В-третьих, пять установленных в нашей работе различных комбинаций генотипов, имеющих рисковое значение для возникновения рассматриваемых форм осложнений беременности, могут иметь важное практическое значение для выделения среди женщин при прегравидарной подготовке и на ранних сроках беременности группы риска по возникновению осложнений беременности, среди которых наиболее перспективными могут быть три рисковые комбинации генотипов, имеющие наибольший уровень статистической значимости ассоциаций (р<0,005) с осложнениями беременности: ТТ-rs2234693 ESR1хGA-rs6214 IGF1 – изолированная ЗРП (β = 1,86, р=0,003); AA-rs9340799 ESR1хTT-rs2234693 ESR1 – изолированная ПЭ (β = 2,45, р=0,0009) и сочетание ПЭ и ЗРП (β = 2,38, р=0,002).
Согласно полученных нами данных, важную роль в развитии ПЭ имеют полиморфные локусы rs9340799 и rs2234693 гена ESR1: комбинация генотипов AA-rs9340799 ESR1хTT-rs2234693 ESR1 является значимым фактором риска возникновения как изолированной ПЭ, так и сочетания ПЭ и ЗРП. Анализ регуляторного потенциала 26 SNPs, сильно сцепленных с полиморфными локусами rs2234693 и rs9340799 гена ESR1 (Табл. 4 и 5), показал, что большинство из них проявляют значимые эпигенетические эффекты. Полиморфизм rs2077647 расположен в экзоне гена ESR1 и приводит к синонимичной замене в кодируемом белке. Полиморфный локус rs2077647 локализуется в эволюционно консервативном регионе. Наиболее выраженный регуляторный потенциал демонстрируют полиморфные локусы rs2077647, rs62442056, rs9479130 (Табл. 3 и 4). Так, полиморфный локус rs9479130, сцепленный с rs2234693 and rs9340799 гена ESR1 (r2=1,00 and r2=0,61 соответственно) расположен в области гиперчувствительности к ДНКазе 1 в 24 тканях, регионе двух регуляторных мотивов ДНК (ZBTB33, AP-1) и регионе связывания с тремя регуляторными белками (TCF12, NRSF, SIN3AK20). Также локус rs2077647 (сцеплен с rs2234693) находится в регионе промоторов в 24 различных тканях, сайтах гиперчувствительности к ДНКазе 1 в 7 тканях, области 4 регуляторных мотивов ДНК (Znf143, RP58, LUN-1, Zfp410),регионе связывания с регуляторным белком HAE2F1. SNP rs62442056 (сцеплен с rs9340799) локализуется в регионе гиперчувствительности к ДНКазе 1 в 29 тканях, регионе пяти регуляторных мотивов ДНК (CEBPB, Foxa, Foxi1, TCF12, HDAC2) и регионе связывания с тремя регуляторными белками (NRSF, TCF12, SIN3AK20).
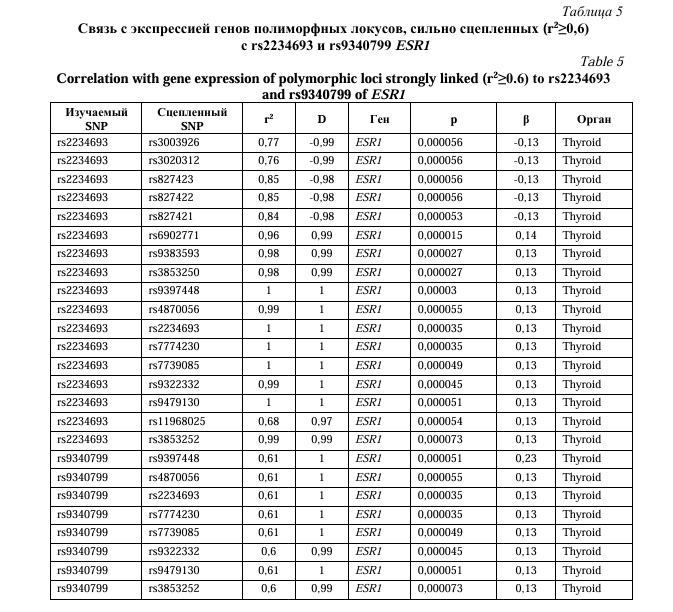
С использованием данных проекта Genotype-Tissue Expression (GTEx) установлена связь полиморфизма rs2234693 и 16 SNPs, сильно сцепленных с с полиморфными локусами rs2234693 и rs9340799 гена ESR1 с уровнем экспрессии гена ESR1 в щитовидной железе (Табл. 5).
Общеизвестно, что ген ESR1 кодирует рецепторы первого типа к эстрогенам, которые, с одной стороны, играют важную роль в потенциировании эффектов эстрогенов в организме, с другой стороны, служат важнейшим регулятором экспрессии множества различных генов (http://www.genecards.org/). Следует отметить, что эстрогены играют важную регуляторную роль в развитии и функционировании репродуктивной системы [28]. У мышей и крыс нарушение в функционировании ESR1 вызывает бесплодие как у самок, так и у самцов [29]. ESR1 преимущественно экспрессируется в молочных железах, гипоталамусе, гипофизе, матке и клетках теки яичников [30]. Эстроген является главным регулятором гонадотропного рилизинг гормона (ГнРГ). ГнРГ синтезируется в гипоталамусе и влияет на синтез лютеинизирующего и фолликулостимулирующего гормонов в гипофизе, которые являются ключевыми регуляторами каскада гормональных событий, необходимых для нормального полового созревания и репродуктивной функции (http://www.genecards.org/).
Наряду с этим эстрогены стимулируют активацию рецептора инсулиноподобного фактора роста 1 (IGF1R) [30]. IGF1R опосредует эффекты инсулиноподобных факторов роста IGF-1 и IGF-2, тем самым способствуя росту плода и новорожденного, реагируя на материнские, фетальные и плацентарные сигналы, такие как кислород, гормоны и питательные вещества [31]. IGF-1 контролирует рост плода в ответ на доступность питательных веществ, в то время как IGF-2 стимулирует дифференцировку и рост плаценты [32]. Кроме того, IGF-1 и IGF-2 контролируют секрецию гормонов, транспорт субстратов и влияют на рост плода либо непосредственно, влияя на поглощение и транспорт питательных веществ плацентой, либо косвенно, влияя на доступность материнских субстратов [32]. Поглощение глюкозы и аминокислот стимулируется IGF-1, IGF-2 и трофобластами [33]. Как показано в ряде исследований ЗРП у человека может быть связано с хронической гипогликемией плода [34].
Рецепторы эстрогенов находятся и в плаценте. ESR1 играет важную роль как в стимуляции терминальной дифференцировки мононуклеарных клеток трофобласта в синцитиотрофобласт, так и в стимулировании функции плаценты [35]. Исследования, проведенные in vivo, показывают, что плацентарные стероидные гормоны могут играть важную роль в управлении изменениями метаболизма глюкозы и чувствительности матери к инсулину во время беременности (играют роль в регуляции гомеостаза глюкозы и инсулина, регуляции аппетита и регуляции липидов) [36].
В работе Molvarec et al. сообщается о том, что гомозиготные носители гаплотипа TA полиморфных локусов rs2234693 и rs9340799 гена ESR1 имели повышенный риск развития тяжелой преэклампсии [37]. Эти данные полностью соответствуют полученным нами результатам, согласно которым комбинация генотипов AA-rs9340799 ESR1хTT-rs2234693 ESR1 оказывают рисковое влияние на развития ПЭ как изолированной (β = 2,45), так и в сочетании с ЗРП (β = 2,38). В то же время имеются литературные данные, которые отличаются от полученных нами результатов. Так, в мета-анализе, проведенном Zhao et al., показано, что генотип GG полиморфизма rs9340799 гена ESR1 может быть генетическим фактором риска развития тяжелой преэклампсии [38]. Наличие этих противоречий указывает на необходимость продолжения исследований в области изучения роли полиморфных локусов гена ESR1 в развитии осложнений беременности с учетом межэтнических и межпопуляционных различий, которые могут быть одной из причин неоднозначности в характере и направленности выявляемых ассоциаций.
Заключение. Риск развития осложнений беременности в значительной степени определяется генетической комбинаторикой трех полиморфных локусов rs2234693 ESR1, rs9340799 ESR1, rs6214 IGF1. Комбинация генотипов ТТ-rs2234693 ESR1хGA-rs6214 IGF1 определяет подверженность к формированию изолированной ЗРП (β = 1,86), а комбинация генотипов AA-rs9340799 ESR1хTT-rs2234693 ESR1 ассоциирована с возникновением изолированной ПЭ (β = 2,45) и сочетанием ПЭ и ЗРП (β = 2,38).





















Список литературы