Влияние даларгина на содержание матриксных металлопротеиназ и тканевого ингибитора металлопротеиназ в толстом кишечнике мышей с экспериментальным язвенным колитом
Aннотация
Актуальность: Язвенный колит – хроническое, мультифакториальное заболевание, развитие которого определяется нарушениями микробиоты толстого кишечника, неправильным питанием, неадекватным иммунным ответом на патогенную и комменсальную микрофлору на фоне генетической предрасположенности, имеющее важное социальное значение. Показано повышение содержания матриксных металлопротеиназ в плазме и ткани ободочной кишки при язвенном колите. Важное значение в развитии воспаления в толстом кишечнике имеют матриксные металлопротеиназы-2, 9 и тканевой ингибитор металлопротеиназ-2. Существующие методы лечения язвенного колита недостаточно эффективны. Даларгин обладает уникальной совокупностью свойств, что делает перспективным его применение при лечении язвенного колита. Цель исследования:Изучение влияния даларгина на концентрацию матриксной металлопротеиназы-2, матриксной металлопротеиназы-9 и тканевого ингибитора металлопротеиназ-2 в медиальном отделе ободочной кишки мышей с экспериментальным язвенным колитом. Материалы и методы:Язвенный колит у мышей Balb/C моделировали заменой питьевой воды 5% раствором декстрана сульфата натрия в кипяченой воде на 5 суток. На 5, 7 и 28 сутки эксперимента в гомогенате медиального отдела ободочной кишки определяли содержание матриксных металлопротеиназ-2 и 9, тканевого ингибитора металлопротеиназ-2. Даларгин вводили подкожно в дозе 100 мкг/кг в течение 7 суток. Результаты:Установлено повышение содержания матриксных металлопротеиназ-2 и 9, а также тканевого ингибитора металлопротеиназ-2 в стенке толстого кишечника мышей с язвенным колитом на 5 и 7 сутки эксперимента. При хроническом язвенном колите только концентрация тканевого ингибитора металлопротеиназ-2 была достоверно выше, чем у интактных мышей. Применение даларгина приводило к снижению концентрации матриксных металлопротеиназ-2 и 9, тканевого ингибитора металлопротеиназ-2 в острый период болезни. При хроническом язвенном колите введение даларгина уменьшало концентрацию тканевого ингибитора металлопротеиназ-2 в стенке медиального отдела ободочной кишки. Заключение:Даларгин снижал содержание матриксных металлопротеиназ-2 и 9, тканевого ингибитора металлопротеиназ-2 в стенке толстого кишечника мышей с язвенным колитом на 5 и 7 сутки эксперимента. Указанный эффект был выше, чем у сульфасалазина, широко применяемого при лечении язвенного колита
Ключевые слова: язвенный колит, даларгин, матриксная металлопротеиназа-2, матриксная металлопротеиназа-9, тканевой ингибитор металлопротеиназ-2
Введение. Язвенный колит (ЯК) – хроническое, рецидивирующее, мультифакториальное заболевание, возникновение и развитие которого определяются нарушениями микробиоты толстого кишечника, неправильным питанием, неадекватным иммунным ответом на патогенную и комменсальную микрофлору на фоне генетической предрасположенности [1, 2, 3]. В 2023 году в мире было установлено 5 миллионов случаев развития ЯК, и отмечается стойкая тенденция увеличения распространенности этого заболевания, особенно в странах Восточной Европы, включая Россию, и Юго-Восточной Азии [4]. Высокая социальная значимость ЯК определяется следующими особенностями развития заболевания: 1) первый пик заболеваемости наблюдается у молодых людей в возрасте 20-40 лет; 2) прогрессирование ЯК сопровождается высокой вероятностью развития тяжелых осложнений и инвалидизации пациентов; 3) до настоящего времени отсутствуют эффективные методы терапии ЯК, позволяющие добиться стойкой ремиссии заболевания [3]. Несмотря на значительное количество исследований, посвященных изучению различных аспектов этого заболевания, этиология и патогенетические механизмы ЯК, остаются недостаточно выясненными.
В последние годы расширились представления о роли микробиоты кишечника в развитии воспалительных заболеваний кишечника. Показано, что персистирующие возбудители при нарушении защитных свойств слизистой кишечника и повышении ее проницаемости способны проникать из просвета кишечника в кровеносные и лимфатические сосуды, вызывая нарушение иммунного ответа с формированием хронического воспалительного процесса [5]. Необходимо подчеркнуть, что в настоящее время ни один из микроорганизмов не идентифицирован как возбудитель ЯК [3]. Развитие ЯК объясняют воздействием комплекса средовых и генетических факторов, вызывающих нарушение барьерной функции слизистой оболочки толстого кишечника, что приводит к пенетрации патогенной и комменсальной микрофлоры из просвета кишечника в его слизистую оболочку и подслизистый слой [1, 2]. Бактериальные антигены вызывают активацию нейтрофилов, макрофагов, дендритных клеток, лимфоцитов, прежде всего, CD8+IL-17+-клеток, что приводит к развитию хронического воспаления, сопровождающегося формированием язв и разрушением крипт слизистой оболочки толстого кишечника [1, 2].
В настоящее время общепризнано, что отсутствуют надежные критерии, позволяющие диагностировать заболевание на ранних стадиях, а существующие методы лечения ЯК недостаточно эффективны. Как показывают многочисленные исследования, одним из возможных информативных маркеров развития воспаления в стенке толстого кишечника являются матриксные металлопротеиназы (ММП) [6].
ММП представляют собой семейство, включающее более 20 цинк-зависимых эндопротеаз, основными функциями которых являются участие в регуляции дифференцировки, пролиферации клеток, апоптозе и ангиогенезе [7]. ММП выступают как внутри- и внеклеточные биологически активные молекулы, контролирующие ремоделирование экстрацеллюлярного матрикса путем разрушения его основных компонентов: коллагена, эластина, фибронектина, а также регулирование активности репаративных процессов [7]. Активность ММП контролируется специальными белками - тканевыми ингибиторами металлопротеиназ (ТИМП). В настоящее время установлено 4 ТИМП: 1, 2, 3, 4, при этом действие их в отношении различных ММП неспецифично [6, 7]. Известно, что ММП играют важную роль в развитии сердечно-сосудистой и акушерской патологии, опухолей, воспалительных заболеваний [6, 8, 9]. Усиление экспрессии ММП и ТИМП наблюдается при развитии таких воспалительных заболеваний, как ревматоидный артрит, остеоартрит, псориаз и хроническая обструктивная болезнь легких. На клеточном уровне транскрипция ММП и ТИМП регулируется факторами роста, цитокинами, взаимодействием клеток и внеклеточного матрикса [10]. Повышение содержания ММП и ТИМП индуцирует активацию сигнальных путей, включая фосфоинозитид-3-киназу/протеинкиназу B, митоген-активируемая протеинкиназа (МАРК), ядерный фактор kB, усилитель легкой каппа-цепи активированных В-клеток (NF-B), протоонкоген jun – протоонкоген/fos белок-активатор 1 (Jun-Fos/AP-1) [10].
В толстом кишечнике в условиях физиологического покоя концентрация ММП низкая, но при развитии острого воспаления она значительно повышается, что приводит к нарушению барьерной функции слизистой толстого кишечника вследствие разрушения межклеточного вещества, включая муцины и клаудины [7]. Установлено увеличение концентрации различных ММП в стенке толстого кишечника, как в экспериментальных исследованиях [7], так и у пациентов с ЯК [10]. Особый интерес исследователей вызывают ММП-2 и ММП-9 [11, 12]. ММП-2 и МПП-9 – желатиназы, регулирующие различные звенья патогенеза ЯК [6]. Показано, что ММП-2 участвует в ремоделировании коллагеновых структур, предупреждает развитие нейтрофильной инфильтрации и фиброза в ткани толстого кишечника [7]. ММП-9 помимо участия в ремоделировании экстрацелюллярного матрикса, стимулирует развитие нейтрофильной инфильтрации при воспалении, нарушает репаративные процессы в эпителии, увеличивает проницаемость сосудистой стенки, вызывает активацию цитокинов (ИЛ-1β, ИЛ-8, трансформирующего фактора роста-β) [7]. Некоторые авторы подчеркивают ключевую роль ММП-9 в прогрессировании ЯК [12]. Также показано, что увеличение концентрации ММП-9 в плазме крови коррелирует с тяжестью ЯК [11, 12]. ТИМП-2 оказывает ингибирующее действие на активность ММП-2, ММП-9 и ММП-14 [10].
Учитывая важную роль ММП в развитии ЯК, изучение влияния фармакологических препаратов, применяемых для лечения ЯК, на активность ММП при воспалении толстого кишечника, представляет несомненный интерес.
Даларгин был предложен как противоязвенный препарат, но в настоящее время используется в лечении панкреатита [13]. Ранее показано, что он обладает антиоксидантным, иммуномодулирующим действием, оказывает стимулирующее влияние на репаративные процессы при повреждении. Противовоспалительное действие даларгина связывают с его эффектом на макрофаги, фибробласты, что приводит к усилению синтеза коллагена и ДНК в эпителии [13]. Ранее нами показан корригирующий эффект даларгина на течение экспериментального ЯК у мышей, что проявлялось снижением индекса активности болезни, уменьшением распространенности язв и воспалительных инфильтратов в дистальном отделе ободочной кишки [14]. В связи с этим представляет интерес изучение влияния даларгина на содержание ММП в стенке толстого кишечника при экспериментальном ЯК.
Цель исследования. Изучение влияния даларгина на концентрацию ММП-2, ММП-9 и ТИМП-2 в медиальном отделе ободочной кишки мышей с экспериментальным ЯК.
Материалы и методы исследования. Эксперименты выполнены на 67 мышах-самцах линии Balb/C весом 20-23 г. из филиала "Столбовая" Федерального государственного бюджетного учреждения науки "Научный центр биомедицинских технологий Федерального медико-биологического агентства".
Животных разделили на следующие группы: 1) интактные (n=4); 2) контрольная (n=21) – ЯК+физраствор; 3) опытная №1(n=21) – ЯК+даларгин; 4) опытная №2 (n=21) – ЯК+сульфасалазин.
Животным контрольной и опытных групп ЯК моделировали заменой питьевой воды 5% раствором декстрана сульфата натрия (ДСН) (Mr=40000, PanReac-AppliСhem, ФРГ) в кипяченой воде на 5 суток [15]. Развитие ЯК у животных после потребления 5% раствора ДСН подтверждено морфологическими исследованиями. Мышей выводили из эксперимента на 5, 7 сутки (острый колит) и на 28 сутки (хронический колит) цервикальной дислокацией под хлоралгидратным наркозом.
Даларгин (Тир-D-Ала-Гли-Фен-Лей-Арг) (НПО «Микроген», Россия) растворяли в 0,9% растворе хлорида натрия, применяли подкожно в объеме 0,1 мл ежедневно в дозе 100 мкг/кг массы тела 1 раз в сутки в течение 7 дней с начала моделирования ЯК. По данным литературы исследованный пептид проявляет высокую фармакологическую активность при его использовании в указанной дозе [16].
Сульфасалазин (компания «КРКА», Словения) применяли в качестве препарата сравнения и вводили мышам внутрижелудочно в виде суспензии в физиологическом растворе в дозе 200 мг/кг массы тела в объеме 0,3 мл в течение 7 суток с начала моделирования ЯК [16]. Ранее показано, что применение сульфасалазина в дозе 200 мг/кг внутрижелудочно вызывало уменьшение площади язвенных дефектов и кровоизлияний в прямой кишке, снижение концентрации индуцированной NO-синтазы, ИЛ-1β, ИЛ-6, ФНОα в гомогенате прямой кишки у крыс с экспериментальным ЯК [17].
Контрольная группа животных с ЯК состояла из 21 особи, 12 из которых физраствор вводили подкожно, 9 – внутрижелудочно. На 5, 7 и 28 сутки эксперимента из опыта выводили по 7 мышей: 4 получали физраствор подкожно и 3 внутрижелудочно. Ранее установлено отсутствие клинических и морфологических различий между мышами Balb/C с экспериментальным ЯК, получавших физраствор указанными способами, на всех сроках эксперимента [14]. Физраствор вводили 1 раз в сутки в течение 7 дней с начала моделирования ЯК в объеме 0,1 мл подкожно или 0,3 мл внутрижелудочно.
У животных, выведенных из эксперимента, извлекали ободочную кишку, выделяли медиальный отдел, вскрывали его продольным разрезом по краю прикрепления брыжейки, промывали фосфатно-солевым буфером (pH=7,4, 0,01М) и ткань (70 мг) гомогенизировали в гомогенизаторе Поттера-Эльвегейма в течение 10 минут. Гомогенат центрифугировали на центрифуге SL-16R («Thermo Fisher Scientific», Германия) в течение 10 минут при 3000 об/мин. Полученный супернатант замораживали при t=-40oC и хранили не более 2 месяцев. Содержание ММП-2, ММП-9 и ТИМП-2 определяли в гомогенате медиального отдела ободочной кишки методом иммуноферментного анализа (ИФА) с помощью стандартных наборов фирмы Cloud-Clone Corp. (США) на автоматическом иммуноферментном анализаторе «Лазурит» (Dynex Technologies, США) согласно стандартной инструкции.
Работа выполнена в лаборатории доклинических исследований лекарственных средств НИИ экспериментальной медицины Курского государственного медицинского университета с соблюдением принципов гуманного отношения к лабораторным животным [18, 19], положений Хельсинской декларации Всемирной медицинской ассоциации о гуманном отношении к лабораторным животным (2000 г.), директивы Европейского сообщества (86/609EC) и Правил надлежащей лабораторной практики в Российской Федерации (приказ МЗ РФ №199н от 01.04.2016 г.). Проведение экспериментов по теме исследования было одобрено Региональным этическим комитетом (РЭК) (протокол заседания секции доклинических исследований РЭК №1 от 03.04.2023).
При статистической обработке полученных результатов нормальность распределения оценивали с помощью критерия Шапиро-Уилка, а гомогенность дисперсий по критерию Левена. Проверку статистических гипотез проводили с помощью непараметрического U-критерия Манна-Уитни. Применение непараметрической статистики было связано с небольшим размером выборок, разным характером распределения в вариационных рядах и неравенством дисперсий при сравнении групп. Материал представлен как медиана (Me) нижний (Ql) и верхний (Q3) квартили. В ходе проведения статистического анализа нулевая гипотеза отвергалась при p≤0,05. Статистическую обработку проводили с помощью программного обеспечения Statistica версия 10.
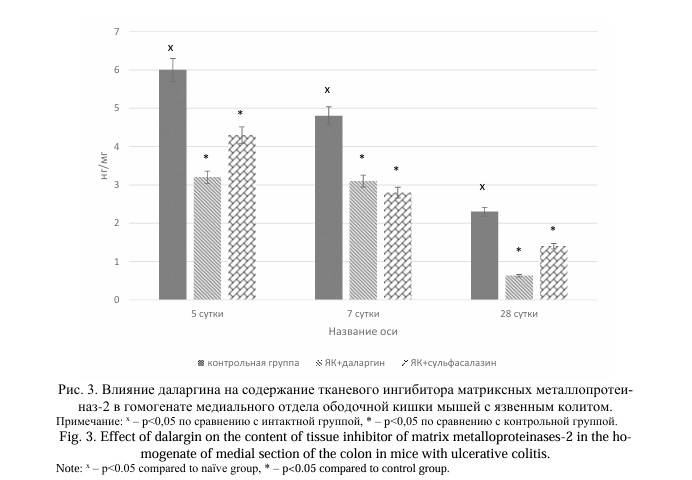
Результаты и их обсуждение. Моделирование ЯК у мышей линии Balb/C приводило к повышению содержания ММП-2, ММП-9 и ТИМП-2 в гомогенате медиального отдела ободочной кишки на 5 сутки эксперимента в 16,1, 21,8 и 20,7 раз соответственно (P=0,0107) по сравнению с интактными животными (Рис. 1, 2, 3). На 7 сутки отмечено снижение концентраций ММП-2 и ТИМП-2 на 37,9% и 20,0% соответственно по сравнению с предыдущим сроком наблюдения. Напротив, содержание ММП-9 увеличилось на 11,5%. На 28 сутки при хроническом ЯК концентрации ММП-2, ММП-9, ТИМП-2 значительно снижались, при этом содержание ММП-2 и ММП-9 не отличалось значимо от аналогичных значений у животных интактной группы, а концентрации ТИМП-2 оставалась достоверно выше (в 7,9 раза, P=0,0107).
Применение даларгина у мышей Balb/C с ЯК вызывало значимое снижение содержания ММП-2, ММП-9 и ТИМП-2 на 5 и 7 сутки эксперимента. Так, при введении даларгина концентрация ММП-2 уменьшилась в 6,3 и 3,9 раза, ММП-9 – в 4,1 и 5,6 раза, ТИМП-2 – на 46,7% и 35,4% соответственно на 5 и 7 сутки после начала моделирования ЯК по сравнению с контрольной группой (Р=0,0022). Не установлено значимых отличий концентраций ММП-2 и ММП-9 на 28 сутки (хронический колит) у мышей с ЯК, получавших даларгин, по сравнению с контрольной группой (P>0,05). Содержание ТИМП-2 было в 3,7 раза ниже при применении даларгина (Р=0,0022).
Применение сульфасалазина у мышей с ЯК приводило к снижению содержания ММП-2 и ТИМП-2 в гомогенате медиального отдела ободочной кишки в 3,1 раза (P=0,0022) и на 28,3% (P=0,0022) соответственно на 5 сутки эксперимента по сравнению с животными контрольной группы. Не установлено изменений концентрации ММП-9 в этот период. На 7 сутки содержание ММП-2 было в 2,1 раза (P=0,0049), ММП-9 в 3,0 раза (P=0,0022), ТИМП-2 на 41,7% (P=0,0022) ниже, чем в контрольной группе. На 28 сутки (хронический колит) только концентрация ТИМП-2 была ниже на 39,1% (P=0,0409), чем у мышей контрольной группы.
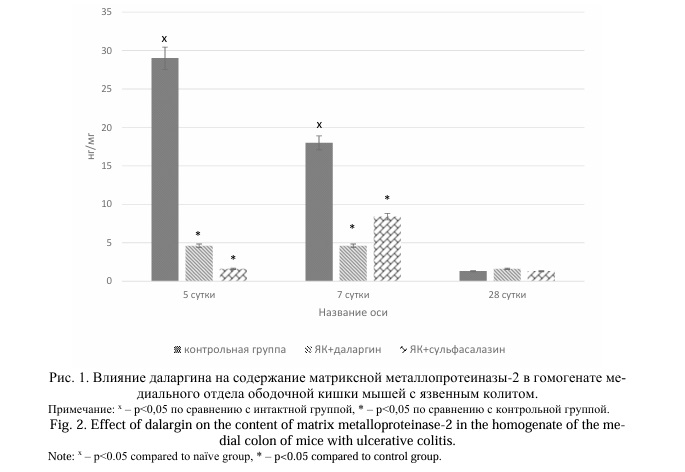
При сравнении влияния даларгина и сульфасалазина на концентрацию ММП и ТИМП у мышей с ЯК установлено, что эффекты даларгина значимо выше по сравнению с действием сульфасалазина на 5 и 7 сутки развития заболевания. Так, на 5 сутки содержание в гомогенате медиального отдела ободочной кишки ММП-2 в 2,0 раза ниже у мышей, получавших даларгин, по сравнению с группой ЯК+сульфасалазин (P=0,0022). На 7 сутки также установлено снижение концентрации ММП-2 в группах ЯК+даларгин на 45,2% по сравнению с животными, получавшими сульфасалазин (P=0,0022). Содержание ММП-9 на 5 и 7 сутки у мышей, которым применяли даларгин, было значимо ниже, чем в группе ЯК+сульфасалазин: на 5 сутки в 3,8 раза (P=0,0022), на 7 сутки на 46,9% (P=0,0033). Более низкие значения концентрации ТИМП-2 у крыс, получавших даларгин, отмечались только на 5 сутки эксперимента (на 25,6% (P=0,0022)).
У мышей с хроническим ЯК, которым применяли даларгин, показано снижение содержания ТИМП-2 на 28 сутки в 2,2 раза (P=0,0181) по сравнению с животными, которым вводили сульфасалазин.
Таким образом, в наших экспериментах установлено корригирующее влияние даларгина и сульфасалазина на концентрации ММП-2, ММП-9 и ТИМП-2 в гомогенате медиального отдела ободочной кишки, что подтверждает их противовоспалительное действие у мышей с ЯК. При этом максимальный эффект наблюдался при применении даларгина.
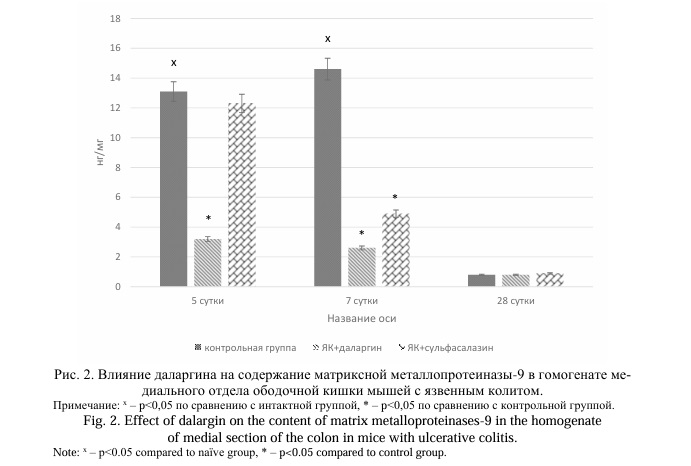
Полученные в работе результаты подтверждают данные литературы о повышении содержания ММП-2, ММП-9 и ТИМП-2 при развитии ЯК, как у лабораторных животных, так и у пациентов [6, 20]. Однако динамика концентрации измеряемых параметров была различной: если содержание ММП-2 и ТИМП-2 оказалось максимальным на 5 сутки эксперимента, то концентрация ММП-9 на 7. Ранее показано, что тяжесть экспериментального ЯК у лабораторных мышей нарастает от 5 суток к 7 [14, 20]. Полученные в работе данные подтверждают ранее полученные результаты о том, что динамика ММП-9 при ЯК прямо пропорциональна тяжести заболевания, а изменения концентрации ММП-2 и ТИМП-2 обратно пропорциональны [20]. У мышей с хроническим ЯК содержание всех исследованных показателей существенно снижается, а концентрация ММП не отличается достоверно от аналогичных значений у интактных мышей. Указанные изменения объясняются, по-видимому, изменением популяции лейкоцитов в очаге воспаления и преобладанием В-лимфоцитов [21]. Ранее показано, что концентрация ММП-9 в сыворотке крови пациентов с острым ЯК значимо выше, чем у больных с неактивной формой заболевания или у здоровых добровольцев, что указывает на возможность использования концентрации ММП-9 как маркера активности воспалительного процесса в толстом кишечнике и эффективности проводимой терапии [22].
При воспалении отмечается повышение концентрации ТИМП, что является защитным механизмом при значительном увеличении активности ММП [23]. Однако, как показано в большинстве исследований, повышение уровня ТИМП обычно не способно предупредить активацию ММП [23].
Известно, что основными продуцентами ММП при воспалении являются макрофаги и
нейтрофилы [7]. Общепризнано, что опиоидные рецепторы, преимущественно μ-типа присутствуют на нейтрофилах, макрофагах, дендритных клетках, Т- и В-лимфоцитах в стенке толстого кишечника [24]. Установлено усиление экспрессии мРНК опиоидных μ-рецепторов в острый период развития болезни. При хроническом течении ЯК наблюдалась нормальная экспрессия мРНК опиоидных μ-рецепторов [25]. Эти данные указывают на вовлеченность опиоидных μ-рецепторов в регуляцию воспаления в толстом кишечнике.
Опиоидные δ-рецепторы также присутствуют в толстом кишечнике, главным образом на нейронах нервного сплетения, регулирующих перистальтику [26]. У мышей с экспериментальным ЯК отмечается увеличение количества опиоидных δ-рецепторов, стимуляция которых угнетает сократительную активность мышц толстого кишечника [26].
Даларгин – аналог лей-энкефалина, имеющий высокую устойчивость к действию эндопептидаз, что связано с замещением аминокислоты глицина на D-аланин во втором положении и присоединением остатка аргинина к С-концу молекулы, проявляющий высокую селективность в отношении опиоидных δ- и μ-рецепторов [13]. Установленный в нашем исследовании фармакологический эффект даларгина на содержание ММП-2, ММП-9 и ТИМП-2 у мышей с ЯК связан, по-видимому с активацией опиоидных μ-рецепторов на моно- и полинуклеарах в стенке толстого кишечника, что приводит к снижению их функциональной активности, уменьшению продукции ММП макрофагами, лимфоцитами и нейтрофилами. Связывание даларгина с опиоидными δ-рецепторами на клетках нервного сплетения, количество которых увеличивается при ДСН-индуцированном ЯК, вызывает снижение перистальтики, что может опосредованно приводить к уменьшению интенсивности воспаления в толстом кишечнике.
Ранее показано, что применение природного ингибитора энкефалиназы опиорфина при экспериментальном ЯК у мышей вызывает падение концентрации провоспалительных цитокинов (ИЛ-1β, ИЛ-6, ФНОα) и увеличение содержания противовоспалительного ИЛ-10, как в стенке толстого кишечника, так и в плазме крови [21]. Указанные биохимические изменения сопровождались уменьшением клинических проявлений ЯК, таких как индекс активности болезни и длина толстого кишечника, а также выраженности гистологических изменений в толстом кишечнике при воспалении [21]. Авторы связывают противовоспалительное действие опиорфина с подавлением активности ядерного фактора kB p65, толл-подобного рецептора-4 (TLR-4), индуцированной NO-синтазы, циклооксигеназы 2 типа. Кроме того, применение опиорфана приводило к угнетению активности нейтральной эндопептидазы и аминопептидазы N – ферментов, участвующих в разрушении эндогенных энкефалинов. Таким образом, применение опиорфина приводило не только к повышению содержания лей-и мет-энкефалинов в сыворотке крови, но и к увеличению экспрессии опиоидных μ- и δ-рецепторов [21]. Такое действие исследованного ингибитора энкефалиназы, по мнению авторов, связано с активацией периферических μ-рецепторов, поскольку применение налоксона гидрохлорида, блокирующего преимущественно периферические μ-рецепторы и имеющего меньшее сродство к опиоидным δ-рецепторам, устраняло корригирующий эффект опиорфина на течение ЯК [21]. Ранее показано, что применение селективных антагонистов опиоидных δ-рецепторов налтриндола и 7-бензилиденналтрексона не оказывало существенного влияния на течение экспериментального ЯК у мышей, что позволило авторам сделать вывод о том, что опиоидные δ-рецепторы не вовлекаются в корригирующий эффект опиоидов при ЯК [27].
Установлено ингибирующее влияние агонистов опиоидных рецепторов на ММП-9 [28]. Показано, что эндогенный агонист опиоидных μ-рецепторов эндоморфин-2 оказывает ингибирующее действие на ММП-9, а синтетические опиоиды MML617, MML717 и MML1017 угнетали активность ММП-2 и ММП-9 [28]. У больных раком пищевода установлено снижение активности опиоидных κ-рецепторов, что приводило к повышению активности ММП-2 и прогрессированию злокачественной опухоли [29].
Заключение. В работе установлено, что развитие экспериментального ЯК у мышей Balb/C сопровождается повышением концентрации ММП-2, ММП-9 и ТИМП-2 в гомогенате медиального отдела ободочной кишки на 5 и 7 сутки эксперимента (острый ЯК), что указывает на развитие острого воспаления в толстом кишечнике. При хроническом язвенном колите содержание исследованных ММП не отличается значимо от аналогичных значений у интактных животных, а концентрация ТИМП-2 остается повышенной, что подтверждает ранее полученные литературные данные [23]. Увеличение концентрации ММП и ТИМП связано с активацией макрофагов, нейтрофилов и лимфоцитов, количество которых значительно увеличивается в стенке толстого кишечника при воспалении, являющихся основными продуцентами ММП.
Применение даларгина у мышей Balb/C с экспериментальным ЯК вызывает снижение концентрации ММП-2, ММП-9 и ТИМП-2 на 5, 7 и 28 сутки эксперимента по сравнению с группой ЯК+физраствор, что указывает на снижение тяжести воспалительного процесса у животных. Фармакологический эффект даларгина объясняется, по-видимому, активацией опиоидных μ-рецепторов, количество которых значительно увеличивается на макрофагах, нейтрофилах, Т- и В-лимфоцитах при остром ЯК. Стимуляция агонистами опиоидных μ-рецепторов приводит к угнетению ядерного фактора kB p65, TLR-4, индуцированной NO-синтазы, циклооксигеназы 2 типа [20]. При сравнении корригирующего действия даларгина и сульфасалазина на содержание ММП-2, ММП-9 и ТИМП-2 в гомогенате медиального отдела ободочной кишки мышей с экспериментальным ЯК установлено, что фармакологический эффект даларгина значимо выше (p<0,05), что проявлялось снижением концентрации ММП-2 и ММП-9 на 5 и 7 сутки эксперимента, а ТИМП-2 на 5 и 28 сутки.
Учитывая важную роль ММП и ТИМП в развитии воспалительных процессов в различных тканях, использование ингибиторов ММП представляется перспективным направлением терапии таких заболеваний.
Таким образом, полученные результаты открывают перспективы использования даларгина как средства фармакологической коррекции ЯК, особенно при его использовании в комбинации с другими лекарственными препаратами.





















Список литературы