Возможности ранней диагностики поражений ЦНС плода в антенатальном периоде (обзор)
Aннотация
Актуальность: Поражение головного мозга плода во время беременности – это одна из основных причин смерти и инвалидности у детей раннего возраста, а также детского церебрального паралича. У детей с детским церебральным параличом наблюдаются двигательные нарушения различной степени выраженности, которые оказываются вторичными по отношению к поражениям или аномалиям головного мозга, возникающим в антенатальном периоде. Цель исследования:Анализ современных методов ранней диагностики поражений ЦНС плода в антенатальном периоде. Материалы и методы:Поиск в информационных базах по заданным ключевым словам: «плацентарная недостаточность», «магнитно-резонансная томография», «нейросонография плода», «ультразвуковая допплерография», «поражения головного мозга плода» выявил 1473 статьи, посвященные проблемам диагностики поражений ЦНС плода в антенатальном периоде. После исключения дублирующих публикаций (852) и публикаций давностью выхода более 10 лет (574) анализу подлежали 47 литературных источников. В исследовании использованы информационные базы: PubMed, PubMed Central, Scopus, MEDLINE, ScienceDirect, Cochrane Library, eLibrary за период с 2014 г. до ноября 2023 г. Результаты:Магнитно-резонансная томография (МРТ) позволяет определить у плода наличие врожденных аномалий развития ЦНС, аномалий белого вещества, количество дезоксигемоглобина в нервной ткани; а также выявить плацентарные нарушения. Нейросонография является методом пренатальной диагностики, который визуализирует внутримозговые кровоизлияния, структуру коры головного мозга, сильвиевой борозды и мозолистого тела. Последовательное применение данных методов диагностики у пациенток группы риска способствует персонификации тактики ведения и родоразрешения, что в перспективе позволит снизить частоту неблагоприятных перинатальных исходов и потерь. Заключение:При помощи МРТ возможно провести не только оценку состояния ЦНС плода, но и получить представление о состоянии плаценты. Данный метод исследования позволит по-новому взглянуть на проблему хронической плацентарной недостаточности и более качественно оценить степень влияния плацентарных нарушений на состояние плода. Нейросонография, в свою очередь, является более доступным методом диагностики патологических состояний ЦНС плода, который тоже имеет высокую чувствительность в рамках выявления ишемически-гипоксического повреждения головного мозга в антенатальном периоде
Ключевые слова: плацентарная недостаточность, гипоксически-ишемическое поражение головного мозга, магнитно-резонансная томография, нейросонография, ультразвуковая допплерография
Введение. В настоящее время плацентарная недостаточность – это распространённое осложнение беременности, которое является основной причиной задержки роста плода (ЗРП). В результате хронической плацентарной недостаточности (ХПН) плод испытывает гипоксию и дефицит питательных веществ.
Неонатальная заболеваемость, обусловленная ХПН, зависит от сроков развития плацентарной дисфункции, а также от своевременности родоразрешения. Состояние сердечно-сосудистой системы и недостаточное развитие других органов и систем плода при ЗРП на момент родоразрешения – это основной фактор, способствующий неблагоприятным постнатальным последствиям [1, 2, 3].
Перинатальное повреждение головного мозга считается одной из основных причин смерти и инвалидности у детей раннего возраста. Отсутствие достаточного количества кислорода и питательных веществ при плацентарной недостаточности может привести не только к задержке роста, но и гипоксии плода. Гипоксия же, в свою очередь, сопровождается повреждением клеток мозга и нарушением его развития. Следствием этого могут стать такие осложнения, как перинатальная асфиксия, церебральный паралич и т.д. Кроме того, среди выживших новорожденных отмечается увеличение распространенности неврологических, поведенческих и психиатрических проблем в более позднем возрасте. Недавние достижения в области акушерства, репродуктивной медицины и интенсивной терапии новорожденных привели к значительному повышению показателей выживаемости недоношенных детей, а также новорожденных, перенесших асфиксию. Акцент исследований в настоящее время сместился с изучения факторов, вызывающих последствия для функционирования мозга в постнатальном периоде, на изучение возможностей диагностики и профилактики данных осложнений. Этиология повреждения головного мозга плода является многофакторной, поражение ЦНС может развиваться не только вследствие плацентарной недостаточности, но и внутриутробной инфекции. Определенную роль играют и генетические факторы, являющиеся важными предикторами неблагоприятного неврологического исхода [4, 5].
Детский церебральный паралич (ДЦП) – термин, объединяющий группу хронических непрогрессирующих симптомокомплексов двигательных нарушений, вторичных по отношению к поражениям или аномалиям головного мозга, возникающим в перинатальном периоде. Согласно европейским данным, средняя частота ДЦП составляет 2,08 на 1000 живорожденных, показатель которой в группе детей, родившихся с низкой массой тела, в 70 раз выше, чем у детей с нормальной массой тела при рождении. Считается, что значительная часть ДЦП связана с осложнениями антенатального периода. Аномалии пуповины и плаценты сопровождаются увеличением риска неблагоприятных исходов для новорожденных. Однако в настоящее время остается невыясненным, несут ли эти состояния повышенный риск развития ДЦП [6, 7]. Повреждение развивающегося мозга до, во время или сразу после родов влияет как на неврологическую, так и на опорно-двигательную системы организма, вызывая аномальное сокращение мышц, постуральные изменения, ограничение движений и активности, которые сопровождаются сенсорными нарушениями наряду с расстройствами восприятия, когнитивными проблемами, неспособностью общаться, поведенческими проблемами, эпилепсией и вторичными проблемами опорно-двигательного аппарата [8, 9].
На данном этапе не существует методов лечения ХПН, которые имеют доказательную базу. В связи с этим ЗРП сопряжена с риском преждевременных родов, что, в свою очередь, ухудшает перинатальные исходы, поскольку недоношенность сопровождается функциональной незрелостью всех органов и систем. Частота неблагоприятных исходов, в том числе и патологии развития нервной системы, обратно пропорциональна сроку, на котором потребовалось родоразрешение [10, 11].
Цель исследования. Анализ современных методов ранней диагностики поражений ЦНС плода в антенатальном периоде.
Материалы и методы исследования. В исследовании использованы информационные базы: PubMed, PubMed Central, Scopus, MEDLINE, ScienceDirect, Cochrane Library, eLibrary за период с 2014 г. до ноября 2023 г. По указанным ключевым словам: «плацентарная недостаточность»/«placental insufficiency», «магнитно-резонансная томография»/«magnetic resonance imaging», «нейросонография плода»/«neurosonography», «ультразвуковая допплерография»/«ultrasound dopplerometry», «поражения головного мозга плода»/«brain damage» в поисковых системах обнаружено 1473 статьи, посвященные проблемам диагностики поражений ЦНС плода в антенатальном периоде. После исключения дублирующей информации (852) и литературных источников, датированных ранее 2014 года (574), заявленной проблеме соответствовало 47 публикаций.
Возможности магнитно-резонансной томографии в ранней диагностике поражений ЦНС плода в антенатальном периоде
Магнитно-резонансная томография (МРТ), которая впервые проведена в 1983 году, всё чаще используется в мире для диагностики врождённых аномалий развития у плода и особенно ЦНС. Данный способ исследования основан на измерении электромагнитного отклика атомных ядер, находящихся в сильном постоянном магнитном поле, в ответ на возбуждение их определённым сочетанием электромагнитных волн. В МРТ такими ядрами являются ядра атомов водорода, присутствующие в огромном количестве в человеческом теле в составе воды и других веществ [12]. Достоинствами МРТ считается безопасность, в том числе и для плода, возможность многоплоскостного сканирования, высокое качество изображения мягких тканей. Отрицательная сторона МРТ – это невозможность проведения исследования при наличии металлических магнитных имплантов в теле пациента [13, 14].
В настоящее время цель МРТ во время беременности – уточнение результатов экспертного ультразвукового исследования, а также получение некоторого объема дополнительной информации. Следует отметить, что МРТ не используется в качестве инструмента первичного скрининга в антенатальном периоде, хотя стандартизированная оценка анатомии плода возможна. Тем не менее, в отдельных случаях (например, при наличии аномалий головного мозга у родственников первой степени родства) МРТ плода может рассматриваться в качестве основного метода, позволяющего своевременно выявить патологию, несмотря на нормальную ультразвуковую картину, предшествовавшую проведению МРТ [15, 16].
МРТ плода может быть выполнена при напряженности поля 1,5 Тл и 3,0 Тл, которые отражают мощность томографа. Мощность МРТ томографа – величина постоянного магнитного поля, измеряемая в Теслах (Тл) согласно Международной системе. Чем выше напряженность магнитного поля, тем более четкое изображение получается на выходе. Таким образом, визуализация головного мозга плода при 3,0 Тл может обеспечить более высокое разрешение и лучшее качество визуализации при одновременном снижении поглощения электромагнитной энергии человеческим телом и может служить эффективным средством визуализации мозга, тела и сосудов плода [17].
Известно, что хроническая гипоксия может быть следствием аномального развития нервной системы плода и предиктором когнитивных нарушений, развивающихся впоследствии. Уровень оксигенации крови головного мозга плода представляет собой важный физиологический параметр, позволяющий выявить группу риска повреждения головного мозга. В недавних работах, посвященных изучению возможностей количественной МРТ в измерении уровня оксигенации крови у плода, использовали оценку скорости поперечной релаксации (T2), а также исследование парамагнитной природы дезоксигемоглобина (dHb) с помощью магнитно-резонансной (МР) спектрометрии. Скорость поперечной релаксации (T2) – это время релаксации после 90° радиочастотного импульса. С помощью специальных приборов можно зарегистрировать сигналы (резонансное излучение) от релаксирующих протонов, и на их анализе построить представление об исследуемом объекте. МР-спектрометрия – это методика проведения исследования на магнитно-резонансном томографе, которая дает возможность определять биохимические изменения тканей при развитии различных заболеваний. Первый метод был успешно применен в магистральных сосудах сердца плодов в III триместре беременности. Он был восприимчив к неоднородностям радиочастотного поля, особенно при напряженности поля равной 3,0 Тл. МР-спектрометрия измеряет магнитную восприимчивость крови, которая связана с количеством присутствующего дезоксигемоглобина [18, 19]. Следовательно, на основании МР-спектрометрии, позволяющей оценить уровень оксигенации крови, можно спрогнозировать развитие гипоксически-ишемической энцефалопатии у плода. В условиях длительной гипоксии происходит перераспределение кровотока в церебральных артериях в сторону его уменьшения в корковых областях головного мозга. Формируется так называемый «гипоксический стресс» с выбросом адреналина и норадреналина, а также других соответствующих гормонов и нейромедиаторов, что приводит к более выраженному перераспределению кровотока в сторону жизненно важных органов со значительным повышением сопротивления в периферических органах и системах [20].
Исследования Westby A. и Miller L. (2021) продемонстрировали уменьшение окружности головы (ОГ) плода в сочетании со снижением объема серого вещества его головного мозга, которое в дальнейшем приводит к снижению процессов восприятия, познания, способности к концентрации внимания и ухудшению памяти у детей. Имеются данные и о том, что у новорожденных с ЗРП наблюдаются снижение миелинизации и уменьшение объема белого вещества задних отделов головного мозга, подтверждённое МРТ-исследованиями. Примечательно, как дефицит общего объема мозга и, в частности, белого вещества лежит в основе снижения intelligence quotient (IQ) и когнитивных нарушений у детей с задержкой развития [21, 22].
В свою очередь, Neumane S. et al. (2022) утверждают, что возможно широкое применение МРТ для оценки влияния преждевременных родов на развитие головного мозга. Как известно, ХПН сопряжена с риском преждевременных родов, в том числе и спонтанных. Даже при отсутствии очаговых поражений головного мозга недоношенность сопровождается нарушениями роста мозга. В частности, белое вещество головного мозга недоношенных новорожденных в эквивалентном доношенному сроку возрасте имеет более «незрелый» микроструктурный профиль по сравнению с доношенными новорожденными, что согласуется с задержкой или нарушением развития и созревания белого вещества. Степень выраженности ранних аномалий белого вещества (даже при отсутствии явного поражения головного мозга) напрямую связана с худшим исходом развития нервной системы. Недоношенные дети также подвержены более высокому риску нарушения нейромоторной функции, что может проявляться в недостаточном развитии навыков мелкой и крупной моторики по сравнению с детьми, рожденными в срок [23].
Несмотря на то, что МРТ во время беременности долгое время использовалась для диагностики патологии со стороны плода, в последние годы её применение для визуализации плаценты значительно возросло. В дополнение к возможностям оценки функции, МРТ с широким полем зрения и высоким контрастным разрешением позволяет охарактеризовать анатомию плаценты [24]. Развитие плаценты и головного мозга плода тесно связаны между собой. Плацентарная недостаточность сопряжена с неблагоприятными неонатальными исходами и влияет на развитие нервной системы. Т2-взвешенная МРТ характеризует намагничивание тканей поперек статического магнитного поля и является простым, но полезным методом оценки функции плаценты [25]. Исследования Hutter J. et al. (2023) показали, что снижение плацентарного Т2 (время релаксации плаценты после 90° радиочастотного импульса.) характерно для беременности, осложнённой преэклампсией и ранней ЗРП. Полученные результаты ученых дали основания предположить, что значения плацентарного Т2 имеют прогностическую ценность в рамках оценки вероятности низкой массы тела плода при рождении в сравнении с оценкой пульсационного индекса маточных артерий [26].
Авторы другого современного исследования, Hansen D.N. et al. (2022), также доказали чувствительность метода Т2–взвешенной МРТ в диагностике изменений морфологии плаценты и уровня оксигенации, свидетельствующего о развитии ХПН. Т2-взвешенная МРТ – это метод образования изображений с использованием МРТ, при котором сигнал от тканей с различной скоростью релаксации по Т2 взвешивается, чтобы создать изображение с лучшим контрастом между различными типами тканей. Предыдущие работы этих авторов продемонстрировали, что плацента при ЗРП и преэклампсии характеризуется низкими значениями плацентарного Т2-звена (времени релаксации плаценты после 90° радиочастотного импульса.), что свидетельствует о низкой плотности протонов, как при кальцинозе или фиброзе плаценты [27].
Таким образом, результаты исследований значительного числа ученых доказали перспективность использования МРТ в клинической практике и необходимость усовершенствования существующих методов измерения [28]. Белое вещество и проводящие пути головного мозга плода развиваются во втором-третьем триместре беременности в быстром, но отчетливом иерархическом порядке. Структура и целостность этих связей белого вещества играют неотъемлемую роль в поддержании эффективности и координации функциональных сетей. Современное понимание этих процессов в значительной степени опирается на посмертные данные. В настоящее время МРТ плода может зафиксировать развитие всего мозга в его живом функционирующем состоянии, тем самым предоставляя важную дополнительную информацию об интенсивности его роста [29]. Несмотря на высокую стоимость данного метода исследования, существует необходимость его внедрения с целью выявления патологических состояний плаценты и ЦНС плода у пациенток группы риска с целью улучшения перинатальных исходов. Своевременное выявление при помощи МРТ аномалий плаценты и головного мозга плода способствуют правильной маршрутизации беременной и привлечению необходимых узких специалистов для оказания квалифицированной медицинской помощи.
Возможности нейросонографии в ранней диагностике поражений ЦНС плода в антенатальном периоде
Нейросонография (НСГ) считается перспективным методом пренатальной диагностики, позволяющим путем ультразвуковой визуализации оценить состояние нервной системы плода. Головной мозг является трехмерной структурой, поэтому наблюдение за его морфологией в трех основных плоскостях (сагиттальной, фронтальной и осевой) обязательно. Передний родничок и сагиттальный шов могут служить акустическими ультразвуковыми окнами при трансвагинальном сканировании головного мозга, позволяя получать изображения внутричерепных структур с высоким разрешением. В свою очередь, 3D-допплерография позволяет визуализировать внутримозговую васкуляризацию, что дает возможность получить более точную информацию о церебральной перфузии головного мозга плода [30, 31].
НСГ повышает точность диагностики врожденных аномалий развития головного мозга, оценивает динамику ишемических и травматических внутричерепных повреждений у плодов и новорожденных. Кроме того, в современной НСГ применяется 22-многоплоскостная методика осмотра головного мозга. Для сканирования используется ряд различных плоскостей, применение которых варьирует в зависимости от особенностей расположения плода [32].
Длительное течение гипоксии вызывает кислородное голодание, что связано с нарушением функции нейронов головного мозга. Ишемия – общее или очаговое ограничение кровоснабжения тканей, которое вызывает некроз, и значится гораздо более сложным событием, чем гипоксия, поскольку она сопровождается снижением объёма циркулирующей крови и ограничением интенсивности выведения продуктов метаболизма головного мозга [33, 34]. Морфологические изменения, связанные с гипоксически-ишемическим поражением мозга плода, могут проявляться: множественными кровоизлияниями в различные отделы головного мозга, отёком, повреждением эндотелия, некрозами серого и белого вещества, инфарктами, глиозом белого вещества, атрофией, кистами различной локализации, задержкой миелинизации, вентрикуломегалией, гидроцефалией и врожденными пороками развития [35].
Исследования Abdelkader M.A. et al. (2017) наглядно продемонстрировали, что, благодаря пренатальному проведению НСГ в группе риска по развитию внутримозгового кровоизлияния у плода, у 21 плода было диагностировано внутримозговое кровоизлияние, у 2 – экстрацеребральное (субдуральное) кровоизлияние, у 16 – внутримозговое (внутрижелудочковое) кровоизлияние, у 3 – комбинированное кровоизлияние. Средний гестационный возраст, в котором им был поставлен диагноз, составлял 29,8 ± 5,2 недели. Обращает внимание, что в 76% случаев не имелось идентифицируемых факторов риска. ЗРП при этом была ассоциирована с 57,9% внутримозговых кровоизлияний, что составило больше половины от всех случаев [35, 36].
На данном этапе перинатальные и ранние постнатальные исходы внутричерепного кровоизлияния, диагностированного у плода, изучены недостаточно. Авторы Gupta V. et al. (2023) провели исследование, согласно которому живорождением закончились 75% случаев внутримозгового кровоизлияния, выявленного внутриутробно, прерыванием беременности по медицинским показаниям – 14%, антенатальной гибелью плода – 11%. Обращает на себя внимание, что наличие обширных кровоизлияний сопровождается снижением частоты живорождений до 33%. Проспективное клиническое наблюдение до двухлетнего возраста 37 младенцев, у которых внутриутробно было диагностировано внутримозгового кровоизлияния, показало, что у 57% наблюдалось нормальное развитие нервной системы, у 24% – легкие отклонения от нормы, у 14% – умеренные отклонения, у 5% – выраженные нарушения развития нервной системы [37].
В настоящее время появляется всё больше доказательств того, что преэклампсия приводит к нарушениям развития нервной системы у плода, которые впоследствии проявляются умственной отсталостью, синдромом дефицита внимания и гиперактивности, аутизмом, эпилепсией и другими когнитивными нарушениями. У плодов с ЗРП также наблюдаются изменения в развитии коры головного мозга, мозолистого тела, размера ствола мозга и мозжечка, а также метаболизма мозга, которые в дальнейшем связаны с аномальным развитием нервной системы. Исследования Basso A. et al. (2022) продемонстрировали, что при ЗРП наблюдаются значительные различия в развитии коры головного мозга в сравнении с нормой по результатам НСГ у плода, проведённой на сроке 31-35 недель гестации, которые проявляются уменьшением глубины сильвиевой борозды и увеличением глубины островковой доли. Интересно, что аналогичная картина развития коры головного мозга наблюдалась при беременности, осложнённой преэклампсией: отмечается уменьшение глубины сильвиевой борозды и увеличение глубины островковой доли. Существенных различий в глубине теменно-затылочной борозды, поясной извилины или пяточной борозды в указанных группах выявлено не было [38, 39].
При оценке особенностей развития ЦНС у маловесных плодов для срока гестации и плодов с ЗРП в сравнении с группой контроля (с учетом поправки на бипариетальный размер) отмечаются: увеличение глубины островков, линейная тенденция к уменьшению глубины сильвиевой борозды. Обращает на себя внимание тот факт, что данные показатели не отличались статистически значимо между маловесными плодами для срока гестации и плодами с ЗРП. Единственным параметром, позволяющим с высокой долей достоверности идентифицировать маловесный плод от плода с задержкой роста, оказалась длина мозолистого тела, которая была значительно ниже при ЗРП в сравнении как с группой контроля, так и со случаями маловесности плода. Длина мозолистого тела у маловесных плодов была сопоставима с группой контроля. Различий в глубине теменно-затылочной борозды между тремя исследуемыми группами выявлено не было [40, 41, 42]. Приведенные сведения позволяют заключить, что указанные параметры могут быть использованы в качестве дополнительных критериев диагностики не только ЗРП, но и плацентарной недостаточности. Кроме того, следует рассмотреть возможность применения комплексного анализа вышеназванных характеристик для прогнозирования неблагоприятных антенатальных исходов.
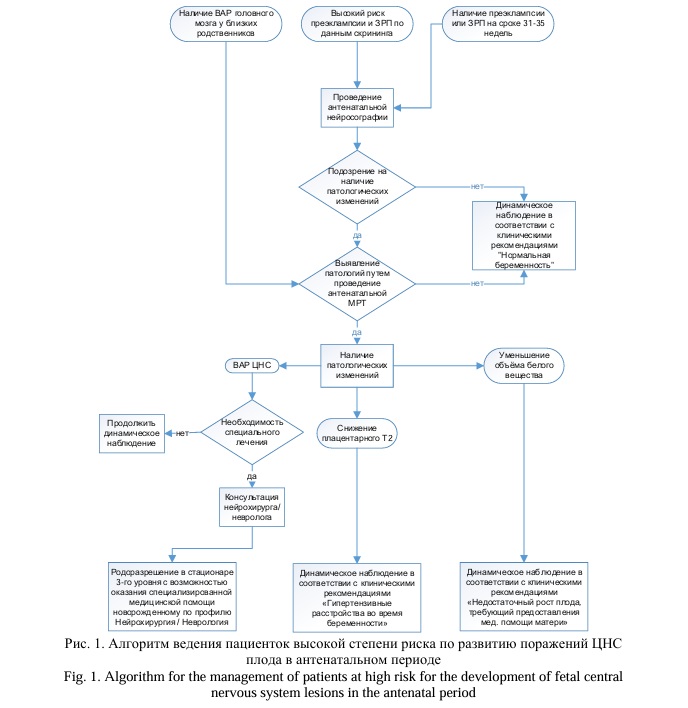
Таким образом, можно сделать вывод, что МРТ и НСГ – это взаимодополняющие методы диагностики. Как показано на рисунке 1, совместное применение НСГ и МРТ поможет оптимизировать диагностику антенатальных повреждений ЦНС и тактику ведениях таких пациенток.
Возможности ультразвуковой допплерографии в ранней диагностике поражений ЦНС плода в антенатальном периоде
Ультразвуковая допплерография (УЗДГ) широко применяется в акушерстве с целью оценки маточно-плацентарного и плодово-плацентарного кровотока. Исследования Sirico A. et al. (2018) продемонстрировали, что показатели церебро-плацентарного отношения (ЦПО), т.е. отношения индекса резистентности в средней мозговой артерии к индексу резистентности в артерии пуповины, в значительной степени коррелируют с патологическим типом кардиотокографии (КТГ) и оценкой состояния новорожденного по шкале Апгар на 5 минуте жизни менее 7 баллов. Также в данном исследовании было показано, что более низкие значения ЦПО наблюдались у плодов с ЗРП в сравнении с маловесными плодами и плодами, размеры которых соответствуют гестационному возрасту [43]. В свою очередь Ismail A. et al. (2022) определили, что значения ЦПО относительно постоянны в течение последних 10 недель течения нормальной беременности. В данном исследовании было установлено, что значение ЦПО ниже 1,08 считается аномальным и сопряжено с неблагоприятными перинатальными исходами (экстренное кесарево сечение, госпитализация новорожденного в отделение реанимации и интенсивной терапии). Первостепенное значение имеет правильное определение значений пульсационного индекса (PI) средней мозговой артерии (СМА) и PI маточных артерий как нормальных, так и патологических, поскольку эти параметры отражают наличие плацентарной недостаточности [44].
Беременность, протекающая на фоне ЗРП, сопряжена с высоким риском краткосрочных и долгосрочных осложнений для новорожденного. Исследования ряда авторов продемонстрировали, что PI маточных артерий был выше в группе беременных с ЗРП, в то время как PI СМА и ЦПО были ниже, что является статистически значимым результатом. В свою очередь, низкие показатели ЦПО (менее 10-го процентиля) ассоциировались с повышенным риском неблагоприятного перинатального исхода, наличием маркеров перинатальной гипоксии (рН пуповинной артериальной или венозной пуповинной крови ≤7 и ≤7,1 соответственно, оценка по шкале Апгар менее 7 баллов на пятой минуте жизни или госпитализация в отделение интенсивной терапии новорожденных на период времени более 24 часов), кесаревым сечением при предполагаемом ухудшении состояния плода и рождением новорожденных с массой тела менее третьего процентиля. Многофакторный регрессионный анализ показал, что PI маточных артерий (p = 0,04) и ЦПО (p = 0,002) коррелируют с вероятностью развития неблагоприятного перинатального исхода. Однако следует особо отметить низкую диагностическую значимость указанных параметров, что напрямую указывает на необходимость комплексной оценки состояния плода у матерей с хронической плацентарной недостаточностью [45, 46]. Между тем, показатели кровотока в маточных артериях соотносятся с плацентарной функцией, поэтому плацентарная недостаточность, даже субклиническая, может быть заподозрена достаточно рано. Патология развития плаценты, характерная для преэклампсии и ЗРП, определяет наличие недостаточности маточно-плацентарного кровотока вследствие отсутствия трансформации спиральных артерий. Исследования, проведенные в последние десятилетия, подтвердили повышение сопротивления кровотока в маточных артериях у пациенток, у которых впоследствии развилась преэклампсия или ЗРП. PI маточных артерий более 95 процентиля коррелирует с вероятностью развития преэклампсии и ЗРП как во втором, так и в третьем триместре [47]. Как известно, преэклампсия может стать причиной тяжёлых осложнений не только у плода, но и у матери. Своевременное выявление преэклампсии и ЗРП поможет впоследствии избежать неблагоприятных исходов как для матери, так и для плода.
Заключение. С позиций реализации потребностей современной перинатальной медицины магнитно-резонансная томография имеет перспективы для активного внедрения в клиническую практику, несмотря на экономическую затратность метода. При помощи МРТ возможно провести не только оценку состояния ЦНС плода, но и получить представления о состоянии плаценты.
Данный метод исследования позволит по-новому взглянуть на проблему хронической плацентарной недостаточности и более качественно оценить степень влияния плацентарных нарушений на плод. Нейросонография, в свою очередь, является более доступным методом диагностики патологии ЦНС плода, который тоже имеет высокую чувствительность в рамках внутриутробной диагностики ишемически-гипоксического повреждения головного мозга. Следовательно, НСГ в перспективе может стать скрининговым методом. Внедрение совместного применения МРТ и НСГ, на наш взгляд, позволит не только своевременно диагностировать хроническую плацентарную недостаточность, но и повысить точность прогноза перинатальных поражений ЦНС у детей от матерей с плацентарными нарушениями [48]. Оценка показателей УЗДГ, в свою очередь, отличается низкой диагностической ценностью в прогнозировании неблагоприятных перинатальных исходов. Следовательно, допплерография зачастую используется в качестве метода, позволяющего выделить группу риска угрожаемых по развитию перинатального поражения ЦНС.





















Список литературы