Ассоциация полиморфного локуса rs4880 гена супероксиддисмутазы 2 (SOD2) с синдромом поликистозных яичников: мета-анализ
Aннотация
Актуальность: По данным ВОЗ примерно 8-13% женщин репродуктивного возраста страдают синдромом поликистозных яичников (СПКЯ), при этом до 70% женщин во всем мире с СПКЯ остаются не диагностированными. СПКЯ является наиболее распространенной причиной ановуляции и основной причиной бесплодия. Для СПКЯ характерны окислительный стресс и снижение антиоксидантного статуса. Активность антиоксидантных ферментов генетически детерминирована и зависит от наличия полиморфных аллелей. Показано, что полиморфный вариант Ala16Val гена SOD2 может приводить к истощению фермента и быть ассоциированным с риском развития СПКЯ. В литературе присутствуют противоречивые данные об ассоциации полиморфного локуса rs4880 гена SOD2 с СПКЯ. Цель исследования:Исследовать ассоциацию полиморфного локуса Val16Ala гена митохондриальной супероксиддисмутазы (SOD2) с синдромом поликистоза яичников по протоколу проведения систематических обзоров и мета-анализов PRISMA в исследованиях «случай-контроль». Материалы и методы Проведен всесторонний поиск по электронным базам данных, включая PubMed, eLibrary, Science Direct, Google Scholar, EMBASE, Scopus и Кокрановскую библиотеку исследований, опубликованных до декабря 2022 года и посвященных поиску ассоциаций между полиморфизмом rs4880 в гене SOD2 и СПКЯ. Поиск проводился по следующим ключевым словам: «Синдром поликистозных яичников» или «СПКЯ», «супероксиддисмутаза 2» или «SOD2» или «MnSOD», «полиморфизм» или «SNP» или «вариант» или «rs4880» или Ala16Val или C47T на английском, арабском и русском языках. Из 95 релевантных публикаций критериям соответствовали 6 подходящих исследований «случай-контроль» с 1606 случаями СПКЯ и 1333 контролями для включения в данный мета-анализ. Большинство отобранных исследований были проведены в Западной Азии. Мета-анализ проводился в соответствии с протоколом PRISMA и использованием Review Manager версии 5.4. Результаты:Показано, что наличие, по крайней мере, одной копии T-аллеля в полиморфном локусе rs4880 у пациентов с СПКЯ увеличивает риск развития синдрома в трех генетических моделях: доминантной, аллельной и гетерозиготной. Заключение:Результаты мета-анализа демонстрируют, что полиморфизм rs4880 гена SOD2 может быть фактором риска развития СПКЯ, и предполагается, что аллель Val может повышать риск развития СПКЯ
Введение. Синдром поликистозных яичников (СПКЯ) – одно из самых распространенных патологических состояний среди женщин репродуктивного возраста: По данным ВОЗ примерно 8-13% женщин репродуктивного возраста страдают синдромом поликистозных яичников (СПКЯ), при этом до 70% женщин во всем мире с СПКЯ остаются недиагностированными. СПКЯ является наиболее распространенной причиной ановуляции и основной причиной бесплодия [1, 2]. СПКЯ – хроническое системное заболевание со многими гетерогенными клиническими проявлениями, наиболее распространенными из которых являются гирсутизм, гиперандрогения, хронические нарушения менструального цикла или овуляции и морфология поликистозных яичников [3, 4]. Показано, что в 40% случаев СПКЯ приводит к бесплодию [5]. Это часто связано с метаболическими нарушениями, такими как дислипидемия [6], нарушение толерантности к глюкозе и резистентности к инсулину [7], что, в свою очередь, приводит к развитию ожирения, диабета 2 типа [8, 9], сердечно-сосудистым заболеваниям, раку эндометрия [10, 11] и метаболическим нарушениям [12], которые действуют синергически. Вариабельность клинических проявлений СПКЯ обусловливает наличие значительных трудностей при постановке диагноза. Появляется все больше доказательств того, что в патогенезе участвуют хроническое воспаление и окислительный стресс [13, 14]. Недавно было обнаружено, что окислительный стресс и хроническое воспаление низкой степени активности сопровождаются снижением антиоксидантной способности у пациенток с СПКЯ [3, 15]. В то же время активные формы кислорода играют важную физиологическую роль в процессах женской репродукции, таких как оогенез, фолликулогенез, стероидогенез, эмбриональное развитие и беременность [16]. Избыточные уровни активных форм кислорода обладают достаточно разрушительным эффектом. Окислительный стресс изменяет овариальный стероидогенез в сторону увеличения выработки андрогенов, что приводит к атрезии фолликулов. Кроме того, это состояние сильно ассоциировано с хроническим воспалением. Таким образом, окислительный стресс может повлиять на созревание яйцеклеток и исход беременности [17]. СПКЯ имеет сложную этиологию, вызванную сочетанием генетических, эпигенетических факторов и факторов окружающей среды. Высокая интенсивность хронического воспаления и ассоциированная с ним повышенная интенсивность свободно-радикальных процессов влияют на развитие СПКЯ [13, 18, 19]. При изучении патогенеза СПКЯ появляется все больше информации о повреждающем влиянии окислительного стресса на антиоксидантные свойства организма [20]. Биомаркеры окислительного стресса значительно повышены в сыворотке крови и фолликулярной жидкости, а общий уровень антиоксидантов в сыворотке крови снижен у женщин с СПКЯ, по сравнению со здоровыми женщинами [21, 22, 23]. Среди различных детерминант СПКЯ, ассоциированных с окислительным стрессом, важнейшая роль отводится генетическим факторам: полиморфизму генов, регулирующих окислительный стресс, и эпигенетической регуляции.
Супероксиддисмутаза 2 (SOD2) является митохондриальной изоформой SOD, или марганцевой SOD (MnSOD), которая является ведущим антиоксидантным ферментом в митохондриях и находится во всех клетках, потребляющих кислород. SOD2 детоксицирует супероксидные анион-радикалы (O2-), превращая их в перекись водорода (H2O2), которая затем восстанавливается каталазой (CAT) и глутатионпероксидазами (GPx) до воды [24]. По данным геномного браузера UCSC [25], структурная организация гена SOD2 представлена пятью экзонами, расположенными на хромосоме 6q25.3. По данным проекта GTEx, экспрессия гена демонстрируется в 54 тканях человека. Суммарное медианное количество транскриптов на миллион пар оснований (TPM) – 3058. Наибольшее медианное значение отмечается в скелетной мышечной ткани – 496.1 TPM [26]. Было показано, что наличие полиморфизмов в гене SOD2 ассоциировано с наличием ряда многофакторных заболеваний, таких как сердечно-сосудистые заболевания, диабет и его осложнения, ожирение, рак простаты и рак молочной железы [27-30]. SOD2 является важным ферментом, который играет центральную роль в ответе на окислительный стресс. Полиморфный локус rs4880 (Ala16Val или C47T) гена SOD2, приводит к замене аланина на валин, что приводит к накоплению супероксида в митохондриальном матриксе и, соответственно, большей выраженности окислительных повреждений мтДНК [31]. Ранее ассоциация полиморфизма rs4880 гена SOD2 c СПКЯ была изучена в различных популяциях мира [13, 24, 32-35], однако результаты остаются противоречивыми.
Цель исследования. Исследовать ассоциацию полиморфного локуса Val16Ala гена митохондриальной супероксиддисмутазы (SOD2) с синдромом поликистоза яичников по протоколу проведения систематических обзоров и мета-анализов PRISMA в исследованиях «случай-контроль».
Материалы и методы исследования
Стратегия поиска исследований
В течение декабря 2022 года мы систематически проводили всесторонний поиск по электронным базам данных, включая PubMed, eLibrary, Science Direct, Google Scholar, EMBASE, Scopus и Кокрановскую библиотеку исследований, выявив значимые ассоциации между полиморфизмом rs4880 в гене SOD2 и СПКЯ. Поиск проводился по следующим ключевым словам: "Синдром поликистозных яичников" или "СПКЯ", "супероксиддисмутаза 2" или "SOD2" или "MnSOD", "полиморфизм" или "SNP" или "вариант" или "rs4880" или Ala16Val или C47T на английском, арабском и русском языках. Также был проведен ручной поиск в списке литературы для выявления других потенциальных публикаций. Данный систематический обзор был проведен в соответствии с основными требованиями к систематическим обзорам и мета-анализам PRISMA [36].
Критерии включения и исключения
Отбор работ для мета-анализа проводился в соответствии со следующими критериями: (i) исследования с дизайном «случай-контроль»; (ii) исследования, в которых оценивалась ассоциация локуса rs4880 (Ala16Val или C47T) гена SOD2 с СПКЯ; (iii) оригинальные исследования с генотипическими данными для расчета отношения шансов (ОШ) и 95% доверительного интервала (ДИ). Критерии исключения: (i) исследования, в которых не рассматривалась ассоциация rs4880 с СПКЯ; (ii) повторяющиеся публикации; (iii) рефераты, мета-анализы или обзорные статьи;
Отбор исследований
Извлечение данных из оригинальных публикаций и их методологическая оценка были проведены тремя исследователями независимо друг от друга. Для каждого исследования были определены следующие основные характеристики: (i) имя первого автора; (ii) год публикации; (iii) место проведения исследования; (iv) количество участников в экспериментальной и контрольной группах; (v) методы генотипирования; (vi) генотипические и аллельные распределения (Табл. 1).
Статистический анализ
Для каждого исследования в контрольных группах соблюдалось уравнение Харди–Вайнберга (HWE). Для проведения мета-анализа использовали программное обеспечение Review Manager версии 5.4 [37]. Величина ассоциации между полиморфизмом rs4880 гена SOD2 и риском СПКЯ оценивалась с использованием критерия отношения шансов (ОШ) с 95% доверительным интервалом (ДИ). Изучалась общая ассоциация в рамках доминантной модели (CC + CT против TT), рецессивной модели (ТТ против ТС + СС), аллельной модели (С против Т), гомозиготной модели (CC против TT) и гетерозиготной модели (CT против TT). Важность комбинированного ОШ оценивалась с использованием Z-значений, а p-значение <0,05 было установлено статистически значимым.
Статистическая неоднородность между исследованиями оценивалась с помощью Q-критерия на основе хи-квадрат и статистики I2. Если I2 превышал 50%, неоднородность считалась высокой, и для объединения ОШ использовалась модель случайного эффекта. В противном случае, если I2 составлял менее 50%, использовалась модель с фиксированным эффектом.
Результаты
Характеристика включенных исследований
В результате поиска литературы было отобрано в общей сложности 95 релевантных публикаций. После исключения повторяющихся и нерелевантных публикаций, в мета-анализ были включены 6 оригинальных работ, исследующих ассоциацию rs4880 гена SOD2 с СПКЯ (Рис. 1). Большинство отобранных исследований было проведено на популяциях, проживающих в Турции, Иране, Саудовской Аравии [32-35]. Две работы были проведены на китайской и словенской популяциях [13, 24]. Отобранные исследования и их основные характеристики представлены в таблице 1.
Результат мета-анализа
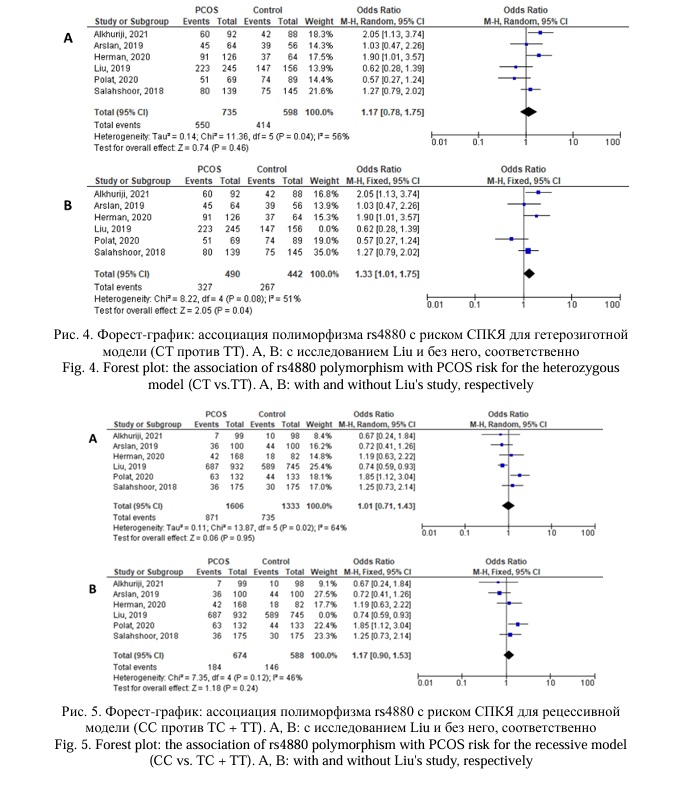
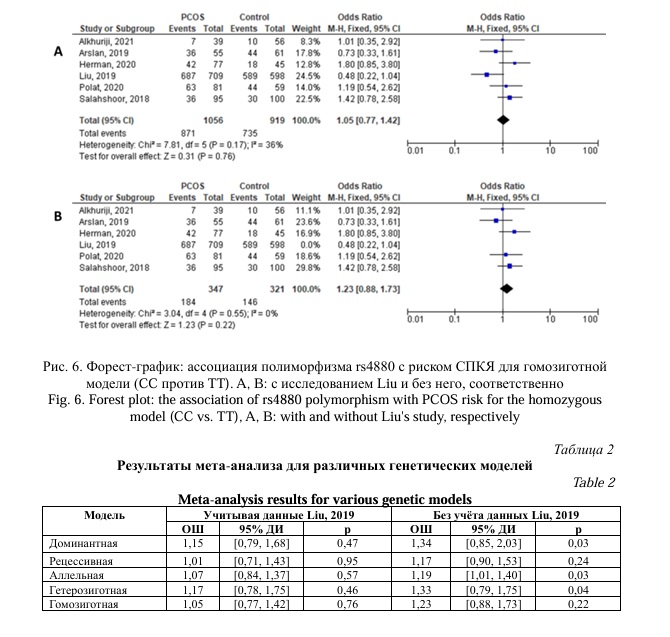
Данный мета-анализ был основан на 6 исследованиях, посвященных поиску ассоциаций полиморфного локуса rs4880 гена SOD2 c СПКЯ, которые были опубликованы в период с 2018 по 2021 год. В общей сложности 1606 случая и 1333 контрольных исследований были оценены для поиска ассоциации между полиморфизмом rs4880 гена SOD2 и СПКЯ. Аллель Т рассматривался как аллель риска. Мета-анализ продемонстрировал, что отсутствует статистически значимая ассоциация, как показано на рисунках 2, 3, 4, 5, 6 и таблице 2. Однако, за исключением исследования [24], которое проводилось на китайской популяции, результаты показали значимую ассоциацию с СПКЯ при трех генетических моделях: доминантной, аллельной и гетерозиготной (p = 0,03, ОШ = 1,34, 95% ДИ 0,85 – 2,03; p = 0,03, ОШ = 1,19, 95% ДИ 1,01 – 1,40; p = 0,04, ОШ = 1,33, 95% ДИ 0,79 – 1,75), соответственно (Рис. 2, 3, 4; Табл. 2). Не было выявлено значимой связи между rs4880 и риском СПКЯ с использованием рецессивной и гомозиготной моделей (p = 0,24, OR = 1,17, 95% ДИ 0,90–1,53; p = 0,22, ОШ = 1,23, 95% ДИ 0,88–1,73), соответственно (Рис. 5, 6; Табл. 2).
Предвзятость публикаций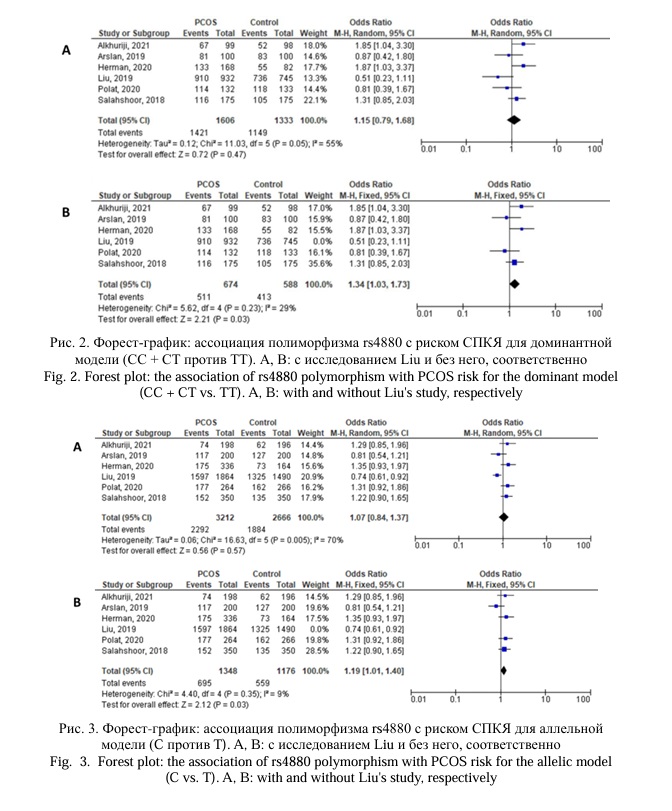
Систематическая ошибка публикации оценивалась с помощью воронкообразных диаграмм (Рис. 7). Они не показали явной асимметрии, и это указывает на отсутствие предвзятости публикаций, отобранных для данного мета-анализа.
Обсуждение. Полиморфный локус Ala9Val (47C>T) гена SOD2 изменяет последовательность, кодирующую сигнальный N-концевой пептид MTS (Matrix Targeting Signal), который направляет фермент в матрикс митохондрий. Установлено, что SOD2, содержащий Ala в сигнальном пептиде, на 30-40% эффективнее транспортируется в митохондрии, что способствует большей активности фермента. Val–вариант SOD2 обладает меньшей активностью, что обусловливает повышенную продукцию супероксида и других АФК [38].
Распространенность данного полиморфизма значительно варьирует в разных этнических группах. Референсным аллелем является аллель A со средней частотой встречаемости 59% во всех популяциях мира [39]. Однако, у китайских женщин он регистрировался в 89% в контрольной группе, и в 85,7% в группе пациенток с СПКЯ [24]. Мы исключили исследование, проведенное Liu на китайской популяции [24], из-за генетической вариации, которая внесла бы повышенную гетерогенность в данный мета-анализ. Согласно данным 1000 Genome Browser, частота полиморфизма rs4880 гена SOD2 значительно варьирует между популяциями Восточной Азии (12%) и другими популяциями, в том числе Южной и Западной Азии, Европы, Африки и Америки, где она составляет от 41% до 58%. Такое различие в частоте аллелей наблюдалось в исследованиях, включенных в данный мета-анализ. Включение исследований из различных популяций со значительно отличающимися частотами аллелей может привести к появлению дополнительной вариабельности, что потенциально может привести к необъективным или противоречивым результатам. Мы не включили исследование Liu в данный мета-анализ для сохранения сопоставимости и минимизации неоднородности данных. Проведенный мета–анализ показал снижение гетерогенности и выявил значительную ассоциацию между rs4880 гена SOD2 и развитием СПКЯ в доминантной, аддитивной и гетерозиготной моделях. Эти результаты указывают на то, что наличие, по крайней мере, одной копии аллеля T может быть фактором риска развития СПКЯ.
СПКЯ является наиболее распространенной эндокринопатией, многофакторность которой обусловлена генетическими, эпигенетическими факторами и факторами окружающей среды. Результаты современных исследований прояснили ключевую роль гиперандрогении и инсулинорезистентности в возникновении и прогрессировании СПКЯ [40]. Гиперандрогения и инсулинорезистентность запускают различные сигнальные пути и патологические процессы в организме, способствуя появлению сложного спектра симптомов и признаков, связанных с СПКЯ [11, 41]. При этом важно отметить, что гиперандрогения и инсулинорезистентность демонстрируют синергизм и циклическое взаимодействие. В то же время все большее внимание уделяется влиянию окислительного стресса и последующего хронического воспаления в яичниках пациенток с СПКЯ [15, 16, 42]. Окислительный стресс определяется как нарушение равновесия в системе прооксиданты↔антиоксиданты, сопровождающееся повышенной интенсивностью свободно-радикальных процессов, что приводит к повреждению биологических молекул и клеточных структур. Многочисленные исследования показали, что интенсивность свободно-радикальных процессов значительно повышена у женщин с СПКЯ [43, 44, 45]. Биомаркеры окислительного стресса значительно изменены в сыворотке крови и фолликулярной жидкости женщин с СПКЯ по сравнению с контрольной группой. Окислительный стресс вступает в цикл синергетического эффекта с гиперандрогенизмом и резистентностью к инсулину. Поскольку окислительный стресс может ухудшать основные признаки синдрома, он способен влиять на поглощение глюкозы в таких тканях, как мышцы и жировая ткань, снижая секрецию инсулина. Он также может стимулировать пролиферацию тека-клеток яичников и выработку андрогенов [42]. На структуру и функцию белков, задействованных в регуляции окислительного стресса, может оказывать значимое влияние генетический полиморфизм. Функциональные миссенс-полиморфизмы могут приводить к изменению заряда белковой молекулы, а также могут изменять активность антиоксидантных ферментов, и ферментов, участвующих в стероидогенезе, таких как CYP17A и др.
Митохондрии являются важной структурой, которая продуцирует активные формы кислорода, что способствует развитию окислительного стресса, поскольку дисфункция митохондрий и снижение их способности элиминировать АФК связаны с такими проявлениями СПКЯ, как ожирение, инсулинорезистентность, гиперандрогения, гиперинсулинемия, патологическое развитие фолликулов и хроническое воспаление низкой степени активности [46]. Окислительный стресс в этом состоянии может индуцировать воспалительную среду, которая стимулирует выработку андрогенов яичниками путем стимуляции пролиферации тека-клеток и усиления экспрессии стероидогенных ферментов, таких как CYP11A1, CYP17A1 и 3βHSD. Кроме того, окислительный стресс и провоспалительные цитокины повышают резистентность к инсулину и влияют на сигнальный путь инсулина, что приводит к гиперинсулинемии, стимулируя стероидогенез тека-клеток [6]. Таким образом, накопление АФК, следовательно, способствует нарушению регуляции яичниковых тека-клеток и приводит к гиперандрогении, ановуляции, метаболическим и сердечно-сосудистым последствиям.
SOD2 является основным ферментом в системах антиоксидантной защиты, ключевая роль которого заключается в детоксикации митохондриальных супероксидных анион-радикалов (O2-) до перекиси водорода (H2O2) и далее до H2O с помощью каталазы (CAT) и глютатион пероксидазы (GPx). Полиморфный локус rs4880 (Ala16Val или C47T) в гене SOD2 представляет собой однонуклеотидный полиморфизм, который участвует в замене цитозина на тимин (аланина на валин) в N-концевой митохондриальной последовательности-мишени Matrix Targeting Signal (MTS) [31]. Предполагается, что этот SNP снижает эффективность транспорта SOD2 в матрикс митохондрий из-за образования вторичной β-структуры вместо амфифильных макромолекул с α-спиральной структурой, что приводит к снижению активности SOD на 30-40%. В последнее время в нескольких публикациях исследовали ассоциацию между rs4880 и риском СПКЯ [13, 24, 32-35]. Однако их результаты противоречивы. Аналогично нашим результатам, исследования, проведенные среди популяций Саудовской Аравии и Словении [13, 32], показали, что гомозигота по аллелю Ala чаще встречается у здоровых женщин, в то время как у женщин с СПКЯ значимо чаще регистрируется в генотипе один аллель Val. Среди турецких женщин с СПКЯ носители генотипа ТТ имеют повышенный риск развития синдрома в 2 раза. Этот полиморфный локус гена SOD2 отрицательно ассоциирован с базальным уровнем глюкозы у носителей по крайней мере одной копии аллеля Val среди турецких и словенских пациенток. Однако этот результат противоречит исследованию Liu, которое показало, что высокий риск СПКЯ у китайских женщин связан с аллелем Ala. Этот факт также наблюдается в исследовании Murri и др., которые показали, что у пациенток с СПКЯ средняя активность SOD2 увеличивается в сыворотке на 34%, а активность GPx-1 снижается на 32% по сравнению с контролем [22]. Таким образом, более высокий уровень АФК и активность SOD2 при сниженной способности выводить эти высокотоксичные АФК с помощью GPx-1 или CAT приводила к накоплению Н2О2 и усилению окислительного стресса. В других исследованиях, проведенных на курдских и турецких популяциях, ассоциация между полиморфным локусом rs4880(Ala/Val) и СПКЯ отсутствует. В совокупности накопление высокотоксичных АФК как внутри, так и снаружи митохондрий, со сниженной способностью выводить их с помощью SOD2 и других антиоксидантных ферментов приводит к окислительному стрессу у пациенток с СПКЯ. Таким образом, логично предположить, что rs4880 потенциально ответственен за развитие СПКЯ.
Это исследование имеет некоторые ограничения, которые следует учитывать. Во-первых, относительно ограниченный размер выборки снижал статистическую мощность. Большинство исследований, включенных в данный мета-анализ, были проведены на западноазиатских популяциях. Во-вторых, гетерогенность в общем анализе и анализе между исследованиями, использованном для различных генетических моделей, не была статистически значимой, что, возможно, повлияло на результаты. Наконец, СПКЯ является многофакторным заболеванием, и на ассоциацию полиморфизма rs4880 и СПКЯ может влиять взаимодействие с факторами окружающей среды или другими генами.
Заключение. Наши результаты показывают, что наличие в генотипе аллеля Val полиморфного локуса rs4880 гена SOD2 в гетерозиготном или гомозиготном состоянии может быть фактором риска развития СПКЯ.
Информация о финансировании
Исследование выполнено в рамках гранта Российского научного фонда № РНФ 23-15-00464.





















Список литературы