Ассоциации полиморфизма 786T>C (rs2070744) гена NOS3 с основными соматометрическими показателями и характеристиками сердечно-сосудистой системы в возрастном аспектеу мужчин-северян
Aннотация
Актуальность: Недостаток информации об ассоциации вариантов полиморфизма гена NOS3 с возрастными изменениями основных соматометрических характеристик и системы кровообращения не позволяет составить полной картины возрастных изменений основных показателей сердечно-сосудистой системы у жителей-северян. Цель исследования:Анализ возрастной динамики соматометрических характеристик и показателей сердечно-сосудистой системы у мужчин-северян, а также выявление ассоциаций данных показателей с различными вариантами полиморфизма 786T>C (rs2070744) гена NOS3. Материалы и методы:Исследованная выборка общей численностью 245 человек была разделена на три возрастные группы: юношеского (n=109), зрелого (n=97) и пожилого (n=39) периодов онтогенеза. Проведено генотипирование локуса эндотелиальной синтазы окиси азота (rs2070744) методом ПЦР в режиме реального времени. В каждой возрастной группе были выделены подгруппа 1 (генотипы ТС+СС) и подгруппа 2 (гомозиготы с генотипом ТТ), которые сравнивались по соматометрическим характеристикам и показателям сердечно-сосудистой системы. Результаты:Выявлены прогрессивные изменения показателей массы тела, ИМТ, общего содержания жира в организме в онтогенетическом ряду от юношей к группе пожилых мужчин. Установлено возраст-ассоциированное увеличение систолического, диастолического артериального давления и общего периферического сопротивления сосудов, при уменьшении объёмных характеристик сердечно-сосудистой системы – ударного и минутного объёмов кровообращения. Показано, что наличие аллеля NOS3 *С в генотипе ассоциировано с менее выраженными изменениями массы тела, ИМТ и общего содержания жира в организме. При этом наличие данного аллеля в генотипе можно рассматривать в качестве дополнительного фактора риска возраст-ассоциированных нарушений показателей сердечно-сосудистой системы. Так, только у мужчин пожилого возраста группы 2 (генотипы ТС+СС) выявлена систолическая изолированная гипертензия с вазоконстрикторными проявлениями. Снижение систолического объема крови в возрастном аспекте было обусловлено сочетанным воздействием факторов «возраст» и «генотип». Заключение:Полученные результаты свидетельствуют о наличии ассоциаций полиморфизма 786T>C (rs2070744) гена NOS3 с такими показателями сердечно-сосудистой системы, как систолическое, диастолическое артериальное давление и общее периферическое сопротивление сосудов
Ключевые слова: юноши, мужчины зрелого возраста, мужчины пожилого возраста, антропометрические показатели, сердечно-сосудистая система, полиморфизм 786T>C (rs2070744) гена NOS3
Список сокращений
ССС – сердечно-сосудистая система;
ССЗ – сердечно-сосудистые заболевания;
БСК – болезни системы кровообращения;
АГ – артериальная гипертензия;
eNOS – эндотелиальная синтаза оксида азота;
NO – оксида азота;
ИМТ – индекс массы тела;
ПЦР – полимеразная цепная реакция;
АД – артериальное давление;
САД – систолическое артериальное давление, мм рт. ст.;
ДАД – диастолическое артериальное давление, мм рт. ст.;
ЧСС – частота сердечных сокращений, уд. / мин;
УО – ударный объем, мл;
МОК – минутный объем кровообращения, л/мин;
ОПСС – общее периферическое сопротивление сосудов, дин2 с см-5.
Введение. Отличительной особенностью демографической ситуации современного общества является демографическое старение населения и увеличение доли пожилых людей во всех мировых популяциях человека независимо от экономического развития регионов. Это привело к активизации научного интереса к проблемам изучения детерминант продолжительности жизни и первичных механизмов старения [1]. Одним из перспективных направлений является изучение функционально ослабленных полиморфных вариантов генов, составляющих основу мультифакториальной патологии (ССЗ, ожирение, сахарный диабет 2 типа и т.д.), т.к. именно эти гены связаны с продолжительностью периода активного долголетия. Выявление всей совокупности фундаментальных механизмов старения является научно обоснованной базой для разработки эффективных мер сохранения активного долголетия [2, 3, 4], что достаточно наглядно представлено в Указе Президента Российской Федерации от 18 июня 2024 г. № 529 «Об утверждении приоритетных направлений научно-технологического развития и перечня важнейших наукоемких технологий» одним из которых является – «Превентивная и персонализированная медицина, обеспечение здорового долголетия».
ССС представляет собой сложную систему артерий, капилляров, вен и центрального органа – сердца, которое систематически обеспечивает циркуляцию крови по всему организму. Это критическая система, которая управляет транспортировкой жизненно важных ресурсов и сигналов в различные области организма, при этом изофермент eNOS взаимодействует с сердечно-сосудистой системой, регулируя передачу сигналов и распределение ресурсов [5]. eNOS экспрессируется в эндотелии (единственный слой клеток, образующих выстилку кровеносных сосудов) дисфункция которого, как считается, лежит в основе большинства типов ССЗ [6] и является основным физиологическим источником NO, который рассматривается как вазоактивный метаболит, определяющий регуляцию гомеостаза ССС: модулирует, контролирует и поддерживает сосудистый тонус ССС, ингибирует адгезию и агрегацию тромбоцитов, предотвращает адгезию между лейкоцитами и эндотелиальными клетками, а также сдерживает пролиферацию гладкомышечных клеток [7, 8]. В настоящее время функциональному состоянию эндотелия придаётся большое значение в контексте этиологии, патогенеза и прогрессирования артериальной гипертензии [9, 10]. Функция эндотелия зависит от eNOS, а должным образом функционирующая активность eNOS в эндотелии имеет решающее значение для целостности сосудов и гомеостаза [8, 11]. Полиморфизмы гена NOS3 детерминируют различные функциональные варианты еNOS и могут увеличивать риски развития ССЗ.
Однонуклеотидный полиморфизм (SNP, single nucleotide polymorphism) rs2070744 гена NOS3, расположенный в промоторе гена изучен достаточно подробно. Предполагают, что наиболее вероятным механизмом снижения активности промотора является специфическое связывание с репликационным белком A1 и уменьшение количества информационных РНК. В результате чего экспрессия eNOS снижается и, соответственно, угнетается продукция NO [12, 13]. Пациенты с таким состоянием имеют повышенный риск развития гипертонии [14], ретинопатии [15] и мигрени [16]. Доказана ассоциация этого аллеля с более частыми эпизодами коронарного вазоспазма, разрывом аневризмы с последующим субарахноидальным кровоизлиянием и вазоспазмом [17, 18, 19].
Результатов относительно влияния вариантов полиморфизма -786T>C (rs2070744) NOS3 на соматометрические показатели в доступных нам научных источниках недостаточно. Имеются данные, что NO, полученный eNOS, способствует биогенезу митохондрий [20] и может способствовать антивозрастному эффекту ограничения калорий. Хроническое воздействие относительно высоких уровней NO приводит к биогенезу митохондрий, которые могут перепрограммировать клетку или ткань на более высокую метаболическую способность [21]. Избыточная экспрессия NOS3 предотвращает увеличение веса на мышиной модели ожирения, вызванного диетой [22]. Появляющиеся данные свидетельствуют о том, что изменения в функции сосудов могут регулировать метаболический гомеостаз, а молекула NO может играть ключевую роль в регуляции системного метаболизма, состава тела и чувствительности к инсулину [23, 24].
Цель исследования. Анализ возрастной динамики соматометрических характеристик и показателей сердечно-сосудистой системы у мужчин-северян, а также выявление ассоциаций данных показателей с различными вариантами полиморфизма 786T>C (rs2070744) гена NOS3.
Материал и методы исследования. Общий объем комплексно обследованной выборки мужчин-северян составил 245 человека. Критерии включения в выборку: 1-2 группа здоровья, возраст, пол, регион проживания (уроженцы или постоянные жители Магаданской области), информированное согласие на обследование и обработку персональных данных. Критерии исключения: наличие в анамнезе хронических кардиологических заболеваний, отсутствие информированного согласия. Для анализа возрастной динамики соматометрических характеристик и показателей ССС были выделены 3 группы мужчин разных периодов жизненного цикла: 1 группа – юноши (17-21 год) (109 респондентов, средний возраст 18,1±0,4 лет), 2 группа – мужчины зрелого возраста (22-60 лет) (97 респондентов, средний возраст 39,5 ±0,8 года) и 3 группа – мужчины пожилого возраста (61-74 года) (39 респондентов, средний возраст 65,5±1,5 лет). Данные группы были выделены согласно общепринятой возрастной периодизации (1965 г.).
Комплексное обследование представителей выделенных групп включало:
1) анализ основных показателей соматометрического статуса: длины тела стоя (см), массы тела (кг), ИМТ (кг/м2), определение общего содержания жира в организме (%) с использованием биоимпедансного анализатора обменных процессов и состава тела АВС-02 «МЕДАСС»(Россия);
2) генетическое тестирование полиморфизма -786 Т>С (rs 2070744) гена NOS3 методом ПЦР в режиме реального времени, проведённого на базе лаборатории Молекулярной генетики человека кафедры медико-биологических дисциплин НИУ БелГУ (руководитель – проф., д.м.н. М.И. Чурносов) с использованием коммерческих наборов «SNP-Скрин» (производства Синтол, Россия);
3) исследование основных параметров гемодинамики (САД, ДАД, ЧСС, УО по Старру, МОК, ОПСС). Высокое нормальное артериальное давление (ВНАД) и артериальная гипертензия (АГ) определялись согласно классификации Mancia G et al., 2023 [25].
Биоэтические принципы проведения исследования соблюдены. Было получено положительное заключение Локального этического комитета НИЦ «Арктика» ДВО РАН (№ 002/021 от 26.11.2021г.).
Статистическая обработка полученных результатов проведена с использованием программы Statistica 7.0. Проверку нормальности распределения выполнили с использованием критерия Шапиро–Уилка. В связи с тем, что распределение всех изученных количественных признаков соответствует нормальному, данные представлены в виде средней арифметической величины (M) и ошибки средней (m). Для анализа значимости различий между выделенными группами использовали t-критерий Стьюдента для независимых выборок. При множественном сравнении был использован параметрический двухфакторный дисперсионный анализ (ANOVA), для выявления статистически значимых различий между конкретными группами – апостериорный анализ с помощью теста для множественных сравнений Scheffe.
Результаты и их обсуждение. Результаты SNP-генотипирования мужчин-северян трех возрастных групп представлены в таблице 1. Во всех исследуемых группах были выявлены 2 аллельных варианта гена NOS3: NOS3*Т и NOS3*C. Средняя частота гена NOS3*С варьировала в пределах от 32,24% до 35,9%, и данный размах вариабельности типичен для европеоидов. Выделенные группы по частотам генов и генотипов не различаются, равновесие Харди–Вайнберга (р>0,05) не нарушено.
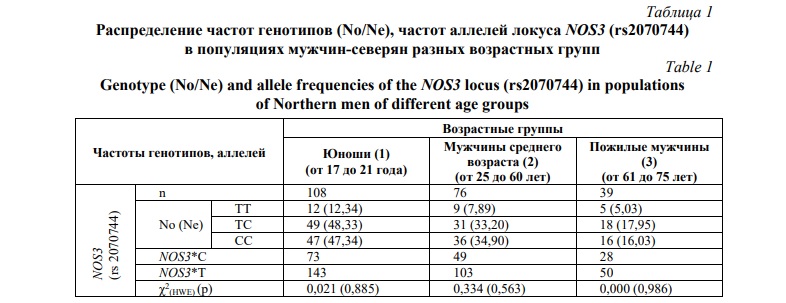
Для последующего анализа мужчины каждой возрастной группы были разделены на две подгруппы: подгруппа 1 (генотип ТТ) и подгруппа 2 (генотипы ТС+СС, у которых генетически обусловленная сниженная продукция NO).
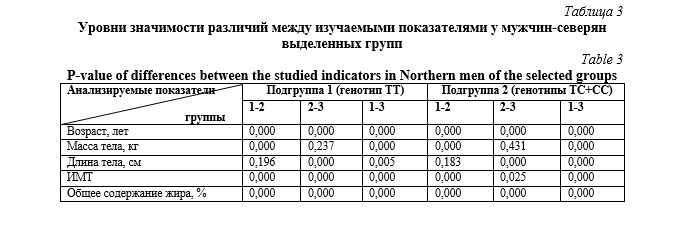
В таблице 2 и 3 представлены основные соматометрические показатели, а также уровни значимости различий между анализируемыми характеристиками у обследуемых из числа юношей, мужчин зрелого и пожилого возрастов в выделенных подгруппах. Установлено, что вне зависимости от генотипа NOS3 происходит значимое возраст-ассоциированное увеличение основных показателей соматометрического статуса: массы тела, ИМТ, а также общего содержания жира в организме. При этом следует отметить значимые различия между подгруппами 1 и 2 у мужчин пожилого возраста, где обследуемым подгруппы 2 (генотипы ТС+СС) были характерны значимо более низкие значения массы тела, общего содержания жира в организме и ИМТ.

На рисунке 1 представлены результаты двухфакторного дисперсионного анализа основных показателей сердечно-сосудистой системы у юношей, мужчин зрелого и пожилого возрастов в выделенных подгруппах: подгруппа 1 (гомозиготы ТТ) и подгруппа 2 (генотипы ТС+СС).
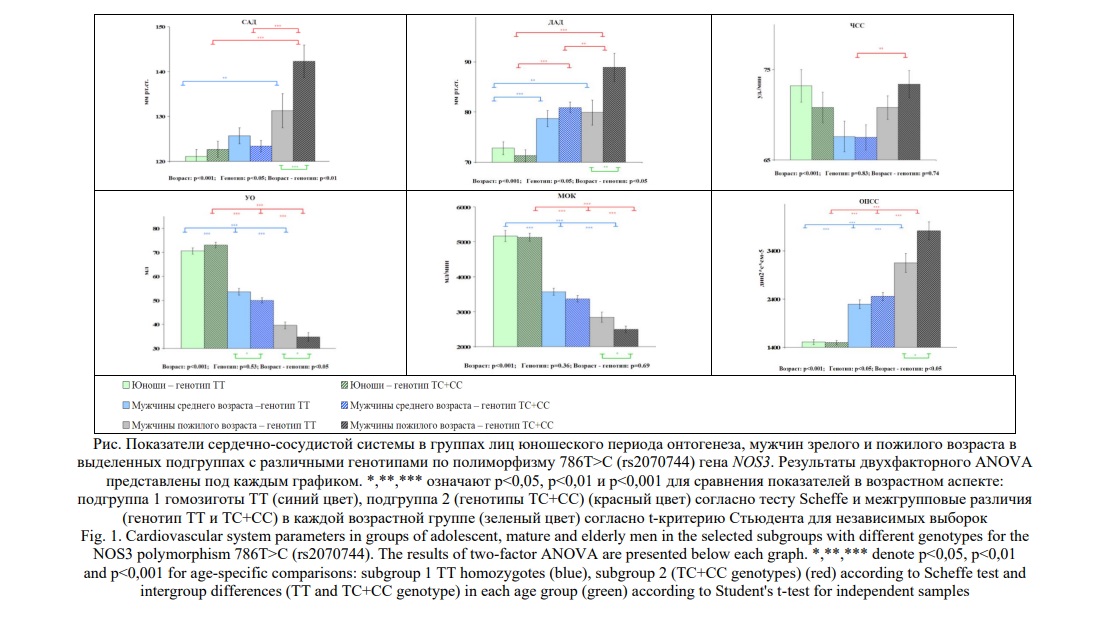
В онтогенетическом ряду от юношей к пожилому возрасту выявлен возраст-ассоциированный тренд увеличения основных показателей ССС (САД, ДАД, ОПСС) на фоне снижения УО и МОК. Анализ изменчивости основных параметров гемодинамики в выделенных в зависимости от генотипа подгруппах показал, что в группе юношей межгрупповых отличий относительно основных показателей ССС в выделенных подгруппах не выявлено. Далее, в группе мужчин зрелого возраста отмечаются значимо более низкие величины систолического объема крови в подгруппе 2 (генотипы ТС+СС ) с одновременной тенденцией возрастания ОПСС и снижения МОК. В возрастной категории пожилого периода онтогенеза из 6 проанализированных показателей сердечно-сосудистой системы значимые отличия в подгруппах были выявлены уже относительно 5 характеристик. Так, в группе пожилых мужчин установлены значимо более высокие показатели САД, ДАД, ОПСС на фоне значимого снижения УО и МОК в подгруппе 2 (генотипы ТС+СС) относительно сверстников подгруппы 1 (генотип ТТ).
Результаты двухфакторного дисперсионного анализа свидетельствуют о том, что отдельно фактор «возраст» имел значимое влияние лишь на показатели ЧСС и МОК. Полиморфизм 786T>C (rs2070744) гена NOS3 (фактор «генотип») был значимо связан с возрастным увеличением САД, ДАД и ОПСС, которое в большей степени было выражено у пожилых мужчин подгруппы 2 (генотипы ТС+СС). Совокупное действие двух факторов «возраст» и «генотип» обуславливает значимое снижение УO и увеличение САД, ДАД, ОПСС в онтогенетическом ряду, более низкие/высокие значения которых были характерны мужчинам подгруппы 2 (генотипы ТС+СС).
Общеизвестный факт, что АД определяется рядом параметров, включая объем крови и МОК (количество крови, перекачиваемое сердцем в минуту), а также баланса артериального тонуса, на который влияют как внутрисосудистый объем, так и нейрогуморальные системы [26]. Уровень САД неуклонно и непрерывно повышается с возрастом как у мужчин, так и у женщин и объясняется тем, что возраст является показателем вероятности и продолжительности воздействия многочисленных факторов окружающей среды (нарушение баланса поступления натрия и калия с пищей, гиподинамия, избыточный вес и др.) которые постепенно повышают АД с течением времени. Другие факторы, такие как генетическая предрасположенность, имеют небольшие, но определенные ассоциации с высоким уровнем АД во взрослом возрасте [26]. Полученные нами данные свидетельствуют о возраст-ассоциированном повышении величин АД независимо от генотипа по локусу NOS3, однако, при наличии в генотипе аллеля NOS3*С возрастная динамика данного параметра оказывается более выраженной. Так в группе пожилых мужчин подгруппы 2 (носители функционально ослабленного варианта с генотипами ТС+СС) наблюдались максимально высокие (различия значимы) величины САД и ДАД. У пожилых мужчин подгруппы 2 (генотипы ТС+СС) относительно обследуемых мужчин зрелого возраста этой же подгруппы отмечается значительный прирост САД, достигающий 19 мм рт.ст., что в результате может приводить к формированию изолированной систолической артериальной гипертензии, являющейся важным подтипом АГ, лишь у представителей данной подгруппы. Изолированная систолическая гипертензия определяется как САД ≥140 мм рт. ст. или ДАД <90 мм рт. ст. [27] и является достаточно прогностическим предиктором ССЗ [28].
Хотя повышение как САД, так и ДАД свидетельствует о повышенном риске сердечно-сосудистых событий, в настоящее время признано, что повышенное САД может быть более важным компонентом сердечно-сосудистого риска, чем повышенное ДАД [29]. Это связано с тем, что прогностическая ценность САД увеличивается с возрастом и становится информативнее, чем прогностическое значение ДАД именно в выборке пожилых людей [30]. Еще более частым предвестником и лучшим предиктором развития систолической гипертензии является жесткость аорты, чем АД [31], также имеются сведения о том, что артериальная ригидность является фактором, определяющим повышенное САД, в результате структурных изменений в сосудистой системе, опосредованных нейрогормональными изменениями, которые происходят с возрастом и заключаются в потере функции эндотелия и, в более общем плане, в снижении выработки сосудорасширяющих факторов (например, оксида азота) и повышенной выработки сосудосуживающих веществ (например, эндотелинов, норадреналина и т.д.) [32]. Эндотелиальная дисфункция и артериальная жесткость являются тесно взаимосвязанными медиаторами возрастной сосудистой дисфункции [31]. eNOS играет одну из ключевых ролей в регуляции АД и опосредуется выработкой NO, что приводит к вазодилатации за счет активации ЦГМФ-зависимая протеинкиназы в клетках гладкой мускулатуры сосудов [33, 34]. У пожилых людей ряд функциональных и структурных нарушений, включая эндотелиальную дисфункцию, обусловленную в том числе снижением выработки NO вызывают увеличение жесткости крупных эластичных артерий, что приводит к увеличению САД [35], что согласуется с результатами наших исследования, когда лишь в группе пожилых мужчин подгруппы 2 (генотипы ТС+СС), у которых в генотипе присутствует одна или две копии функционально ослабленного аллельного варианта NOS3*C было выявлено наличие систолической изолированной гипертензии.
Известно, что изолированная артериальная гипертензия является одним из основных факторов риска ССЗ и смертности от БСК, поэтому полученные нами данные указывают о достаточно высоком риске развития ССЗ именно у пожилых мужчин – носителей минорного аллеля NOS3*С (подгруппа 2, генотипы ТС+СС).
Показатель ОПСС играет ключевую роль в регуляции градиента давления артериально-венозной системы. Варьирование его значений отражает состояние прекапиллярного кровотока и может служить чувствительным маркером ССС. Анализ возрастной динамики ОПСС указывает на то, что у обследуемых двух выделенных по генотипам NOS3 подгрупп в возрастном ряду от юношей к группе мужчин пожилого возраста оно значимо возрастает, с более выраженными вазоконстрикторными проявлениями в подгруппе 2 (генотипы ТС+СС). Известно, что такие возраст-ассоциированные изменения обусловлены снижением эластичности и диаметра просвета артериального дерева и связанные с этим структурные изменения в сердце. Кроме того, мелкие артерии и артериолы становятся менее чувствительными к сосудорасширяющим средствам, таким как NO, что способствует нарушению тонуса гладкомышечных волокон и ещё больше увеличивает периферическое сопротивление [36]. Данный эффект достаточно наглядно проявляется и в наших исследованиях, когда у мужчин подгруппы 2 (генотипы ТС+СС) показатели ОПСС достигают наибольших величин при значимом влиянии фактора «генотип».
Способность ССС быстро реагировать на какие-либо изменения путём адекватного обеспечения кровью организма отражает функциональные резервы ССС, о которых можно судить по таким гемодинамическим параметрам, как систолический и минутный объемы крови [37, 38]. Согласно литературным данным эти изменения могут быть обусловлены возрастными дегенеративными процессами, которые приводят к увеличению удельной массы соединительной ткани в миокарде и снижению сократительной способности кардиомиоцитов [39]. В результате наших исследований установлено значимое возрастное снижение функциональных резервов ССС мужчин-северян обусловленное уменьшением значений МОК и УО. Так у мужчин-северян наблюдается выраженное уменьшение объёмных гемодинамических показателей, которое начинается уже в период зрелого возраста и далее прогрессивно нарастает, при этом более выраженная динамика снижения УО наблюдается в подгруппе 2 (генотипы ТС+СС). Таким образом данные изменения обусловлены совокупным влиянием двух главных факторов – «генотип» и «возраст». По-видимому, снижение объёмных характеристик гемодинамики – минутного и ударного объёма крови направлено на уравновешивание или перекрытие значительно повышенного сосудистого сопротивления.
Вариабельность ЧСС у мужчин-северян в выделенных подгруппах различна, в зависимости от генотипов локуса NOS3. Так у гомозигот подгруппы 1 (генотип ТТ) значимого возрастного изменения параметров ЧСС не наблюдалось, в отличие от гомо- и гетерозиготных носителей аллельного варианта NOS3*С подгруппы 2 (генотипы ТС+СС), где выявлено значимое увеличение ЧСС у мужчин пожилого возраста, относительно группы мужчин среднего возраста.
Заключение. Полученные результаты свидетельствуют о наличии ассоциаций полиморфизма 786T>C (rs2070744) гена NOS3 с такими показателями сердечно-сосудистой системы, как САД, ДАД, ЧСС и ОПСС. Это обусловливает необходимость проведения мониторинговых исследований основных показателей ССС с одновременной оценкой полиморфизма гена NOS3 как базы для концептов персонализированной и превентивной медицины, при этом мужчин пожилого возраста с физиологически сниженной продукцией NO (генотипы ТС и СС) стоит рассматривать как группу риска по развитию ССЗ.
Информация о финансировании
Работа выполнена при финансовой поддержке РНФ, проект №23-15-20001.





















Список литературы