Ассоциация вариантов гаплогруппы Н1 митохондриальной ДНК с риском сердечно-сосудистых катастроф
Aннотация
Актуальность: Митохондрии играют главную роль в обеспечении клетки энергией, но в то же время являются источником свободных радикалов, увеличивающих окислительный стресс. Известно, что генотип митохондриальной ДНК может влиять на эффективность поглощения кислорода и синтеза АТФ. В предыдущих исследованиях было показано, что гаплогруппа Н1 мтДНК может являться фактором риска развития жизнеугрожающих состояний при заболеваниях сердечно-сосудистой системы. Цель исследования: Выявить варианты мтДНК гаплогруппы Н1, влияющие на риск развития сердечно-сосудистых катастроф. Материалы и методы Проведено секвенирование полной последовательности мтДНК, принадлежащих к гаплогруппе Н1, в двух выборках: (1) индивиды, умершие от сердечно-сосудистых заболеваний в возрасте до 55 лет, либо имевшие повторные инфаркты миокарда или резкое прогрессирование сердечной недостаточности в течение года наблюдения после инфаркта миокарда; (2) индивиды старше 60 лет без симптомов сердечно-сосудистых заболеваний, либо дожившие до 90 лет. Выявленные гаплотипы мтДНК были классифицированы по субгаплогруппам Н1. Медианная сеть гаплотипов была построена в программе Network v5.0. Результаты: В исследованных группах было выявлено 13 различных субгаплогрупп мтДНК. В группе с сердечно-сосудистыми катастрофами частота встречаемости полиморфизма Т16189С составила 18,75%, по сравнению с выборкой долгожителей и индивидов без симптомов сердечно-сосудистых заболеваний (62,5%). Уровень значимости для двустороннего точного критерия Фишера был равен 0,029. Других статистически значимых различий между группами не было выявлено. Заключение: Полученные результаты позволяют предположить, что полиморфизм Т16189С на фоне гаплогруппы Н1 мтДНК может оказывать протективный эффект в отношении развития жизнеугрожающих состояний при заболеваниях сердечно-сосудистой системы.
Введение. Развитие и прогрессирование сердечно-сосудистых заболеваний в значительной мере связано с функциональным состоянием митохондрий, которые должны обеспечивать энергетические потребности мышц (в том числе миокарда) и в то же время являются источником свободных радикалов, усиливающих окислительный стресс в клетке. Митохондрии обладают собственным генетическим аппаратом – митохондриальным геномом, который кодирует субъединицы комплексов дыхательной цепи, а также РНК, необходимые для процесса трансляции внутри митохондрий. Будучи подвержена воздействию активных форм кислорода, образующихся как побочные продукты окислительного фосфорилирования, мтДНК характеризуется высокой скоростью мутирования и, как следствие, высоким уровнем популяционного полиморфизма. В настоящее время на основе десятков тысяч полных последовательностей мтДНК человека реконструировано родословное древо гаплотипов мтДНК (митотипов), «ветви» которого называются гаплогруппами. Каждая гаплогруппа характеризуется набором накопленных в процессе микроэволюции нуклеотидных замен, в том числе аминокислотных, а также замен в рибосомных и транспортных РНК, которые могут влиять и на эффективность белкового синтеза в митохондриях, и на функцию субъединиц дыхательной цепи, кодируемых мтДНК. Несмотря на то, что эти варианты являются нормальным популяционным полиморфизмом, т.е. не приводят к развитию наследственных митохондриальных заболеваний, в многочисленных работах было показано, что они могут в некоторой степени снижать или повышать эффективность синтеза АТФ и продукцию активных форм кислорода. В частности, были проведены эксперименты на цибридных клеточных линиях (в которых митохондрии были заменены на митохондрии с определенным генотипом), которые продемонстрировали, что в клеточных культурах с мтДНК гаплогруппы J уровень продукции АТФ и активных форм кислорода был несколько ниже по сравнению с культурами, имевшими тот же самый ядерный геном, но содержащих мтДНК гаплогруппы Н [1]. Также было показано, что цибридные линии с гаплогруппой J имели более высокую скорость роста при воздействии сублетальных доз ультрафиолетового излучения, по сравнению с Н [2]. Сравнение цибридных культур с гаплогруппами Т и Н выявило более высокое число копий мтДНК в клетке, большую скорость роста культуры и меньшую чувствительность к окислительному стрессу у культур с гаплогруппой Т [3].
Митохондриальные заболевания, вызванные мутациями мтДНК, зачастую имеют среди своих симптомов нарушения со стороны сердечно-сосудистой системы. Например, одним из основных симптомов синдрома Кернса-Сейра является атриовентрикулярная блокада, и при этом заболевании высок риск внезапной сердечной смерти [4]. Другой митохондриальный синдром – MELAS, вызываемый наиболее частой митохондриальной мутацией A2343G, также может приводить к риску развития аритмии и внезапной сердечной смерти [5]. В целом можно сказать, что нарушения ритма сердца и кардиомиопатии довольно часто встречаются при мутациях мтДНК. Также недавно было показано, что если число копий мтДНК на клетку в лейкоцитах крови находится в нижнем 20% квантиле популяционного распределения этого показателя, то такие индивиды имеют более высокий риск внезапной смерти, по сравнению с верхним 20% квантилем (OR=2,24) [6].
Ассоциации полиморфизма мтДНК с многофакторными заболеваниями сердечно-сосудистой системы получены во многих исследованиях. Например, была показана связь атеросклероза и инфаркта миокарда с несколькими гаплогруппами мтДНК, в частности, с гаплогруппой H [7]. При изучении полиморфизма мтДНК в выборке пациентов с ишемической кардиомиопатией было обнаружено, что гаплогруппа Н чаще встречается у пациентов по сравнению с популяцией (фактор риска), а гаплогруппа J – реже, т.е. имеет протективный эффект [8]. В проведенных нами исследованиях, наиболее частая субгаплогруппа Н (Н1) показала ассоциацию с вероятностью повторных сердечно-сосудистых катастроф в течение года после инфаркта миокарда [9] и со смертью от сердечно-сосудистых заболеваний в возрасте до 55 лет [10]. Полиморфизм T16189C был ассоциирован с коронарным атеросклерозом у населения Саудовской Аравии [11] и с вероятностью повторных инфарктов в течение года у русских [9], а для гаплогруппы D в популяции японцев выявлен протективный эффект в отношении инфаркта миокарда [12]. Гаплогруппа Н была также ассоциирована с гипертрофической кардиомиопатией в выборке датчан [13]. Эти факты свидетельствуют о том, что полиморфизм мтДНК вносит определенный вклад в предрасположенность к развитию критических состояний в сердечно-сосудистом континууме. Исходя из приведенных данных, наиболее интересной для исследования в этом направлении является гаплогруппа Н1 – самая распространенная ветвь гаплогруппы Н (около 10% в европейских популяциях), которая в наших предыдущих исследованиях была ассоциирована с сердечно-сосудистыми катастрофами [9, 14]. Учитывая, что в мтДНК отсутствует мейотическая рекомбинация, все возникшие мутации наследуются совместно в ряду поколений, и поэтому вновь возникающие варианты могут либо усиливать, либо ослаблять эффект «предыдущих» мутаций – такое взаимодействие можно назвать эпистазом.
Целью данного исследования было выявление возможных вариантов в «рисковой» гаплогруппе Н1, которые позволили бы далее стратифицировать риск развития сердечно-сосудистых катастроф у обладателей мтДНК, принадлежащих к этой гаплогруппе.
Материал и методы исследования. Группа для анализа полной последовательности митохондриальной ДНК с помощью высокопроизводительного секвенирования была сформирована на основе коллекции образцов ДНК НИИ медицинской генетики «Биобанк населения Северной Евразии». Всего были исследованы образцы ДНК от 32 человек, мтДНК которых принадлежит к гаплогруппе Н1. В том числе, в группу с «неблагоприятным» течением сердечно-сосудистых заболеваний вошли 16 образцов ДНК от индивидов, имевших в анамнезе 2 инфаркта миокарда в течение года либо умерших от сердечно-сосудистых заболеваний в возрасте до 55 лет. «Контрольную» группу составили 16 образцов ДНК от индивидов, либо не имевших сердечно-сосудистых заболеваний в анамнезе (в возрасте старше 55 лет), либо являвшихся долгожителями (старше 90 лет).
Для проведения высокопроизводительного секвенирования готовили ДНК-библиотеки на основе ПЦР-продуктов, охватывающих полную последовательность митохондриального генома. МтДНК амплифицировали в двух длинных фрагментах (9065 п.о. и 11170 п.о.) с использованием праймеров, описанных H. Stawski с соавт. [15], с помощью набора для long-range ПЦР «БиоМастер LR HS-ПЦР» (ООО «Биолабмикс», г. Новосибирск). ДНК-библиотеки готовили с помощью набора для ДНК-библиотек Nextera XT (Illumina), согласно экспериментальному протоколу Illumina (Human mtDNA Genome for the Illumina sequencing platform). Оценку качества ДНК-библиотек проводили с помощью прибора BioAnalyzer (Agilent). Высокопроизводительное секвенирование по технологии Illumina проводили на приборе MiSeq (MiSeq Micro Kit v.2 300 cycles).
Файлы в формате *.fastq, сгенерированные в результате запуска прибора, анализировали с помощью программы для анализа данных мтДНК mtDNA-server [16, 17]. После загрузки файлов программа самостоятельно выравнивает полученные прочтения на последовательность митохондриального генома и выявляет замены относительно референсной последовательности, классифицируя образцы по принадлежности к гаплогруппам мтДНК в соответствии с принятой в настоящее время номенклатурой [18, 19], а также оценивает возможную кросс-контаминацию образцов.
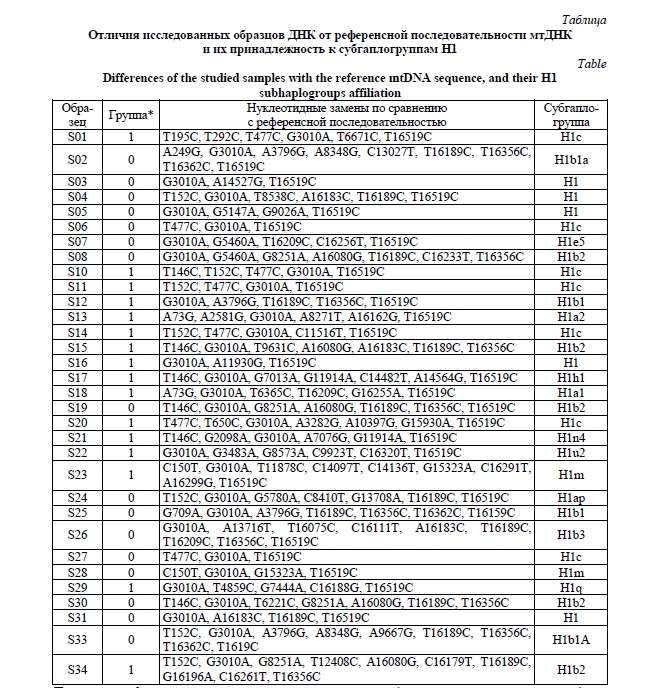
Результаты и их обсуждение. В результате секвенирования были получены данные о полной последовательности мтДНК 32 образцов, принадлежащих к гаплогруппе Н1 мтДНК, в том числе 16 индивидов, имевших в анамнезе 2 инфаркта в течение года (10 человек) или умерших от сердечно-сосудистых заболеваний в возрасте до 55 лет (6 человек), и 16 образцов ДНК от индивидов, не имевших сердечно-сосудистых заболеваний в анамнезе (7 человек) или являвшихся долгожителями (7 человек) – условно «контрольная» группа. На основе этих данных была определена принадлежность всех выявленных гаплотипов мтДНК к определенным гаплогруппам, согласно принятой классификации [19]. Список нуклеотидных замен в исследованных образцах по сравнению с референсной последовательностью мтДНК [20] приведен в таблице 1. Кроме перечисленных в таблице замен, во всех образцах присутствовали также замены A263G, A750G, A1438G, A4769G, A8860G, A15326G, которые отличают референсную последовательность (H2a2) от «корневой» последовательности гаплогруппы Н. Только в одном образце (S12) в позиции 263 находился аденин – вероятно, вследствие повторной мутации. Неоднократное появление одинаковых нуклеотидных замен на разных ветвях филогении называется гомоплазией и связано с высокой скоростью мутирования мтДНК.
Примечание: «0» – «здоровые» индивиды или долгожители; «1» – индивиды с повторными инфарктами или умершие от сердечно-сосудистых заболеваний.
Note: “0” - “healthy” individuals or centenarians; "1" - individuals with recurrent heart attacks or who have died from cardiovascular disease
Все образцы ДНК имели замену G3010A в гене 16S рибосомной РНК, которая определяет гаплогруппу Н1 на филогенетическом древе мтДНК человека. Таким образом, мы сравнивали изменчивость мтДНК в пределах одного филогенетического кластера в группах лиц с «контрастными» фенотипами сердечно-сосудистой системы.
Анализ полученных последовательностей не выявил значительного преобладания какой-либо субгаплогруппы Н1. Также не было показано различий между группами в количестве мутаций, приводящих к заменам аминокислот в кодируемых мтДНК белках. Можно отметить, что субгаплогруппа Н1с несколько чаще выявлялась в группе с неблагоприятным фенотипом (5 чел. из 16, по сравнению с 2 из 16 в «контрольной» группе), тогда как в «контроле» более часто были выявлены субгаплогруппы Н1b: H1b1, H1b2 и H1b3 (7 чел. из 16, по сравнению с 3 чел. из 16 в группе с сердечно-сосудистыми катастрофами) (см. Рисунок 1). Частота аллеля С в гипервариабельном сайте 16519 составила 75% в группе «ССЗ» (12 образцов из 16) и 87,5% в контроле (14 образцов из 16).
Частота аллеля С в гипервариабельном сайте 16189 была намного выше в «контрольной» группе (62,5%) по сравнению с выборкой «ССЗ» (18,75%). Несмотря на небольшой объем выборок, эти различия были статистически значимы: уровень значимости для двустороннего точного критерия Фишера равнялся 0,029. Полиморфизм Т16189С является общим для ветвей субгаплогруппы H1b, однако в «контрольной» группе он встретился также на фоне других субгаплогрупп Н1. Таким образом, можно говорить о вероятном протективном эффекте этого варианта «на фоне» гаплогруппы Н1 в отношении неблагоприятных сердечно-сосудистых событий. Интересно, что в научных публикациях этот полиморфизм чаще ассоциирован с неблагоприятным эффектом – в частности, со сниженным количеством копий мтДНК [21]. Также полиморфизм Т16189С известен как фактор риска для сахарного диабета 2 типа в европеоидных и монголоидных популяциях [22, 23]. Есть данные об ассоциации данной замены и полицитозинового тракта с коронарным атеросклерозом [11, 24]. Кроме того, вариант 16189С представляет собой по сути обратную мутацию, так как является «предковым» для всего человеческого вида: замена С16189Т произошла на ранних этапах развития человечества и маркирует кластер L2’3’4’6, в который входит и супергаплогруппа L3, ставшая родоначальницей всех не-африканских мтДНК [25].
Гаплогруппа Н1с (31% в группе больных и 14% в контрольной группе), с другой стороны, не имеет замены Т16189С и определяется полиморфизмом T477C в главном некодирующем регионе митохондриального генома, на расстоянии примерно 300 п.н. от сайта связывания митохондриального фактора транскрипции mtTF1 (позиции 418-445), промотора L-цепи мтДНК (445-391) и origin репликации Н-цепи (110-441). Стоит отметить тот факт, что в филогении мтДНК человека замена T477C встречается только один раз (а именно в гаплогруппе Н1с), в то время как многие другие варианты, особенно в некодирующих регионах, встречаются на родословном древе мтДНК более одного раза. Это может быть косвенным доказательством неблагоприятного эффекта замены T477C. На настоящий момент неизвестно, входит ли этот нуклеотид в сайт связывания каких-либо регуляторных белков и влияет ли он на вторичную структуру области D-петли, однако недавно было показано, что область D-петли мтДНК связывает не только митохондриальные, но и ядерные факторы транскрипции [26].
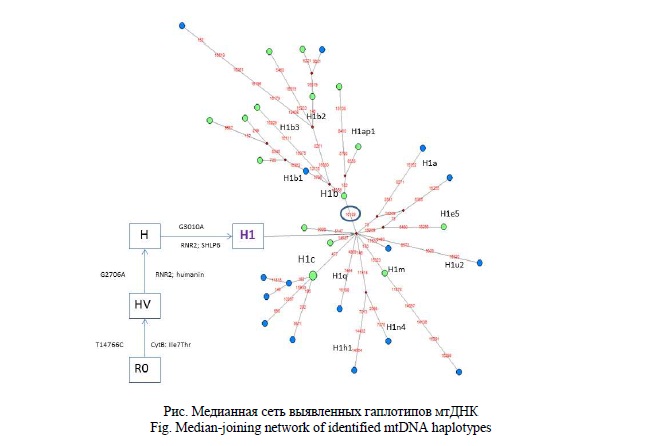
Гаплогруппа Н1 определяется заменой G3010A в гене 16S рРНК. Учитывая, что гаплогруппа Н в целом определяется в том числе заменой G2706A в том же гене, можно предположить, что сочетание этих вариантов может оказывать влияние на вторичную структуру 16S рРНК. Кроме того, известно, что эти нуклеотиды находятся в участках, кодирующих митохондриальные пептиды – сигнальные молекулы, обладающие кардиопротекторными свойствами [27]. В частности, замена G2706A в гене хуманина (2634-2707) приводит к образованию стоп-кодона, общего с универсальным генетическим кодом, что делает возможным трансляцию этого пептида не только в митохондриальном матриксе, но и в цитоплазме. Замена G3010A в гене SHLP6 (2992-3051), хотя и не меняет аминокислотной последовательности этого пептида, но убирает из нее CpG сайт, т.е. может иметь значение при условии метилирования мтДНК.
Заключение. В результате подробного анализа полных последовательностей мтДНК, принадлежащих к гаплогруппе Н1, в группе индивидов с неблагоприятным течением сердечно-сосудистых заболеваний (инфаркты в возрасте до 55 лет, а также повторные инфаркты в течение года, в том числе фатальные) в сравнении с группой долгожителей и индивидов, которые в пожилом возрасте не имели симптомов сердечно-сосудистых заболеваний, нами выявлено неравномерное распределение индивидуальных гаплотипов мтДНК на филогенетическом древе. В группе «контроля», по сравнению с пациентами, преобладают гаплотипы Н1, имеющие замену Т16189С. Таким образом, хотя в целом гаплогруппа Н1, как было показано ранее, может быть ассоциирована с повышенным риском сердечно-сосудистых катастроф, равно как и в целом вариант 16189С [9], сочетание Н1 (т.е. варианта 3010А) и варианта 16189C на одном гаплотипе мтДНК можно рассматривать как фактор, снижающий этот риск. Гаплогруппа Н1с, определяемая полиморфизмом T477C, напротив, может быть ассоциирована с повышенным риском. Для подтверждения этих ассоциаций, однако, требуются дополнительные исследования на выборках большего объема. Полученные результаты подчеркивают возможность функциональной значимости некодирующих участков митохондриального генома, а также необходимость детального рассмотрения генотипа мтДНК в целом (как гаплотипа) в исследованиях ассоциаций с заболеваниями.
В отношении данной статьи не было зарегистрировано конфликта интересов.
Благодарности
Работа выполнена при финансовой поддержке комплексной программы фундаментальных научных исследований СО РАН II.1 «Митохондриальная дисфункция и изменчивость митохондриального генома в развитии инфаркта миокарда и внезапной сердечной смерти». Для выполнения работы использованы образцы ДНК из биоколлекции «Биобанк населения Северной Евразии». Исследование выполнено с использованием оборудования ЦКП «Медицинская геномика» Томского НИМЦ.





















Список литературы