Морфологические изменения тканей десны при интоксикации тирамом с последующей коррекцией препаратами ресвератрол и облепиховое масло
Aннотация
Актуальность: Широкое применение пестицидов может приводить к нарушению экологического равновесия межу внешней средой и организмом человека, провоцируя развитие окислительного стресса, что приводит к росту токсических форм поражений органов и систем макроорганизма. С целью подавления окислительного стресса, который развивается при многих патологических процессах целесообразно применять препараты антиоксидантного ряда, которые угнетают процессы образования свободных радикалов. Цель исследования:Изучить морфологические изменения тканей десны при интоксикации тирамом с последующей коррекцией препаратами ресвератрол и облепиховое масло. Материалы и методы:Эксперимент был выполнен на 50 крысах, которые получали фунгицид тирам в течение 28 дней, с последующей коррекцией ресвератролом или облепиховым маслом. Для оценки выраженности воспалительных изменений в гистологических препаратах анализировали морфофункциональные изменения эпителия слизистой и клеточный состав субэпителиального слоя. По кариологическим признакам дифференцировали клетки фибробластического дифферона, макрофаги, гранулоциты и лимфоциты, а также измеряли толщину эпителиального пласта, площадь, занимаемую волокнистым, сосудистым и клеточным компонентом. Результаты:В экспериментальных группах «тирам 28 суток» и «тирам+стандартный рацион» у всех крыс наблюдалось развитие воспалительной реакции тканей десны, проявляющейся в гиперкератозе и увеличении толщины эпителия до 173,438 мкм и 230,568 мкм соответственно, диффузной полиморфноклеточной инфильтрацией субэпителиального слоя в основном за счет гранулоцитов до 21,40 и 21,92 соответственно, расширением просвета и кровенаполнением сосудов микроциркуляторного русла. После применения препаратов ресвератрол и облепиховое масло происходило восстановление толщины эпителиального слоя до 114,07 мкм и 190,03 мкм соответственно, уменьшение интерстициального отека и клеточной инфильтрации субэпителиального слоя. При этом за счет миграции и увеличения клеток фибробластического дифферона (28,96 и 29,44) наблюдались процессы неоколлагеногенеза и увеличение волокнистого компонента до 65,62 и 33,69 после применения ресвератрола и облепихового масла соответственно. Заключение:Доказана эффективность монотерапии ресвератролом и облепиховым маслом в нормализации морфологии тканей десны. При этом ресвератрол обладает как противоспалительным эффектом, так и высоким регенеративным действием
Введение. По мере развития различных отраслей промышленности и сельского хозяйства все актуальнее становится проблема воздействия экологических экзогенных факторов на организм человека. Интенсивное использование пестицидов может приводить к нарушению экологического равновесия между внешней средой и макроорганизмом [1, 2].
Одним из широко используемых пестицидов фунгицидного ряда, которые применяются для борьбы с заболеваниями растений, является тирам (ТМДТ). Тирам обладает средней токсичностью для теплокровных животных и человека [3, 4].
Известно, что пестициды являются неспецифическими структурными и метаболическими ядами, а также вызывают значительные перестройки в структуре и метаболизме клеток и тканей организма. Экзогенные ксенобиотики, в частности пестициды, оказывают негативное влияние на многоуровневую и многокомпонентную систему антиоксидантной защиты, что может привести к росту токсических форм поражений органов и систем макроорганизма [5]. Согласно современным литературным данным, тирам приводит к образованию свободных радикалов и обладает цитотоксическим действием [6].
При поступлении ксенобиотиков с пищей, ротовая полость является мишенью негативного воздействия экзогенных факторов, поступающих в организм [7, 8, 9]. При попадании ксенобиотиков в полость рта развивается окислительный стресс, который может привести к повреждению клеточных компонентов в пародонте. Важно отметить, что клиническую картину пародонтопатий определяет выраженность и характер изменений капиллярно-трофических процессов, а нарушение микроциркуляции играет ведущую роль в развитии патогенетических механизмов воспаления в тканях пародонта [10, 11, 12].
Заболевания полости рта начинаются с воспаления десен, которое проходит несколько фаз, в дальнейшем поражает другие отделы пародонта и, наконец, переходит в пародонтит. Изменения на уровне сосудов появляются как первые проявления воспаления десен (начальное поражение), отмечается расширение капилляров и усиление кровотока. На начальных этапах определяется выраженная миграция сегментоядерных нейтрофилов, которые способны фагоцитировать разрушенные участки коллагеновых волокон. Образованные пространства могут служить дополнительным «резервуаром» для клеток воспалительного ряда. В зависимости от защитных механизмов хозяина острая фаза воспаления может быть прекращена реституцией тканей или может превратиться в хронические воспалительные поражения с вовлечением связочного аппарата и костной ткани [13, 14, 15].
С целью подавления окислительного стресса, который развивается при многих патологических процессах целесообразно применять препараты антиоксидантного ряда, которые угнетают процессы образования свободных радикалов. К препаратам-антиоксидантам относят ресвератрол и облепиховое масло. Ресвератрол содержится в винограде, чернике, клюкве, красном вине и обладает антиоксидантным, противораковым, противовоспалительным, антитромбоцитарным действием. Антиоксидант ресвератрол у человека и животных метаболизируется в печени. Поступление ресвератрола в клетки обусловлено его активным связыванием с альбумином и липопротеинами [16]. Облепиховое масло является антиоксидантом, обладающим свойствами, предотвращающими образование свободных радикалов. Биологически активные вещества, такие как фитостерины, полиненасыщенные жирные кислоты, некоторые незаменимые аминокислоты, каротиноиды, витамины A, C, E, K, фолиевая кислота, рибофлавин, органические кислоты: яблочная, щавелевая, содержатся в составе облепихового масла [17].
Цель исследования. Изучить морфофункциональные изменения тканей десны при интоксикации тирамом с последующей коррекцией препаратами ресвератрол и облепиховое масло.
Материалы и методы исследования. Эксперимент был проведен на 50 крысах – самцах линии Вистар возрастом 2 месяца c массой тела 200-220 грамм. Все манипуляции с животными выполняли на базе НИИ Экспериментальной медицины Курского государственного медицинского университета с соблюдением международных и отечественных норм гуманного обращения с лабораторными животными: Директива 2010/63/EU Европейского Парламента и Совета Европейского союза от 22 сентября 2010 г. по охране животных, используемых в научных целях, приказ Минздрава России № 199н от 01 апреля 2016 г. «Об утверждении правил надлежащей лабораторной практики. Экспериментальное исследование утверждено региональным этическим комитетом при ФГБОУ ВО КГМУ Минздрава России (протокол № 4 от 30 ноября 2017 г.).
Для решения поставленных задач животные были разделены на пять групп по 10 крыс в каждой группе.
Животные 1 группы – здоровые интактные крысы, которые являлись биологическим контролем. Группа содержалась на стандартном рационе в условиях вивария в осенне-зимний период (группа «контроль (интактные)»).
Животным 2 группы моделировалась субхроническая интоксикация пестицидом на протяжении 28 суток (группа «тирам 28 суток»). Ежедневно утром вместе с гранулированным кормом животные получали пестицид тирам в дозе 1/50 ЛД50. Дозу тирама рассчитывали исходя из токсикологических данных, где ЛД50 для крыс составляет 400 мг/кг. Поэтому доза пестицида, который получали крысы один раз в день, составила 1,6 мг [18]. Для приготовления кормовых гранул, содержащих пестицид тирам, гранулы стандартного корма измельчали, после чего добавляли взвешенную дозу пестицида, перемешивали с 2 мл дистиллированной воды, снова формировали гранулы и сушили на воздухе 12 часов. Данный способ введения пестицида животным служит моделью естественного поступления пестицида с пищей и, таким образом, исключается физиологический стресс, который может повлиять на результаты эксперимента.
Животным 3 группы моделировалась интоксикация тирамом на протяжении 28 суток, после чего животные были переведены на стандартный пищевой рацион на 30 дней (группа «тирам+стандартный рацион»). Данная группа крыс послужила контролем с целью оценки компенсаторных возможностей макроорганизма после интоксикации пестицидом тирамом.
В 4 группе моделировалась интоксикация на протяжении 28 суток, с последующим применением per os антиоксиданта ресвератрола (Ресвератрол 100 мг, Solgar Inc. (США)) в дозе 8,58 мг/кг в день в течение 30 дней, так как рекомендованная продолжительность приема препарата составляет 1 месяц (группа «ресвератрол) [18].
В 5 группе моделировалась интоксикация на протяжении 28 суток, с последующим применением per os антиоксиданта облепихового масла (Облепихи масло, Вифитех ЗАО (Россия)) в дозе 0,78 мг/кг в течение 30 дней, так как рекомендованная продолжительность приема препарата составляет 1 месяц (группа «облепиховое масло») [18].
Расчет доз проводили следующим образом. Ресвератрол. В перерасчете на 1 кг массы тела человека необходимо 1,43 мг/кг препарата. Коэффициент пересчета дозы с отдельного животного на человека составляет 39,0. Для крысы массой 200 грамм коэффициент пересчета составляет 6,5. Следовательно, терапевтическая доза ресвератрола для крыс составляет: (1,43*39) / 6,5 = 8,58 мг/кг, для крысы массой 200 г – 1,72 мг препарата. Содержимое капсулы ресвератрола (порошок) смешивали с 10 мл воды и вводили животным по 0,17 мл [18].
Облепиховое масло. В пересчете на 1 кг массы тела человека данного препарата необходимо 0,13 мг/кг. Коэффициент пересчета дозы с отдельного животного на человека составляет 39,0. Для крысы массой 200 грамм коэффициент пересчета составляет 6,5. Поэтому терапевтическая доза облепихового масла для крыс составляет: (0,13*39) / 6,5 = 0,78 мг/кг, для крысы массой 200 г – 0,156 мг препарата. Животным вводили по 0,17 мл облепихового масла [18].
Забой животных осуществлялся методом цервикальной дислокации после окончания эксперимента. Гистологическое исследование проводили в лаборатории морфологии и клеточных технологий НИИ Экспериментальной медицины Курского государственного медицинского университета. Материалом настоящего исследования послужил фрагмент десны экспериментального животного, включающий альвеолярную и маргинальную части общей площадью 0,25 см2. Для изготовления гистологических препаратов аутопсийный материал помещали в раствор забуференного формалина концентрацией 10%. Далее следовала стандартная проводка из спиртов и ксилолов, и заливка в парафиновые блоки. После микротомирования срезы толщиной 5 мкм окрашивали гематоксилином и эозином. Полученные срезы были оценены на аппаратно-программном комплексе для биологических исследований Nikon Eclipse NI (Nikon, Япония). Документация изображений производилась цифровой камерой Nikon DS-Fi3 5,9 мгп. Обработку полученных данных проводили с использованием программного обеспечения NIS – Elements (Nikon, Япония).
Морфометрический подсчет клеточных элементов проводили в субэпителиальном слое десны. По гистологическим критериям определяли клетки фибробласты, фиброциты, макрофаги, гранулоциты и лимфоциты. Подсчет проводили на 100 клеток в 20 полях зрения, с последующим расчетом средних значений.
На полученных микрофотографиях проводили измерение толщины эпителиального пласта, площади, занимаемую волокнистым, сосудистым и клеточным компонентом. Каждый из параметров был измерен на 30 участках препарата в местах наиболее хорошо сохранившегося слоя. Затем было вычислено среднее значение для каждого животного.
Статистическая обработка полученных результатов проводилась с использованием программной среды Statistica 10 (производитель Dell Software Company, Round Rock, Texas, United States of America). Ввиду небольших размеров выборки в экспериментальных группах исследования при выполнении расчетов было принято решение в качестве основной методики определения уровня статистической значимости отличий использовать U-тест Манна-Уитни.
Результаты и их обсуждение. По результатам экспериментального исследования было отмечено, что в контрольной группе животных десна покрыта слизистой, в состав которой входит многослойный плоский неороговевающий эпителий, покрывающий плотную соединительнотканную пластинку. Эпителий, обращенный к ротовой полости, составляет ротовой эпителий, в то время как часть, обращенная к зубу, представляет эпителий борозды, который продолжается соединительным эпителием. Собственная пластинка включает надальвеолярный волокнистый аппарат, кровеносные и лимфатические сосуды и нервы. Слизистая десны имеет свою архитектонику со следующими структурами – бороздчатый и соединительный эпителий с увеличенными межклеточными пространствами, в которых присутствует незначительное количество нейтрофилов и десневой жидкости, единичные макрофаги, лимфоциты и плазматические клетки.
При морфологическом исследовании гистологических препаратов, полученных от животных экспериментальной группы «тирам 28 суток», которые были подвергнуты интоксикации пестицидом в течении 28 дней, у всех крыс наблюдается развитие воспалительной реакции тканей десны различной степени тяжести. В эпителиальном пласте слизистой свободной части десны отмечаются признаки выраженного гиперкератоза, проявляющегося расширением зернистого и шиповатого слоев. В некоторых случаях наблюдается появление баллонообразных клеток как проявление дистрофии эпителиоцитов. При этом в базальном слое количество эпителиоцитов, находящихся в стадии деления, не определяется. Субэпителиально отмечается отек сосочкового слоя и расширение межсосочкового пространства. Собственная пластинка слизистой состоит из тонких хаотично расположенных коллагеновых волокон с достаточно большим количеством аморфного вещества между ними. На более поздних сроках явление отека не отмечается, однако гистологическое строение десны имеет морфологию псевдоэпителиоматозной гиперплазии – расширение эпителиальных выростов, базальная мембрана четко не прослеживается. Субэпителиально отмечается расширение и полнокровие сосудов микроциркуляторного русла. В периваскулярной зоне очаговая выраженная лимфоцитарная инфильтрация (Рис. 1А).

Данные патоморфологические изменения сохраняются даже после прекращения поступления пестицида и перевода животных на стандартный пищевой рацион на 30 дней (группа «тирам+стандартный рацион»). На альвеолярных участках десна была покрыта резко утолщенным пластом эпителия с признаками пролиферации клеток базального слоя и очаговым дискератозом. В некоторых случаях отмечается десквамация эпителия. Очагово отмечаются участки изъязвления и десквамации поверхностного эпителия. В субэпителиальном слое определяется выраженная диффузная полиморфноклеточная инфильтрация с примесью сегментоядерных лейкоцитов. Коллагеновые волокна собственной пластинки слизистой сохраняют нормальную ориентацию, однако в глубоком слое подэпителиальной соединительной ткани коллагеновые волокна были более плотными и более параллельными эпителию десны. В поверхностном слое соединительной ткани располагались удлиненные капилляры, а в глубоком слое – артериолы с ориентацией параллельно коллагеновым волокнам. Интересно отметить увеличение количества и размера глубоких коллагеновых волокон из-за значительной склеротизации и меньшей рыхлости поверхностных волокон. Кроме того, в склеротических участках присутствовало уменьшенное количество сосудов (Рис. 1Б).
С целью купирования окислительного стресса в эксперименте были использованы препараты-антиоксиданты с выраженными антиокислительными свойствами: ресвератрол и облепиховое масло.
Согласно литературным данным, ресвератрол препятствует перекисному окислению липидов в клетках, действуя как поглотитель радикалов (гидроксильных, супероксидных и др.), таким образом, предотвращает повреждение ДНК [19]. В экспериментальной группе животных, которым проводилась коррекция ресвератролом (группа «ресвератрол») в эпителиальном пласте определяются явления акантоза и гиперкератоза. При этом толщина эпителиального пласта достоверно снижается. Акантотичекие тяжи достаточно тонкие и глубокие и достигают сетчатого слоя собственной пластинки. Субэпителиально определяются незначительные склеротические изменения соединительной ткани. При этом коллагеновые волокна расположены упорядоченно, повторяя форму сосочковых углублений. Лимфоцитарная инфильтрация не выражена. Клеточный состав преимущественно представлен клетками фибробластического ряда с примесью круглоклеточной инфильтрации. Альвеолярная часть десны практически не изменена. Эпителиальный пласт ровный, не утолщен, с сохраненной стратификацией. В некоторых полях отмечается очаговый дискератоз. Субэпителиально небольшое количество горизонтально расположенных сосудов микроциркуляторного русла с расширенным просветом (Рис. 1В).
Облепиховое масло является источником витаминов А и Е, которые обладают антиоксидантными свойствами, что позволяет использовать облепиховое масло с целью коррекции нарушений, вызванных окислительным стрессом [20, 21].
В экспериментальной группе животных, которым проводилась коррекция облепиховым маслом (группа «облепиховое масло») свободная десна покрыта незначительно утолщенным пластом многослойного плоского эпителия. Субэпителиально умеренно выраженный отек и диффузная полиморфноклеточная инфильтрация не определяется. Среди клеток преобладают фиброциты и фибробласты. В собственной пластинке слизистой в поле зрения единичные расширенные сосуды. Коллагеновые волокна толстые с достаточно плотным расположением. В альвеолярной части десны эпителиальный пласт значительно утолщен с признаками акантоза, паракератоза и папилломатоза. Стратификация эпителиального слоя нарушена. Однако в базальном слое отмечается увеличение количества клеток, находящихся в стадии митотического деления (Рис. 1Г).
По результатам подсчета клеточного состава в субэпителиальном слое при моделировании субхронической интоксикации происходит увеличение клеток воспалительного ряда (Табл. 1).
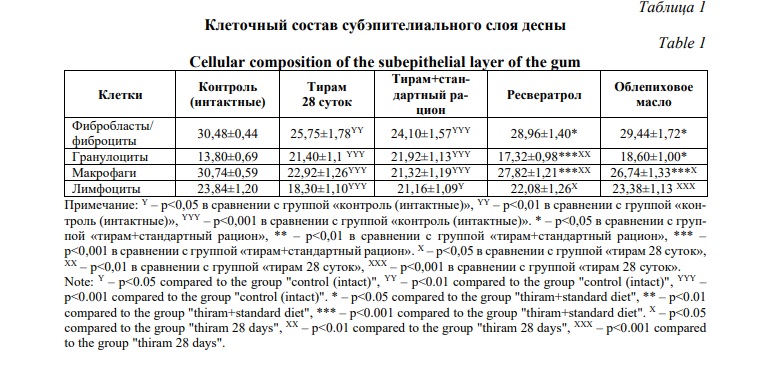
Так у крыс, которые были подвергнуты интоксикации пестицидом в течении 28 дней количество гранулоцитов достоверно увеличивается в 1,6 раз по сравнению с интактными животными. Количество лимфоцитов, напротив, достоверно снижается в 1,3 раза при сравнении тех же групп. Данная тенденция сохраняется после прекращения поступления пестицида и перевода животных на стандартный пищевой рацион на 30 дней. В группе «тирам+стандартный рацион» наблюдается достоверное увеличение количества гранулоцитов в 1,6 раз и уменьшение количества лимфоцитов в 1,1 раза по сравнению с интактными животными. Данные морфофункциональные изменения могут свидетельствовать о признаках острого воспаления и частичного угнетения местного иммунитета. При подсчете клеток фибробластического дифферона происходит их достоверное снижение в группе «тирам 28 суток» в 1,2 раза и в 1,3 раза в группе «тирам+стандартный рацион» по сравнению с контрольной группой. При подсчете макрофагов также наблюдается тенденция к их снижению – в группе «тирам 28 суток» в 1,3 раза и в 1,4 раза в группе «тирам+стандартный рацион» по сравнению с интактными животными.
При коррекции ресвератролом происходит достоверное уменьшение количества гранулоцитов по сравнению с группой «тирам 28 суток» и группой «тирам+стандартный рацион» в 1,23 и в 1,26 раза соответственно. При применении облепихового масла происходит достоверное уменьшение количества гранулоцитов только по сравнению с группой «тирам+стандартный рацион» и их количество составило 18,60±1,00.
Количество лимфоцитов напротив увеличивается в 1,2 раза после применения ресвератрола и в 1,1 раза после применения облепихового масла.
Количество клеток фибробластического дифферона также увеличивается по сравнению с группой «тирам+стандартный рацион» и составило 28,96±1,40 при применении ресвератрола и 29,44±1,72 при применении облепихового масла соответственно.
Численность клеток моноцитарно-макрофагального ряда также изменяется в сторону увеличения их количества как при применении ресвератрола, так и применении облепихового масла по сравнению с группой «тирам 28 суток» и «тирам+стандартный рацион».
Важными показателями в оценке морфофункционального состояния тканей десны является толщина эпителия. При коррекции ресвератролом происходит достоверное его уменьшение в 1,5 раза по сравнению с группой «тирам 28 суток» и в 2,2 раза по сравнению с группой «тирам+стандартный рацион» (Табл. 2).
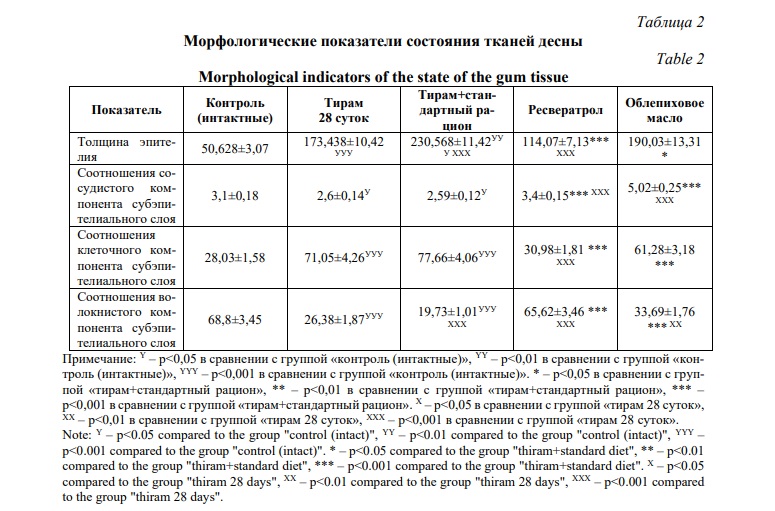
При коррекции облепиховым маслом толщина эпителия уменьшилась только по сравнению с группой «тирам+стандартный рацион» и составила 190,03±13,31 мкм. Данные подсчета клеточного состава напрямую коррелирую с результатами морфометрии компонентов подслизистого слоя. Так, общее количество клеток на единицу площади среза достоверно уменьшилось в 2,5 раза при применении ресвератрола и в 1,3 раза при использовании облепихового масла по сравнению с группой «тирам+стандартный рацион».
Анализируя соотношение волокнистого компонента и сопоставляя эти данные с количеством клеток фибробластического дифферона, можно говорить и том, что его увеличение при коррекции ресвератролом и облепиховым маслом по сравнению с группой «тирам 28 суток» происходит за счет уменьшения интерстициального отека, а по сравнению с группой «тирам+стандартный рацион» – за счет миграции клеток резидентов соединительной ткани. Площадь волокнистого компонента при использовании ресвератрола увеличивается в 2,5 раза по сравнению с группой «тирам 28 суток» и в 3,3 раза по сравнению с группой «тирам+стандартный рацион». Площадь волокнистого компонента при использовании облепихового масла увеличивается незначительно – в 1,8 раза по сравнению с группой «тирам 28 суток» и в 1,7 раза по сравнению с группой «тирам+стандартный рацион».
Одним из клинических проявлений воспалительных изменений ротовой полости является кровоточивость десен. Морфологическим субстратом этого является большое количество сосудов микроциркуляторного русла, близко расположенных к поверхностному эпителию. При коррекции препаратами антиоксидантного ряда (ресвератрол и облепиховое масло) происходит достоверное снижение сосудистого компонента по сравнению как с группой «тирам 28 суток» так и с группой «тирам+стандартный рацион» в 1,3 и 1,9 раза соответственно.
Заключение. Таким образом, субхроническая интоксикация животных пестицидом тирамом вызывает воспалительные изменения десны, выражающиеся в резком утолщении поверхностного эпителия и полиморфноклеточной инфильтрацией. Данные патоморфологические изменения нарастают и приводят к появлению участков изъязвления даже после прекращения поступления пестицида и перевода животных на стандартный пищевой рацион в течении 30 дней. Применение препаратов ресвератрол и облепиховое масло приводит к уменьшению воспалительных изменений. При этом ресвератрол обладает как противоспалительным эффектом, так и высоким регенеративным действием. Однако следует отметить, что морфометрические показатели тканей десны не достигают контрольных значений.
Информация о финансировании
Работа выполнена за счет средств Курского государственного медицинского университета.




















Список литературы